비대칭 수소화
Asymmetric hydrogenation비대칭 수소화는 3차원 공간 선택성을 가진 표적(기질) 분자에 수소 원자 2개를 추가하는 화학 반응입니다. 결정적으로, 이 선택성은 표적 분자 자체에서 오는 것이 아니라 반응에 존재하는 다른 시약이나 촉매에서 오는 것입니다. 이것은 공간 정보(화학자들이 키랄리티라고 부르는 것)가 한 분자에서 표적으로 전달되어 생성물을 하나의 거울상이성질체로 형성할 수 있게 합니다. 카이랄 정보는 촉매에 가장 일반적으로 포함되어 있으며, 이 경우 단일 분자의 촉매 정보는 많은 기질 분자에 전달되어 존재하는 카이랄 정보의 양을 증폭시킬 수 있습니다. 효소와 같은 키랄 분자가 키랄 중심의 도입을 촉매하여 세포가 기능하는 데 필요한 아미노산과 같은 단일 거울상이성질체로서의 생성물을 제공할 수 있는 자연에서도 유사한 과정이 일어납니다. 화학자들은 이 과정을 모방함으로써 특정한 방법으로 생물학적 시스템과 상호작용하는 많은 새로운 합성 분자를 생성하여 새로운 제약 물질과 농약을 생성할 수 있습니다. 비대칭 수소화의 중요성은 학계와 산업계 모두에서 그 선구자들 중 두 명인 William Standish Knowles와 Ryoji Noyori가 2001년 노벨 화학상의 절반을 공동으로 수상하는 데 기여했습니다.[1]
역사
1956년에 실크 위에 팔라듐을 증착한 이종 촉매가 비대칭 수소화에 영향을 미치는 것으로 나타났습니다.[2] 이후 1968년 윌리엄 놀스(William Knowles)와 레오폴드 호너(Leopold Horner) 그룹은 각각 독립적으로 균질한 촉매를 이용한 비대칭 수소화의 예를 발표했습니다. 이러한 초기 반응은 약간의 거울상이성질체 과잉만을 나타내면서도 실현 가능성을 보여주었습니다. 1972년에 이르러 90%의 거울상이성질체 과잉이 달성되었고, 이 기술을 이용하여 파킨슨병 약물 L-DOPA의 첫 번째 산업적 합성이 시작되었습니다.[3][4]

비대칭 수소화 분야는 여러 가지 주목할 만한 진보를 계속 경험했습니다. Henri Kagan은 특정 반응에서 높은 ee를 제공하는 쉽게 준비된 C-대칭2 디포스핀인 DIOP를 개발했습니다. 료지 노요리는 케톤과 알데히드와 같은 비대칭 수소화된 극성 기질을 위한 루테늄 기반 촉매를 소개했습니다. 1979년 로버트 H. 크랩트리는 크랩트리의 촉매를 발명하여 이리듐 화합물이 비대칭 수소화 반응을 촉매하는 능력을 입증했습니다.[5] 1990년대 초에 여러 그룹이 독립적으로 P,N 리간드를 도입한 후 C 대칭2 리간드의 범위를 더욱 확장했지만 회전 대칭이 없는 키랄 리간드보다 근본적으로 우수하지는 않습니다.[6]
오늘날 비대칭 수소화는 실험실 및 산업 규모 유기 화학에서 일상적인 방법론입니다. 비대칭 수소화의 중요성은 2001년 윌리엄 스탠디시 놀스와 료지 노요리에게 수여된 노벨 화학상을 통해 인정받았습니다.
메카니즘
비대칭 수소화는 다른 수소화에 대해 호출되는 기존 메커니즘에 의해 작동합니다. 여기에는 내부 구 메커니즘, 외부 구 메커니즘 및 σ-결합 메타시스 메커니즘이 포함됩니다. 촉매에 사용되는 메커니즘의 유형은 시스템에 사용되는 리간드에 크게 의존하며, 이는 다시 특정 촉매-기질 친화성으로 이어집니다.
내권 메커니즘
소위 내부 구 메커니즘은 알켄을 금속 중심에 조정하는 것을 수반합니다.[8] 이 메커니즘의 다른 특성은 더 많은 전자가 풍부하고 저가 금속이 존재하는 반면 전자가 부족하고 고가 금속은 일반적으로 염기에 의해 보조되는 다이하이드로겐의 헤테로분해 절단을 나타내는 경향을 포함합니다.[9]
아래 다이어그램은 내부 구 메커니즘인 로듐 복합체와의 촉매적 수소화 메커니즘을 설명합니다. 불포화 메커니즘에서 형성되는 카이랄 생성물은 사용되는 촉매와 반대의 모드를 가질 것입니다. 촉매와 기질 사이의 열역학적으로 유리한 복합체는 수소화를 겪을 수 없는 반면, 불안정하고 유리하지 않은 복합체는 빠르게 수소화를 겪습니다.[10] 반면에, 이무수물 메커니즘은 이 복합체가 처음에는 수소화되어 이무수물 형태가 되는 것을 봅니다. 이를 통해 방해받지 않는 쪽의 이중 결합을 조정할 수 있습니다. 삽입 및 환원 제거를 통해 제품의 키랄성은 리간드의 키랄성과 일치합니다.[11]
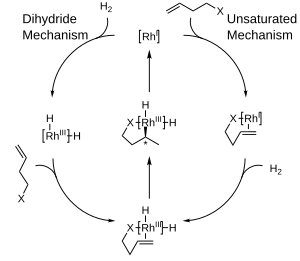
이러한 반응에서 다른 거울상이성질체 대신 하나의 거울상이성질체를 생성하는 선호는 종종 리간드와 프로카이랄 기질 사이의 입체적 상호작용으로 설명됩니다. 이러한 상호 작용을 고려하여 "차단된" 영역은 음영 상자로 표시되고 "열린" 영역은 채워지지 않은 상태로 유지되는 사분면 다이어그램이 개발되었습니다. 모델링된 반응에서 들어오는 올레핀의 큰 그룹은 다이어그램의 열린 영역을 채우도록 방향을 잡는 경향이 있는 반면, 작은 그룹은 막힌 영역으로 향하고 이후에는 올레핀의 뒷면으로 수소 전달이 일어나 입체화학을 고정시킵니다. 명확성을 위해 카이랄 포스핀 리간드의 일부만 표시됩니다.

외구 메커니즘

일부 촉매는 기질이 금속에 직접 결합하지 않고 리간드와 상호 작용하도록 "외부 구 메커니즘"에 의해 작동합니다. 이 경우 금속 수소화물과 리간드의 양성 H입니다. BINAP-Ru-다이아민 디할라이드 전촉매는 염기가 존재하는 상태에서 H의2 반응에 의해 촉매로 전환됩니다.[12]
- RuCl(BINAP)(다이아민)+2 KOBu-t+2 H → RuH(BINAP)(다이아민)+2 KCl+2 HOBu-t
생성된 촉매에는 세 가지 종류의 리간드가 있습니다.
- 불포화 기질로 이동하는 수소화물
- 제2 배위구에 의해 기질 및 염기 활성제와 상호작용하는 디아민
- 비대칭성을 부여하는 디포스핀
흔히 금속과 (아민) 리간드가 모두 기능적이라는 사실을 강조하기 위해 노요리급 촉매를 2관능 촉매라고 부릅니다.[13] 이 메커니즘은 6개의 구성된 주변환 전이 상태/intermedi산염에 의해 작동하는 것으로 오랫동안 가정되었으며, 이는 히드로루테늄 수소화물 중심(HRU-NH)이 카르보닐 기질 RC=O와 상호작용합니다. DFT 및 실험 연구에 따르면 이 모델은 대체로 잘못된 것으로 나타났습니다. 대신 아민 백본은 염기 활성제와 강하게 상호 작용하며, 이 활성제는 종종 과량으로 사용됩니다.[12]
금속
실용적인 AH는 백금 금속 기반 촉매를 사용합니다.[15][16][17]
기본금속
철은 다른 전이 금속에 비해 비용이 저렴하고 독성이 낮기 때문에 많은 촉매 공정의 인기 있는 연구 대상입니다.[18] 철을 이용한 비대칭 수소화 방법이 실현되었지만 속도와 선택도 면에서 귀금속을 기반으로 한 촉매에 비해 열세입니다.[19] 어떤 경우에는 구조적으로 정의되지 않은 나노 입자가 제자리에서 활성 종임이 입증되었으며 관찰된 적당한 선택성은 제어되지 않는 기하학적 구조에서 기인할 수 있습니다.[20]
리간드급
포스핀 리간드
키랄 포스핀 리간드, 특히 C-대칭2 리간드는 대부분의 비대칭 수소화 촉매에서 키랄성의 원천입니다. 이 중 BINAP 리간드는 노요리 비대칭 수소화에서 노벨상을 수상한 결과로 잘 알려져 있습니다.[3]
카이랄 포스핀 리간드는 일반적으로 단일 또는 이중성으로 분류될 수 있습니다. 그들은 입체 중심의 위치에 따라 더 분류될 수 있습니다. 인 대 유기 치환기. C2 대칭 요소가 있는 리간드는 특히 인기가 있었는데, 부분적으로 이러한 요소의 존재가 기질과 금속-리간드 복합체의 가능한 결합 형태를 극적으로 감소시키기 때문입니다(종종 탁월한 선택성을 초래함).[21]
단당류 포스핀
모노포스핀형 리간드는 비대칭 수소화, 예를 들어 리간드 CAMP에 나타난 최초의 리간드 중 하나였습니다.[22] 이러한 종류의 리간드에 대한 지속적인 연구는 P-알킬 및 P-헤테로 원자 결합 리간드를 모두 탐구했으며, 일반적으로 포스파이트 및 포스포라미다이트와 같은 P-헤테로 원자 리간드는 더 인상적인 결과를 달성했습니다.[23] 성공적인 리간드의 구조적 등급에는 MonoPHOS의 binapthyl 구조 또는 SiPHOS의 spiring system에 기반한 것이 포함됩니다.[25] 특히, 이러한 모노덴테이트 리간드는 서로 조합하여 사용하여 에난티오스 선택성의 상승적 개선을 달성할 수 있으며,[26] 이는 디포스핀 리간드로는 불가능합니다.[23]
카이랄 디포스핀 리간드
디포스핀 리간드는 모노포스핀보다 훨씬 더 많은 관심을 받았고, 결과적으로 훨씬 더 긴 성취 목록을 가지고 있습니다. 이 등급에는 높은 선택성(DIOP)을 달성하기 위한 첫 번째 리간드, 산업 비대칭 합성(DIPAMP[27][28][4])에 사용되는 첫 번째 리간드 및 가장 잘 알려진 카이랄 리간드(BINAP)가 포함됩니다.[3] 카이랄 디포스핀 리간드는 이제 비대칭 수소화에 편재합니다.

P,N and P,O ligands
비대칭 수소화에서 P,N 리간드의 사용은 C 대칭2 비속사졸린 리간드로 추적할 수 있습니다.[29] 그러나 이러한 대칭 리간드는 곧2 C 대칭의 결여가 비대칭 촉매 작용에서의 효능을 결코 제한하지 않는 모노옥사졸린 리간드로 대체되었습니다.[30] 이러한 리간드는 일반적으로 펜던트 인 함유 암으로 기능화된 카이랄 질소 함유 헤테로사이클로 구성되지만, 헤테로사이클의 정확한 특성과 화학적 환경 인 중심 모두는 매우 다양합니다. 포스핀-옥사졸린 또는 PHOX 아키텍처와 같은 특정 특권 구조가 확립되었지만 광범위한 기질에서 일관되게 효과적인 단일 구조는 나타나지 않았습니다.[31][30][32] 또한 좁게 정의된 기질 등급 내에서 키랄 P,N 리간드와의 금속 복합체의 성능은 표적화하기 매우 어려운 시스템에서 완벽한 전환 및 선택성에 근접할 수 있습니다.[33] 킬레이트화 P-O 리간드에서 파생된 특정 복합체는 α,β-불포화 케톤 및 에스테르의 수소화에서 유망한 결과를 보여주었습니다.[34]
NHC 리간드
간단한 N-헤테로사이클릭 카벤(NHC) 기반 리간드는 비대칭 수소화에 비실용적인 것으로 입증되었습니다.
일부 C,N 리간드는 NHC와 키랄 옥사졸린을 결합하여 킬레이트 리간드를 제공합니다.[35][36] 첫 번째 유형의 NHC 기반 리간드는 개별 NHC 및 옥사졸린의 더 작은 라이브러리의 반응으로부터 큰 라이브러리로 생성되었습니다.[35][36] 이리듐 상에서 부피가 큰 7원 금속 고리를 특징으로 하는 NHC 기반 촉매는 80년대 또는 90년대에 전환된 비기능화 올레핀[35] 및 비닐에테르 알코올의 촉매적 수소화에 적용되었습니다.[37] 동일한 시스템이 다수의 알돌,[38] 비시날[39] 디메틸 및 디옥시폴리케타이드[40] 모티프의 합성 및 디옥시폴리케타이드 자체에 적용되었습니다.[41]
C-대칭2 NHC는 비대칭 수소화에 매우 유용한 리간드임을 보여주었습니다.[42]
비순환 기판
비환식 불포화 기질(올레핀, 케톤, 에나민)은 가장 일반적인 프로카이랄 기질을 나타냅니다.
알케네스
비대칭 수소화에 특히 적합한 기질은 종종 수소화될 부위에 인접한 극성 작용기를 특징으로 합니다. 이 기능성 그룹이 없는 경우, 촉매 작용은 종종 낮은 이를 초래합니다. 기능화되지 않은 올레핀의 경우 P,N-기반 리간드를 가진 이리듐이 성공적인 촉매를 입증했습니다. 이 범주 내의 촉매 유용성은 비정상적으로 좁으며, 그 결과 해결된 촉매 문제와 해결되지 않은 촉매 문제의 다양한 범주가 개발되었습니다. 1,1-치환, 1,2-다이아릴 삼중치환, 1,1,2-트리알킬 및 테트라치환된 올레핀은 별도로 조사된 부류를 나타냅니다.[44][45] 그리고 이러한 클래스 내에서도 다양한 솔루션을 최적화하는 변형이 존재할 수 있습니다.[46]


올레핀의 경우와 반대로 에나민의 비대칭 수소화는 디포스핀형 리간드를 선호했습니다. 이리듐 및 로듐 기반 시스템 모두에서 우수한 결과를 얻었습니다. 그러나 최고의 시스템도 종종 낮은 수준과 일반성 부족으로 고통을 받습니다. 방향족 케톤의 특정 피롤리딘 유래 에나민은 양이온성 로듐(I) 포스포나이트 시스템과 비대칭적인 수소화에 적합하며, ee 값이 보통 90%를 초과하고 잠재적으로 99.9%[47]만큼 높은 I2 및 아세트산 시스템. 이리듐(I)과 매우 밀접하게 관련된 포스포라미다이트 리간드를 사용하는 유사한 시스템은 이중 결합이 고리 내부에 있는 피롤리딘 유형 에나민의 비대칭 수소화, 즉 디하이드로피롤에 효과적입니다.[48] 두 경우 모두 링 크기를 5개에서 6개로 늘렸을 때 거울상 선택성이 크게 떨어졌습니다.
이민과 케톤

케톤과 이민은 관련 작용기이며, 각각의 비대칭 수소화를 위한 효과적인 기술도 밀접하게 연관되어 있습니다. 이 중 노요리의 루테늄-카이랄 디포스핀-다이아민 시스템은 아마도 가장 잘 알려진 것 중 하나일 것입니다.[49][50] 광범위한 포스핀 및 아민(아민은 카이랄일 수 있지만, 그럴 필요는 없음)과 함께 사용할 수 있으며, 일반적으로 90%[51][52] 이상의 거울상이성질체 과잉(ee's)을 달성하여 표적 기질과 최적의 일치를 위해 쉽게 조정할 수 있습니다.
카르보닐 및 이민 기판의 경우 엔드온, η 조정이 η 모드와 경쟁할 수 있습니다. η 결합 기질의 경우 수소 수용 탄소가 촉매에서 제거되어 수소화에 저항합니다.
이리듐/P,N 리간드 기반 시스템은 케톤과 이민의 비대칭 수소화에도 일반적으로 사용됩니다. 예를 들어, 벤질아릴이민에 대한 일관된 시스템은 양이온 복합체에서 이리듐(I)과 함께 P,N 리간드 SIPHOX를 사용하여 ee >90%[54]의 비대칭 수소화를 달성합니다. 케톤의 비대칭 수소화를 위해 개발된 촉매 중 가장 효율적이고 효과적인 촉매 중 하나는 회전수(TON)가 최대 4,550,000이고 ee가 최대 99.9%로 밀접하게 관련된 삼변 리간드를 가진 또 다른 이리듐(I) 시스템을 사용합니다.[55]

BINAP/diamine-Ru 촉매는 기능화된 케톤과 단순 케톤의 비대칭 환원에 효과적이며,[56] BINAP/diamine-Ru 촉매는 방향족, 헤테로방향족 및 올레핀계 케톤을 선택적으로 촉매할 수 있습니다.[57] 한 치환기가 다른 치환기보다 크면 입체 선택성이 향상됩니다(플립핀-로지 각도 참조).

방향족 기판
방향족(특히 헤테로방향족) 기질의 비대칭 수소화는 매우 활발한 연구 분야입니다. 이 분야의 촉매는 안정성이 높은 방향족 화합물이 수소화에 저항하는 경향, 기질과 생성물 모두의 잠재적 배위(및 따라서 촉매-독소) 능력을 포함하여 여러 가지 복잡한 요인과 싸워야 합니다. 그리고 하나의 방향족 고리에 존재할 수 있는 치환 패턴의 매우 다양성.[58] 이러한 기질 중 가장 일관된 성공은 질소 함유 헤테로사이클에서 관찰되었으며, 여기서 방향족 고리는 종종 양성자화 또는 질소의 추가 기능화(일반적으로 전자 인출 보호기를 사용함)에 의해 활성화됩니다. 이러한 전략은 산소 및 황 함유 헤테로사이클에는 덜 기본적이고 덜 친핵성이기 때문에 덜 적용 가능합니다. 이러한 추가적인 어려움은 비대칭 수소화를 위한 효과적인 방법이 거의 존재하지 않는 이유를 설명하는 데 도움이 될 수 있습니다.
퀴놀린, 이소퀴놀린 및 퀴녹살린
분리된 수율이 일반적으로 80% 이상이고 ee 값이 일반적으로 90% 이상인 2-치환된 퀴놀린의 비대칭 수소화를 위한 두 가지 시스템이 존재합니다. 첫 번째는 Iridium(I)/chiral phosphine/I2 시스템으로 Zhou et al. 이 처음 보고했습니다.[59] 이 시스템에 사용된 최초의 카이랄 포스핀은 MeOBiPhep 이었지만, 새로운 반복은 이 리간드의 성능을 향상시키는 데 초점을 맞추고 있습니다. 이를 위해 시스템은 공기 안정성,[60] 재활용성,[60] 준비 용이성,[61] 낮은 촉매 로딩[62][63] 및 카이랄 포스핀 첨가제의 잠재적 역할을 가진 포스핀(또는 관련 리간드)을 사용합니다.[64] 2012년 10월 현재 I2 또는 할로겐 대리인의 필요성과 반응성을 보조하는 헤테로방향족 N의 가능한 역할이 모두 문서화되었지만 메커니즘은 제안되지 않은 것으로 보입니다.[58]
두 번째는 Hantzsch 에스테르와 chiral Brönsted acid를 기반으로 하는 유기촉매 전달 수소화 시스템입니다. 이 경우 저자들은 아이소퀴놀린이 활성화 단계에서 교대로 양성자화된 다음 Hantzsch 에스테르로부터 수소화물의 접합체 첨가에 의해 환원되는 메커니즘을 구상합니다.[65]
퀴녹살린의 비대칭 수소화 화학의 대부분은 구조적으로 유사한 퀴놀린의 화학과 밀접한 관련이 있습니다. Ir(I)/phophinite/I2 시스템[66] 및 Hantzsh 에스테르 기반 유기 촉매 시스템을 사용하면 효과적인(그리고 효율적인) 결과를 얻을 수 있으며,[67] 둘 다 퀴놀린과 관련하여 앞서 논의된 시스템과 유사합니다.
피리딘스
피리딘은 초기 고리에서 차등 치환이 가능한 5개의 탄소 중심을 사용할 수 있다는 점에서 비대칭 환원을 위한 매우 가변적인 기질입니다. 2012년 10월 현재, 적어도 하나의 합리적인 일반적인 방법이 존재하지만, 다섯 가지를 모두 제어할 수 있는 방법은 존재하지 않는 것으로 보입니다.
비대칭 피리딘 수소화의 가장 일반적인 방법은 실제로 이질적인 방법이며, 여기서 비대칭은 피리딘의 C2 위치에 결합된 키랄 옥사졸리디논으로부터 발생합니다. 이러한 기능화된 피리딘을 다양한 이종 금속 촉매에 수소화하면 올시스 기하학에서 C3, C4 및 C5 위치의 치환기를 가진 해당 피리딘이 높은 수율 및 우수한 선택성으로 제공됩니다. 옥사졸리디논 보조제도 수소화 조건에서 편리하게 절단됩니다.[68]

2-치환된 피리딘 수소화를 위해 특별히 설계된 방법은 2-치환된 퀴놀린 및 퀴녹살린과 같은 관련 기질을 위해 개발된 비대칭 시스템을 포함할 수 있습니다. 예를 들어 이리듐(I)\chiral phosphine\I2 시스템은 활성화된(알킬화된) 2-피리디늄[69] 또는 특정 사이클로헥사논-퓨즈된 피리딘의 비대칭 수소화에 효과적입니다.[70] 마찬가지로, Hantzsh 에스테르를 수소화물 공급원으로 사용하는 카이랄 브뢴스테드 산 촉매 작용은 추가적인 활성화 치환을 갖는 일부 2-알킬 피리딘에 효과적입니다.[71]
인돌
인돌의 비대칭 수소화는 처음에 N-보호 인돌에 초점을 맞추었으며, 여기서 보호 그룹은 헤테로사이클을 수소화로 활성화하고 금속의 2차 배위 부위로 작용할 수 있습니다. 이후 작업을 통해 비보호 인돌은 인돌의 브뢴스테드 산 활성화를 통해 표적이 될 수 있었습니다.
비대칭 인돌 수소화에 대한 초기 보고서에서 N-아세틸 2-치환 인돌은 87-95%의 높은 수율과 ee로 보호될 수 있었습니다. 3-substit화된 인돌은 덜 성공적이었고, 보호기의 가수분해가 인돌의 수소화를 능가했습니다. N-토실 보호기로 전환하면 가수분해 반응이 억제되고 2- 및 3-치환된 인돌이 모두 높은 수율 및 ee에서 수소화될 수 있습니다.[73][74] 그러나 두 가지 방법의 문제점은 N-아세틸 및 N-토실 그룹이 복잡한 기질과 양립할 수 없는 가혹한 절단 조건을 필요로 한다는 것입니다. 쉽게 절단된 N-Boc 그룹을 사용하면 이러한 문제를 해결할 수 있으며, 이러한 인돌(2-치환 및 3-치환 둘 다)의 비대칭 수소화를 위한 매우 효과적인 방법이 곧 개발되었습니다.[75][76]

이러한 보호 인돌의 비대칭 수소화의 발전에도 불구하고 보호 그룹을 완전히 제거함으로써 상당한 운영 단순성을 얻을 수 있습니다. 이는 인돌을 활성화하기 위해 Brønsted 산을 사용하는 촉매 시스템을 통해 달성되었습니다. 초기 시스템은 Pd(TFA)/2H8-BINAP 시스템을 사용하여 높은 수율과 우수한 ee로 2,3- 및 2-치환된 인돌의 선택적 시스-수소화를 달성했습니다. 하나의 포트에서 순차적인 Friedel-Crafts 알킬화 및 비대칭 수소화가 발생하는 유사한 프로세스는 유사하게 높은 수율 및 ee에서 2-치환된 인돌로부터 비대칭 2,3-치환된 인돌을 선택적으로 제조할 수 있도록 합니다.[77][78]

카이랄 루이스 염기를 이용한 2,3-치환 인돌의 비대칭 수소화를 위한 유망한 유기 촉매 방법도 존재하지만, 관찰된 ee는 금속 기반 수소화와 완전히 동일하지는 않습니다.[77]
피롤스
비대칭 수소화에 의해 피롤을 피롤리딘으로 완전히 전환하는 것은 지금까지 어려운 것으로 입증되었으며, 부분 수소화 생성물이 종종 관찰되었습니다.[79][80] 시작 기판과 방법에 따라 결과가 달라지며 완전한 선택적 환원이 가능합니다.
2,3,5-치환된 피롤의 비대칭 수소화는 이러한 기질이 2-치환된 인돌과 동일한 치환 패턴을 갖는다는 인식에 의해 달성되었으며, 이러한 기질 중 하나에 효과적인 비대칭 수소화 시스템이 두 가지 모두에 효과적일 수 있습니다. 이러한 분석은 피롤 치환기의 특성에 따라 디하이드로 또는 테트라하이드로피롤(피롤리딘)을 제공할 수 있는 2,3,5-치환된 N-Boc 피롤에 대한 루테늄(I)/포스핀/아민 염기 시스템의 개발로 이어졌습니다. 올-페닐 치환 패턴은 매우 높은 수율(>96%)과 본질적으로 완벽한 엔안티오스 선택성으로 디히드로피롤을 유도합니다. 완전히 수소화된 All-cis dihydropyrole에 대한 접근은 디아스테레오 선택적 이종 수소화를 통해 접근할 수 있습니다. 알킬 치환은 다이하이드로 또는 테트라하이드로피롤을 유도할 수 있지만, 수율(>70%) 및 에난티오스 선택성(종종 >90%)은 높은 수준을 유지합니다. 두 경우 모두 국소 선택성은 스테릭에 의해 지배되는 것으로 보이며, 치환이 덜 된 이중은 우선적으로 수소화됩니다.[79]

보호되지 않은 2,5-피롤은 또한 Brønsted 산/Pd(II)/카이랄 포스핀 촉매 방법에 의해 비대칭적으로 수소화되어 상응하는 2,5-치환된 1-피롤린을 약 70-80% 수율 및 80-90% ee로 제공할 수 있습니다.[80]
산소가 함유된 헤테로사이클
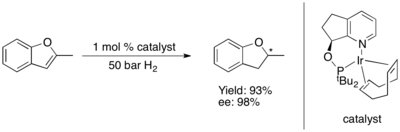
푸란과 벤조퓨란의 비대칭 수소화는 지금까지 어려운 것으로 입증되었습니다.[81] 일부 Ru-NHC 복합체는 벤조퓨란과[82] 퓨란의 비대칭 수소화를 촉매합니다.[83] 높은 수준의 에난티오 인덕션으로
황 함유 헤테로사이클
산소 함유 헤테로사이클의 경우와 마찬가지로 지금까지 황이 초기 불포화 파이 결합 시스템의 일부인 화합물의 비대칭 수소화는 티오펜과 벤조티오펜에 국한된 것으로 보입니다. 이러한 헤테로사이클의 비대칭 수소화에 대한 핵심 접근법은 루테늄(ruthenium)을 포함합니다.II) 촉매 및 카이랄, C2 대칭 N-헤테로사이클릭 카벤(NHC). 이 시스템은 기질이 융합된(또는 직접 결합된) 페닐 고리를 가지고 있지만 다른 모든 테스트 사례에서 라세미 생성물만 생성하는 경우 우수한 선택성(ee > 90%)과 완벽한 디아스테레오 선택성(모든 시스)을 갖는 것으로 보입니다.[84]

이종촉매작용
비대칭 수소화를 위한 이종 촉매는 상용화된 바가 없습니다.
첫 번째 비대칭 수소화는 실크 지지대 위에 증착된 팔라듐에 초점을 맞췄습니다. Cinchona alkaloids는 선택성 수소화를 위한 키랄 조절제로 사용되어 왔습니다.[85]

활성 촉매 부위의 구조적 및 전자적 특성에 대한 보다 많은 제어를 가능하게 하는 대안적인 기술 및 하나는 이종 지지체 상에서 균질한 촉매 작용을 위해 개발된 촉매를 고정화하는 것입니다. 촉매의 고정화는 표면 흡착, 이온 교환 또는 심지어 물리적 캡슐화에 의해서도 달성될 수 있지만, 촉매를 폴리머 또는 기타 고체 지지체에 공유 결합하는 것이 가장 일반적일 수 있습니다. 이 접근법의 한 가지 단점은 지지체가 근접하여 촉매의 거동을 변화시켜 반응의 병소선택성을 낮출 가능성이 있다는 것입니다. 이를 방지하기 위해 촉매는 종종 긴 링커에 의해 지지체에 결합되지만, 지지체의 근접성이 실제로 촉매의 성능을 향상시킬 수 있는 경우가 알려져 있습니다.[85]
최종 접근법은 잠재적으로 카이랄 및 카이랄 유기 리간드, 구조 금속 이온, 촉매 활성 금속 이온 및/또는 미리 조립된 촉매 활성 유기 금속 코어를 포함하는 다양한 구성 요소로부터 카이랄 반응 부위를 통합하는 MOF의 구성을 포함합니다.[86] 이 중 하나는 루테늄 기반 촉매와 관련이 있습니다. 0.005 mol%의 이러한 촉매만이 아릴 케톤의 비대칭 수소화를 달성하기에 충분하다는 것이 입증되었지만, 일반적인 조건은 0.1 mol%의 촉매를 특징으로 하고 90.6-99.2%[87]의 거울상이성질체 과잉을 초래했습니다.

산업용 애플리케이션

비대칭 수소화는 항균제 레보플록신, 항생제 카바페넴 및 항정신병제 BMS181100과 같은 여러 약물의 생산에 사용됩니다.[15][16][17]

비대칭 수소화에 대한 Knowles의 연구와 L-Dopa의[4] 생산 규모 합성에 대한 적용은 비대칭 수소화가 산업계에서 강력한 출발을 하게 했습니다. 2001년 검토에 따르면 비대칭 수소화는 산업에서 생산 규모의 50%, 파일럿 규모의 90%, 벤치 규모의 촉매, 거울 선택 공정의 74%를 차지했으며, 일반적으로 비대칭 촉매 방법은 아직 널리 사용되지 않았다는 주의 사항이 있습니다.[88]
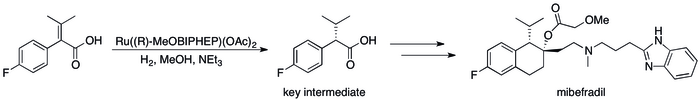
비대칭 수소화는 운동 분해능 기반 방법을 대체하여 공정 효율을 크게 향상시켰습니다.[12] 예를 들어, 로슈의 촉매 그룹은 (S,S)-Ro 67-8867의 합성을 전체 수율의 53%로 달성할 수 있었으며, 이는 3보다 크게 증가한 수치입니다.해상도 기반 합성에서 달성된 5%.[89] 로슈의 미베프라딜 합성도 해상도를 비대칭 수소화로 대체하여 스텝 카운트를 3개 줄이고 핵심 중간체의 수율을 원래 70%[90]에서 80%로 높임으로써 향상되었습니다.
노요리에서 영감을 얻은 수소화 촉매는 많은 미세 화학 물질의 상업적 합성에 적용되었습니다. (R)-1,2-프로판디올, 항균 레보플록사신의 전구체는 노요리 비대칭 수소화를 사용하여 하이드록시아세톤으로부터 효율적으로 합성될 수 있습니다.[17]

새로운 경로는 (R)-메틸 락테이트의 수소화에 초점을 맞추고 있습니다.[12]
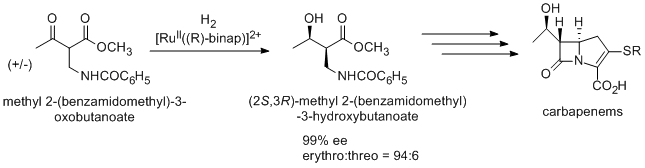
또한, 동역학적 분해에 의해 라세미 메틸 2-(벤즈아미도메틸)-3-옥소부타노에이트로부터 합성되는 (2S,3R)-메틸 2-(벤즈아미도메틸)-3-하이드록시부타노에이트를 통한 노요리 비대칭 수소화를 이용하여 항생제 카바페넴을 제조하는 방법.
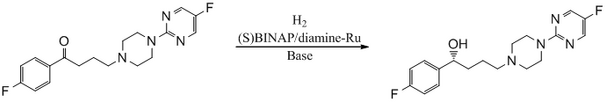
BINAP/diamine-Ru 촉매를 사용하여 항정신병제 BMS 181100을 합성합니다.
참고문헌
- ^ "The Nobel Prize in Chemistry 2001". 2001-10-10.
- ^ Akabori, S.; Sakurai, S.; Izumi, Y.; Fujii, Y. (1956). "An Asymmetric Catalyst". Nature. 178 (4528): 323. Bibcode:1956Natur.178..323A. doi:10.1038/178323b0. PMID 13358737. S2CID 4221816.
- ^ a b c Noyori, R. (2003). "Asymmetric Catalysis: Science and Opportunities (Nobel Lecture 2001)". Advanced Synthesis & Catalysis. 345 (12): 15–41. doi:10.1002/adsc.200390002.
- ^ a b c Knowles, W. S. (2002). "Asymmetric Hydrogenations (Nobel Lecture)". Angewandte Chemie International Edition. 41 (12): 1998–2007. doi:10.1002/1521-3773(20020617)41:12<1998::AID-ANIE1998>3.0.CO;2-8. PMID 19746594.
- ^ Crabtree, Robert (1979). "Iridium compounds in catalysis". Accounts of Chemical Research. 12 (9): 331–337. doi:10.1021/ar50141a005.
- ^ Pfaltz, A. (2004). "Asymmetric Catalysis Special Feature Part II: Design of chiral ligands for asymmetric catalysis: From C2-symmetric P,P- and N,N-ligands to sterically and electronically nonsymmetrical P,N-ligands". Proceedings of the National Academy of Sciences. 101 (16): 5723–5726. Bibcode:2004PNAS..101.5723P. doi:10.1073/pnas.0307152101. PMC 395974. PMID 15069193.
- ^ de Vries, Johannes G.; Elsevier, Cornelis J., eds. (2006-10-20). The Handbook of Homogeneous Hydrogenation (1 ed.). Wiley. doi:10.1002/9783527619382. ISBN 978-3-527-31161-3.
- ^ Gridnev, I. D.; Imamoto, T. (2004). "On the Mechanism of Stereoselection in Rh-Catalyzed Asymmetric Hydrogenation: A General Approach for Predicting the Sense of Enantioselectivity". Accounts of Chemical Research. 37 (9): 633–644. doi:10.1021/ar030156e. PMID 15379579.
- ^ Wen, Jialin; Wang, Fangyuan; Zhang, Xumu (2021). "Asymmetric hydrogenation catalyzed by first-row transition metal complexes". Chemical Society Reviews. 50 (5): 3211–3237. doi:10.1039/D0CS00082E. ISSN 0306-0012.
- ^ Gridnev, Ilya D.; Imamoto, Tsuneo (2004-09-01). "On the Mechanism of Stereoselection in Rh-Catalyzed Asymmetric Hydrogenation: A General Approach for Predicting the Sense of Enantioselectivity". Accounts of Chemical Research. 37 (9): 633–644. doi:10.1021/ar030156e. ISSN 0001-4842.
- ^ Imamoto, Tsuneo; Tamura, Ken; Zhang, Zhenfeng; Horiuchi, Yumi; Sugiya, Masashi; Yoshida, Kazuhiro; Yanagisawa, Akira; Gridnev, Ilya D. (2012-01-25). "Rigid P-Chiral Phosphine Ligands with tert -Butylmethylphosphino Groups for Rhodium-Catalyzed Asymmetric Hydrogenation of Functionalized Alkenes". Journal of the American Chemical Society. 134 (3): 1754–1769. doi:10.1021/ja209700j. ISSN 0002-7863.
- ^ a b c d Dub, Pavel A.; Gordon, John C. (2018). "The role of the metal-bound N–H functionality in Noyori-type molecular catalysts". Nature Reviews Chemistry. 2 (12): 396–408. doi:10.1038/s41570-018-0049-z. S2CID 106394152.
- ^ Noyori, Ryōji; Masashi Yamakawa; Shohei Hashiguchi (2001-11-01). "Metal−Ligand Bifunctional Catalysis: A Nonclassical Mechanism for Asymmetric Hydrogen Transfer between Alcohols and Carbonyl Compounds". The Journal of Organic Chemistry. 66 (24): 7931–7944. doi:10.1021/jo010721w. PMID 11722188.
- ^ Ohkuma, T.; Ooka, H.; Ikariya, T.; Noyori, R. (1995), "Preferential hydrogenation of aldehydes and ketones", Journal of the American Chemical Society, 117 (41): 10417–10418, doi:10.1021/ja00146a041
- ^ a b Ikariya, T.; Blacker, A. J. (2007). "Asymmetric Transfer Hydrogenation of Ketones with Bifunctional Transition Metal-Based Molecular Catalysts". Accounts of Chemical Research. 40 (12): 1300–1308. doi:10.1021/ar700134q. PMID 17960897.
- ^ a b Pilkington, C.; Lennon, I. (2003). "The Application of Asymmetric Hydrogenation for the Manufacture of Pharmaceutical Intermediates:The Need for Catalyst Diversity". Synthesis. 2003 (11): 1639. doi:10.1055/s-2003-40871.
- ^ a b c Noyori, R. (2002), "Asymmetric Catalysis: Science and Opportunities (Nobel Lecture)", Angewandte Chemie International Edition, 41 (12): 2008–22, doi:10.1002/1521-3773(20020617)41:12<2008::aid-anie2008>3.0.co;2-4, PMID 19746595
- ^ Enthaler, S.; Junge, K.; Beller, M. (2008). "Sustainable Metal Catalysis with Iron: From Rust to a Rising Star?". Angewandte Chemie International Edition. 47 (18): 3317–21. doi:10.1002/anie.200800012. PMID 18412184.
- ^ Mikhailine, A.; Lough, A. J.; Morris, R. H. (2009). "Efficient Asymmetric Transfer Hydrogenation of Ketones Catalyzed by an Iron Complex Containing a P−N−N−P Tetradentate Ligand Formed by Template Synthesis". Journal of the American Chemical Society. 131 (4): 1394–1395. doi:10.1021/ja809493h. PMID 19133772.
- ^ Sonnenberg, J. F.; Coombs, N.; Dube, P. A.; Morris, R. H. (2012). "Iron Nanoparticles Catalyzing the Asymmetric Transfer Hydrogenation of Ketones". Journal of the American Chemical Society. 134 (13): 5893–5899. doi:10.1021/ja211658t. PMID 22448656.
- ^ Whitesell, J. K. (1989). "C2 symmetry and asymmetric induction". Chemical Reviews. 89 (7): 1581–1590. doi:10.1021/cr00097a012.
- ^ Knowles, W. S.; Sabacky, M. J.; Vineyard, B. D. (1972). "Catalytic asymmetric hydrogenation". Journal of the Chemical Society, Chemical Communications. 214 (1): 119–124. doi:10.1039/C39720000010. PMID 4270504.
- ^ a b Jerphagnon, T.; Renaud, J. L.; Bruneau, C. (2004). "Chiral monodentate phosphorus ligands for rhodium-catalyzed asymmetric hydrogenation". Tetrahedron: Asymmetry. 15 (14): 2101. doi:10.1016/j.tetasy.2004.04.037.
- ^ Van Den Berg, M.; Minnaard, A. J.; Schudde, E. P.; Van Esch, J.; De Vries, A. H. M.; De Vries, J. G.; Feringa, B. L. (2000). "Highly Enantioselective Rhodium-Catalyzed Hydrogenation with Monodentate Ligands" (PDF). Journal of the American Chemical Society. 122 (46): 11539. doi:10.1021/ja002507f. hdl:11370/3c92d080-f024-45fe-b997-b100634bd612. S2CID 95403641.
- ^ Fu, Y.; Xie, J. H.; Hu, A. G.; Zhou, H.; Wang, L. X.; Zhou, Q. L. (2002). "Novel monodentate spiro phosphorus ligands for rhodium-catalyzed hydrogenation reactions". Chemical Communications (5): 480–481. doi:10.1039/B109827F. PMID 12120551.
- ^ Reetz, M. T.; Sell, T.; Meiswinkel, A.; Mehler, G. (2003). "A New Principle in Combinatorial Asymmetric Transition-Metal Catalysis: Mixtures of Chiral Monodentate P Ligands". Angewandte Chemie International Edition. 42 (7): 790–3. doi:10.1002/anie.200390209. PMID 12596201.
- ^ Vineyard, B. D.; Knowles, W. S.; Sabacky, M. J.; Bachman, G. L.; Weinkauff, D. J. (1977). "Asymmetric hydrogenation. Rhodium chiral bisphosphine catalyst". Journal of the American Chemical Society. 99 (18): 5946. doi:10.1021/ja00460a018.
- ^ Knowles, W. S.; Sabacky, M. J.; Vineyard, B. D.; Weinkauff, D. J. (1975). "Asymmetric hydrogenation with a complex of rhodium and a chiral bisphosphine". Journal of the American Chemical Society. 97 (9): 2567. doi:10.1021/ja00842a058.
- ^ Müller, D.; Umbricht, G.; Weber, B.; Pfaltz, A. (1991). "C2-Symmetric 4,4',5,5'-Tetrahydrobi(oxazoles) and 4,4',5,5'-Tetrahydro-2,2'-methylenebis[oxazoles] as Chiral Ligands for Enantioselective Catalysis Preliminary Communication". Helvetica Chimica Acta. 74: 232–240. doi:10.1002/hlca.19910740123.
- ^ a b Helmchen, G. N.; Pfaltz, A. (2000). "PhosphinooxazolinesA New Class of Versatile, Modular P,N-Ligands for Asymmetric Catalysis". Accounts of Chemical Research. 33 (6): 336–345. doi:10.1021/ar9900865. PMID 10891051.
- ^ Lightfoot, A.; Schnider, P.; Pfaltz, A. (1998). "Enantioselective Hydrogenation of Olefins with Iridium-Phosphanodihydrooxazole Catalysts". Angewandte Chemie International Edition. 37 (20): 2897–2899. doi:10.1002/(SICI)1521-3773(19981102)37:20<2897::AID-ANIE2897>3.0.CO;2-8. PMID 29711115.
- ^ Franzke, A.; Pfaltz, A. (2011). "Zwitterionic Iridium Complexes with P,N-Ligands as Catalysts for the Asymmetric Hydrogenation of Alkenes". Chemistry: A European Journal. 17 (15): 4131–44. doi:10.1002/chem.201003314. PMID 21381140.
- ^ Maurer, F.; Huch, V.; Ullrich, A.; Kazmaier, U. (2012). "Development of Catalysts for the Stereoselective Hydrogenation of α,β-Unsaturated Ketones". The Journal of Organic Chemistry. 77 (11): 5139–5143. doi:10.1021/jo300246c. PMID 22571628.
- ^ Rageot, D.; Woodmansee, D. H.; Pugin, B. T.; Pfaltz, A. (2011). "Proline-Based P,O Ligand/Iridium Complexes as Highly Selective Catalysts: Asymmetric Hydrogenation of Trisubstituted Alkenes". Angewandte Chemie International Edition. 50 (41): 9598–601. doi:10.1002/anie.201104105. PMID 21882320.
- ^ a b c Perry, M. C.; Cui, X.; Powell, M. T.; Hou, D. R.; Reibenspies, J. H.; Burgess, K. (2003). "Optically Active Iridium Imidazol-2-ylidene-oxazoline Complexes: Preparation and Use in Asymmetric Hydrogenation of Arylalkenes". Journal of the American Chemical Society. 125 (1): 113–123. doi:10.1021/ja028142b. PMID 12515512.
- ^ a b Nanchen, S.; Pfaltz, A. (2006). "Synthesis and Application of Chiral N-Heterocyclic Carbene–Oxazoline Ligands: Iridium-Catalyzed Enantioselective Hydrogenation". Chemistry: A European Journal. 12 (17): 4550–8. doi:10.1002/chem.200501500. PMID 16557626.
- ^ Zhu, Y.; Burgess, K. (2008). "Iridium-Catalyzed Asymmetric Hydrogenation of Vinyl Ethers". Advanced Synthesis & Catalysis. 350 (7–8): 979. doi:10.1002/adsc.200700546.
- ^ Zhao, J.; Burgess, K. (2009). "Aldol-Type Chirons from Asymmetric Hydrogenations of Trisubstituted Alkenes". Organic Letters. 11 (10): 2053–2056. doi:10.1021/ol900308w. PMID 19368378.
- ^ Zhao, J.; Burgess, K. (2009). "Synthesis of Vicinal Dimethyl Chirons by Asymmetric Hydrogenation of Trisubstituted Alkenes". Journal of the American Chemical Society. 131 (37): 13236–13237. doi:10.1021/ja905458n. PMID 19719102.
- ^ Zhou, J.; Burgess, K. (2007). "Α,ω-Functionalized 2,4-Dimethylpentane Dyads and 2,4,6-Trimethylheptane Triads through Asymmetric Hydrogenation". Angewandte Chemie International Edition. 46 (7): 1129–31. doi:10.1002/anie.200603635. PMID 17200966.
- ^ Zhou, J.; Zhu, Y.; Burgess, K. (2007). "Synthesis of (S,R,R,S,R,S)-4,6,8,10,16,18- Hexamethyldocosane from Antitrogus parvulus via Diastereoselective Hydrogenations". Organic Letters. 9 (7): 1391–1393. doi:10.1021/ol070298z. PMID 17338543.
- ^ Urban, S.; Ortega, N.; Glorius, F. (2011). "Ligand-Controlled Highly Regioselective and Asymmetric Hydrogenation of Quinoxalines Catalyzed by Ruthenium N-Heterocyclic Carbene Complexes". Angewandte Chemie International Edition. 50 (16): 3803–6. doi:10.1002/anie.201100008. PMID 21442699.
- ^ Cui, X.; Burgess, K. (2005). "Catalytic Homogeneous Asymmetric Hydrogenations of Largely Unfunctionalized Alkenes". Chemical Reviews. 105 (9): 3272–3296. doi:10.1021/cr0500131. PMID 16159153.
- ^ Pàmies, O.; Andersson, P. G.; Diéguez, M. (2010). "Asymmetric Hydrogenation of Minimally Functionalised Terminal Olefins: An Alternative Sustainable and Direct Strategy for Preparing Enantioenriched Hydrocarbons". Chemistry: A European Journal. 16 (48): 14232–40. doi:10.1002/chem.201001909. PMID 21140401.
- ^ Woodmansee, D. H.; Pfaltz, A. (2011). "Asymmetric hydrogenation of alkenes lacking coordinating groups". Chemical Communications. 47 (28): 7912–7916. doi:10.1039/c1cc11430a. PMID 21556431.
- ^ Mazuela, J.; Verendel, J. J.; Coll, M.; SchäFfner, B. N.; BöRner, A.; Andersson, P. G.; PàMies, O.; DiéGuez, M. (2009). "Iridium Phosphite−Oxazoline Catalysts for the Highly Enantioselective Hydrogenation of Terminal Alkenes". Journal of the American Chemical Society. 131 (34): 12344–12353. doi:10.1021/ja904152r. PMID 19658416.
- ^ Hou, G. H.; Xie, J. H.; Wang, L. X.; Zhou, Q. L. (2006). "Highly Efficient Rh(I)-Catalyzed Asymmetric Hydrogenation of Enamines Using Monodente Spiro Phosphonite Ligands". Journal of the American Chemical Society. 128 (36): 11774–11775. doi:10.1021/ja0644778. PMID 16953614.
- ^ Hou, G. H.; Xie, J. H.; Yan, P. C.; Zhou, Q. L. (2009). "Iridium-Catalyzed Asymmetric Hydrogenation of Cyclic Enamines". Journal of the American Chemical Society. 131 (4): 1366–1367. doi:10.1021/ja808358r. PMID 19132836.
- ^ Noyori, R.; Ohkuma, T.; Kitamura, M.; Takaya, H.; Sayo, N.; Kumobayashi, H.; Akutagawa, S. (1987), "Asymmetric hydrogenation of β-keto carboxylic esters. A practical, purely chemical access to .beta.-hydroxy esters in high enantiomeric purity", Journal of the American Chemical Society, 109 (19): 5856–5858, doi:10.1021/ja00253a051
- ^ Ohkuma, T.; Ooka, H.; Hashiguchi, S.; Ikariya, T.; Noyori, R. (1995). "Practical Enantioselective Hydrogenation of Aromatic Ketones". Journal of the American Chemical Society. 117 (9): 2675. doi:10.1021/ja00114a043.
- ^ Noyori, R.; Ohkuma, T. (2001). "Asymmetric Catalysis by Architectural and Functional Molecular Engineering: Practical Chemo- and Stereoselective Hydrogenation of Ketones". Angewandte Chemie International Edition. 40 (1): 40–73. doi:10.1002/1521-3773(20010105)40:1<40::AID-ANIE40>3.0.CO;2-5. PMID 11169691.
- ^ Hems, W. P.; Groarke, M.; Zanotti-Gerosa, A.; Grasa, G. A. (2007). "[(Bisphosphine) Ru(II) Diamine] Complexes in Asymmetric Hydrogenation: Expanding the Scope of the Diamine Ligand". Accounts of Chemical Research. 40 (12): 1340–1347. doi:10.1021/ar7000233. PMID 17576143.
- ^ Noyori, R.; Yamakawa, M.; Hashiguchi, S. (2001). "Metal−Ligand Bifunctional Catalysis: A Nonclassical Mechanism for Asymmetric Hydrogen Transfer between Alcohols and Carbonyl Compounds". The Journal of Organic Chemistry. 66 (24): 7931–7944. doi:10.1021/jo010721w. PMID 11722188.
- ^ Zhu, S. F.; Xie, J. B.; Zhang, Y. Z.; Li, S.; Zhou, Q. L. (2006). "Well-Defined Chiral Spiro Iridium/Phosphine−Oxazoline Cationic Complexes for Highly Enantioselective Hydrogenation of Imines at Ambient Pressure". Journal of the American Chemical Society. 128 (39): 12886–12891. doi:10.1021/ja063444p. PMID 17002383.
- ^ Xie, J. H.; Liu, X. Y.; Xie, J. B.; Wang, L. X.; Zhou, Q. L. (2011). "An Additional Coordination Group Leads to Extremely Efficient Chiral Iridium Catalysts for Asymmetric Hydrogenation of Ketones". Angewandte Chemie International Edition. 50 (32): 7329–32. doi:10.1002/anie.201102710. PMID 21751315.
- ^ Ohkuma, T.; Ooka, H.; Yamakawa, M.; Ikariya, T.; Noyori, R. (1996), "Stereoselective Hydrogenation of Simple Ketones Catalyzed by Ruthenium(II) Complexes", The Journal of Organic Chemistry, 61 (15): 4872–4873, doi:10.1021/jo960997h
- ^ Noyori, R.; Ohkuma, T. (2001), "Asymmetric Catalysis by Architectural and Functional Molecular Engineering: Practical Chemo- and Stereoselective Hydrogenation of Ketones", Angewandte Chemie International Edition, 40 (1): 40–73, doi:10.1002/1521-3773(20010105)40:1<40::aid-anie40>3.0.co;2-5, PMID 11169691
- ^ a b Zhou, Y. G. (2007). "Asymmetric Hydrogenation of Heteroaromatic Compounds". Accounts of Chemical Research. 40 (12): 1357–1366. CiteSeerX 10.1.1.653.5495. doi:10.1021/ar700094b. PMID 17896823.
- ^ Wang, W. B.; Lu, S. M.; Yang, P. Y.; Han, X. W.; Zhou, Y. G. (2003). "Highly Enantioselective Iridium-Catalyzed Hydrogenation of Heteroaromatic Compounds, Quinolines". Journal of the American Chemical Society. 125 (35): 10536–10537. CiteSeerX 10.1.1.651.3119. doi:10.1021/ja0353762. PMID 12940733.
- ^ a b Xu, L.; Lam, K. H.; Ji, J.; Wu, J.; Fan, Q. H.; Lo, W. H.; Chan, A. S. C. (2005). "Air-stable Ir-(P-Phos) complex for highly enantioselective hydrogenation of quinolines and their immobilization in poly(ethylene glycol) dimethyl ether (DMPEG)". Chemical Communications (11): 1390–2. doi:10.1039/B416397D. hdl:10397/8906. PMID 15756313.
- ^ Lam, K. H.; Xu, L.; Feng, L.; Fan, Q. H.; Lam, F. L.; Lo, W. H.; Chan, A. S. C. (2005). "Highly Enantioselective Iridium-Catalyzed Hydrogenation of Quinoline Derivatives Using Chiral Phosphinite H8-BINAPO". Advanced Synthesis & Catalysis. 347 (14): 1755. doi:10.1002/adsc.200505130. hdl:10397/26878.
- ^ Wang, Z. J.; Deng, G. J.; Li, Y.; He, Y. M.; Tang, W. J.; Fan, Q. H. (2007). "Enantioselective Hydrogenation of Quinolines Catalyzed by Ir(BINAP)-Cored Dendrimers: Dramatic Enhancement of Catalytic Activity". Organic Letters. 9 (7): 1243–1246. doi:10.1021/ol0631410. PMID 17328554.
- ^ Qiu, L.; Kwong, F. Y.; Wu, J.; Lam, W. H.; Chan, S.; Yu, W. Y.; Li, Y. M.; Guo, R.; Zhou, Z.; Chan, A. S. C. (2006). "A New Class of Versatile Chiral-Bridged Atropisomeric Diphosphine Ligands: Remarkably Efficient Ligand Syntheses and Their Applications in Highly Enantioselective Hydrogenation Reactions". Journal of the American Chemical Society. 128 (17): 5955–5965. doi:10.1021/ja0602694. hdl:10397/60397. PMID 16637664.
- ^ Reetz, M. T.; Li, X. (2006). "Asymmetric hydrogenation of quinolines catalyzed by iridium complexes of BINOL-derived diphosphonites". Chemical Communications (20): 2159–60. doi:10.1039/b602320g. PMID 16703140.
- ^ Rueping; Antonchick, A.; Theissmann, T. (2006). "A highly enantioselective Brønsted acid catalyzed cascade reaction: organocatalytic transfer hydrogenation of quinolines and their application in the synthesis of alkaloids". Angewandte Chemie International Edition in English. 45 (22): 3683–3686. doi:10.1002/anie.200600191. PMID 16639754.
- ^ Tang, W.; Xu, L.; Fan, Q. H.; Wang, J.; Fan, B.; Zhou, Z.; Lam, K. H.; Chan, A. S. C. (2009). "Asymmetric Hydrogenation of Quinoxalines with Diphosphinite Ligands: A Practical Synthesis of Enantioenriched, Substituted Tetrahydroquinoxalines". Angewandte Chemie International Edition. 48 (48): 9135–8. doi:10.1002/anie.200904518. hdl:10397/20432. PMID 19876991.
- ^ Rueping, M.; Tato, F.; Schoepke, F. R. (2010). "The First General, Efficient and Highly Enantioselective Reduction of Quinoxalines and Quinoxalinones". Chemistry: A European Journal. 16 (9): 2688–91. doi:10.1002/chem.200902907. PMID 20140920.
- ^ Glorius, F.; Spielkamp, N.; Holle, S.; Goddard, R.; Lehmann, C. W. (2004). "Efficient Asymmetric Hydrogenation of Pyridines". Angewandte Chemie International Edition. 43 (21): 2850–2. doi:10.1002/anie.200453942. PMID 15150766.
- ^ Ye, Z. S.; Chen, M. W.; Chen, Q. A.; Shi, L.; Duan, Y.; Zhou, Y. G. (2012). "Iridium-Catalyzed Asymmetric Hydrogenation of Pyridinium Salts". Angewandte Chemie International Edition. 51 (40): 10181–4. doi:10.1002/anie.201205187. PMID 22969060.
- ^ Tang, W. J.; Tan, J.; Xu, L. J.; Lam, K. H.; Fan, Q. H.; Chan, A. S. C. (2010). "Highly Enantioselective Hydrogenation of Quinoline and Pyridine Derivatives with Iridium-(P-Phos) Catalyst". Advanced Synthesis & Catalysis. 352 (6): 1055. doi:10.1002/adsc.200900870. hdl:10397/22884.
- ^ Rueping, M.; Antonchick, A. P. (2007). "Organocatalytic Enantioselective Reduction of Pyridines". Angewandte Chemie International Edition. 46 (24): 4562–5. doi:10.1002/anie.200701158. PMID 17492817.
- ^ Kuwano, R.; Sato, K.; Kurokawa, T.; Karube, D.; Ito, Y. (2000). "Catalytic Asymmetric Hydrogenation of Heteroaromatic Compounds, Indoles". Journal of the American Chemical Society. 122 (31): 7614. doi:10.1021/ja001271c.
- ^ Kuwano, R.; Kaneda, K.; Ito, T.; Sato, K.; Kurokawa, T.; Ito, Y. (2004). "Highly Enantioselective Synthesis of Chiral 3-Substituted Indolines by Catalytic Asymmetric Hydrogenation of Indoles". Organic Letters. 6 (13): 2213–2215. doi:10.1021/ol049317k. PMID 15200323.
- ^ Kuwano, R.; Kashiwabara, M.; Sato, K.; Ito, T.; Kaneda, K.; Ito, Y. (2006). "Catalytic asymmetric hydrogenation of indoles using a rhodium complex with a chiral bisphosphine ligand PhTRAP". Tetrahedron: Asymmetry. 17 (4): 521. doi:10.1016/j.tetasy.2006.01.016.
- ^ Kuwano, R.; Kashiwabara, M. (2006). "Ruthenium-Catalyzed Asymmetric Hydrogenation of N-Boc-Indoles". Organic Letters. 8 (12): 2653–2655. doi:10.1021/ol061039x. PMID 16737337.
- ^ Baeza, A.; Pfaltz, A. (2010). "Iridium-Catalyzed Asymmetric Hydrogenation of N-Protected Indoles". Chemistry: A European Journal. 16 (7): 2036–9. doi:10.1002/chem.200903105. PMID 20104554.
- ^ a b Xiao, Y. C.; Wang, C.; Yao, Y.; Sun, J.; Chen, Y. C. (2011). "Direct Asymmetric Hydrosilylation of Indoles: Combined Lewis Base and Brønsted Acid Activation". Angewandte Chemie International Edition. 50 (45): 10661–4. doi:10.1002/anie.201105341. PMID 21932274.
- ^ Duan, Y.; Chen, M. W.; Ye, Z. S.; Wang, D. S.; Chen, Q. A.; Zhou, Y. G. (2011). "An Enantioselective Approach to 2,3-Disubstituted Indolines through Consecutive Brønsted Acid/Pd-Complex-Promoted Tandem Reactions". Chemistry: A European Journal. 17 (26): 7193–7. doi:10.1002/chem.201100576. PMID 21567504.
- ^ a b Kuwano, R.; Kashiwabara, M.; Ohsumi, M.; Kusano, H. (2008). "Catalytic Asymmetric Hydrogenation of 2,3,5-Trisubstituted Pyrroles". Journal of the American Chemical Society. 130 (3): 808–809. doi:10.1021/ja7102422. PMID 18154340.
- ^ a b Wang, D. S.; Ye, Z. S.; Chen, Q. A.; Zhou, Y. G.; Yu, C. B.; Fan, H. J.; Duan, Y. (2011). "Highly Enantioselective Partial Hydrogenation of Simple Pyrroles: A Facile Access to Chiral 1-Pyrrolines". Journal of the American Chemical Society. 133 (23): 8866–8869. doi:10.1021/ja203190t. PMID 21591641.
- ^ Wang, D. S.; Chen, Q. A.; Lu, S. M.; Zhou, Y. G. (2012). "Asymmetric Hydrogenation of Heteroarenes and Arenes". Chemical Reviews. 112 (4): 2557–2590. doi:10.1021/cr200328h. PMID 22098109.
- ^ Ortega, Nuria; Urban, Slawomir; Beiring, Bernhard; Glorius, Frank (2012). "Ruthenium NHC Catalyzed Highly Asymmetric Hydrogenation of Benzofurans". Angewandte Chemie International Edition. 51 (7): 1710–3. doi:10.1002/anie.201107811. PMID 22311814.
- ^ Wysocki, Jędrzej; Ortega, Nuria; Glorius, Frank (2014). "Asymmetric Hydrogenation of Disubstituted Furans". Angewandte Chemie International Edition. 53 (33): 8751–5. doi:10.1002/anie.201310985. PMID 24554623.
- ^ Urban, S.; Beiring, B.; Ortega, N.; Paul, D.; Glorius, F. (2012). "Asymmetric Hydrogenation of Thiophenes and Benzothiophenes". Journal of the American Chemical Society. 134 (37): 15241–15244. doi:10.1021/ja306622y. PMID 22934527.
- ^ a b Heitbaum, M.; Glorius, F.; Escher, I. (2006). "Asymmetric Heterogeneous Catalysis". Angewandte Chemie International Edition. 45 (29): 4732–62. doi:10.1002/anie.200504212. PMID 16802397.
- ^ Yoon, M.; Srirambalaji, R.; Kim, K. (2012). "Homochiral Metal–Organic Frameworks for Asymmetric Heterogeneous Catalysis". Chemical Reviews. 112 (2): 1196–1231. doi:10.1021/cr2003147. PMID 22084838.
- ^ Hu, A.; Ngo, H. L.; Lin, W. (2003). "Chiral Porous Hybrid Solids for Practical Heterogeneous Asymmetric Hydrogenation of Aromatic Ketones". Journal of the American Chemical Society. 125 (38): 11490–11491. doi:10.1021/ja0348344. PMID 13129339.
- ^ Blaser, H. U.; Spindler, F.; Studer, M. (2001). "Enantioselective catalysis in fine chemicals production". Applied Catalysis A: General. 221 (1–2): 119–143. doi:10.1016/S0926-860X(01)00801-8. PMID 12613584.
- ^ Blaser, Hans-Ulrich; Federsel, Hans-Jürgen, eds. (2010). Asymmetric Catalysis on Industrial Scale. Weinheim: Wiley-VCH. pp. 13–16. doi:10.1002/9783527630639. ISBN 978-3-527-63063-9.
- ^ Jacobsen, E.N.; Pfaltz, Andreas; Yamamato, H., eds. (1999). Comprehensive Asymmetric Catalysis. Berlin; New York: Springer. pp. 1443–1445. ISBN 978-3-540-64336-4.








