에난티오머
Enantiomer
화학에서, 에난티오머(/ɪˈnænti).ἐνάντιοςmέροςr, ɛ-, -oʊ-/ih-NAN-te-ə-mər; 고대 그리스어 ə(에난티오스) '반대', μə(메로스) '부분'에서 유래한, 광학 이성질체, 역음 또는 광학 역음이라고도 불리는, 자신의 거울 이미지 상에서 대체할 수 없는 두 개의 입체 이성질체 중 하나입니다.거울상이성질체는 한 사람의 오른손과 왼손과 매우 비슷합니다. 둘 중 하나를 거울에 비추지 않으면, 손은 [5]서로 겹쳐질 수 없습니다.3개 공간 차원에서 방향을 변경해도 키랄 탄소 위의 4개의 고유 그룹(키랄성 참조)이 정확하게 정렬될 수 없습니다.분자가 갖는 입체 이성질체의 수는 분자가 갖는 카이랄 탄소의 수에 의해 결정될 수 있습니다.입체 이성질체는 이성질체와 이성질체를 모두 포함합니다.
거울상이성질체들은 거울상이성질체들과 마찬가지로 같은 분자식을 공유하고 서로에게 중첩될 수 없지만 서로의 [6]거울상은 아닙니다.
키랄성을 가진 분자는 평면 편광된 [7]빛을 회전시킵니다.동일한 양의 각 에난티오머의 혼합물, 즉 인종적 혼합물 또는 인종적 짝은 [8][9]빛을 회전시키지 않습니다.
명명 규칙
주어진 카이랄 분자의 두 개의 거울상이성질체(절대 구성) 중 하나를 지정하기 위한 세 가지 일반적인 명명 규칙이 있습니다. R/S 시스템은 분자의 기하학적 구조에 기초합니다. (또한 오래된 등가물 d-와 l-을 사용하여 작성됨) +- 및 (-) 시스템은 광학 회전 특성에 기초합니다. 그리고 D/L 시스템은 기본입니다.글리세르알데하이드의 거울상이성질체에 대한 분자의 관계를 분석합니다.
R/S 시스템은 카이랄 [11]중심에 대한 분자의 기하학적 구조를 기반으로 합니다.R/S 시스템은 Cahn-Ingold-Prelog 우선 순위 규칙에 의해 할당된 우선 순위 규칙에 기초하여 분자에 할당됩니다. 이 규칙에서 원자 번호가 가장 큰 그룹 또는 원자에 가장 높은 우선 순위가 할당되고 가장 작은 그룹 또는 원자에 가장 낮은 우선 순위가 할당됩니다.
(+)- 및 (-)-는 분자의 광 회전 - 편광에서 [12]분자가 회전하는 방향 - 을 지정하는 데 사용됩니다.분자가 덱스트로터리라고 표시되면 편광면을 시계방향으로 회전하며 (+)로 [11]표시할 수도 있습니다.레보로터리로 표시하면 편광면을 반시계 방향으로 회전하며 (-)[11]로도 표시할 수 있습니다.
왼쪽을 가리키는 라틴어는 laevus와 불길한 단어이고 오른쪽을 가리키는 단어는 덱스터(또는 올바르거나 덕이 있다는 의미에서 직설)입니다.영어 단어 right는 rectus의 동족입니다.이것이 D/L 및 R/S 표기법의 기원이며, 접두사 levo- 및 dextro-를 공통 이름으로 사용한 것입니다.
접두사 ar-는, 라틴어 recto(오른쪽)에서, es-는, 라틴어 sinister(왼쪽)에서, 왼손잡이 [citation needed]분자에 적용됩니다.예: 케타민, 아르케타민, 에스케타민.
키랄리티 센터

비대칭 원자는 입체 중심의 [13][14]한 종류인 키랄리티 센터라고 불립니다.키랄 중심은 키랄 중심[15][16][17] 또는 비대칭 [18]중심이라고도 합니다.일부 소스는 입체 중심, 입체 중심, 입체 원자 또는 입체 중심이라는 용어를 사용하여 키랄리티 [15][17][19]중심을 독점적으로 언급하는 반면, 다른 소스는 다이아스테레오머(에노타이머가 아닌 입체 이성질체)[14][20][21]를 초래하는 중심을 더 광범위하게 언급하기 위해 이 용어를 사용합니다.
비대칭 원자를 정확히 한 개(또는 임의의 홀수) 포함하는 화합물은 항상 카이랄입니다.그러나 짝수 개의 비대칭 원자를 포함하는 화합물은 거울-대칭 쌍으로 배열되기 때문에 키랄성이 결여되기도 하며, 메조 화합물로 알려져 있습니다.예를 들어, 메소 타르타르산(오른쪽 그림)은 두 개의 비대칭 탄소 원자를 가지고 있지만 거울 대칭면이 존재하기 때문에 거울상 이성질체를 나타내지 않습니다.반대로 비대칭 원자를 필요로 하지 않는 축, 평면 [15]: pg. 3 및 나선형 키랄리티와 같은 키랄리티의 형태가 있습니다.
키랄 분자는 반사(Cs) 및 회전 반사 대칭(S2n)이 결여되어 있지만, 다른 분자 대칭을 가질 수 있고, 그 대칭은 키랄 점군들 중 하나인n C, Dn, T, O 또는 I에 의해 기술됩니다.예를 들어, 과산화수소는 카이랄성이고 C (이중 회전) 대칭을 갖습니다2.일반적인 카이랄 경우는 점군1 C로 대칭이 없음을 의미하며 젖산의 경우입니다.
예

그러한 에난티오머의 한 예는 1957년부터 1961년까지 전세계 여러 나라에서 판매된 진정제 탈리도마이드입니다.선천성 기형을 유발하는 것으로 밝혀지면서 시장에서 철수했습니다.하나의 엔안티오머는 바람직한 진정 효과를 유발했고, 다른 하나는 어쩔[22] 수 없이 동일한 양으로 존재하여 선천적 [23]결함을 유발했습니다.
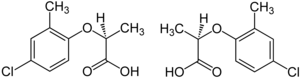
제초제 메코프로프는 (R)-(+)-엔안티오머 ("Mecoprop-P", "Duplosan KV")가 제초 [24]활성을 가지고 있는 인종적 혼합물입니다.
다른 예로는 항우울제인 에스시탈로프람과 시탈로프람이 있습니다.시탈로프람은 (S)-시탈로프람과 (R)-시탈로프람의 1:1 혼합물이며, 에스시탈로프람은 순수한 에난티오머입니다.일반적으로 에시탈로프람의 투여량은 시탈로프람의 투여량의 1/2입니다.여기서, (S)-시탈로프람은 시탈로프람의 카이랄 스위치(chiral switch)라고 불립니다.
카이랄 약물
엔티오퓨어 화합물은 두 개의 엔티오머 중 하나로만 이루어져 있습니다.그러한 조성물은 치료 [25]효능이 향상되기 때문에, 항균성은 실용적으로 중요합니다.인종차별 약물에서 항진균 약물로 전환하는 것을 카이랄 스위치라고 합니다.많은 경우, 거울상이성질체는 뚜렷한 효과를 갖습니다.한가지 경우는 프로폭시펜의 경우입니다.프로폭시펜은 일라이 릴리와 회사에서 별도로 판매합니다.파트너 중 한 명은 진통제인 덱스트로폭시페네이고 다른 한 명은 효과적인 진탕제인 레보프로폭시페네라고 불립니다.[26][27]DARVON과 NOBRAD라는 약품의 상호명도 화학적 거울-이미지 관계를 반영한다는 것은 흥미로운 일입니다.그 외의 경우에는 환자에게 어떠한 임상적 이점도 없을 수 있습니다.일부 지역에서는 단일항체 약물이 라세믹 [28]혼합물과 별도로 특허를 받을 수 있습니다.거울상이성질체 중 하나만 활성일 가능성이 있습니다.또는, 둘 다 활성인 것일 수도 있고, 이 경우 혼합물을 분리하는 것은 객관적인 이점은 없지만, 약물의 특허성을 [29]확장합니다.
선택적 제제 활성화
효과적인 이성질체 환경(전구체, 카이랄 촉매, 또는 운동 분해능)이 없는 경우, 특정한 이성질체 혼합물이 이성질체 집합체의 형태로 자발적으로 결정화되지만, 이성질체 혼합물을 이성질체 성분으로 분리하는 것은 불가능합니다.여기서 거울상이성질체의 결정은 물리적으로 분리되고 기계적으로 분리될 수 있습니다.하지만, 대부분의 인종은 두 이성질체를 포함하는 결정체를 1:1 비율로 형성합니다.
그의 선구적인 연구에서, 루이스 파스퇴르는 개별적인 거울상이성질체들이 용액으로부터 따로 결정화되기 때문에 나트륨 암모늄 타르트레이트의 이성질체들을 분리할 수 있었습니다.확실히 동일한 양의 반동형 결정이 생성되지만, 두 종류의 결정은 핀셋으로 분리할 수 있습니다.이런 행동은 특이합니다.덜 일반적인 방법은 enantiomer self-disportion입니다.
두 번째 전략은 비대칭 합성입니다: 높은 엔티오머 과량으로 원하는 화합물을 제조하기 위해 다양한 기술을 사용하는 것입니다.포괄하는 기술은 키랄 출발 물질의 사용(키랄 풀 합성), 키랄 보조제 및 키랄 촉매의 사용, 비대칭 유도의 적용을 포함합니다.효소(생물 촉매)의 사용은 또한 원하는 화합물을 생성할 수 있습니다.
세 번째 전략은 두 개의 에난티오머를 모두 사용하여 라세믹 전구체로부터 하나의 에난티오머의 합성인 에난티오콘센트 합성입니다.카이랄 촉매제를 사용함으로써 반응물의 두 거울상이성질체는 [30]생성물의 단일 거울상이성질체를 생성합니다.
주어진 온도와 시간 척도에서 인종화(인종 혼합물을 생성하기 위해 에난티모프 간의 상호 변환)를 위한 접근 가능한 경로가 있다면 에난티모머는 분리될 수 없을 수 있습니다.예를 들어, 3개의 상이한 치환기를 갖는 아민은 카이랄성이지만, 몇 가지 예외(예: 치환된 N-클로로아지리딘)를 제외하고 실온에서 빠르게 "우산 반전"을 일으켜 인종화로 이어집니다.레이스미즈화가 충분히 빠르면 분자는 종종 카이랄 평균 구조로 취급될 수 있습니다.
패리티 위반
모든 목적과 목적을 위해, 한 쌍의 각각의 에난티오머는 같은 에너지를 가집니다.그러나 이론 물리학은 약한 핵력(자연계에서 "오른쪽에서 왼쪽을 구분할 수 있는" 유일한 힘)의 패리티 위반으로 인해 약한 중성 전류 메커니즘으로 인해 거울상이성질체 사이에−12−10 실제로 미세한 에너지 차이가 있다고 예측합니다.이러한 에너지의 차이는 분자 형태의 작은 변화에 의한 에너지 변화보다 훨씬 작고, 현재의 기술로 측정하기에는 너무 작기 때문에 화학적으로 [16][31][32]중요하지 않습니다.입자 물리학자들이 사용하는 의미에서, 원래의 분자와 정확히 같은 질량 에너지 함량을 가진 분자의 "진정한" 에난티오머는 반물질(반양성자, 반중성자, 양전자)[16]로부터 만들어진 거울상입니다.이 글 전체에서 "엔안티오머(enantiomer)"는 거울 이미지 상에서 중첩될 수 없는 일반 물질의 화합물의 화학적 의미에서만 사용됩니다.
준대칭자
준 거울상이성질체는 엄밀하게 거울상이성질체는 아니지만 마치 그런 것처럼 행동하는 분자 종입니다.준항성체에서는 분자의 대부분이 반사되지만, 분자 내의 원자나 그룹은 유사한 원자나 [33]그룹으로 바뀝니다.준항이성질체는 분자 내의 원자나 그룹이 [34]대체되면 항이성질체가 될 가능성이 있는 분자로 정의될 수도 있습니다.준항이성질체의 예로는 (S)-브로모부탄과 (R)-아이오도부탄이 있습니다.정상 조건에서 (S)-브로모부탄 및 (R)-요오드부탄에 대한 에난티오머는 각각 (R)-브로모부탄 및 (S)-요오드부탄에 대한 에난티오머입니다.준 거울상이성질체는 또한 [33]준 거울상이성질체의 동등한 혼합물을 형성한다는 점에서 일반적인 이성질체와 유사한 준 거울상이성질체를 생성할 것입니다.
실제 거울상이성질체로 간주되지는 않지만, 준 거울상이성질체에 대한 명명 규칙도 기하학적 기준에서 고려되는 (R) 및 (S) 구성을 볼 때 거울상이성질체와 같은 경향을 따릅니다(Cahn-Ingold-Prelog 우선 순위 규칙 참조.
준 거울상이성질체는 평행 운동 [35]분해능에 응용됩니다.
참고 항목
참고문헌
- ^ "Compare Synonyms: See How The Synonyms Differ". Thesaurus.com. Retrieved 2022-11-17.
- ^ Chemistry (IUPAC), The International Union of Pure and Applied. "IUPAC - optical isomers (O04308)". goldbook.iupac.org. doi:10.1351/goldbook.O04308. Retrieved 2022-11-17.
- ^ Chemistry (IUPAC), The International Union of Pure and Applied. "IUPAC - antipodes (A00403)". goldbook.iupac.org. doi:10.1351/goldbook.A00403. Retrieved 2022-11-17.
- ^ Chemistry (IUPAC), The International Union of Pure and Applied. "IUPAC - optical antipodes (O04304)". goldbook.iupac.org. doi:10.1351/goldbook.O04304. Retrieved 2022-11-17.
- ^ McConathy, Jonathan; Owens, Michael J. (2003). "Stereochemistry in Drug Action". Primary Care Companion to the Journal of Clinical Psychiatry. 5 (2): 70–73. doi:10.4088/pcc.v05n0202. ISSN 1523-5998. PMC 353039. PMID 15156233.
- ^ Smith, Michael B.; March, Jerry (2007), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th ed.), New York: Wiley-Interscience, ISBN 978-0-471-72091-1
- ^ "Chirality and Optical Activity". chemed.chem.purdue.edu. Retrieved 2022-11-17.
- ^ Chemistry (IUPAC), The International Union of Pure and Applied. "IUPAC - racemic (R05026)". goldbook.iupac.org. doi:10.1351/goldbook.R05026. Retrieved 2022-11-17.
- ^ Chemistry (IUPAC), The International Union of Pure and Applied. "IUPAC - racemate (R05025)". goldbook.iupac.org. doi:10.1351/goldbook.R05025. Retrieved 2022-11-17.
- ^ Weber, Erin. "Library Guides: CHEM 221: Stereochemistry / Isomerism". libraryguides.salisbury.edu. Retrieved 2022-11-17.
- ^ a b c Brewster, James H. (December 1986). "The distinction of diastereomers in the Cahn-Ingold-Prelog (RS) notation". The Journal of Organic Chemistry. 51 (25): 4751–4753. doi:10.1021/jo00375a001. ISSN 0022-3263.
- ^ Caldwell, John; Wainer, Irving W. (December 2001). "Stereochemistry: definitions and a note on nomenclature". Human Psychopharmacology: Clinical and Experimental. 16 (S2): S105–S107. doi:10.1002/hup.334. ISSN 0885-6222. PMID 12404716. S2CID 12367578.
- ^ IUPAC, 화학 용어 해설서, 제2판("골드북") (1997).온라인 수정 버전: (2006–) "Chirality center", Doi:10.1351/goldbook.C01060
- ^ a b Wade, LeRoy G. (2006). "Precision in Stereochemical Terminology". J. Chem. Educ. 83 (12): 1793. Bibcode:2006JChEd..83.1793W. doi:10.1021/ed083p1793. ISSN 0021-9584.
- ^ a b c Karras, Manfred (2018). "Synthesis of Enantiomerically Pure Helical Aromatics Such As NHC Ligands and Their Use in Asymmetric Catalysis (PhD). Charles University. Retrieved 6 August 2021.
- ^ a b c Eliel, Ernest L.; Wilen, Samuel H.; Mander, Lewis N. (1994). Stereochemistry of organic compounds. New York: Wiley. ISBN 0471016705. OCLC 27642721.
- ^ a b Clayden, Jonathan; Greeves, Nick; Warren, Stuart G. (2012). Organic chemistry. Oxford: Oxford University Press. ISBN 978-0-19-927029-3. OCLC 761379371.
- ^ IUPAC, 화학 용어 해설서, 제2판("골드북") (1997).온라인 수정 버전: (2006–) "비대칭 중심". doi:10.1351/goldbook.A00480
- ^ Clark, Andrew; Kitson, Russell R. A.; Mistry, Nimesh; Taylor, Paul; Taylor, Matthew; Lloyd, Michael; Akamune, Caroline (2021). Introduction to stereochemistry. Cambridge, UK. ISBN 978-1-78801-315-4. OCLC 1180250839.
{{cite book}}: CS1 유지 관리: 위치 누락 게시자(링크) - ^ IUPAC, 화학 용어 해설서, 제2판("골드북") (1997).온라인 수정 버전: (2006–) "스테레오겐/스테레오 원소(stereogenic unit)", Doi: 10.1351/goldbook.S05980
- ^ Mislow, Kurt; Siegel, Jay (1984). "Stereoisomerism and local chirality". J. Am. Chem. Soc. 106 (11): 3319–3328. doi:10.1021/ja00323a043. ISSN 0002-7863.
- ^ Knoche, B; Blaschke, G (1994). "Investigations on the in vitro racemization of thalidomide by high-performance liquid chromatography". Journal of Chromatography A. 666 (1–2): 235–240. doi:10.1016/0021-9673(94)80385-4.
- ^ Voet, Donald; Voet, Judith G.; Pratt, Charlotte W. (2006). Fundamentals of Biochemistry. p. 89. ISBN 0-471-21495-7.
- ^ G. Smith; C. H. L. Kennard; A. H. White; P. G. Hodgson (April 1980). "(±)-2-(4-Chloro-2-methylphenoxy)propionic acid (mecoprop)". Acta Crystallogr. B. 36 (4): 992–994. doi:10.1107/S0567740880005134.
- ^ Ariëns, Everardus J. (1986). "Stereochemistry: A source of problems in medicinal chemistry". Medicinal Research Reviews. 6 (4): 451–466. doi:10.1002/med.2610060404. ISSN 0198-6325. PMID 3534485. S2CID 36115871.
- ^ Drayer, Dennis E (1986). "Pharmacodynamic and pharmacokinetic differences between drug enantiomers in humans: An overview". Clinical Pharmacology and Therapeutics. 40 (2): 125–133. doi:10.1038/clpt.1986.150. ISSN 0009-9236. PMID 3731675. S2CID 33537650.
- ^ Ariens, E.J (1989). Chiral Separations by HPLC. Chichester: Ellis Horwwod. pp. 31–68.
- ^ "European Medicines Agency - - Sepracor Pharmaceuticals Ltd withdraws its marketing authorisation application for Lunivia (eszopiclone)". www.ema.europa.eu. 17 September 2018.
- ^ Merrill Goozner (2004). The $800 Million Pill: The Truth Behind the Cost of New Drugs (excerpt). University of California Press. ISBN 0-520-23945-8.
- ^ Mohr, J.T.; Moore, J.T.; Stoltz, B.M. (2016). "Enantioconvergent catalysis". Beilstein J. Org. Chem. 12: 2038–2045. doi:10.3762/bjoc.12.192. PMC 5082454. PMID 27829909. Retrieved 4 August 2021.
- ^ Albert, Guijarro (2008). The origin of chirality in the molecules of life: a revision from awareness to the current theories and perspectives of this unsolved problem. Yus, Miguel. Cambridge, UK: Royal Society of Chemistry. ISBN 9781847558756. OCLC 319518566.
- ^ Stickler, Benjamin A.; Diekmann, Mira; Berger, Robert; Wang, Daqing (2021-09-14). "Enantiomer Superpositions from Matter-Wave Interference of Chiral Molecules". Physical Review X. 11 (3): 031056. arXiv:2102.06124. Bibcode:2021PhRvX..11c1056S. doi:10.1103/PhysRevX.11.031056. ISSN 2160-3308. S2CID 231879820.
- ^ a b Zhang, Qisheng; Rivkin, Alexey; Curran, Dennis P. (2002-05-01). "Quasiracemic Synthesis: Concepts and Implementation with a Fluorous Tagging Strategy to Make Both Enantiomers of Pyridovericin and Mappicine". Journal of the American Chemical Society. 124 (20): 5774–5781. doi:10.1021/ja025606x. ISSN 0002-7863. PMID 12010052.
- ^ Zhang, Qisheng; Curran, Dennis P. (2005-08-19). "Quasienantiomers and Quasiracemates: New Tools for Identification, Analysis, Separation, and Synthesis of Enantiomers". Chemistry - A European Journal. 11 (17): 4866–4880. doi:10.1002/chem.200500076. ISSN 0947-6539. PMID 15915521.
- ^ G.S. 콤바리데스, M. 딩잔, J. 임스, A.플린, J. 노던, Y.요하네스, 사면체 Lett. 46 (2005), p. 2897er
외부 링크
 Wikimedia Commons의 Enantiomers 관련 미디어
Wikimedia Commons의 Enantiomers 관련 미디어- chemwiki:cycloisomerism


