카포시 육종 관련 헤르페스 바이러스
Kaposi's sarcoma-associated herpesvirus| 인간감마헤르페스바이러스8 | |
|---|---|
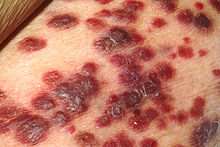 | |
| 카포시육종 | |
| 바이러스분류 | |
| (순위 없음): | 바이러스 |
| 영역: | 뒤플로드나비리아 |
| 왕국: | 흥공비래 |
| 문: | 페플로비코타속 |
| 클래스: | Herviviricetes |
| 순서: | 헤르페스바이러스속 |
| 가족: | 오르토헤르페스바이러스과 |
| 속: | 라디노바이러스 |
| 종: | 인간감마헤르페스바이러스8 |
카포시의 육종 관련 헤르페스 바이러스(KSHV)는 9번째로 알려진 인간 헤르페스 바이러스이며, 국제 바이러스 분류 위원회(ICTV)에 따르면 공식적인 이름은 인간 감마 헤르페스 바이러스 8 또는 줄여서 HHV-8입니다.[1] 다른 헤르페스 바이러스와 마찬가지로 비공식적인 이름은 공식적인 ICTV 이름과 혼용됩니다. 이 바이러스는 에이즈 환자에게 흔히 발생하는 암인 카포시 육종을 [2]비롯해 원발성 삼출림프종,[3] HHV-8 연관 다기관 캐슬만병, KSHV 염증성 사이토카인 증후군을 유발합니다.[4] 현재 알려진 7가지 인간 암 바이러스 중 하나, 또는 종양 바이러스입니다.[2] KSHV/HHV8이 발견된 지 수년이 지난 지금까지도 KSHV 관련 종양 발생에 대한 알려진 치료법은 없습니다.
역사
1872년, 모리츠 카포시는 그 후로 카포시 육종(KS)이라는 가명으로 명명된 혈관 종양(원래는[5] "특발성 피부 다발성 색소 육종"이라고 불림)을 기술했습니다. KS는 나중에 사하라 사막 이남의 아프리카 인구에 걸쳐 매우 흔한 것으로 밝혀지기 전까지 처음에는 유대인과 지중해 인구의 흔치 않은 종양으로 생각되었습니다. 이것은 1950년대에 이 종양이 바이러스에 의한 것일 수 있다는 최초의 제안으로 이어졌습니다. 1980년대 초 에이즈 전염병이 시작되면서 에이즈 환자에게 영향을 미치는 KS가 갑자기 재발했는데, 보고된 에이즈 환자의 최대 50%가 이 종양을 가지고 있어 암에 걸릴 확률이 매우 높습니다.[6]
발레리 베랄(Valerie Beral), 토마스 페터만(Thomas Peterman), 해롤드 제페([7]Harold Jaffe)의 역학 데이터를 주의 깊게 분석한 결과, 이 연구자들은 KS가 에이즈에서처럼 숙주가 면역 억제되지 않는 한 종양을 거의 일으키지 않는 알려지지 않은 성 매개 바이러스에 의해 발생한다고 제안했습니다.[citation needed]

일찍이 1984년에 과학자들은 전자현미경으로 관찰한 KS 종양에서 헤르페스바이러스와 유사한 구조를 보고했습니다. 과학자들은 KS를 유발하는 물질을 찾고 있었고, 가능한 원인으로 거대세포바이러스와 HIV 자체를 포함하여 20개 이상의 물질이 제안되었습니다. 이 병원체는 결국 1994년 위안창과 패트릭 S에 의해 확인되었습니다. 컬럼비아 대학의 아내이자 남편인 무어 교수팀은 에이즈 환자의 KS 종양에서 발견된 헤르페스 바이러스의 DNA 조각을 분리해냈습니다.[8][9][10] Chang과 Moore는 표현 차이 분석, 즉 RDA를 사용하여 에이즈 환자의 KS 종양 조직을 영향을 받지 않은 자신의 조직과 비교하여 KSHV를 찾았습니다. 이 실험의 배경에는 바이러스가 KS를 일으킨다면 두 샘플의 유전체 DNA는 바이러스에 속하는 DNA를 제외하고는 정확히 일치해야 한다는 생각이 있었습니다. 그들의 초기 RDA 실험에서 그들은 실제 바이러스 유전체의 1% 미만을 나타내는 두 개의 작은 DNA 조각을 분리했습니다. 이 조각들은 알려진 헤르페바이러스 서열과 유사하지만 여전히 구별되며, 이는 새로운 바이러스의 존재를 나타냅니다. 이 조각들로부터 시작하여, 이 연구팀은 2년도 채 지나지 않아 바이러스의 전체 유전체의 염기서열을 분석할 수 있었습니다.[citation needed]
이 헤르페스 바이러스의 발견은 KSHV가 실제로 카포시 육종의 원인 물질이라는 것을 보여주는 충분한 데이터가 수집될 때까지 상당한 논란과 과학적 싸움을 일으켰습니다.[11] 이 바이러스는 현재 사하라 사막 이남의 아프리카에 사는 사람들의 광범위한 감염으로 알려져 있으며 중간 수준의 감염은 지중해 인구(레바논, 사우디아라비아, 이탈리아, 그리스 포함)에서 발생하고 대부분의 북유럽 및 북미 인구에서 낮은 수준의 감염이 발생합니다. 동성애자와 양성애자 남성은 (아직 알려지지 않은 성적 전염 경로를 통해) 감염에 더 취약한 반면, 바이러스는 개발도상국에서 비성적 경로를 통해 전염됩니다.[citation needed]
바이러스학
KSHV는 헤르페스 바이러스로, 캡시드라고 불리는 핵산을 포장하는 단백질을 덮고 있는 커다란 이중가닥 DNA 바이러스이며, 그 다음 외피라고 불리는 비정질 단백질 층으로 둘러싸여 있고, 마지막으로 세포막에서 부분적으로 유래된 지질 외피에 둘러싸여 있습니다. KSHV는 길이가 약 165,000개의 핵산 염기인 게놈을 가지고 있습니다. 바이러스 유전체는 ~145 킬로베이스 길이의 고유 영역으로 구성되며, 모든 발현된 바이러스 유전자를 암호화하며, 이 영역에는 ~20-30 킬로베이스의 말단 반복 서열이 있습니다.[12] 각 터미널 반복 장치는 길이가 801bp이고 G+C 함량이 85%이며 반복적인 머리에서 꼬리로 향합니다. KSHV는 숙주 세포로부터, 보체 결합 단백질을 암호화하는 유전자, IL-6, BCL-2, 사이클린-D, G 단백질 결합 수용체, 인터페론 조절 인자 및 Flice 억제 단백질(FLIP)을 포함하는 수많은 유전자를 훔쳤기 때문에 주목할 만한 헤르페스 속인, radino바이러스 디히드로폴레이트 환원효소, 티미딘 키나제, 티미딜레이트 합성효소, DNA 중합효소 등을 포함하는 DNA 합성 단백질. 다른 인간 종양 바이러스는 이러한 동일한 유전자를 가지고 있지 않지만, 다른 종양 바이러스는 기본적인 수준에서 모든 종양 바이러스가 동일한 세포 제어 경로, 소위 종양 억제 경로를 공격하는 것으로 보인다는 것을 보여줍니다.[citation needed]
세포 내로 KSHV가 진입하는 데 중요한 것은 EPH 수용체 A2,[14] Hrs,[15] TSG101 [16]및 소수의 인테그린(그들의 정체는 아직 확인되지 않음)입니다.[17] 감염 후 바이러스는 매크로이노솜을 통해 림프구로 들어갑니다.[citation needed] 바이러스가 세포에 새로 감염되면 지질막이 벗겨지고 비리온이 핵으로 이동합니다. 바이러스 유전체는 말단 반복의 상동 재조합을 포함하는 것으로 보이는 잘 이해되지 않은 과정을 통해 에피솜으로 순환되는 곳에서 방출됩니다.[citation needed] 바이러스 에피솜은 숙주 세포 핵에 들어가면 염색질화됩니다.[18]
바이러스는 일반적으로 유입된 후 잠복 상태("조용한")를 유지합니다. 레이턴시 관련 핵항원(LANA), vFLIP, vCyclin 및 12개의 마이크로RNA를 포함하여 KSHV 레이턴시 관련 영역(KLAR)에서 인코딩된 유전자의 하위 집합만 레이턴시 동안 발현됩니다. 잠복기는 모든 KSHV 관련 종양 발생을 포함하여 현재까지 알려진 모든 KSHV 관련 병인의 특징입니다. LANA와 같은 단백질 코딩 유전자와 KLAR에 암호화된 비코딩 유전자(microRNA) 모두 KSHV 관련 종양 발생에 중요한 것으로 나타났습니다. 마이크로RNA의 기능을 연구하기 위해, bacmid 돌연변이 유발의 상세한 프로토콜과 마이크로RNA 결손 돌연변이를 운반하는 완전한 세포주 세트가 확립되었고 연구자들에게 자원으로 이용 가능합니다.[19] 또한 vFLIP와 vCyclin은 발암성 숙주 mir17-92 군집을 유도하여 TGF-β 신호전달 경로를 간접적으로 방해하는 것으로 나타났습니다.[20] 이러한 관찰은 KS의 특징인 KSHV 종양 발생 및 혈관 발생에 중요할 수 있는 새로운 기전을 나타냅니다.[citation needed]
잠복기 동안 LANA는 숙주 복제 기계에 의해 수행되는 바이러스 복제에 필요한 유일한 바이러스 단백질입니다. LANA는 바이러스 DNA를 세포 염색체에 묶고, p53 및 망막모세포종 단백질을 억제하며, 완전한 바이러스 생산 및 조립에 필요한 바이러스 유전자("용해 복제")를 억제합니다. 잠복기 동안 발현되는 바이러스 유전자의 일부만 완전히 이해되지 않는 이유. 그러나 잠복기 관련 유전자 발현은 KSHV 에피솜이 잠복기 동안 획득하는 특징적인 후성유전학적 상태에 의해 부분적으로 설명될 수 있는 것으로 나타났습니다. LANA는 잠복기 동안 중요한 역할을 하며 숙주 및 바이러스 전사체를 조절하고 여러 활성 프로모터에 결합합니다. 또한 염색질에서 H3K4me3 마크를 생성하는 숙주 단백질 hSET1과 결합합니다.[21]
염증과 같은 다양한 신호가 바이러스를 자극하여 용해 복제에 들어갈 수 있습니다. 잠복 복제와 용해 복제 사이의 전환을 담당하는 주요 바이러스 단백질은 ORF50 복제 트랜스액티베이션 활성화제(RTA)로 알려져 있습니다. 세포 신호 전달 조건이 RTA의 생성을 활성화하면, 그것은 결국 바이러스 캡시드의 구성 요소와 바이러스 유전체 복제에 필요한 DNA 합성 효소를 만드는 정형화된 2차 및 3차 바이러스 단백질 캐스케이드의 합성을 활성화합니다.[22] 용해 복제 동안 바이러스 유전체는 에피솜(이른바 롤링 서클 모델)에서 연속적인 선형 분자로 복제되는 것으로 여겨집니다. 각 단위 게놈이 복제되면서 말단 반복 영역 내에서 절단된 후 바이러스 입자(virion)로 패키징됩니다. 그러면 바이러스는 세포 밖으로 나가기 위해 핵과 세포질을 통과하면서 지질막으로 둘러싸이게 됩니다. 따라서 KSHV 유전체는 잠복 감염된 세포의 핵에서 원형인 반면, 선형 분자로 감염성 바이러스로 포장됩니다. 바이러스가 용해성 복제에 들어가면 단일 세포에서 수천 개의 바이러스 입자가 만들어질 수 있고, 이는 보통 감염된 세포의 죽음을 초래합니다.[citation needed]
코로나19 및 KSHV
2020년 코로나19를 일으키는 바이러스인 SARS-CoV-2 바이러스에 감염되면 인체 내에서 KSHV의 용해 재활성화를 유도해 헤르페스 바이러스가 잠복기를 멈추고 암세포 형성을 시작할 수 있다는 사실이 밝혀졌습니다. 또한, SARS-CoV-2 감염을 치료하기 위해 사용된 일부 약물, 즉 Nafamostat와 Azithromycin은 성숙한 비리온의 생성을 촉진하여 "... 잠재적으로 KSHV 용해 재활성화를 유도"하는 것으로 밝혀졌습니다.[23]
병태생리학
바이러스가 감염되는 메커니즘은 잘 알려져 있지 않습니다. 건강한 사람은 바이러스에 감염될 수 있고, 감염을 억제하는 면역 체계의 능력 때문에 징후나 증상을 보이지 않습니다. 감염은 면역력이 저하된 사람들에게 특히 중요합니다. 항암 치료를 받는 암 환자, 에이즈 환자, 장기 이식 환자 모두 감염 징후를 보일 위험이 높습니다.[citation needed]
최근 시퀀싱 기술의 발전으로 바이러스가 잠복기 동안 염색질화된다는 사실이 밝혀졌습니다. 또한 바이러스로 암호화된 microRNA가 숙주 mRNA뿐만 아니라 숙주 long-non-coding RNA(lncRNA)를 조작하고 상호작용하는 것으로 나타났습니다.[24] 최근에는 원형으로최근 EBV와 KSHV 모두에서 RNA(circRNA)가 발견되었습니다.
이 바이러스에 감염되는 것은 평생이라고 생각되지만, 건강한 면역 체계가 바이러스를 억제할 것입니다. KSHV에 감염된 많은 사람들은 결코 어떠한 증상도 보이지 않을 것입니다. 카포시 육종은 KSHV에 감염된 사람이 에이즈나 진료, 또는 아주 드물게 노화로 인해 면역력이 저하될 때 발생합니다.
KSHV는 4가지 질병의 원인으로 알려져 있습니다.[4][28]
- 카포시 육종 – 피부(가장 자주), 림프절 또는 내장을 침범할 수 있는 혈관증식 종양,
- HHV-8 관련 다심성 캐슬만병 – 림프증식성 질환,
- 원발성 삼출 림프종 – KSHV 관련 공격성 림프종은 형질세포라고 하는 미성숙 형질세포이며, 형질세포 분화를 갖는 림프성 신생물의 한 유형으로 간주되는 B-세포를 포함하며,
- KSHV 염증성 사이토카인 증후군 – MCD와 유사한 증상이 있지만 관련 병리학이 없는 증후군.
역학
1970년대 HHV-8의 전 세계 유병률은 2~10%[29]였습니다. HHV-8의 혈청 유병률은 지리적으로 크게 다르며 북유럽, 동남아시아 및 카리브해 국가의 감염률은 2-4%,[30] 지중해 국가는 약 10%, 사하라 사막 이남 아프리카 국가는 약 40%[31]입니다. 남미에서는 전반적으로 감염률이 낮지만 미국인들 사이에서는 높은 편입니다.[32] 개별 국가 내에서도 중국 후베이성의 약 9.5%에 비해 신장은 약 19.2%의 감염률을 보이는 등 지역에 따라 상당한 변이가 관찰될 수 있습니다.[33] 혈청 유병률은 연령이 증가함에 따라 선형적으로 증가하는 것으로 일관되게 [33][34][35][36]나타났지만, 감염률이 높은 국가는 젊은 연령층에서 더 높은 혈청 유병률을 보일 수 있습니다.[37] 교육 수준은 감염률과 역의 상관관계를 보였습니다.[34][35] HIV-1이나 생식기 사마귀에 감염된 사람은 일반적으로 HHV-8에 공동 감염될 가능성이 더 높습니다.[31][33][38]
혈청 유병률이 낮은 국가에서 HHV-8은 주로 에이즈와 KS 환자로 제한됩니다.[39] 혈청 유병률이 높은 국가에서는 소아기에 감염이 빈번하여 [40]타액에 의한 모자간 전염 가능성이 있음을 나타냅니다.[41][42] 잠비아의 한 조사에서 KS에 걸린 모든 아이들이 HHV-8에 양성 반응을 보인 엄마가 있는 반면, KS에 걸린 모든 아이들이 HHV-8에 양성 반응을 보인 것은 아니었습니다.[43] 또 다른 잠비아 조사에서는 4세까지 HHV-8에 대해 13.8%의 어린이가 혈청 양성이었습니다.[44] 혈청 유병률은 성별이나 결혼 여부 때문에 크게 달라지지 않는 것으로 나타났습니다.[36]
진화
가장 최근에 지중해와 이란, 중국 신장에서 발견된 이 바이러스의 공통 조상은 29,872년 전(95% 최고 확률밀도 26,851–32,760년)에 진화한 것으로 추정됩니다.[45] 신장에서 분리된 바이러스의 가장 최근 공통 조상은 2037년 전(95% 최고 확률밀도 1843–2229년)입니다. 로마 시대에 지중해와 신장 사이의 역사적 연관성으로 볼 때 이 바이러스가 실크로드를 따라 신장에 유입되었을 가능성이 높아 보입니다. 돌연변이율은 연간 사이트당 3.44×10−6 치환(95% 가장 높은 확률 밀도 2.2×10−6 ~ 4.71×10−6)으로 추정되었습니다. 그러나 KSHV의 다양한 유전자형의 세계적인 분포와 잠재적인 전파 경로는 더 많은 연구가 필요합니다.[citation needed]
분리주의 유형은 가변 K1 막 단백질을 기반으로 합니다. 6가지 유형이 인정됩니다(A~F).[46]
예방
KSHV에 감염된 사람은 무증상으로 바이러스를 주기 때문에 성 파트너는 보호되지 않은 성관계를 가질 때 주의해야 하며 성행위 중 타액이 공유될 수 있는 활동을 해야 합니다. 필요할 때 콘돔을 사용하고 KSHV 및 HIV 감염이 있거나 상태가 알려지지 않은 파트너와 깊은 키스를 하지 않는 것이 신중한 조언입니다.
치료
카포시 육종은 일반적으로 수술이나 국소 방사선 조사를 통해 치료할 수 있는 국소 종양입니다. 특히 침습성 질환의 경우 리포솜 안트라사이클린이나 파클리탁셀과 같은 약물을 사용한 화학요법이 사용될 수 있습니다. KSHV와 같은 헤르페스 바이러스의 복제를 표적으로 하는 간시클로비르와 같은 항바이러스제는 일단 종양이 발생하면 이러한 약물이 거의 또는 전혀 사용되지 않지만 카포시 육종의 발생을 성공적으로 방지하는 데 사용되었습니다.[47] 에이즈-KS 환자에게 가장 효과적인 치료법은 HIV 감염을 줄이기 위한 활동성이 높은 항레트로바이러스 요법입니다.[48] 적절한 항HIV 치료를 받는 에이즈 환자는 카포시의 육종 발생을 최대 90%까지 감소시킬 수 있습니다.
KSHV가 숙주 면역계에 영향을 주지만, 이 변화를 회복하기 위한 임상적 개입의 가능성은 충분합니다. 한 가지 과제는 표적 세포 억제 면역의 과발현 억제입니다. 오랜 시간 염증 자극을 받으면 표적 세포가 반응하지 못하게 되고, 이로 인해 표현형이 고갈됩니다. 활성화 면역 요법은 면역 세포 기능을 되살리고 향상시킬 수 있습니다. 다른 면역 요법과 비교하여, 항-프로그래밍된 세포 사멸 단백질 1(PD-1)/프로그래밍된 사멸-리간드 1(PD-L1)을 표적으로 하는 치료법은 큰 성공을 거두었습니다. 단핵구는 KSHV 감염으로 인해 억제 분자인 PD-1의 발현을 증가시키고, 많은 종양 유형에서 면역 탈출을 유발합니다. KS-HIV 환자의 NK 세포에서 PD-1 발현이 높고 표현형이 고갈됩니다. 항PD-1 항체(니볼루맙 또는 펨브롤리주맙)는 유의한 항종양 효과를 나타냈습니다. Nivolumab은 현재 임상1상을 진행 중이며, Pembrolizumab은 임상1상에서 HIV와 KS 환자의 치료에 그 기능을 보여주었고 치료를 위한 임상2상을 진행 중입니다. 탈리도마이드 아날로그 의약품 – 포말리도마이드도 2011년 FDA로부터 허가를 받았습니다. 포말리도마이드는 세포 독성 T 세포에 세포 내 단백질을 표시하는 것을 돕는 MHC-1의 발현을 회복시키는 것으로 나타났으며, 또한 PD-L1의 발현을 억제하고 CD8+ T 세포 사멸을 증가시킬 수 있습니다.[49]
KSHV 유전자
KSHV는 ~90개의 유전자와 microRNA와 같은 다수의 비암호화 RNA를 암호화합니다.[50] "ORF" 유전자는 최초로 기술된, 헤르페스바이러스 사이미리(herpesvirus saimiri)의 상동 유전자의 게놈 위치에 기초하여 명명됩니다. "K" 유전자는 KSHV에 고유하고, 일부 KSHV 유전자는 기능이 잘 특성화되어 있는 반면, 다른 유전자는 특성화되지 않은 상태로 남아 있습니다.[citation needed]
ORF2 – 디히드로폴레이트 환원효소
ORF8 – gB – 바이러스 진입에 관여하는 외피 당단백질
ORF9 – Pol8 – 바이러스 DNA 복제에 필요한 DNA 중합효소
ORF10 – RNA 내보내기 및 I형 IFN에 대한 반응을 조절합니다.
ORF16 – vBcl2
ORF18, ORF24, ORF30, ORF31, ORF34, ORF66 – 후기 유전자 발현에 필요한 바이러스 전사 인자
ORF21 – vTK – 티미딘 키나아제
ORF22 – gH – 바이러스 진입에 관여하는 외피 당단백질
ORF23 – 특성화되지 않음
ORF25, ORF26 및 ORF65 – 캡시드 단백질
ORF33 – 바이러스 입자 형성에 관여
ORF34 – 불분명한 기능
ORF35 – 불분명한 기능, 돌연변이가 초기 바이러스 유전자를 발현하지 않음
ORF36 – vPK – 복제 주기에서 여러 역할을 하는 바이러스 단백질 키나아제
ORF37 – SOX – 이중기능 단백질 – 유전체 포장에 필요한 DNase 활성 및 RNase 활성이 숙주 유전자 발현을 조절함
ORF38 – 바이러스 입자 형성에 관여
ORF39 – gM – 외피 당단백질
ORF40 및 ORF41 – 헬리카제 및 프리마제 – DNA 복제
ORF42 – 특성화되지 않음
ORF45 – 외피 단백질, ERK/RSK MAPK 신호전달 경로 조절을 위한 p90 리보솜 S6 키나제(RSK) 및 ERK의 탈인산화를 결합 및 방지하는 것
ORF47 – gL – 바이러스 진입에 관여하는 외피 당단백질
ORF49 – 바이러스 유전자 발현에 필요할 수 있음
ORF50 – RTA, 복제 및 전사 활성화제 – 용해성 KSHV 재활성화를 주도하는 주요 전사 인자
ORF52 – KicGAS – 비리온 형성 및 cGAS DNA 감지 억제에 필요한 외피 단백질
ORF53 – gN – 외피 당단백질
ORF55 – 특성화되지 않음
ORF57 – MTA – 바이러스 유전자의 RNA 안정성, 내보내기 및 번역을 조절합니다.
ORF59 – PF–8 – 중합효소 진행성 인자, 바이러스 DNA 중합효소의 부속 소단위
ORF67 및 ORF69 – 핵 출구
ORF70 – 티미딜레이트 합성효소
ORF72 – vCyclin
ORF73 – LANA, 잠복기 관련 핵 항원 – 잠복기 동안 염색체에 유전체를 연결하는 것 또한 숙주 유전자 발현을 조절합니다. 세포질 형태의 LANA는 면역 반응의 활성화를 억제할 수 있습니다.
ORF74 – vGPCR
ORF75 – FGARAT
PAN, 폴리아데닐화 핵 RNA – 비암호화 선형 및 원형 RNA
miRNA(mirKs) – 잠복기 동안 발현되어 증식 및 세포 사멸을 조절하는 바이러스 마이크로RNA
K1 – 종양 발생에 관여함
K2 – Interleukin 6 homolog, Q2HRC7
K3 및 K5 – 유비퀴틴 E3 연결효소 – 항원 제시 조절
K4 – vCCL2 – chemokine
K4.1 – vCCL3 – chemokine
K8 – 전사 억제인자 – 염색질 조절
K8.1 – 외피 당단백질
K9 – vIRF1, 바이러스 인터페론 조절 인자 1
K10 – vIRF4. 이 유전자좌에서 원형 RNA(circRNA)도 생성됩니다.
K10.5 – vIRF3(초기에 LANA2로 지정됨)는 PEL 세포주에서 잠복기 동안 발현되지만 모든 vIRF와 마찬가지로 진정한 용해 인자이기도 합니다.[51]
K11 – vIRF2
K12 – kaposin
K13 – vFLIP
참고 항목
참고문헌
- ^ "ICTV Master Species List 2018b.v2". International Committee on Taxonomy of Viruses. Archived from the original on March 30, 2019. Retrieved 13 June 2019.
- ^ a b Boshoff, C.; Weiss, R. (2002). "Aids-related malignancies". Nature Reviews Cancer. 2 (5): 373–382. doi:10.1038/nrc797. PMID 12044013. S2CID 13513517.
- ^ Cesarman, E.; Chang, Y.; Moore, P. S.; Said, J. W.; Knowles, D. M. (1995). "Kaposi's Sarcoma–Associated Herpesvirus-Like DNA Sequences in AIDS-Related Body-Cavity–Based Lymphomas". New England Journal of Medicine. 332 (18): 1186–1191. doi:10.1056/NEJM199505043321802. PMID 7700311.
- ^ a b Goncalves, Priscila H.; Ziegelbauer, Joseph; Uldrick, Thomas S.; Yarchoan, Robert (2017). "Kaposi sarcoma herpesvirus-associated cancers and related diseases". Curr Opin HIV AIDS. 12 (1): 47–56. doi:10.1097/COH.0000000000000330. PMC 6311702. PMID 27662501.
- ^ Kaposi, M (1872). "Idiopathisches multiples Pigmentsarkom der Haut". Archiv für Dermatologie und Syphilis. 4 (2): 265–273. doi:10.1007/BF01830024. S2CID 31438763.
번역: - ^ La Ferla, L.; Pinzone, M. R.; Pellicanò, G. F.; Nunnari, G. (2016-04-01). "Kaposi's sarcoma in HIV-infected patients: a review of the literature". Infectious Diseases and Tropical Medicine. p. 2. Retrieved 2023-02-21.
- ^ Beral V, Peterman TA, Berkelman RL, Jaffe HW (1990). "Kaposi's sarcoma among persons with AIDS: a sexually transmitted infection?". Lancet (Submitted manuscript). 335 (8682): 123–8. doi:10.1016/0140-6736(90)90001-L. PMID 1967430. S2CID 35639169.
- ^ Chang, Y.; Cesarman, E.; Pessin, M. S.; Lee, F.; Culpepper, J.; Knowles, D. M.; Moore, P. S. (1994). "Identification of herpesvirus-like DNA sequences in AIDS-associated Kaposi's sarcoma". Science. 266 (5192): 1865–1869. Bibcode:1994Sci...266.1865C. doi:10.1126/science.7997879. PMID 7997879.
- ^ Moore PS, Chang Y (May 1995). "Detection of herpesvirus-like DNA sequences in Kaposi's sarcoma in patients with and without HIV infection". The New England Journal of Medicine. 332 (18): 1181–5. doi:10.1056/NEJM199505043321801. PMID 7700310. S2CID 13465834.
- ^ Antman, K.; Chang, Y. (2000). "Kaposi's Sarcoma". New England Journal of Medicine. 342 (14): 1027–1038. doi:10.1056/NEJM200004063421407. PMID 10749966.
- ^ Boshoff C, Weiss RA (May 2000). "Addressing Controversies Over Kaposi's Sarcoma". Journal of the National Cancer Institute. 92 (9): 677–679. doi:10.1093/jnci/92.9.677. PMID 10793096.
- ^ Russo JJ, Bohenzky RA, Chien MC, et al. (December 1996). "Nucleotide sequence of the Kaposi sarcoma-associated herpesvirus (HHV8)". Proceedings of the National Academy of Sciences of the United States of America. 93 (25): 14862–7. Bibcode:1996PNAS...9314862R. doi:10.1073/pnas.93.25.14862. PMC 26227. PMID 8962146.
- ^ Kumar, Binod; Chandran, Bala (November 14, 2016). "KSHV Entry and Trafficking in Target Cells-Hijacking of Cell Signal Pathways, Actin and Membrane Dynamics". Viruses. 8 (11): 305. doi:10.3390/v8110305. ISSN 1999-4915. PMC 5127019. PMID 27854239.
- ^ Neipel F, Fleckenstein B, Hahn A, et al. (June 2012). "The ephrin receptor tyrosine kinase A2 is a cellular receptor for Kaposi's sarcoma-associated herpesvirus". Nature Medicine. 18 (6): 961–968. doi:10.1038/nm.2805. PMC 3645317. PMID 22635007.
- ^ Veettil, Mohanan Valiya; Kumar, Binod; Ansari, Mairaj Ahmed; Dutta, Dipanjan; Iqbal, Jawed; Gjyshi, Olsi; Bottero, Virginie; Chandran, Bala (April 2016). "ESCRT-0 Component Hrs Promotes Macropinocytosis of Kaposi's Sarcoma-Associated Herpesvirus in Human Dermal Microvascular Endothelial Cells". Journal of Virology. 90 (8): 3860–3872. doi:10.1128/JVI.02704-15. ISSN 1098-5514. PMC 4810545. PMID 26819309.
- ^ Kumar, Binod; Dutta, Dipanjan; Iqbal, Jawed; Ansari, Mairaj Ahmed; Roy, Arunava; Chikoti, Leela; Pisano, Gina; Veettil, Mohanan Valiya; Chandran, Bala (October 2016). "ESCRT-I Protein Tsg101 Plays a Role in the Post-macropinocytic Trafficking and Infection of Endothelial Cells by Kaposi's Sarcoma-Associated Herpesvirus". PLOS Pathogens. 12 (10): e1005960. doi:10.1371/journal.ppat.1005960. ISSN 1553-7374. PMC 5072609. PMID 27764233.
- ^ Campadelli-Fiume G, Collins-McMillen D, et al. (July 2016). "Integrins as Herpersvirus Receptors and Mediators of the Host Signalosome". Annual Review of Virology. 3 (1): 215–236. doi:10.1146/annurev-virology-110615-035618. hdl:11585/593080. PMID 27501260.
- ^ Purushothaman, et al. (February 2016). "KSHV Genome Replication and Maintenance". Frontiers in Microbiology. 7: 54. doi:10.3389/fmicb.2016.00054. PMC 4740845. PMID 26870016.
- ^ Jain, Vaibhav; Plaisance-Bonstaff, Karlie; Sangani, Rajnikumar; Lanier, Curtis; Dolce, Alexander; Hu, Jianhong; Brulois, Kevin; Haecker, Irina; Turner, Peter; Renne, Rolf; Krueger, Brian (19 February 2016). "A Toolbox for Herpesvirus miRNA Research: Construction of a Complete Set of KSHV miRNA Deletion Mutants". Viruses. 8 (2): 54. doi:10.3390/v8020054. ISSN 1999-4915. PMC 4776209. PMID 26907327.
- ^ Choi, HS; Jain, V; Krueger, B; Marshall, V; Kim, CH; Shisler, JL; Whitby, D; Renne, R (2015). "Kaposi's Sarcoma-Associated Herpesvirus (KSHV) Induces the Oncogenic miR-17-92 Cluster and Down-Regulates TGF-β Signaling". PLOS Pathogens. 11 (11): e1005255. doi:10.1371/journal.ppat.1005255. PMC 4636184. PMID 26545119.
- ^ Bu W, Palmeri D, Krishnan R, et al. (November 2008). "Identification of Direct Transcriptional Targets of the Kaposi's Sarcoma-Associated Herpesvirus Rta Lytic Switch Protein by Conditional Nuclear Localization". Journal of Virology. 82 (21): 10709–23. doi:10.1128/JVI.01012-08. PMC 2573185. PMID 18715905.
- ^ Angela Betsaida B. Laguipo (6 October 2020). "SARS-CoV-2 and anti-COVID-19 drugs activate Kaposi sarcoma-associated herpesvirus". News Medical Life Sciences.
- ^ Sethuraman, S; Gay, LA; Jain, V; Haecker, I; Renne, R (July 2017). "microRNA dependent and independent deregulation of long non-coding RNAs by an oncogenic herpesvirus". PLOS Pathogens. 13 (7): e1006508. doi:10.1371/journal.ppat.1006508. PMC 5531683. PMID 28715488.
- ^ Toptan, T; Abere, B; Nalesnik, MA; Swerdlow, SH; Ranganathan, S; Lee, N; Shair, KH; Moore, PS; Chang, Y (11 September 2018). "Circular DNA tumor viruses make circular RNAs". Proceedings of the National Academy of Sciences of the United States of America. 115 (37): E8737–E8745. doi:10.1073/pnas.1811728115. PMC 6140489. PMID 30150410.
- ^ Tagawa, T; Gao, S; Koparde, VN; Gonzalez, M; Spouge, JL; Serquiña, AP; Lurain, K; Ramaswami, R; Uldrick, TS; Yarchoan, R; Ziegelbauer, JM (11 December 2018). "Discovery of Kaposi's sarcoma herpesvirus-encoded circular RNAs and a human antiviral circular RNA". Proceedings of the National Academy of Sciences of the United States of America. 115 (50): 12805–12810. doi:10.1073/pnas.1816183115. PMC 6294913. PMID 30455306.
- ^ Ungerleider, NA; Jain, V; Wang, Y; Maness, NJ; Blair, RV; Alvarez, X; Midkiff, C; Kolson, D; Bai, S; Roberts, C; Moss, WN; Wang, X; Serfecz, J; Seddon, M; Lehman, T; Ma, T; Dong, Y; Renne, R; Tibbetts, SA; Flemington, EK (15 March 2019). "Comparative Analysis of Gammaherpesvirus Circular RNA Repertoires: Conserved and Unique Viral Circular RNAs". Journal of Virology. 93 (6). doi:10.1128/JVI.01952-18. PMC 6401440. PMID 30567979.
- ^ Chen BJ, Chuang SS (March 2020). "Lymphoid Neoplasms With Plasmablastic Differentiation: A Comprehensive Review and Diagnostic Approaches". Advances in Anatomic Pathology. 27 (2): 61–74. doi:10.1097/PAP.0000000000000253. PMID 31725418.
- ^ Gallo, Robert C. (1998-12-04). "The Enigmas of Kaposi's Sarcoma". Science. 282 (5395): 1837–1839. doi:10.1126/science.282.5395.1837. ISSN 0036-8075. PMID 9874635. S2CID 29362584.
- ^ Zhang, Tiejun; Wang, Linding (2016). "Epidemiology of Kaposi's sarcoma-associated Herpesvirus in Asia: Challenges and Opportunities". Journal of Medical Virology. 89 (4): 563–570. doi:10.1002/jmv.24662. ISSN 0146-6615. PMID 27531516. S2CID 1145299.
- ^ a b Chatlynne, L. G.; Ablashi, D. V. (1999). "Seroepidemiology of Kaposi's sarcoma-associated herpesvirus (KSHV)". Seminars in Cancer Biology. 9 (3): 175–85. doi:10.1006/scbi.1998.0089. PMID 10343069.
- ^ Mohanna, S; Maco, V; Bravo, F; Gotuzzo, E (2005). "Epidemiology and clinical characteristics of classic Kaposi's sarcoma, seroprevalence, and variants of human herpesvirus 8 in South America: A critical review of an old disease". International Journal of Infectious Diseases. 9 (5): 239–50. doi:10.1016/j.ijid.2005.02.004. PMID 16095940.
- ^ a b c Fu, B; Sun, F; Li, B; Yang, L; Zeng, Y; Sun, X; Xu, F; Rayner, S; Guadalupe, M; Gao, S. J.; Wang, L (2009). "Seroprevalence of Kaposi's sarcoma-associated herpesvirus and risk factors in Xinjiang, China". Journal of Medical Virology. 81 (8): 1422–31. doi:10.1002/jmv.21550. PMC 2755560. PMID 19551832.
- ^ a b Pelser, C; Vitale, F; Whitby, D; Graubard, B. I.; Messina, A; Gafà, L; Brown, E. E.; Anderson, L. A.; Romano, N; Lauria, C; Goedert, J. J. (2009). "Socio-economic and other correlates of Kaposi sarcoma-associated herpesvirus seroprevalence among older adults in Sicily". Journal of Medical Virology. 81 (11): 1938–44. doi:10.1002/jmv.21589. PMC 2784645. PMID 19777527.
- ^ a b Wang, H; Liu, J; Dilimulati; Li, L; Ren, Z; Wen, H; Wang, X (2011). "Seroprevalence and risk factors of Kaposi's sarcoma-associated herpesvirus infection among the general Uygur population from south and north region of Xinjiang, China". Virology Journal. 8: 539. doi:10.1186/1743-422X-8-539. PMC 3266657. PMID 22168313.
- ^ a b Olsen, S. J.; Chang, Y; Moore, P. S.; Biggar, R. J.; Melbye, M (1998). "Increasing Kaposi's sarcoma-associated herpesvirus seroprevalence with age in a highly Kaposi's sarcoma endemic region, Zambia in 1985". AIDS. 12 (14): 1921–5. doi:10.1097/00002030-199814000-00024. PMID 9792393. S2CID 1734745.
- ^ Wawer, M. J.; Eng, S. M.; Serwadda, D; Sewankambo, N. K.; Kiwanuka, N; Li, C; Gray, R. H. (2001). "Prevalence of Kaposi sarcoma-associated herpesvirus compared with selected sexually transmitted diseases in adolescents and young adults in rural Rakai District, Uganda". Sexually Transmitted Diseases. 28 (2): 77–81. doi:10.1097/00007435-200102000-00003. PMID 11234789. S2CID 7592869.
- ^ Klaskala, W; Brayfield, B. P.; Kankasa, C; Bhat, G; West, J. T.; Mitchell, C. D.; Wood, C (2005). "Epidemiological characteristics of human herpesvirus-8 infection in a large population of antenatal women in Zambia". Journal of Medical Virology. 75 (1): 93–100. doi:10.1002/jmv.20242. PMID 15543582. S2CID 9051177.
- ^ Kourí, V; Eng, S. M.; Rodríguez, M. E.; Resik, S; Orraca, O; Moore, P. S.; Chang, Y (2004). "Seroprevalence of Kaposi's sarcoma-associated herpesvirus in various populations in Cuba". Revista Panamericana de Salud Pública. 15 (5): 320–5. doi:10.1590/s1020-49892004000500006. PMID 15231079.
- ^ Schulz, T. F. (2000). "Kaposi's sarcoma-associated herpesvirus (human herpesvirus 8): Epidemiology and pathogenesis". The Journal of Antimicrobial Chemotherapy. 45 Suppl T3 (90004): 15–27. doi:10.1093/jac/45.suppl_4.15. PMID 10855768.
- ^ Mesri, Enrique A.; Cesarman, Ethel; Boshoff, Chris (October 2010). "Kaposi's sarcoma herpesvirus/ Human herpesvirus-8 (KSHV/HHV8), and the oncogenesis of Kaposi's sarcoma". Nature Reviews. Cancer. 10 (10): 707–19. doi:10.1038/nrc2888. PMC 4721662. PMID 20865011.
- ^ Brayfield, B. P.; Phiri, S; Kankasa, C; Muyanga, J; Mantina, H; Kwenda, G; West, J. T.; Bhat, G; Marx, D. B.; Klaskala, W; Mitchell, C. D.; Wood, C (2003). "Postnatal human herpesvirus 8 and human immunodeficiency virus type 1 infection in mothers and infants from Zambia". The Journal of Infectious Diseases. 187 (4): 559–68. doi:10.1086/367985. PMID 12599072.
- ^ He, J; Bhat, G; Kankasa, C; Chintu, C; Mitchell, C; Duan, W; Wood, C (1998). "Seroprevalence of human herpesvirus 8 among Zambian women of childbearing age without Kaposi's sarcoma (KS) and mother-child pairs with KS". The Journal of Infectious Diseases. 178 (6): 1787–90. doi:10.1086/314512. PMID 9815235.
- ^ Minhas, V; Crabtree, K. L.; Chao, A; m'Soka, T. J.; Kankasa, C; Bulterys, M; Mitchell, C. D.; Wood, C (2008). "Early childhood infection by human herpesvirus 8 in Zambia and the role of human immunodeficiency virus type 1 coinfection in a highly endemic area". American Journal of Epidemiology. 168 (3): 311–20. doi:10.1093/aje/kwn125. PMC 2727264. PMID 18515794.
- ^ LiuZ, Fang Q, Zuo J, Minhas V, Wood C, HeN, Zhang T (2017) Kaposi의 육종 관련 헤르페스 바이러스는 고대 실크로드를 통해 중국에 유입되었습니까? 진화론적 관점. 비롤 대주교
- ^ Jary A, Leducq V, Desire N, Petit H, Palich R, Jolly V, Canestri A, Gotland A, Lambert-Niclot S, Surger L, Amiel C, Descamps D, Spano JP, Katlama C, Calvez V, Marcelin AG (2020) 중증 병리와 관련된 남성과 성관계를 갖는 남성에서 새로운 카포시의 육종 관련 헤르페스바이러스 변이체. J 인펙트 디스
- ^ Martin DF, Kuppermann BD, Wolitz RA, Palestine AG, Li H, Robinson CA (April 1999). "Oral ganciclovir for patients with cytomegalovirus retinitis treated with a ganciclovir implant. Roche Ganciclovir Study Group". The New England Journal of Medicine. 340 (14): 1063–70. doi:10.1056/NEJM199904083401402. PMID 10194235.
- ^ Yarchoan, R.; Tosato, G.; Little, R. F. (2005). "Therapy insight: AIDS-related malignancies – the influence of antiviral therapy on pathogenesis and management". Nature Clinical Practice Oncology. 2 (8): 406–415, quiz 415. doi:10.1038/ncponc0253. PMID 16130937. S2CID 23476060.
- ^ Broussard, Grant; Damania, Blossom (2020-02-07). "KSHV: Immune Modulation and Immunotherapy". Frontiers in Immunology. 10: 3084. doi:10.3389/fimmu.2019.03084. ISSN 1664-3224. PMC 7025529. PMID 32117196.
- ^ Samols MA, Hu J, Skalsky RL, Renne R (Jul 2005). "Cloning and identification of a microRNA cluster within the latency-associated region of Kaposi's sarcoma-associated herpesvirus". Journal of Virology. 79 (14): 9301–5. doi:10.1128/JVI.79.14.9301-9305.2005. PMC 1168752. PMID 15994824.
- ^ Golas, G.; Jang, S. J.; Naik, N. G.; Alonso, J. D.; Papp, B.; Toth, Z. (2020). "Comparative analysis of the viral interferon regulatory factors of KSHV for their requisite for virus production and inhibition of the type I interferon pathway". Virology. 541: 160–173. doi:10.1016/j.virol.2019.12.011. PMC 7024068. PMID 32056714.
더보기
- Edelman DC (2005). "Human herpesvirus 8 – A novel human pathogen". Virology Journal. 2: 78. doi:10.1186/1743-422X-2-78. PMC 1243244. PMID 16138925.
외부 링크
- Human Herpesvirus-8: 관련 자료 HIV InSite
- KSHV 연례 워크숍 제22회 카포시 육종 헤르페스 바이러스(Kaposi Sarcoma Herpesvirus, KSHV) 및 관련 요원에 대한 국제 워크숍, 2019년 6월 30일 - 7월 3일, 미국 뉴욕


