액티나이드
Actinide| 다음 시리즈의 일부 |
| 주기율표 |
|---|
액티나이드(/ˈktktnadd/) 또는 액티노이드(/ˈktktnɔdd/) 시리즈는 89 ~ 103의 원자 번호를 가진 15개의 금속 화학 원소, 로렌슘을 통한 액티늄을 포괄한다.액티나이드 시리즈는 시리즈의 첫 번째 요소인 액티늄에서 그 이름을 따왔다.비공식 화학 기호 A는 액티나이드 화학에 대한 일반적인 논의에서 어떤 액티나이드를 지칭하는 데 사용된다.[1][2][3]
1985년 IUPAC "Red Book"( 페이지 45)은 "actinide"가 아닌 "actinoid"를 사용할 것을 권고한다.끝 "-ide"는 일반적으로 음이온을 나타낸다.그러나, 넓은 전류 사용 때문에, "실제"는 여전히 허용된다.
"actinoid"는 "actinium like"(cf)를 의미하기 때문이다.휴머노이드 또는 안드로이드)는 액티늄이 논리적으로 액티노이드일 수 없다는 의미론적 이유로 주장되어 왔지만 IUPAC는 일반적인 용도에 근거하여 그 포함을 인정한다.[4]
d-블록 요소인 최종 요소(로렌슘)를 제외한 모든 액티니드는 f-블록 요소다.액티늄은 때때로 로렌슘 대신 d-블록으로 여겨졌지만, d-블록에서 로렌슘과의 분류는 이 문제를 연구하는 사람들에 의해 채택되는 경우가 더 많다.[5][6]이 시리즈는 대부분 5f 전자껍질 충전에 해당하지만, 지면 상태에서는 많은 것이 정전기적 반발로 인해 6d 셸 충전을 수반하는 비정상적인 구성을 가지고 있다.또한 대부분 f-블록 원소인 란타니드(lantanids)와 비교하여 액티니드(actinids)는 훨씬 더 가변적인 용맹성을 보인다.그들은 모두 매우 큰 원자 반경과 이온 반경을 가지고 있으며, 비정상적으로 큰 범위의 물리적 성질을 보인다.액티늄과 후기 액티니이드(아메리슘 이후로부터)는 란타니드와 비슷하게 작용하지만, 토륨, 프로토티늄, 우라늄 원소는 화학에서 전환 금속과 훨씬 유사하며, 넵투늄과 플루토늄은 중간 위치를 차지하고 있다.
모든 액티니드는 방사능이며 방사능 붕괴 시 에너지를 방출한다; 자연적으로 발생하는 우라늄과 토륨, 그리고 합성적으로 생산된 플루토늄은 지구상에서 가장 풍부한 액티니이드들이다.이것들은 원자로와 핵무기에 사용된다.우라늄과 토륨은 또한 다양한 전류 또는 역사적 용도를 가지고 있으며, 아메리슘은 대부분의 현대식 연기 감지기의 이온화 챔버에 사용된다.
액티니이드 중 원시 토륨과 우라늄은 자연적으로 상당한 양이 발생한다.우라늄의 방사성 붕괴는 액티늄과 프로actinium의 과도량을 발생시키며, 넵투늄과 플루토늄의 원자는 우라늄 광석의 투과 반응에서 가끔 발생한다.다른 액티니드는 순전히 합성 원소들이다.[1][7]핵무기 실험은 플루토늄보다 무거운 최소한 6개의 액티니드를 환경에 방출했다; 1952년 수소 폭탄 폭발로 인한 파편의 분석은 아메리슘, 큐륨, 베르켈륨, 캘리포늄, 아인슈타인륨, 페르뮴의 존재를 보여주었다.[8]
주기율표 표시에서 f-블록 요소는 표 본체 아래 2개의 추가 행으로 관습적으로 표시된다.[1]이 관습은 전적으로 미학과 형식적 실용성의 문제로서, 드물게 사용되는 넓은 형식의 주기율표는 표의 6열과 7열(주기)의 일부로서 4f와 5f 시리즈를 적절한 위치에 삽입한다.
발견, 격리 및 통합
| 요소 | 연도 | 방법 |
|---|---|---|
| 넵투늄 | 1940 | 중성자에 의한 U 폭격 |
| 플루토늄 | 1941 | 중수부대의 U 폭격 |
| 아메리슘 | 1944 | 중성자에 의한 Pu 폭격 |
| 큐륨 | 1944 | α-입자 폭격을 하는 Pu |
| 베르켈륨 | 1949 | α 입자폭격 암 |
| 캘리포늄 | 1950 | α 입자별 Cm 폭격 |
| 아인슈타인움 | 1952 | 핵폭발의 산물로서 |
| 페르뮴 | 1952 | 핵폭발의 산물로서 |
| 멘델레비움 | 1955 | α-입자폭격 es |
| 노벨륨 | 1965 | 폭격 암 by N 또는 U with Ne |
| 로렌슘 | 1961 –1971 | B 또는 B의 폭격 CF 그리고 아므와 오의 |
란타니데스처럼 액티나이드는 비슷한 성질을 가진 원소 집단을 형성한다.액티나이드 내에는 주기율표에서 우라늄을 따르는 트랜스우라늄 원소와 플루토늄을 따르는 이산화이불늄 원소의 두 가지 중첩된 그룹이 있다.자연에서 (프로메튬을 제외한) 상당히 많은 양이 발견되는 란타니이드에 비해 대부분의 액티니드는 드물다.대부분은 자연에서 발생하지 않으며, 자연에서 발생하는 것들 중 오직 토륨과 우라늄만이 미량 이상에서 발생한다.가장 풍부하거나 쉽게 합성되는 액티니드는 우라늄과 토륨이며, 플루토늄, 아메리슘, 액티늄, 프로토티늄, 넵투늄, 큐륨이 그 뒤를 이었다.[11]
트랜스우라늄 원소의 존재는 1934년 엔리코 페르미(Enrico Fermi)가 그의 실험을 근거로 제시하였다.[12][13]그러나 그때쯤 네 개의 액티니드가 알려졌음에도 불구하고 란타니드와 비슷한 가문을 형성했다는 사실은 아직 파악되지 않았다.초기의 초창기 트랜스우라늄 연구를 지배한 것은 토륨, 프로토티늄, 우라늄이 각각 6주기 하프늄, 탄탈룸, 텅스텐에 해당하는 7기 정규 원소라는 시각이 지배적이었다.초우라늄의 합성은 점차 이 관점을 약화시켰다.1944년까지 큐륨이 4 이상의 산화 상태를 나타내지 못했다는 관측은 글렌 시보그가 "산화 가설"을 공식화하도록 자극했다.알려진 행동요소에 대한 연구와 추가적인 초우라늄 원소의 발견은 이 위치를 뒷받침하는 더 많은 데이터를 제공했지만, "행동요인 가설" ("가설"이 결정적으로 증명되지 않은 어떤 것이라는 함축성)이라는 문구는 1950년대 후반까지 과학자들에 의해 활발하게 사용되어 왔다.[14][15]
현재 이이부토늄 원소의 동위 원소를 생산하는 주요 방법은 (1) 중성자를 사용한 가벼운 원소의 조사, (2) 가속 충전된 입자를 사용한 조사 등 두 가지가 있다.첫 번째 방법은 원자로를 이용한 중성자 조사만이 상당한 양의 합성 활성제를 생산할 수 있기 때문에 적용에 더 중요하다. 그러나 비교적 가벼운 원소로 제한된다.두 번째 방법의 장점은 중성자 조사 시 형성되지 않는 중성자 결핍 동위원소는 물론 플루토늄보다 무거운 원소를 얻을 수 있다는 점이다.[16]
1962~1966년 미국에선 6차례의 지하 핵폭발을 이용해 이앙우토늄 동위원소를 생산하려는 시도가 있었다.폭발 제품을 연구하기 위해 시험 직후 폭발 구역에서 작은 암석 표본을 추출했지만, 그러한 동위원소가 α-decay의 반감기가 상대적으로 길 것이라는 예측에도 불구하고 질량 257보다 큰 동위원소는 검출할 수 없었다.이러한 비관찰은 생산물의 큰 속도에 의한 자발적 핵분열과 중성자 방출과 핵분열과 같은 다른 붕괴 채널에 기인했다.[17]
액티늄에서 우라늄까지

우라늄과 토륨은 최초로 발견된 액티니드였다.우라늄은 1789년 독일의 화학자 마틴 하인리히 클라프로스에 의해 피치블렌드 광석에서 확인되었다.그는 8년 전에 발견된 천왕성의 이름을 따서 이 행성의 이름을 지었다.[7]클라프로스는 질산에 피치블렌드를 녹이고 수산화나트륨으로 용액을 중화시켜 황색 화합물(약칭 이우라늄 나트륨)을 침전시킬 수 있었다.이어 획득한 노란 가루를 숯으로 줄이고, 금속으로 오인하는 검은 물질을 추출했다.[18]60년 후, 프랑스의 과학자 외젠 멜치오르 펠리고트는 그것을 우라늄 산화물로 확인했다.그는 또한 금속 칼륨으로 테트라클로로이드 우라늄을 가열하여 우라늄 금속의 첫 샘플을 분리했다.[19]그 후 우라늄의 원자 질량은 120으로 계산되었지만 1872년 드미트리 멘델레예프는 그의 주기성 법칙을 이용하여 240으로 정정했다.이 값은 1882년 K. 짐머맨에 의해 실험적으로 확인되었다.[20][21]
산화 토륨은 노르웨이(1827년)에서 발견된 광물 토리아나이트에서 프리드리히 뵐러에 의해 발견되었다.[22]욘스 제이콥 베르젤리우스는 1828년에 이 재료를 더 자세히 특징지었다.그는 칼륨으로 토륨 테트라클로라이드를 줄임으로써 금속을 분리하고 천둥과 번개의 노르웨이의 신 토르의 이름을 따서 토륨이라고 명명했다.[23][24]동일한 격리법이 나중에 펠리코트에 의해 우라늄에 사용되었다.[7]
악티늄은 마리 퀴리의 조수 안드레 루이스 데비에른에 의해 1899년 라듐과 폴로늄을 제거한 후 남은 피치블렌드 폐기물에서 발견되었다.그는 (1899년) 물질이 티타늄과[25] 비슷하고 (1900년) 토륨과 비슷하다고 설명했다.[26]그러나 데비에른에 의한 악티늄의 발견은[27] 1971년과 2000년에 의문시되었고,[28] 1904년 데비에른의 출판물은 그의 초기 작품인 1899–1900과 모순된다고 주장했다.대신 이 견해는 란타넘과 비슷하게 작용한 에마늄이라는 방사성 원소를 발견한 프리드리히 오스카르 기젤의 1902년 작품임을 인정한다.악티늄이라는 이름은 그리스 aktis, ακτίςς, ατίνςςς)에서 따온 것으로, 빔이나 광선을 의미한다.이 금속은 자체 방사선이 아니라 딸 제품의 방사선에 의해 발견되었다.[29][30]액티늄과 란타늄의 유사성과 낮은 풍부함 때문에 순수한 액티늄은 1950년에야 생산될 수 있었다.액티나이드라는 용어는 아마도 빅터 골드슈미트가 1937년에 도입했을 것이다.[31][32]
프로텍티늄은 1900년에 윌리엄 크로크스에 의해 고립되었을 가능성이 있다.[33]1913년 카시미르 파잔스와 오스왈드 헬무트 괴링이 U 붕괴 연구 도중 단명 동위원소 Pa(반감기 1.17분)를 만났을 때 처음 확인됐다.그들은;[34][35]은 이름 protoactinium(그리스 πρῶτος에서+ἀκτίς 의미"첫번째 빛 요소")에 1918년 언제 과학자들 두 그룹으로 나뉘는데,는 오스트리아의 리제 마이트너와 오토 한 독일의 프레더릭 소디와 존 크랜스턴 영국의 주도로, 독립적으로 발견된 변화를 있는 새로운 요소 brevium(라틴어 짧은이 잠깐 의미)라고 이름 붙였다.그mu더 오래 사는 파그 이름은 1949년에 프로토티늄으로 단축되었다.이 원소는 1960년 영국의 A. G. 매독과 그의 동료들이 그것의 광석에서 우라늄을 추출한 후 남은 60톤의 폐기물에서 130그램의 프로토티늄을 분리할 때까지 거의 특징지어지지 않았다.[36]
넵투늄 이상
넵투늄(Neptunium)은 1940년 캘리포니아 버클리에서 에드윈 맥밀런과 필립 H. 아벨슨에 의해 발견되었다.[37]이들은 우라늄에 저속 중성자를 퍼부어 Np 동위원소(반감기 = 2.4일)를 생산했다.[36]그것은 합성적으로 생산된 최초의 트랜스우라늄 원소였다.[38]

트랜스우라늄 원소는 자연에서 상당한 양으로 발생하지 않으며 원자로와 행해지는 핵반응을 통해 일반적으로 합성된다.예를 들어, 원자로 중성자에 대한 조사 하에서 우라늄-238은 부분적으로 플루토늄-239로 변환된다.
이 합성 반응은 Fermi와 그의 협력자들에 의해 Hanford 사이트에 위치한 원자로 설계에 사용되었다. Hanford 사이트는 Manhattan Project의 핵무기와 미국의 전후 핵 무기에 상당한 양의 플루토늄-239를 생산했다.[39]
질소, 산소, 탄소, 네온 또는 붕소의 이온을 입자 가속기에 넣어 우라늄, 플루토늄, 큐륨 및 캘리포늄을 폭격하여 질소, 산소, 네온 또는 붕소를 합성한다.그리하여 노벨륨은 네온-22로 우라늄-238을 폭격하여 생산되었다.
- + + n + ->+
이앙구토늄 원소의 첫 동위 원소인 아메리슘-241과 큐륨-242는 글렌 T에 의해 1944년에 합성되었다.시보그, 랄프 A. 제임스와 알버트 기오르소.[40]큐륨-242는 플루토늄-239에 32-MeV α 입자를 퍼부어 얻은 것이다.
- 는 ->+
아메리슘-241과 큐륨-242 동위원소 또한 원자로에서 플루토늄을 조사하여 생산되었다.후자의 원소는 라듐을 발견하고 방사능에 대한 연구로 유명한 마리 퀴리와 그녀의 남편 피에르의 이름을 따서 명명되었다.[41]
큐륨-242에 α 입자를 퍼부어 캘리포늄 Cf(1950년) 동위원소가 나왔고, 1949년 아메리슘-241에서 유사한 절차가 나왔다.[42]이 새로운 원소들은 란타니드 호몰로뉴 테르비움(lantanide homologue terbium)과 유사하게 캘리포니아 버클리의 이름을 따서 명명되었는데, 스웨덴의 이테르비 마을의 이름을 따서 명명되었다.[43]
1945년, B. B. 커닝햄은 이오이뉴토늄 원소의 첫 번째 벌크 화학 화합물, 즉 아메리슘 수산화물을 얻었다.[44]몇 년 동안 아메리슘과 마이크로그램 양의 큐륨이 축적되어 버켈륨(Thomson, 1949년)[45][46]과 캘리포늄(Thomson,[47][48][49] 1950년)의 동위원소를 생산할 수 있었다.이러한 원소의 상당한 양은 1958년에 생산되었다(Burris B).커닝햄과 스탠리 G.톰슨)[50]과 최초의 캘리포늄 화합물(CfOCl의 0.3µg)은 B. B. 커닝햄과 J. C. 월먼에 의해 1960년에 획득되었다.[51]
아인슈타인늄과 페르뮴은 1952~1953년 수소폭탄의 첫 시험인 '아이비 마이크' 핵실험(1952년 11월 1일)의 결과물에서 확인됐다.폭발로 인한 대형 중성자 속도에 우라늄-238이 즉각 피폭되면서 우라늄-253과 우라늄-255를 포함한 우라늄의 중동위원소가 생성되었고, 이들의 β-decay는 아인슈타인륨-253과 페르뮴-255를 산출했다.새로운 원소의 발견과 중성자 포획에 관한 새로운 데이터는 처음에는 냉전 긴장 때문에 1955년까지 미군의 명령에 대해 비밀로 유지되었다.[8][52]그럼에도 불구하고, 버클리 팀은 플루토늄-239의 중성자 폭격을 통해 민간적인 수단으로 아인슈타인륨과 페르뮴을 준비할 수 있었고, 1954년에 그러한 요소들에 대해 수행된 첫 연구가 아니라는 면책과 함께 이 작품을 발표하였다.[53][54]"Ivy Mike" 연구는 1955년에 기밀 해제되고 출판되었다.[52]1961년 커닝햄과 동료들이 처음으로 상당한 양의 아인슈타인을 생산했지만, 아직 페뮴에 대해서는 생산되지 않았다.[55]
멘델레비움의 첫 동위 원소인 Md(반감기 87분)는 알버트 기오르소, 글렌 T에 의해 합성되었다.시보그, 그레고리 R.초핀, 버나드 G.하비와 스탠리 G.그들이 버클리 방사선 연구소의 60인치 사이클로트론에서 Es 표적에 알파 입자를 퍼부었을 때 톰슨은 이것이 한 번에 원자 한 개를 합성하는 모든 원소의 첫 동위원소였다.[56]
스웨덴(1957년)과 미국(1958) 집단의 노벨륨 동위원소 획득 시도가 여러 차례 있었지만, 1992년 IUPAC가 인정한 대로 1965년 러시아 집단의 No(조지 플라이로프 외.) 합성이 첫 번째 신뢰할 수 있는 결과였다.그들의 실험에서 플라이로프 외는 네온-22로 우라늄-238을 폭격했다.[9]
1961년 기오르소 외 연구진은 붕소-10 및 붕소-11 이온으로 캘리포니아산(대부분 캘리포니아산-252)을 조사하여 최초의 로렌슘 동위원소를 획득하였다.[9]당시 이 동위원소의 질량 번호는 명확하게 설정되지 않았다(아마도 258 또는 259).1965년에 Lr은 Am과 O의 Flyorov 등에 의해 합성되었다.따라서 IUPAC는 더블나와 버클리의 핵물리학 팀을 법률의 공동 발견자로 인정했다.
동위 원소
| 가장 중요한 이앙구토늄 동위[57][58][59] 원소의 핵 특성 | ||||||
|---|---|---|---|---|---|---|
| 동위원소 | 하프라이프 | 의 확률 %의 자발적 해제 | 배출 에너지 (MeV)(수익률(%)) | 특정 활동(Bq/kg)[60] | ||
| α | γ | α, β-particles | 핵분열하다 | |||
| 241암 | 432.2(7) y | 4.3(18)×10−10 | 5.485 (84.8) 5.442 (13.1) 5.388 (1.66) | 0.059 (35.9) 0.026 (2.27) | 1.27×1014 | 546.1 |
| 243암 | 7.37(4)×103 y | 3.7(2)×10−9 | 5.275 (87.1) 5.233 (11.2) 5.181 (1.36) | 0.074 (67.2) 0.043 (5.9) | 7.39×1012 | 273.3 |
| 242CM | 162.8(2) d | 6.2(3)×10−6 | 6.069 (25.92) 6.112 (74.08) | 0.044 (0.04) 0.102 (4×10−3) | 1.23×1017 | 7.6×109 |
| 244CM | 18.10(2) y | 1.37(3)×10−4 | 5.762 (23.6) 5.804 (76.4) | 0.043 (0.02) 0.100 (1.5×10−3) | 2.96×1015 | 4.1×109 |
| 245CM | 8.5(1)×103 y | 6.1(9)×10−7 | 5.529 (0.58) 5.488 (0.83) 5.361 (93.2) | 0.175 (9.88) 0.133 (2.83) | 6.35×1012 | 3.9×104 |
| 246CM | 4.76(4)×103 y | 0.02615(7) | 5.343 (17.8) 5.386 (82.2) | 0.045 (19) | 1.13×1013 | 2.95×109 |
| 247CM | 1.56(5)×107 y | — | 5.267 (13.8) 5.212 (5.7) 5.147 (1.2) | 0.402 (72) 0.278 (3.4) | 3.43×109 | — |
| 248CM | 3.48(6)×105 y | 8.39(16) | 5.034 (16.52) 5.078 (75) | — | 1.40×1011 | 1.29×1010 |
| 249Bk | 330(4) d | 4.7(2)×10−8 | 5.406 (1×10−3) 5.378 (2.6×10−4) | 0.32 (5.8×10−5) | 5.88×1016 | 2.76×107 |
| 249cf | 351(2) y | 5.0(4)×10−7 | 6.193 (2.46) 6.139 (1.33) 5.946 (3.33) | 0.388 (66) 0.333 (14.6) | 1.51×1014 | 7.57×105 |
| 250cf | 13.08(9) y | 0.077(3) | 5.988 (14.99) 6.030 (84.6) | 0.043 | 4.04×1015 | 3.11×1012 |
| 251cf | 900(40) y | ? | 6.078 (2.6) 5.567 (0.9) 5.569 (0.9) | 0.177 (17.3) 0.227 (6.8) | 5.86×1013 | — |
| 252cf | 2.645(8) y | 3.092(8) | 6.075 (15.2) 6.118 (81.6) | 0.042 (1.4×10−2) 0.100 (1.3×10−2) | 1.92×1016 | 6.14×1014 |
| 254cf | 60.5(2) d | ≈100 | 5.834 (0.26) 5.792 (5.3×10−2) | — | 9.75×1014 | 3.13×1017 |
| 253에스 | 20.47(3) d | 8.7(3)×10−6 | 6.540 (0.85) 6.552 (0.71) 6.590 (6.6) | 0.387 (0.05) 0.429 (8×10−3) | 9.33×1017 | 8.12×1010 |
| 254에스 | 275.7(5) d | < 3×10−6 | 6.347 (0.75) 6.358 (2.6) 6.415 (1.8) | 0.042 (100) 0.034 (30) | 6.9×1016 | — |
| 255에스 | 39.8(12) d | 0.0041(2) | 6.267 (0.78) 6.401 (7) | — | 4.38×1017(β) 3.81×1016(α) | 1.95×1013 |
| 255FM | 20.07(7)h | 2.4(10)×10−5 | 7.022 (93.4) 6.963 (5.04) 6.892 (0.62) | 0.00057 (19.1) 0.081 (1) | 2.27×1019 | 5.44×1012 |
| 256FM | 157.6(13)분 | 91.9(3) | 6.872 (1.2) 6.917 (6.9) | — | 1.58×1020 | 1.4×1019 |
| 257FM | 100.5(2) d | 0.210(4) | 6.752 (0.58) 6.695 (3.39) 6.622 (0.6) | 0.241 (11) 0.179 (8.7) | 1.87×1017 | 3.93×1014 |
| 256md | 77(2)분 | — | 7.142 (1.84) 7.206 (5.9) | — | 3.53×1020 | — |
| 257md | 5.52(5)h | — | 7.074 (14) | 0.371 (11.7) 0.325 (2.5) | 8.17×1019 | — |
| 258md | 51.5(3) d | — | 6.73 | — | 3.64×1017 | — |
| 255아니오 | 3.1(2)분 | — | 8.312 (1.16) 8.266 (2.6) 8.121 (27.8) | 0.187 (3.4) | 8.78×1021 | — |
| 259아니오 | 58(5)분 | — | 7.455 (9.8) 7.500 (29.3) 7.533 (17.3) | — | 4.63×1020 | — |
| 256Lr | 27(3)초 | < 0.03 | 8.319 (5.4) 8.390 (16) 8.430 (33) | — | 5.96×1022 | — |
| 257Lr | 646(25) ms | — | 8.796 (18) 8.861 (82) | — | 1.54×1024 | — |
액티늄 동위 원소 32개와 일부 핵종의 흥분된 이소모늄 8개가 2016년까지 확인되었다.[57]자연에서 세 개의 Ac, Ac 및 Ac 동위원소가 발견되었고 다른 동위원소는 실험실에서 생산되었다. 오직 세 개의 자연 동위원소만이 적용에 사용된다.액티늄-225는 방사성 넵투늄 계열의 일원으로,[61] 우라늄-233의 붕괴 산물로 1947년에 처음 발견되었으며, 반감기가 10일인 α-방사선이다.액티늄-225는 액티늄-228에 비해 사용가능성은 떨어지지만 라디오트레이커 애플리케이션에서는 더 유망하다.[30]액티늄-227(반감기 21.77년)은 모든 우라늄 광석에서 발생하지만 소량이다.우라늄 1g(방사성 평형상태)에는 Ac가 2×10g밖에−10 들어 있지 않다.[30][57]Actinium-228은 Ra의 붕괴에 의해 형성된 방사성 토륨 시리즈의 일원이다.[61] 6.15시간의 반감기를 가진 β− 방사체다.토륨 1톤에는 Ac 5×10−8 그램이 있다.1906년 오토 한에 의해 발견되었다.[30]
토륨의 알려진 동위원소는 질량 208부터 238까지 31개가 있다.[57]이 중에서 가장 장수하는 것은 Th인데, 그 반감기가 1.4×10년이라는10 것은 여전히 원시적인 핵종으로서 자연 속에 존재한다는 것을 의미한다.다음으로 수명이 긴 것은 75,400년의 반감기를 가진 U의 중간 부패 제품인 Th이다.몇몇 다른 토륨 동위 원소들은 하루에 반 리브를 가지고 있다; 이 모든 것들은 Th, U, 그리고 U의 부패 사슬에서도 일시적인 것이다.
28개의 프로텍티늄 동위원소는 질량 번호 212–239와[57] 세 개의 흥분된 이소메릭 상태로 알려져 있다.자연에서 파와 파만이 발견되었다.프로토티늄-231(반감기 32,760년)을 제외한 모든 동위원소의 수명이 짧다.가장 중요한 동위원소는 우라늄-233을 획득하는 중간 생산물인 Pa와 Pa로, 인공 프로토티늄 동위원소 중 가장 저렴하다.233Pa는 편리한 반감기와 γ-방사선의 에너지를 가지고 있어서 대부분의 프로토티늄 화학 연구에 사용되었다.프로actinium-233은 26.97일의 반감기를 가진 β-이미터다.[57][62]
우라늄에는 26개의 알려진 동위원소가 있으며 질량 번호는 215–242(220과 241 제외)[58]이다.그 중 U, U, U, 세 가지가 자연적으로 상당히 많은 양이 존재한다.그 중에서도 가장 중요한 것은 저속 중성자에 의해 조사된 Th의 변환의 최종 산물인 U이다.233U는 저에너지(열) 중성자에 의한 핵분열 효율이 U와 비교할 때 훨씬 높다. 대부분의 우라늄 화학 연구는 4.4×10년의9 긴 반감기 때문에 우라늄-238에 대해 수행되었다.[63]
질량 번호가 219, 220, 223–244인 넵투늄 동위원소가 24개 있는데,[58] 모두 방사능이 매우 높다.과학자들 사이에서 가장 인기 있는 것은 장수 Np(t1/2 = 2.20×10년6)와 단명 Np(t1/2 ~ 2일)이다.[38]
아메리슘 동위 원소 18개는 229부터 247까지 질량수로 알려져 있다(231개 제외).[58]가장 중요한 것은 알파 방출체인 Am과 Am이다. 또한 부드럽지만 강렬한 emit선을 방출한다. 두 가지 모두 동위원소 순수 형태로 얻을 수 있다.아메리슘의 화학적 성질은 처음에는 Am과 함께 연구되었으나, 나중에는 방사능이 거의 20배나 적은 Am으로 옮겨갔다.암의 단점은 단명 딸 동위원소 Np의 생산으로, 데이터 분석에서 고려해야 한다.[64]
질량 수 233부터 251까지 19개의 큐륨 동위원소 중 가장 접근하기 쉬운 동위원소는 Cm과 Cm이다. α-제미터지만 아메리슘 동위원소보다 수명이 훨씬 짧다.[58]이러한 동위원소는 거의 γ-방사선을 방출하지 않지만 중성자의 관련 방출과 함께 자발적 핵분열을 겪는다.플루토늄이나 아메리슘의 중성자 조사 시 혼합물로 더 장수하는 큐륨 동위원소(245–248Cm, 모든 α-제미터)가 형성된다.짧은 조사 결과 Cm이 이 혼합물을 지배하게 되고, Cm이 축적되기 시작한다.이들 동위원소, 특히 Cm은 반감기(3.48×10년5)가 길고, Cm과 Cm보다 화학연구를 수행하기에 훨씬 편리하지만, 자연분열률도 다소 높다.247cm은 큐륨 동위 원소 중 수명이 가장 길지만(1.56×10년7) 열 중성자에 의해 유도된 강한 핵분열 때문에 대량으로 형성되지 않는다.
17개의 베르켈륨 동위원소가 질량 번호 233–234, 236, 238 및 240–252로 식별되었다.[58]Bk만 대량으로 구할 수 있는데, 비교적 짧은 반감기가 330일이고 대부분 부드러운 β-입자를 방출하여 검출이 불편하다.알파 방사선은 다소 약하지만(β-방사선에 대해서는 1.45×10−3%) 이 동위원소를 검출하는 데 사용된다.247Bk는 긴 반감기가 1,380년인 알파 방출체지만 상당한 양을 얻기 어렵다. 질량 수가 248 이하인 큐륨 동위원소의 β-안정성 때문에 플루토늄의 중성자 조사 시 형성되지 않는다.[64]
질량 237–256의 캘리포늄 동위 원소 20개는 원자로에서 형성된다.[58] 캘리포늄-253은 β-emitter이고 나머지는 α-emitter이다.질량이 짝수인 동위원소(250Cf, Cf, Cf)는 자연분열 비율이 높으며, 특히 Cf 중 99.7%는 자연분열로 분해된다.캘리포늄-249는 비교적 긴 반감기(352년), 약한 자발적 핵분열 및 강한 ission 방출로 식별이 용이하다.249Cf는 모체 동위원소 Bk의 느린 β-decay와 중성자와의 상호작용의 큰 단면 때문에 원자로에서 다량으로 형성되지 않지만 (사전 선택) Bk의 β-decay 생산물로서 동위원소 순수 형태로 축적될 수 있다.플루토늄의 원자로 방사에 의해 생산되는 캘리포늄은 대부분 Cf와 Cf로 구성되며, 후자는 대규모 중성자 독성이 우세하며, 그 연구는 강한 중성자 방사선에 의해 방해된다.[65]
| 부모 동위 원소 | t1/2 | 딸 동위 원소 | t1/2 | 설정 시간 방사성 평형 |
|---|---|---|---|---|
| 243암 | 7370년 세월 | 239Np | 2.35일 | 47.3일 |
| 245CM | 8265년 | 241PU | 14년 | 129년 |
| 247CM | 1.64×10년7 | 243PU | 4.95시간 | 7.2일 |
| 254에스 | 270일 | 250Bk | 3.2시간 | 35.2시간 |
| 255에스 | 39.8일 | 255FM | 22시간 | 5일 |
| 257FM | 79일 | 253cf | 17.6일 | 49일 |
질량이 240에서 257까지인 것으로 알려진 18개의 알려진 아인슈타인 동위 원소 중 가장 저렴한 것은 ES이다.[58]반감기가 20.47일인 α-방출기로 캘리포니아 동위원소에 비해 상대적으로 γ-배출량이 약하고 자발적 핵분열률이 작다.또한 중성자 조사가 장기화되면 수명이 긴 동위원소 Es(t1/2 = 275.5일)도 생성된다.[65]
20개의 페르뮴 동위원소는 241–260의 질량으로 알려져 있다.254Fm, Fm, Fm은 반감기(시간)가 짧은 α-emiter로 상당한 분리가 가능하다.257Fm(t1/2 = 100일)은 장기간 강력 조사 시 누적될 수 있다.이 모든 동위원소는 높은 자연분열 비율로 특징지어진다.[65][67]
17개의 알려진 멘델레비움 동위 원소(244~260의 질량) 중 가장 많이 연구된 것은 md인데, 주로 전자 포획(α-방사능은 %10%)을 통해 해독하며 반감기는 77분이다.[58]또 다른 알파 방출자인 md는 반감기가 53일이다.이 동위원소는 모두 희귀한 아인슈타인륨(253Es와 Es 각각)에서 생산되며, 따라서 이용가능성이 제한된다.[57]
노벨륨의 장수 동위 원소와 로렌슘 동위 원소(그리고 더 무거운 원소)는 비교적 짧은 반감기를 가지고 있다.노벨륨의 경우 질량 250–260과 262로 11개의 동위원소가 알려져 있다.노벨륨과 로렌슘의 화학적 성질을 No(t1/2 = 3 min)와 Lr(t1/2 = 35 s)로 연구했다.가장 수명이 긴 노벨륨 동위원소인 No는 반감기가 약 1시간이다.[57]로렌슘은 질량 번호 251–262와 266으로 알려진 13개의 알려진 동위원소를 가지고 있다.그중 가장 안정된 것은 반감기가 11시간인 Lr이다.
이 모든 중에서도 충분한 물량의 자연에서 발생하는 유일한 동위 원소들 아무것도 흔적이 넘고 있는 악티늄 원소의 원자량으로 측정 가능한 공헌은 원시 232Th, 235, 그리고 238U, 천연 우라늄의 3오래 사는 부패 제품, 230Th, 231Pa, 234U. 감지할 수 있는 천연 토륨 얼마나 자주'o'를 되어 있다.f0.02(2)%230Th고99.98(2)% Th, 천연 프로토티늄은 100% Pa로 구성되며, 천연 우라늄은 0.0054(5)% U, 0.7204(6)% U, 99.2742(10)% U로 구성된다.[68]
원자로에서의 형성
액티니이드의 수치적 축적은 수평축에 중성자 수(이소토프)와 수직축에 양성자 수(원소)가 있는 핵종의 표다.붉은 점은 핵종을 두 그룹으로 나누기 때문에 수치가 더 콤팩트하다.각 핵종은 원소의 질량 번호와 그 절반 시간을 가진 정사각형으로 표현된다.[69]자연적으로 현존하는 액티나이드 동위 원소(Th, U)는 굵은 테두리로 표시되고 알파 방출체는 노란색을 띠며 베타 방출체는 파란색을 띠게 된다.분홍색은 전자 포획(236Np)을 나타내며, 흰색은 오래 지속되는 전이성 상태(242Am)를 나타낸다.
액티나이드 핵종의 형성은 주로 다음과 같이 특징지어진다.[70]
- 그림에서 오른쪽 짧은 화살표로 표현되는 중성자 포획 반응(n,610)
- (n,2n) 반응과 덜 자주 발생하는 (n,n) 반응도 고려하는데, 두 반응 모두 짧은 왼쪽 화살표로 표시된다.
- 더욱 드물고 빠른 중성자에 의해서만 촉발되는 (n,3n) 반응이 일어나는데, 이 반응은 하나의 예로 그림에서 나타나며, 긴 왼쪽 화살표로 표시된다.
이러한 중성자 또는 감마선에 의한 핵반응 외에도, 활성핵종의 방사능 변환은 원자로 내의 핵종 재고량에도 영향을 미친다.이러한 붕괴 유형은 그림에서 대각선 화살표로 표시된다.왼쪽 위를 가리키는 화살표로 표시된 베타 미누스 붕괴는 핵종의 입자 밀도의 균형에 주요한 역할을 한다.양전자 방출(베타 플러스 붕괴) 또는 전자 포획(전자 포획)에 의한 핵종은 원자로에서 녹아웃 반응의 산물이 아닌 한 발생하지 않는다. 이들의 해독에는 오른쪽을 가리키는 화살표가 표시되어 있다.주어진 핵종의 긴 반감기 때문에 알파 붕괴는 원자로 노심 내 핵연료의 체류시간(몇 년)이 다소 짧기 때문에 원자로 내 액티니드의 형성과 붕괴에 거의 아무런 역할을 하지 못한다.상대적으로 수명이 짧은 두 핵종 Cm(T1/2 = 163 d)과 Pu(T1/2 = 2.9 y)는 예외다.이 두 경우에 대해서만 α 붕괴는 핵종 지도에 왼쪽 아래를 가리키는 긴 화살표로 표시된다.
자연에서의 분포

토륨과 우라늄은 각각 질량농도가 16ppm, 4ppm으로 자연에서 가장 풍부한 활성산소다.[71]우라늄은 대부분 광물 천왕나이트에 산화물 혼합으로 지구의 지각에서 발생하는데, 이 산소를 검은 색 때문에 피치블렌드라고도 한다.그 밖에 카르노타이트(KUOVO24·3) 등 수십 개의 우라늄 광물이 있다.HO2) 및 autunite(Ca(UO2)(2PO4)/2nHO2).천연 우라늄의 동위원소 구성은 U(상대적 풍부함 99.2742%), U(0.7204%), U(0.0054%)로 이 중 반감기가 4.51×10년으로9 가장 크다.[72][73]2009년 전 세계 우라늄 생산량은 5만572톤으로 이 중 27.3%가 카자흐스탄에서 채굴됐다.그 밖에 중요한 우라늄 채굴 국가는 캐나다(20.1%), 호주(15.7%), 나미비아(9.1%), 러시아(7.0%), 니제르(6.4%)[74] 등이다.
| 광석 | 위치 | 우라늄 내용, % | 질량비 239푸/오레 | 비율 239Pu/U(×1012) |
|---|---|---|---|---|
| 천왕나이트 | 캐나다 | 13.5 | 9.1×10−12 | 7.1 |
| 천왕나이트 | 콩고 | 38 | 4.8×10−12 | 12 |
| 천왕나이트 | 미국 콜로라도 주 | 50 | 3.8×10−12 | 7.7 |
| 모나자이트 | 브라질 | 0.24 | 2.1×10−14 | 8.3 |
| 모나자이트 | 미국 노스캐롤라이나 주 | 1.64 | 5.9×10−14 | 3.6 |
| 퍼거슨라이트 | - | 0.25 | <1×10−14 | <4 |
| 카르노타이트 | - | 10 | <4×10−14 | <0.4 |
가장 풍부한 토륨 광물은 토리아나이트(ThO2), 토르나이트(TsiO4), 모나자이트(Th,Ca,Ce)이다.대부분의4 토륨 광물은 우라늄을 함유하고 있으며, 그 반대의 경우도 마찬가지며, 모두 란타니드의 상당 부분을 함유하고 있다.토륨 광물의 풍부한 매장량은 미국(44만톤), 호주와 인도(각각 약 30만톤), 캐나다(약 10만톤)에 있다.[76]
지구 표면의 액티늄의 풍부함은 약 5×10−15%[62]에 불과하다.액티늄은 우라늄 함유량이 대부분이지만 다른 광물에도 훨씬 적은 양으로 존재한다.대부분의 자연물에서 액티늄 함량은 상위 동위원소 U의 동위원소 평형에 해당하며, 약한 Ac 이동의 영향을 받지 않는다.[30]프로텍티늄은 액티늄보다 지각에 더 풍부하다(10−12%)1913년 파잔스와 괴링에 의해 우라늄 광석에서 발견되었다.[34]액티늄으로서, 프로티늄의 분포는 U의 분포에 따른다.[62]
넵투늄의 최장수 동위원소인 Np의 반감기는 지구의 나이에 비해 무시할 수 있다.따라서 넵투늄은 다른 동위원소의 중간 붕괴 산물로 생산되는 무시할 수 있는 양으로 자연에 존재한다.[38]우라늄 광물에서 플루토늄의 흔적은 1942년에 처음 발견되었으며 Pu에 대한 보다 체계적인 결과가 표에 요약되어 있다(그 샘플에서 다른 플루토늄 동위원소는 검출되지 않았다).플루토늄의 최장수 동위원소인 Pu의 풍부 상한치는 3×10−20%이다.달 토양 샘플에서는 플루토늄을 검출할 수 없었다.자연이 희소하기 때문에 대부분의 플루토늄은 합성적으로 생산된다.[75]
추출

액티니드가 풍부하지 않기 때문에, 그들의 추출은 복잡한 다단계 과정이다.액티니이드의 불소화물은 물에 녹지 않고 리독스 반응으로 쉽게 분리할 수 있기 때문에 주로 사용된다.불소는 칼슘, 마그네슘 또는 바륨과 함께 감소한다.[77]
액티니드 중 토륨과 우라늄이 가장 쉽게 분리된다.토륨은 대부분 모나자이트에서 추출된다: 토륨 피로인산염(ThPO27)은 질산과 반응하고, 생산된 토륨 질산은 트리뷰틸 인산염으로 처리한다.희토류 불순물은 황산염 용액에서 pH를 증가시켜 분리된다.[77]
또 다른 추출 방법으로 모나자이트는 140 °C에서 수산화나트륨의 45% 수용액으로 분해된다.혼합 금속 수산화물을 먼저 추출하여 80 °C에서 여과하고 물로 씻어 농축 염산으로 용해한다.다음으로 산성 용액은 희토류 수산화물의 약 3%에 오염된 토륨 수산화물(Th(OH)4의 침수를 초래하는 pH = 5.8로 중화되며, 나머지 희토류 수산화물은 용액에 남아 있다.수산화 토륨은 무기산에 용해된 후 희토류 원소에서 정화된다.효율적인 방법은 질산 토륨 수산화물이 용해되는 것이다. 그 결과 용액은 유기 용제로 추출하여 정화할 수 있기 때문이다.[77]
- Th(OH)4 + 4 HNO3 → Th(NO3)4 + 4 H2O
금속 토륨은 불활성 대기에서 칼슘과 반응하여 무수 산화물, 염화물 또는 불소와 분리된다.[79]
- ThO2 + 2 Ca → 2 CaO + Th
때때로 토륨은 흑연 도가니에서 700–800 °C에서 나트륨과 염화칼륨을 혼합한 불소의 전기분해로 추출된다.매우 순수한 토륨은 결정 막대 공정을 통해 요오드화합물에서 추출될 수 있다.[80]
우라늄은 광석에서 다양한 방법으로 추출된다.한 가지 방법으로 광석을 태운 다음 질산과 반응하여 우라늄을 용해 상태로 변환시킨다.등유에서 인산염(TBP)을 함유한 용액으로 처리하면 우라늄이 유기농 형태의 UO2(NO3)(2TBP)로 변한다.2불용성 불순물은 여과되고 우라늄은 (NH4)2UO로서27 수산화물 또는 UO4·2HO로서2 과산화수소와 반응하여 추출된다.[77]
우라늄 광석이 돌로마이트, 마그네시아 등과 같은 미네랄을 풍부하게 함유하고 있을 때, 그 미네랄들은 많은 산을 소비한다.이 경우 우라늄 추출에는 탄산염 방법을 사용한다.그 주성분은 탄산나트륨의 수용액으로 우라늄을 복합 [UO2(CO3)]34−로 변환하는 것으로, 저농도의 수산화 이온에서 수용액에서 안정적이다.탄산나트륨법의 장점은 화학물질이 (질산염에 비해) 부식성이 낮으며 대부분의 비우라늄 금속이 용액에서 침전된다는 것이다.단점은 4가 우라늄 화합물도 침전된다는 것이다.따라서 우라늄 광석은 높은 온도와 산소 압력 하에서 탄산 나트륨으로 처리된다.
- 2 UO2 + O2 + 6 CO2−
3 → 2 [UO2(CO3)3]4−
이 방정식은 탄산 우라늄 처리를 위한 최선의 용제가 탄산염과 중탄산염을 혼합한 것임을 시사한다.이것은 높은 pH에서 불용성 우라늄 테트라카본산염을 생성하는 니켈 앞에서 수소로 처리되는 이우라늄의 침수를 초래한다.[77]
또 다른 분리법은 고분자 수지를 다전극으로 사용한다.레진에서 이온 교환 과정은 우라늄 분리를 초래한다.레진에서 추출한 우라늄은 질산암모늄 또는 질산암모늄 용액으로 세척되며 질산염은 천왕성2 질산염,2 UO(NO3)/6을 산출한다.HO2. 가열하면 UO로3 변하며, 수소와 함께 UO로 변환된다2.
- UO3 + H2 → UO2 + H2O
이산화 우라늄과 불산을 반응시키면 마그네슘 금속과의 반응으로 우라늄 금속을 산출하는 테트라불화우라늄으로 바뀐다.[79]
- 4 HF + UO2 → UF4 + 2 H2O
플루토늄을 추출하기 위해 중성자 산화 우라늄을 질산에 녹이고, 그 결과 용액에 환원제(FeSO4, 또는 HO22)를 첨가한다.이 첨가물은 플루토늄의 산화 상태를 +6에서 +4로 변화시키는 반면 우라늄은 질산 천왕성(UO2(NO3)의 형태로 남아 있다.2용액은 환원제로 처리하고 탄산암모늄을 pH = 8로 중화시켜 Pu4+ 화합물이 침전되도록 한다.[77]
또 다른 방법으로, Pu와4+ UO는2+
2 우선 triminutyl phosphate로 추출한 다음 회수된 플루토늄을 씻어내는 하이드라진에 반응한다.[77]
액티늄 분리의 주요 난관은 액티늄 성질이 란타늄 성질과 유사하다는 것이다.따라서 악티늄은 라듐 동위원소로부터의 핵반응에서 합성되거나 이온교환 절차를 사용하여 분리된다.[30]
특성.
액티니데스는 란타니데스와 비슷한 성질을 가지고 있다.6d와 7s의 전자 껍질은 액티늄과 토륨으로 채워져 있고, 5f 껍질은 원자 수의 추가 증가로 채워지고 있다; 4f 껍질은 란타니드에 채워진다.액티니이드에서 5f 포탄을 채우기 위한 최초의 실험 증거는 1940년 맥밀런과 아벨슨에 의해 입수되었다.[81]란타니데스(란타니드 수축 참조)에서와 마찬가지로, 활성산소의 이온 반경은 원자 번호와 함께 단조롭게 감소한다(아우프바우 원리 참조).[82]
| 요소 | Ac | TH | 파 | U | Np | PU | 암 | CM | Bk | cf | 에스 | FM | md | 아니요. | Lr |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 코어 차지(Z) | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 | 100 | 101 | 102 | 103 |
| 원자 질량 | [227] | 232.0377(4) | 231.03588(2) | 238.02891(3) | [237] | [244] | [243] | [247] | [247] | [251] | [252] | [257] | [258] | [259] | [266] |
| 자연 동위원소[84] 수 | 3 | 7 | 3 | 8 | 3 | 4 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 천연 동위[84][85] 원소 | 225, 227–228 | 227–232, 234 | 231, 233–234 | 233–240 | 237, 239–240 | 238–240, 244 | — | — | — | — | — | — | — | — | — |
| 자연량 동위 원소 | — | 230, 232 | 231 | 234, 235, 238 | — | — | — | — | — | — | — | — | — | — | — |
| 최장수 동위원소 | 227 | 232 | 231 | 238 | 237 | 244 | 243 | 247 | 247 | 251 | 252 | 257 | 258 | 259 | 266 |
| 최장수 동위원소 반감기 | 21.8년 | 140억년 | 32,500년 | 44억 7천만 년 | 214만년 | 8080만 년 | 칠백오십 년 | 1560만년 | 1,380년 | 900년 | 1.29년 | 100.5일 | 52일 | 58분 | 11시간 |
| 가장 일반적인 동위원소 | 227 | 232 | 231 | 238 | 237 | 239 | 241 | 244 | 249 | 252 | 253 | 255 | 256 | 255 | 260 |
| 가장 흔한 동위원소의 반감기 | 21.8년 | 140억년 | 32,500년 | 44억 7천만 년 | 214만년 | 24,100년 | 433년 | 18.1년 | 320일 | 2.64년 | 20.47일 | 20.07시간 | 78분 | 3.1분 | 2.7분 |
| 전자 구성 위치 지상 상태(가스 단계) | 6d17s2 | 6d27s2 | 5f26d17s2 | 5f36d17s2 | 5f46d17s2 | 5f67s2 | 5f77s2 | 5f76d17s2 | 5f97s2 | 5f107s2 | 5f117s2 | 5f127s2 | 5f137s2 | 5f147s2 | 5f147s27p1 |
| 산화 상태 | 2, 3 | 2, 3, 4 | 2, 3, 4, 5 | 2, 3, 4, 5, 6 | 3, 4, 5, 6, 7 | 3, 4, 5, 6, 7 | 2, 3, 4, 5, 6, 7 | 2, 3, 4, 6 | 2, 3, 4 | 2, 3, 4 | 2, 3, 4 | 2, 3 | 2, 3 | 2, 3 | 3 |
| 금속 반지름(nm) | 0.203 | 0.180 | 0.162 | 0.153 | 0.150 | 0.162 | 0.173 | 0.174 | 0.170 | 0.186 | 0.186 | ? 0.198 | ? 0.194 | ? 0.197 | ? 0.171 |
| 이온 반지름(nm): 안4+ 안3+ | — 0.126 | 0.114 — | 0.104 0.118 | 0.103 0.118 | 0.101 0.116 | 0.100 0.115 | 0.099 0.114 | 0.099 0.112 | 0.097 0.110 | 0.096 0.109 | 0.085 0.098 | 0.084 0.091 | 0.084 0.090 | 0.084 0.095 | 0.083 0.088 |
| 온도(°C): 녹는 끓는 | 1050 3198 | 1842 4788 | 1568 ? 4027 | 1132.2 4131 | 639 ? 4174 | 639.4 3228 | 1176 ? 2607 | 1340 3110 | 986 2627 | 900 ? 1470 | 860 ? 996 | 1530 — | 830 — | 830 — | 1630 — |
| 밀도, g/cm3 | 10.07 | 11.78 | 15.37 | 19.06 | 20.45 | 19.84 | 11.7 | 13.51 | 14.78 | 15.1 | 8.84 | ? 9.7 | ? 10.3 | ? 9.9 | ? 14.4 |
| 표준 전극 전위(V): E° (An4+/An0) E° (An3+/An0) | — −2.13 | −1.83 — | −1.47 — | −1.38 −1.66 | −1.30 −1.79 | −1.25 −2.00 | −0.90 −2.07 | −0.75 −2.06 | −0.55 −1.96 | −0.59 −1.97 | −0.36 −1.98 | −0.29 −1.96 | — −1.74 | — −1.20 | — −2.10 |
| 색상: [M(H2O)n]4+ [M(H2O)n]3+ | — 무색 | 무색 파랑 | 노란색 암청색, 감색 | 녹색 보라색 | 황록색 보라색 | 갈색 바이올렛 | 빨간색 로즈. | 노란색 무색 | 베이지 황록색 | 녹색 녹색 | — 핑크 | — — | — — | — — | — — |
| 수용액 내 액티나이드 이온의 대략적인 색상 액티나이드 100–103의 색상은 충분한 양이 아직 합성되지 않았기 때문에 알려져 있지 않다. | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 액티나이드(Z) | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 | 100 | 101 | 102 | 103 |
| 산화 상태 | |||||||||||||||
| +2 | FM2+ | md2+ | 아니오2+ | ||||||||||||
| +3 | Ac3+ | TH3+ | 파3+ | U3+ | Np3+ | PU3+ | 암3+ | CM3+ | Bk3+ | cf3+ | 에스3+ | FM3+ | md3+ | 아니오3+ | Lr3+ |
| +4 | TH4+ | 파4+ | U4+ | Np4+ | PU4+ | 암4+ | CM4+ | Bk4+ | cf4+ | ||||||
| +5 | 파오+ 2 | UO+ 2 | NpO+ 2 | 푸오+ 2 | 아모+ 2 | ||||||||||
| +6 | UO2+ 2 | NpO2+ 2 | 푸오2+ 2 | 아모2+ 2 | CMO2+ | ||||||||||
| +7 | NpO3+ 2 | 푸오3+ 2 | 아모3− 5 | ||||||||||||
물리적 성질
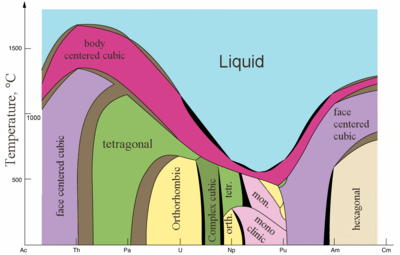 |  |
| 일부 액티니이드 대 온도 결정 구조 | 액티니이드의[83] 금속성 및 이온성 반지름 |

액티니드는 전형적인 금속이다.모두 부드러우며 은빛 빛깔(그러나 공기는 타르니), [88]밀도와 가소성이 비교적 높다.그들 중 일부는 칼로 자를 수 있다.이들의 전기 저항은 15~150µΩ·cm이다.[83]토륨의 경도는 연강과 비슷해 가열된 순수 토륨을 시트로 말아 철사로 끌어낼 수 있다.토륨은 우라늄과 플루토늄의 절반에 가까운 밀도를 가지고 있지만 둘 중 어느 것보다도 단단하다.모든 액티니드는 방사능, 파라마그네틱이며 액티니움을 제외하고 플루토늄은 7개, 우라늄, 넵투늄, 캘리포늄은 3개라는 몇 가지 결정 단계를 가지고 있다.프로토티늄, 우라늄, 넵투늄, 플루토늄의 결정구조는 란타니드 중 명확한 아날로그를 가지고 있지 않으며 3d 변환 금속과 더 유사하다.[73]
모든 액티니드는 화로포린성이며, 특히 미세하게 나누면 상온에서 공기와 반응하면 자연적으로 발화한다.[88][89]액티니이드의 녹는점은 f-전자의 수에 뚜렷한 의존성을 가지고 있지 않다.넵투늄과 플루토늄(약 640 °C)의 비정상적으로 낮은 용해점은 5f와 6d 궤도의 혼합과 이들 금속의 방향 결합 형성에 의해 설명된다.[73]
| 란타니데스 | Ln3+, å | 악티니데스 | 안3+, å | 안4+, å |
|---|---|---|---|---|
| 란타넘 | 1.061 | 악티늄 | 1.11 | – |
| 세륨 | 1.034 | 토륨 | 1.08 | 0.99 |
| 프라세오디뮴 | 1.013 | 프로텍티늄 | 1.05 | 0.93 |
| 네오디뮴 | 0.995 | 우라늄 | 1.03 | 0.93 |
| 프로메튬 | 0.979 | 넵투늄 | 1.01 | 0.92 |
| 사마륨 | 0.964 | 플루토늄 | 1.00 | 0.90 |
| 유로피움 | 0.950 | 아메리슘 | 0.99 | 0.89 |
| 가돌리늄 | 0.938 | 큐륨 | 0.98 | 0.88 |
| 테르비움 | 0.923 | 베르켈륨 | – | – |
| 디스프로슘 | 0.908 | 캘리포늄 | – | – |
| 홀뮴 | 0.894 | 아인슈타인움 | – | – |
| 에르비움 | 0.881 | 페르뮴 | – | – |
| 툴륨 | 0.869 | 멘델레비움 | – | – |
| 이테르비움속 | 0.858 | 노벨륨 | – | – |
| 루테튬 | 0.848 | 로렌슘 | – | – |
화학적 특성
란타니이드와 마찬가지로 모든 액티니드는 할로겐과 찰코균에 매우 반응하지만 액티니드는 더 쉽게 반응한다.액티니데스, 특히 5f전자가 적은 것은 교배되기 쉽다.이것은 5f, 7s, 6d 쉘에서 전자 에너지의 유사성으로 설명된다.대부분의 액티니드는 보다 다양한 발란스 상태를 나타내며, 가장 안정적인 것은 우라늄의 경우 +6, 프로토티늄과 넵투늄의 경우 +5, 토륨과 플루토늄의 경우 +4, 액티늄 및 기타 액티니이드의 경우 +3이다.[91]
액티늄은 화학적으로 란타넘과 유사하며, 이는 비슷한 이온 반경과 전자 구조로 설명된다.란타넘과 마찬가지로 액티늄은 화합물에서 거의 항상 +3의 산화 상태를 가지지만 반응성이 떨어지고 기본 성질이 더 뚜렷하다.다른 삼발효소 중 Ac는3+ 산성이 가장 낮으며, 즉 수용액에서 가수 분해하는 경향이 가장 약하다.[30][73]
토륨은 오히려 화학적으로 활발하다.6d와 5f 궤도상에 전자가 부족하기 때문에 4차 궤도 토륨 화합물은 무색이다.pH < 3에서 토륨염의 용액은 양이온 [Th(HO2)]84+에 의해 지배된다.Th이온은4+ 비교적 크며, 조정수에 따라 반경이 0.95~1.14 å 사이일 수 있다. 그 결과 토륨염은 가수 분해 경향이 약하다.토륨염의 독특한 능력은 물과 극성 유기용제 모두에서 높은 용해성이다.[73]
프로텍티늄은 두 가지 발란스 상태를 보인다; +5는 안정적이며, +4 상태는 쉽게 프로텍티늄(V)으로 산화된다.따라서 용액 내 4차원 프로토티늄은 수소 대기의 강한 환원제의 작용으로 얻는다.사차원균은 화학적으로 우라늄과 유사하다.IV) 및 토륨(IV)프로actinium의 불소화물, 인산염, 저인산염, 요오드산염, 페닐라르손산염().IV)는 물과 희석산에서 불용성이다.프로토티늄은 용해성 탄산염을 형성한다.펜타발 프로텍티늄의 수력학적 성질은 탄탈룸(V)과 니오비움(V)에 가깝다.프로토티늄의 복잡한 화학 작용은 이 원소의 5f 껍질 채우기 시작의 결과물이다.[62]
우라늄은 3에서 6까지 유효하며, 마지막으로 가장 안정적이다.헥사발렌트 상태에서 우라늄은 그룹 6 원소와 매우 유사하다.우라늄의 많은 화합물 (IV)와 우라늄(VI)은 비스토리히메트릭(non stoichychometric), 즉 가변성 성분이다.예를 들어, 이산화 우라늄의 실제 화학식은 UO이며2+x, 여기서 x는 -0.4와 0.32 사이에 차이가 있다.우라늄(VI) 화합물은 약한 산화물이다.그들 대부분은 선형 "우라닐" 그룹 UO를2+
2 포함하고 있다.4~6 리간드는 천왕성 그룹에 수직인 적도 평면에 수용될 수 있다.천왕성 그룹은 경산 역할을 하며 질소-도너 리간드보다 산소-도너 리간드로 더 강한 콤플렉스를 형성한다.NpO와2+
2 PuO도2+
2 +6 산화 상태에서 Np와 Pu의 일반적인 형태다.우라늄().IV) 화합물은 대기 산소에 의해 쉽게 산화되는 등 감소하는 성질을 보인다.우라늄(III)은 매우 강력한 환원제다.d-shell의 존재로 인해 우라늄(및 많은 다른 활성산소)은III U(CH55)3와IV U(CH55)와 같은 유기농 화합물을 형성한다.4[73][92]
넵투늄은 용액에서 동시에 관찰할 수 있는 3부터 7까지의 발란스 상태를 가지고 있다.용액에서 가장 안정된 상태는 +5이지만 고체 넵투늄 화합물에서는 발란스 +4가 선호된다.넵투늄 금속은 매우 반응적이다.넵투늄의 이온은 가수분해와 조정 화합물이 형성되기 쉽다.[38]
플루토늄은 또한 3과 7 사이의 발란스 상태를 나타내므로 화학적으로 넵투늄과 우라늄과 유사하다.이것은 반응성이 매우 높으며, 공기 중에 산화막을 빠르게 형성한다.플루토늄은 25~50℃의 낮은 온도에서도 수소와 반응한다. 또한 할로겐화물과 금속간 화합물을 쉽게 형성한다.산화 상태가 다른 플루토늄 이온의 가수분해 반응은 상당히 다양하다.플루토늄(V)은 중합반응에 들어갈 수 있다.[93][94]
활성산소 중 가장 큰 화학적 다양성은 아메리슘에서 관찰되는데, 아메리슘은 2에서 6사이의 용맹을 가질 수 있다.이분 아메리슘은 건조한 화합물과 비 수용액(아세토나이트릴)에서만 얻을 수 있다.산화 상태 +3, +5 및 +6은 수성 용액에 일반적으로 사용되지만 고체 상태에서도 사용된다.사타원 아메리슘은 수용액에서 콤플렉스는 물론 안정적인 고체 화합물(다이옥사이드, 불소, 수산화물)을 형성한다.알칼리성 용액에서는 아메리슘을 헵타발렌트 상태로 산화시킬 수 있다고 보고되었지만, 이러한 데이터는 잘못된 것으로 판명되었다.아메리슘의 가장 안정적인 용량은 수용액에서 3개, 고체 화합물에서 3개 또는 4개 입니다.[95]
발랑스 3은 (노벨륨을 제외하고) 로렌슘까지 이어지는 모든 후속 요소에서 우세하다.큐륨은 고형분(플루오리드, 이산화질소)에서 4가치가 될 수 있다.베르켈륨은 +3의 발란스와 함께 큐륨의 발란스보다 더 안정적인 +4의 발란스를 보여준다; 발란스 4는 고체 불소와 이산화물에서 관찰된다.수용액에서 bk의4+ 안정성은 ce의4+ 안정성에 가깝다.[96]캘리포니아, 아인슈타인, 페르뮴에 대해서는 발란스 3만이 관찰되었다.분열 상태는 멘델레비움과 노벨리움으로 증명되었고, 노벨리움에서는 3분위 상태보다 안정적이다.로렌슘은 용액과 고형분 둘 다에서 용액 3을 보여준다.[95]
The redox potential increases from −0.32 V in uranium, through 0.34 V (Np) and 1.04 V (Pu) to 1.34 V in americium revealing the increasing reduction ability of the An4+ ion from americium to uranium.모든 액티니드는 소금과 같은 성질을 가진 검은색의3 하이드라이드를 형성한다.Actinides는 또한 AnC 또는 AnC2(우라늄의 경우23 UC)의 일반 공식과 황화물 AnS23, AnS를2 포함한 탄화물을 생산한다.[91]
화합물
산화물과 수산화물
| 화합물 | 색 | 결정 대칭, 유형 | 격자 상수, å | 밀도, g/cm3 | 온도, °C | ||
|---|---|---|---|---|---|---|---|
| a | b | c | |||||
| ACO23 | 흰색 | 육각형, LaO23 | 4.07 | - | 6.29 | 9.19 | – |
| 파오2 | - | 큐빅, CaF2 | 5.505 | - | - | - | - |
| 파오25 | 흰색 | 세제곱, CaF2 큐빅 4각형 육각형 림보헤드랄 정형외과 | 5.446 10.891 5.429 3.817 5.425 6.92 | - - - - - 4.02 | - 10.992 5.503 13.22 - 4. 18 | - | 700 700–1100 1000 1000–1200 1240–1400 – |
| 토오2 | 무색 | 큐빅 | 5.59 | - | - | 9.87 | – |
| UO2 | 흑갈색 | 큐빅 | 5.47 | - | - | 10.9 | – |
| NpO2 | 녹갈색 | 큐빅, CaF2 | 5.424 | - | - | 11.1 | – |
| 푸오 | 블랙 | 큐빅, NaCl | 4.96 | - | - | 13.9 | – |
| 푸오2 | 황록색 | 큐빅 | 5.39 | - | - | 11.44 | – |
| 아모23 | 적갈색 적갈색 | 큐빅, MnO23 육각형, LaO23 | 11.03 3.817 | - | - 5.971 | 10.57 11.7 | – |
| 아모2 | 블랙 | 큐빅, CaF2 | 5.376 | - | - | - | - |
| CMO23 | 흰색[99] - - | 큐빅, MnO22 육각형, LaCl3 모노클리닉, 스모23 | 11.01 3.80 14.28 | - - 3.65 | - 6 8.9 | 11.7 | – |
| CMO2 | 블랙 | 큐빅, CaF2 | 5.37 | - | - | - | - |
| Bk2O3 | 연한 갈색 | 큐빅, MnO23 | 10.886 | - | - | - | - |
| BkO2 | 적갈색 | 큐빅, CaF2 | 5.33 | - | - | - | - |
| Cf2O3[100] | 무색 누리끼리한 - | 큐빅, MnO23 모노클리닉, 스모23 육각형, LaO23 | 10.79 14.12 3.72 | - 3.59 - | - 8.80 5.96 | - | - |
| CfO2 | 블랙 | 큐빅 | 5.31 | - | - | - | - |
| eso23 | - | 큐빅, MnO23 단음이의 육각형, LaO23 | 10.07 14.1 3.7 | - 3.59 - | - 8.80 6 | - | - |
| 산화 상태 | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| +3 | 푸오23 | 아모23 | CMO23 | Bk2O3 | Cf2O3 | eso23 | |||||
| +4 | 토오2 | 파오2 | UO2 | NpO2 | 푸오2 | 아모2 | CMO2 | BkO2 | CfO2 | ||
| +5 | 파오25 | U2O5 | Np2O5 | ||||||||
| +5,+6 | U3O8 | ||||||||||
| +6 | UO3 |
| 화학식 | 토오2 | 파오2 | UO2 | NpO2 | 푸오2 | 아모2 | CMO2 | BkO2 | CfO2 |
| CAS 번호 | 1314-20-1 | 12036-03-2 | 1344-57-6 | 12035-79-9 | 12059-95-9 | 12005-67-3 | 12016-67-0 | 12010-84-3 | 12015-10-0 |
| 어금질량 | 264.04 | 263.035 | 270.03 | 269.047 | 276.063 | 275.06 | 270–284** | 279.069 | 283.078 |
| 녹는점[102] | 3390°C | 2865 °C | 2547°C | 2400°C | 2175 °C | ||||
| 결정구조 |  A4+: __ / O2−: __ | ||||||||
| 스페이스 그룹 | Fm3m | ||||||||
| 조정번호 | 안[8], 오[4] | ||||||||
- A – Actinide
**동위원소에 따라 다름
일부 액티니드는23 ANO2, ANO25, ANO, ANO와3 같은 몇 가지 산화물로 존재할 수 있다.모든 산화물에 대해, 산화물 ANO는3 원형이고, ANO23, ANO2, ANO는25 기본이다. 그들은 물과 쉽게 반응하며, 베이스를 형성한다.[91]
- An2O3 + 3 H2O → 2 An(OH)3.
이 염기들은 물에 잘 녹지 않으며 그 활동으로 희토류 금속의 수산화물에 가깝다.[91]Np(OH)3는 아직 합성되지 않았고, Pu(OH)3는 파란색, Am(OH)3은 분홍색, 큐륨 수산화물 Cm(OH)3은 무색이다.[103]또한 Np, Pu, Am의 경우 4차 수산화물과 Np 및 Am의 경우 5차 수산화물과 마찬가지로 Bk(OH)3와 Cf(OH)3도 알려져 있다.[103]
가장 강력한 근거는 악티늄이다.액티늄의 모든 화합물은 흑색 액티늄 황화물(AcS23)을 제외하고 무색이다.[91]4가성 액티니드의 이산화물은 불소 칼슘과 마찬가지로 입방체계에 결정된다.
토륨이 산소와 단독으로 반응하여 이산화물을 형성한다.
이산화 토륨은 알려진 산화물(3390°C) 중에서 용해점이 가장 높은 내화성 물질이다.[101]텅스텐에 0.8–1% ThO를2 추가하면 구조가 안정화되므로 도핑된 필라멘트는 진동에 대한 기계적 안정성이 향상된다.ThO를2 산으로 용해하기 위해 500–600 °C까지 가열한다. 600 °C 이상 가열하면 ThO의2 산 및 기타 시약 형태에 대한 내성이 매우 강하다.불소 이온을 약간 첨가하면 산에서 이산화 토륨이 용해된다.
두 개의 프로토티늄 산화물이 얻어졌다: PaO2(검은색)와 PaO25(흰색); 전자는 ThO와2 이형이고 후자는 얻기 쉽다.두 산화물 모두 기본이고, Pa(OH)5는 약하고, 용해성이 좋지 않은 염기성이다.[91]
특정 우라늄 염분 분해(예: UO2(NO3)/6)400 °C에서 공기 중 HO2, 주황색 또는 노란색 UO 발생3.[101]이 산화물은 원형질이고 여러 수산화물을 형성하는데, 가장 안정적인 것은 천왕성 수산화물 UO2(OH)이다.2산화 우라늄(VI)이 수소와 반응하면 이산화 우라늄이 나오는데, 이 우라늄은 ToO와2 성질이 비슷하다.이 산화물은 또한 기본이고 수산화 우라늄(OH)에 해당한다.4[91]
플루토늄, 넵투늄 및 아메리슘은 두 가지 기본적인 산화물을 형성한다.아노와23 아노2.삼산화 넵투늄은 불안정하기 때문에 지금까지 NpO만38 얻을 수 있었다.그러나, 화학 공식 ANO와2 ANO를23 가진 플루토늄과 넵투늄의 산화물은 잘 특징지어진다.[91]
소금
| 화학식 | AcCl3 | UCl3 | NpCl3 | PuCl3 | 암클3 | CmCl3 | BkCl3 | CfCl3 |
|---|---|---|---|---|---|---|---|---|
| CAS 번호 | 22986-54-5 | 10025-93-1 | 20737-06-8 | 13569-62-5 | 13464-46-5 | 13537-20-7 | 13536-46-4 | 13536-90-8 |
| 어금질량 | 333.386 | 344.387 | 343.406 | 350.32 | 349.42 | 344–358** | 353.428 | 357.438 |
| 녹는점 | 837 °C | 800°C | 767°C | 715 °C | 695°C | 603°C | 545 °C | |
| 비등점 | 1657 °C | 1767°C | 850 °C | |||||
| 결정구조 |  A3+: __ / Cl−: __ | |||||||
| 스페이스 그룹 | P63/m | |||||||
| 조정번호 | An*[9], Cl [3] | |||||||
| 격자 상수 | a = 762pm c = 455 pm | a = 745.2pm c = 오후 432.8 | a = 오후 739.4시 c = 오후 424.3 | a = 오후 738.2시 c = 421.4pm | a = 오후 726시 c = 오후 414시 | a = 오후 738.2시 c = 오후 412.7 | a = 738 pm c = 409 pm | |
- *An – Actinide
**동위원소에 따라 다름
| 화합물 | 색 | 결정 대칭, 유형 | 격자 상수, å | 밀도, g/cm3 | ||
|---|---|---|---|---|---|---|
| a | b | c | ||||
| ACF3 | 흰색 | 육각형, LaF3 | 4.27 | - | 7.53 | 7.88 |
| PAF4 | 암갈색 | 단음이의 | 12.7 | 10.7 | 8.42 | – |
| PAF5 | 블랙 | 4각형, β-UF5 | 11.53 | - | 5.19 | – |
| ThF4 | 무색 | 단음이의 | 13 | 10.99 | 8.58 | 5.71 |
| UF3 | 불그스름한 퍼플 | 육각형 | 7.18 | - | 7.34 | 8.54 |
| UF4 | 녹색 | 단음이의 | 11.27 | 10.75 | 8.40 | 6.72 |
| α-UF5 | 푸르스 | 4각형 | 6.52 | - | 4.47 | 5.81 |
| β-UF5 | 푸르스 | 4각형 | 11.47 | - | 5.20 | 6.45 |
| UF6 | 누리끼리한 | 정형외과 | 9.92 | 8.95 | 5.19 | 5.06 |
| NpF3 | 검정 또는 보라색 | 육각형 | 7.129 | - | 7.288 | 9.12 |
| NpF4 | 연두색 | 단음이의 | 12.67 | 10.62 | 8.41 | 6.8 |
| NpF6 | 오렌지 | 정형외과 | 9.91 | 8.97 | 5.21 | 5 |
| PUF3 | 보랏빛 청색 | 삼각형 | 7.09 | - | 7.25 | 9.32 |
| PUF4 | 연갈색 | 단음이의 | 12.59 | 10.57 | 8.28 | 6.96 |
| PUF6 | 적갈색 | 정형외과 | 9.95 | 9.02 | 3.26 | 4.86 |
| 암프3 | 핑크 또는 라이트 베이지 | 육각형, LaF3 | 7.04[75][106] | - | 7.255 | 9.53 |
| 암프4 | 주황색-빨간색 | 단음이의 | 12.53 | 10.51 | 8.20 | – |
| CMF3 | 갈색에서 흰색으로 | 육각형 | 4.041 | - | 7.179 | 9.7 |
| CMF4 | 노란색 | 모노클린치, UF4 | 12.51 | 10.51 | 8.20 | – |
| BkF3 | 황록색 | 삼각, LaF3 정형외과, YF3 | 6.97 6.7 | - 7.09 | 7.14 4.41 | 10.15 9.7 |
| BkF4 | - | 모노클린치, UF4 | 12.47 | 10.58 | 8.17 | – |
| CFF3 | - - | 삼각, LaF3 정형외과, YF3 | 6. 94 6.65 | - 7.04 | 7.10 4.39 | – |
| CFF4 | - - | 모노클린치, UF4 모노클린치, UF4 | 1.242 1.233 | 1.047 1.040 | 8.126 8.113 | – |

Actinides는 MX와3 MX4(X = 할로겐)라는 공식으로 소금을 형성하는 할로겐과 쉽게 반응한다.그래서 최초의 베르켈륨 화합물인 BkCl은3 1962년에 3나노그램으로 합성되었다.희토류 원소의 할로겐처럼 액티닌화염소, 브로미이드, 요오드화물은 수용성이 높고 불소는 불용성이다.우라늄은 56.5℃ 온도에서 승화되는 무색의 육불화합물을 쉽게 산출하는데, 휘발성 때문에 가스 원심분리기나 기체 확산으로 우라늄 동위원소를 분리하는 데 사용된다.액틴화 육불화물은 무수체에 가까운 성질을 가지고 있다.그들은 ANOF를22 형성하는 수분과 가수 분해에 매우 민감하다.[107]우라늄의 오타클로라이드와 흑색 헥사클로라이드가 합성됐지만 둘 다 불안정하다.[91]
액티니이드에 대한 산의 작용은 소금을 생산하고, 만약 그 산들이 비산소화된다면, 소금에 함유된 액티니드는 저밸런스 상태에 있다.
- U + 2H2SO4 → U(SO4)2 + 2H2
- 2Pu + 6HCl → 2PuCl3 + 3H2
그러나 이러한 반응에서 재생 수소는 금속과 반응하여 상응하는 하이드라이드를 형성할 수 있다.우라늄은 토륨보다 훨씬 쉽게 산과 물과 반응한다.[91]
액티니드 염은 또한 해당 수산화물을 산으로 용해시킴으로써 얻을 수 있다.질산염, 염소산염, 황산염, 과염소산염은 수용성이 있다.수용액에서 결정되었을 때, 이 염들은 Th(NO3)/46HO2, Th(SO4)/29와 같이 수분을 형성한다.HO와2 Pu2(SO4)/37HO2. 고밸런스 액티니드의 염분은 쉽게 가수분해된다.그래서 토륨의 무색 황산염, 염화물, 과염소산염, 질산염은 Th(2OH4)SO와 Th(3OH)NO3 공식으로 기본 염으로 변모한다.3가액과 4가액막염의 용해성과 불용성(불용성)은 란타니드염과 같다.그래서 인산염, 불소, 옥살산염, 요오드산염 및 활성산소의 탄산염은 물에 약하게 용해된다; 그것들은 ThF4/3와 같은 수산화물로 침전된다.HO2 및 Th(CrO4)/23H2O.[91]
산화 상태 +6으로 작용하며, ANO형22+ 계수를 제외하고 [AnO4],2− [AnO27]2− 및 기타 복잡한 음이온을 형성한다.예를 들어 우라늄24, 넵투늄 및 플루토늄은 2NaUO4(우라늄) 유형 및 (NH)UO27 유형의 염류를 형성한다.란타니드와 비교하여 액티니드는 조정 화합물을 더 쉽게 형성하며, 이 능력은 액티니이드 용기에 따라 증가한다.삼발효소(trivalent actinides)는 불소 조정 화합물을 형성하지 않는 반면 사발효소 토륨은 KThF26, KThF5, 심지어 KThF59 단지를 형성한다.토륨은 또한 해당 황산염(예: NaSO24/Th(SO4)/25)을 형성한다.HO2), 질산염, 티오시아네이트.일반식 AnTh2(NO3)/6n을 사용한 소금HO는2 토륨의 조정 번호가 12가 되는 조정성질의 것이다.더욱 쉬운 것은 펜타발렌트와 육각액액션의 복잡한 염분을 생산하는 것이다.액티니이드의 가장 안정적인 조정 화합물인 4차 토륨과 우라늄은 아세틸라세톤과 같은 디케톤과의 반응으로 얻는다.[91]
적용들
Actinides는 연기 감지기(미국산)[108][109]와 가스 맨틀(토륨)과 같이 일부 확립된 일상 용도를 가지고 있지만,[79] 그것들은 대부분 핵무기와 원자로에서 연료로 사용된다.[79]마지막 두 영역은 액티니이드의 특성을 이용하여 핵반응에 엄청난 에너지를 방출하는데, 특정 조건 하에서 핵반응은 자생적인 연쇄반응이 될 수 있다.
원자력 적용을 위한 가장 중요한 동위원소는 우라늄-235이다.열로에서 사용되며 천연 우라늄 농축은 0.72%를 넘지 않는다.이 동위원소는 많은 에너지를 방출하는 열 중성자를 강하게 흡수한다.U의 1 그램의 핵분열 작용은 약 1 MW·day로 변환된다.중요한 것은 U가
흡수하는 것보다 더 많은 중성자를 방출한다는 것이다;[110] 임계 질량에 도달하자마자 U는
자생적인 연쇄 반응을 일으킨다.[73]일반적으로 우라늄 핵은 2-3 중성자의 방출과 함께 두 조각으로 나뉜다. 예를 들면 다음과 같다.
다른 유망한 원자력용 액티니이드 동위원소는 토륨-232와 토륨 연료 사이클인 우라늄-233이다.
| 원자로[73][111][112] |
| 대부분의 2세대 원자로의 핵은 대개 지르코늄 합금으로 만들어지고 우라늄, 플루토늄 또는 토륨의 산화물, 카바이드, 질화수소 또는 모노황화물 또는 그 혼합물( 소위 MOX 연료)으로 채워진 중공 금속 막대의 세트를 포함한다.가장 흔한 연료는 우라늄-235의 산화물이다. 고속 중성자는 우라늄-235와의 상호작용의 효율성을 높이기 위해 물, 탄소, 중수소 또는 베릴륨을 포함하는 감속기에 의해 감속된다.핵반응 속도는 붕소나 카드뮴으로 만든 봉이나 액체 흡수제인 보통 붕산을 추가로 도입함으로써 조절된다.플루토늄 생산을 위한 원자로는 브리더 원자로 또는 브리더라고 불린다. 그들은 다른 설계를 가지고 있고 빠른 중성자를 사용한다. |
우라늄 핵분열 시 중성자 방출은 핵 연쇄 반응을 유지하는 것뿐만 아니라 보다 무거운 액티니이드의 합성을 위해서도 중요하다.우라늄-239는 β-decay를 통해 플루토늄-239로 변환되는데, 우라늄-235와 마찬가지로 자발적 핵분열이 가능하다.세계 최초의 원자로는 에너지가 아니라 핵무기용 플루토늄-239를 생산하기 위해 건설되었다.
생산된 토륨의 약 절반이 가스 맨틀의 발광 물질로 사용된다.[79]토륨은 마그네슘과 아연의 다단성 합금에도 첨가된다.그래서 Mg-Th 합금은 가볍고 튼튼하지만 용융점과 연성도 높아 항공산업과 미사일 생산에 널리 사용된다.토륨은 또한 전자 방출 특성이 양호하며, 수명이 길고 방출에 대한 잠재적 장벽이 낮다.[110]토륨과 우라늄 동위원소의 상대적 함량은 별을 포함한 다양한 물체의 연령을 추정하는 데 널리 사용된다(방사선 연대 측정 참조).[113]
플루토늄의 주요 적용 분야는 핵무기였는데, 핵분열과 가용성이 용이해 동위원소 플루토늄-239가 핵심 성분이었다.플루토늄 기반의 설계로 임계 질량을 우라늄-235의 약 3분의 1로 줄일 수 있다.[114]맨해튼 프로젝트 기간 중 생산된 '뚱뚱한 남자' 형태의 플루토늄 폭탄은 플루토늄을 폭발적으로 압축해 정상보다 훨씬 높은 밀도를 얻었고, 중앙 중성자원과 결합해 반응을 시작하고 효율성을 높였다.따라서 TNT의 20킬로톤에 해당하는 폭발 수율에는 6.2kg의 플루토늄만 필요했다(핵무기 설계 참조).[115]가정적으로, 4 kg 정도의 플루토늄은 매우 정교한 조립 설계를 사용하여 단일 원자 폭탄을 만드는 데 사용될 수 있다.[116]
플루토늄-238은 우라늄-235에 비해 임계 질량이 작기 때문에 원자로에 잠재적으로 더 효율적인 동위원소지만 제어봉에 의해 핵분열 연쇄반응이 중단되더라도 붕괴에 의해 많은 열 에너지(0.56 W/g)[109][117]를 계속 방출하고 있다.그것의 적용은 그것의 높은 가격(US$1000/g)에 의해 제한된다.이 동위원소는 일부 우주 위성과 관측소의 열가소성 물질과 수증류 시스템에 사용되어 왔다.그래서 갈릴레오와 아폴로 우주선(예: 아폴로 14호[118])은 킬로그램의 플루토늄-238산화물로 구동되는 히터를 가지고 있었다; 이 열은 또한 열가소성 물질을 가진 전기로 변환된다.플루토늄-238의 붕괴는 비교적 무해한 알파 입자를 생성하며 감마선 분해를 동반하지 않는다.따라서 이 동위원소(~160mg)는 기존 배터리에 비해 약 5배 이상 지속되는 심장박동조절기에서 에너지원으로 사용된다.[109]
액티늄-227은 중성자원으로 사용된다.고특정 에너지(14.5W/g)와 열안정성 화합물 상당량 확보 가능성은 원격 사용을 위한 오래 지속되는 열전 발생기에 매력적이다.228ac는 쉽게 검출할 수 있는 고에너지 전자(2.18MeV)를 방출하기 때문에 화학 연구에서 방사능을 나타내는 지표로 사용된다.228Ac-Ra228 혼합물은 산업과 의학에서 강렬한 감마원으로 널리 사용된다.[30]
내구성 있는 결정체를 가진 자기 발광 활성 물질의 개발은 일부 유리 및 결정체에 알파 방출 방사성핵종이 추가되어 발광을 일으킬 수 있기 때문에 새로운 활성 물질 활용 영역이다.[119]
독성

방사성 물질은 (i) 국소 피부 오염, (ii) 방사성 동위원소 섭취에 따른 내부 노출, (iii) β-활성화 및 β-방사선에 의한 외부 과다 노출로 인간의 건강을 해칠 수 있다.라듐, 트랜스우라늄 원소와 함께 액티늄은 특정 α-활성도가 높은 가장 위험한 방사능 독 중 하나이다.액티늄의 가장 중요한 특징은 골격의 표면층에 축적되어 남는 능력이다.중독 초기에는 간에 액티늄이 축적된다.액티늄의 또 다른 위험은 그것이 배설되는 것보다 더 빨리 방사성 붕괴를 겪는다는 것이다.소화관에서 나오는 흡착은 라듐보다 액티늄의 경우 훨씬 작다(~[30]0.05%)
체내의 프로텍티늄은 신장과 뼈에 축적되는 경향이 있다.인체 내 프로티늄의 최대 안전선량은 Pa 0.5마이크로그램에 해당하는 0.03 µCi이다.공기 중에 에어로졸로 존재할 수 있는 이 동위원소는 하이드로사이안산보다 2.5배 10배8 더 독성이 강하다.[62][contradictory]
플루토늄은 공기, 음식 또는 혈액(상처 등)을 통해 체내에 들어갈 때 대부분 폐, 간, 뼈 등에 정착하고 10% 정도만 다른 장기로 가는 것으로 수십 년 동안 그대로 남아 있다.체내 플루토늄의 장기 체류 시간은 부분적으로 물에서의 용해도가 낮다는 것에 의해 설명된다.플루토늄의 일부 동위원소는 이온화 α-방사선을 방출하여 주변 세포를 손상시킨다.플루토늄 정맥주사 후 개에서 30일간 투여되는 중앙 치사량(LD50)은 체중의 kg당 0.32mg이며, 따라서 사람의 치사량은 70kg인 사람의 경우 약 22mg이므로 호흡기 피폭량은 약 4배 이상이어야 한다.또 다른 추정치는 플루토늄이 라듐보다 50배 덜 독성이므로 체내 플루토늄의 허용 함량은 5µg 또는 0.3µCi여야 한다고 가정한다.그러한 양은 현미경으로는 거의 보이지 않는다.동물에 대한 시험 후, 이 최대 허용 선량은 0.65 µg 또는 0.04 µCi로 감소되었다.동물에 대한 연구에서도 가장 위험한 플루토늄 피폭 경로가 흡입이며, 그 후 흡입된 물질의 5~25%가 체내에 유지된다는 사실이 밝혀졌다.플루토늄 화합물의 입자 크기와 용해도에 따라 플루토늄은 폐나 림프계에 국부화되거나 혈액에 흡수된 뒤 간과 뼈로 운반된다.음식을 통한 오염이 가장 가능성이 적은 방법이다.이 경우 플루토늄의 수용성 0.01% 불용성 화합물의 약 0.05%만이 혈액으로 흡수되고 나머지는 배설된다.손상된 피부를 플루토늄에 노출시키는 것은 거의 100%를 유지할 것이다.[93]
핵연료에 액티니드를 사용하면 밀폐된 방사성원소나 자기희생 결정과 같은 첨단 물질은 많은 잠재적 이점을 가지고 있다.그러나 심각한 우려는 액티니이드의 극초단독성과 환경에서의 이동이다.[120]MOX 및 밀봉된 방사능 선원의 화학적으로 불안정한 형태의 방사능 사용은 현대 안전 표준에 의해 적절하지 않다.안전한 보관과 사용, 최종 폐기를 제공하는 안정적이고 내구성 있는 액티나이드 내구성 소재를 개발해야 하는 과제가 있다.핵심 요구 사항은 내구성이 뛰어난 결정체 호스트 단계에서 액티나이드 고체 용액의 적용이다.[119]
핵물성
| 뉴클리드 | 하프라이프 | 붕괴 모드 | 분기분수 | 출처 |
|---|---|---|---|---|
| 206 81Tl | 4.12 ± 0.011m | β− | 1.0 | LNHB |
| 208 81Tl | 3.060 ± 0.008m | β− | 1.0 | BIPM-5 |
| 210 82PB | 22.20 ± 0.22 y | β− | 1.0 | ENSDF |
| α | (1.9 ± 0.4 ) x 10−8 | |||
| 211 82PB | 36.1 ± 0.2 m | β− | 1.0 | ENSDF |
| 212 82PB | 10.64 ± 0.01 h | β− | 1.0 | BIPM-5 |
| 214 82PB | 26.8 ± 0.9 m | β− | 1.0 | ENSDF |
| 211 83비 | 2.14 ± 0.02m | β− | 0.00276 ± 0.00004 | ENSDF |
| α | 0.99724 ± 0.00004 | |||
| 212 83비 | 60.54 ± 0.06m | α | 0.3593 ± 0.0007 | BIPM-5 |
| β− | 0.6407 ± 0.0007 | |||
| 214 83비 | 19.9 ± 0.4m | α | 0.00021 ± 0.00001 | ENSDF |
| β− | 0.99979 ± 0.00001 | |||
| 210 84포 | 138.376 ± 0.002 d | α | 1.0 | ENSDF |
| 219 86Rn | 3.96 ± 0.01초 | α | 1.0 | ENSDF |
| 220 86Rn | 55.8 ± 0.3초 | α | 1.0 | BIPM-5 |
| 221 87FR | 4.9 ± 0.2 m | β− | 0.00005 ± 0.00003 | ENSDF |
| α | 0.99995 ± 0.00003 | |||
| 223 88라 | 11.43 ± 0.05 d | α | 1.0 | ENSDF |
| 14C | (8.9 ± 0.4 ) x 10−10 | |||
| 224 88라 | 3.627 ± 0.007 d | α | 1.0 | BIPM-5 |
| 225 88라 | 14.9 ± 0.2 d | β− | 1.0 | ENSDF |
| 226 88라 | (1.600 ± 0.007 ) x 103 y | α | 1.0 | BIPM-5 |
| 228 88라 | 5.75 ± 0.03 y | β− | 1.0 | ENSDF |
| 224 89Ac | 2.78 ± 0.17 h | α | 0.091 +0.020 -0.014 | ENSDF |
| EC | 0.909 +0.014 -0.020 | |||
| 225 89Ac | 10.0 ± 0.1 d | α | 1.0 | ENSDF |
| 227 89Ac | 21.772 ± 0.003 y | α | 0.01380 ± 0.00004 | ENSDF |
| β− | 0.98620 ± 0.00004 | |||
| 228 89Ac | 6.15 ± 0.02시간 | β− | 1.0 | ENSDF |
| 227 90TH | 18.718 ± 0.005 d | α | 1.0 | BIPM-5 |
| 228 90TH | 698.60 ± 0.23 d | α | 1.0 | BIPM-5 |
| 229 90TH | ( 7.34 ± 0.16 ) x 103 y | α | 1.0 | ENSDF |
| 230 90TH | ( 7.538 ± 0.030 ) x 104 y | α | 1.0 | ENSDF |
| SF | ≤ 4 x 10−13 | |||
| 231 90TH | 25.52 ± 0.01 h | β− | 1.0 | ENSDF |
| α | ~ 4 x 10−13 | |||
| 232 90TH | (1.405 ± 0.006 ) x 1010 y | α | 1.0 | ENSDF |
| SF | ( 1.1 ± 0.4 ) x 10−11 | |||
| 233 90TH | 22.15 ± 0.15m | β− | 1.0 | LNHB |
| 234 90TH | 24.10 ± 0.03 d | β− | 1.0 | ENSDF |
| 231 91파 | (3.276 ± 0.011 ) x 104 y | α | 1.0 | ENSDF |
| SF | ≤ 3 x 10−12 | |||
| 232 91파 | 1.32 ± 0.02 d | EC | 0.00003 ± 0.00001 | ENSDF |
| β− | 0.99997 ± 0.00001 | |||
| 233 91파 | 26.98 ± 0.02 d | β− | 1.0 | LNHB |
| 234 91파 | 6.70 ± 0.05 h | β− | 1.0 | ENSDF |
| 234m 91파 | 1.125 ± 0.016m | IT | 0.0016 ± 0.0002 | IAEA-CRP-XG |
| β− | 0.9984 ± 0.0002 | |||
| 232 92U | 68.9 ± 0.4 y | α | 1.0 | ENSDF |
| SF | ||||
| 233 92U | ( 1.592 ± 0.002) x 105 y | α | 1.0 | ENSDF |
| SF | ||||
| 234 92U | ( 2.455 ± 0.006 ) x 105 y | α | 1.0 | LNHB |
| SF | (1.6 ± 0.2 ) x 10−11 | |||
| 235m 92U | 26 ± 1 m | IT | 1.0 | ENSDF |
| 235 92U | ( 7.038 ± 0.005 ) x 108 y | α | 1.0 | ENSDF |
| SF | (7 ± 2) x 10−11 | |||
| 236 92U | ( 2.342 ± 0.004 ) x 107 y | α | 1.0 | ENSDF |
| SF | (9.4 ± 0.4 ) x 10−10 | |||
| 237 92U | 6.749 ± 0.016 d | β− | 1.0 | LNHB |
| 238 92U | ( 4.468 ± 0.005 ) x 109 y | α | 1.0 | LNHB |
| SF | ( 5.45 ± 0.04) x 10−7 | |||
| 239 92U | 23.45 ± 0.02m | β− | 1.0 | ENSDF |
| 236 93Np | (1.55 ± 0.08 ) x 105 y | α | 0.0016 ± 0.0006 | LNHB |
| β− | 0.120 ± 0.006 | |||
| EC | 0.878 ± 0.006 | |||
| 236m 93Np | 22.5 ± 0.4 h | β− | 0.47 ± 0.01 | LNHB |
| EC | 0.53 ± 0.01 | |||
| 237 93Np | (2.155 ± 0.007 ) x 106 y | α | 1.0 | ENSDF |
| SF | ||||
| 238 93Np | 2.102 ± 0.002 d | β− | 1.0 | ENSDF |
| 239 93Np | 2.102 ± 0.003 d | β− | 1.0 | ENSDF |
| 236 94PU | 2.858 ± 0.008 y | α | 1.0 | ENSDF |
| LNHB | 노동 조합 국가 앙리 베크렐, 추천 자료 http://www.nucleide.org/DDEP_WG/DDEPdata.htm, 2006년 10월 3일. |
| BIPM-5 | M.M. Bé, V. Chisté, C.둘리외, E. 브라운, V.체체프, N. 쿠즈멘코, R. 헬머, A. Nichols, E. Shönfeld, R. Dersch, Monographie BIPM-5, 표 2 – A = 151 ~ 242, 2004. |
| ENSDF | "Evaluated Nuclear Structure Data File". Brookhaven National Laboratory. Retrieved 15 November 2006. |
| IAEA-CRP-XG | 엠엠베, 브이피체체프, R.Dersch, O. A. M. Helene, R. G. Helmer, M.허먼, S. Hlavác, A. Marcinkowski, G. L. Molnár, A. L. Nichols, E. Schönfeld, V. R. Vanin, M. J. Woods, IAEA CRP "Update of X Ray and Gamma Ray Decay Data Standards for Detector Calibration and Other Applications", IAEA Scientific and Technical Information report STI/PUB/1287, May 2007, International Atomic Energy Agency, Vienna, Austria, ISBN 92-0-113606-4. |
참고 항목
참조 및 참고 사항
- ^ a b c Theodore Gray (2009). The Elements: A Visual Exploration of Every Known Atom in the Universe. New York: Black Dog & Leventhal Publishers. p. 240. ISBN 978-1-57912-814-2.
- ^ Morss, Lester; Asprey, Larned B. (1 August 2018). "Actinoid element". britannica.com. Encyclopædia Britannica. Retrieved 3 September 2020.브리태니커 백과사전 온라인
- ^ Neil G. Connelly; et al. (2005). "Elements". Nomenclature of Inorganic Chemistry. London: Royal Society of Chemistry. p. 52. ISBN 978-0-85404-438-2.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. pp. 1230–1242. ISBN 978-0-08-037941-8.
- ^ Jensen, William B. (2015). "The positions of lanthanum (actinium) and lutetium (lawrencium) in the periodic table: an update". Foundations of Chemistry. 17: 23–31. doi:10.1007/s10698-015-9216-1. Retrieved 28 January 2021.
- ^ Scerri, Eric (18 January 2021). "Provisional Report on Discussions on Group 3 of the Periodic Table". Chemistry International. 43 (1): 31–34.
- ^ a b c 그린우드, 페이지 1250
- ^ a b Fields, P.; Studier, M.; Diamond, H.; Mech, J.; Inghram, M.; Pyle, G.; Stevens, C.; Fried, S.; Manning, W.; et al. (1956). "Transplutonium Elements in Thermonuclear Test Debris". Physical Review. 102 (1): 180–182. Bibcode:1956PhRv..102..180F. doi:10.1103/PhysRev.102.180.
- ^ a b c 그린우드, 페이지 1252
- ^ 노벨륨과 로렌슘은 소련과 미국의 과학자들에 의해 거의 동시에 발견되었다.
- ^ 미아소에도프, 페이지 7
- ^ E. Fermi (1934). "Possible Production of Elements of Atomic Number Higher than 92". Nature. 133 (3372): 898–899. Bibcode:1934Natur.133..898F. doi:10.1038/133898a0.
- ^ Mehra, Jagdish; Rechenberg, Helmut (2001). The historical development of quantum theory. Springer. p. 966. ISBN 978-0-387-95086-0.
- ^ Seaborg, G. T. (1994). "118 – Origin of the actinide concept". In K.A. Gschneidner Jr., L; Eyring, G.R. Choppin; G.H. Landet (eds.). Handbook on the Physics and Chemistry of Rare Earths. Vol. 18 – Lanthanides/Actinides: Chemistry. Elsevier. pp. 4–6, 10–14.
- ^ Wallmann, J. C. (1959). "The first isolations of the transuranium elements: A historical survey". Journal of Chemical Education. 36 (7): 340. Bibcode:1959JChEd..36..340W. doi:10.1021/ed036p340.
- ^ 미아소에도프, 페이지 9
- ^ 미아소에도프, 페이지 14
- ^ Martin Heinrich Klaproth (1789). "Chemische Untersuchung des Uranits, einer neuentdeckten metallischen Substanz". Chemische Annalen. 2: 387–403.
- ^ E.-M. Péligot (1842). "Recherches Sur L'Uranium". Annales de chimie et de physique. 5 (5): 5–47.
- ^ Ingmar Grenthe (2006). "Uranium". The Chemistry of the Actinide and Transactinide Elements. pp. 253–698. doi:10.1007/1-4020-3598-5_5. ISBN 978-1-4020-3555-5.
- ^ K. 짐머만, 앤, 213, 290 (1882); 216, 1 (1883); Ber. 15 (1882) 849
- ^ 골럽, 페이지 214
- ^ Berzelius, J. J. (1829). "Untersuchung eines neues Minerals und einer darin erhalten zuvor unbekannten Erde (Investigation of a new mineral and of a previously unknown earth contained therein)". Annalen der Physik und Chemie. 16 (7): 385–415. Bibcode:1829AnP....92..385B. doi:10.1002/andp.18290920702. (현대 인용:안날렌 데르 파이식, 제92권, 제7권, 페이지 385–415)
- ^ Berzelius, J. J. (1829). "Undersökning af ett nytt mineral (Thorit), som innehåller en förut obekant jord" (Investigation of a new mineral (thorite), as contained in a previously unknown earth)". Kungliga Svenska Vetenskaps Akademiens Handlingar (Transactions of the Royal Swedish Science Academy): 1–30.
- ^ André-Louis Debierne (1899). "Sur un nouvelle matière radio-active". Comptes Rendus (in French). 129: 593–595.
- ^ André-Louis Debierne (1900–1901). "Sur un nouvelle matière radio-actif – l'actinium". Comptes Rendus (in French). 130: 906–908.
- ^ H. W. Kirby (1971). "The Discovery of Actinium". Isis. 62 (3): 290–308. doi:10.1086/350760. JSTOR 229943.
- ^ J. P. Adloff (2000). "The centenary of a controversial discovery: actinium". Radiochim. Acta. 88 (3–4_2000): 123–128. doi:10.1524/ract.2000.88.3-4.123.
- ^ 골럽, 페이지 213
- ^ a b c d e f g h i j Z. K. Karalova; B. Myasoedov (1982). Actinium. Analytical chemistry items. Moscow: Nauka.
- ^ Hakala, Reino W. (1952). "Letters". Journal of Chemical Education. 29 (11): 581. Bibcode:1952JChEd..29..581H. doi:10.1021/ed029p581.2.
- ^ George B. Kauffman (1997). "Victor Moritz Goldschmidt (1888–1947): A Tribute to the Founder of Modern Geochemistry on the Fiftieth Anniversary of His Death". The Chemical Educator. 2 (5): 1–26. doi:10.1007/s00897970143a.
- ^ John Emsley (2001). "Protactinium". Nature's Building Blocks: An A-Z Guide to the Elements. Oxford, England: Oxford University Press. pp. 347–349. ISBN 978-0-19-850340-8.
- ^ a b K. Fajans; O. Gohring (1913). "Über die komplexe Natur des Ur X". Naturwissenschaften. 1 (14): 339. Bibcode:1913NW......1..339F. doi:10.1007/BF01495360.
- ^ K. Fajans; O. Gohring (1913). "Über das Uran X2-das neue Element der Uranreihe". Physikalische Zeitschrift. 14: 877–84.
- ^ a b 그린우드, 페이지 1251
- ^ Edwin McMillan; Abelson, Philip (1940). "Radioactive Element 93". Physical Review. 57 (12): 1185–1186. Bibcode:1940PhRv...57.1185M. doi:10.1103/PhysRev.57.1185.2.
- ^ a b c d e f V.A. Mikhailov, ed. (1971). Analytical chemistry of neptunium. Moscow: Nauka.
- ^ Hanford Cultural Resources Program, US Department of Energy (2002). Hanford Site Historic District: History of the Plutonium Production Facilities, 1943–1990. Columbus OH: Battelle Press. pp. 1.22–1.27. doi:10.2172/807939. ISBN 978-1-57477-133-6.
- ^ Nina Hall (2000). The New Chemistry: A Showcase for Modern Chemistry and Its Applications. Cambridge University Press. pp. 8–9. ISBN 978-0-521-45224-3.
- ^ 미아소에도프, 페이지 8
- ^ Thompson, S. G.; Ghiorso, A.; Seaborg, G. T. (1950). "Element 97". Phys. Rev. 77 (6): 838–839. Bibcode:1950PhRv...77..838T. doi:10.1103/PhysRev.77.838.2.
- ^ Thompson, S. G.; Ghiorso, A.; Seaborg, G. T. (1950). "The New Element Berkelium (Atomic Number 97)". Phys. Rev. 80 (5): 781–789. Bibcode:1950PhRv...80..781T. doi:10.1103/PhysRev.80.781.
- ^ 월리스 W. 슐츠(1976) 미국 상무부 아메리시움의 화학, 페이지 1
- ^ Thompson, S.; Ghiorso, A.; Seaborg, G. (1950). "Element 97". Physical Review. 77 (6): 838–839. Bibcode:1950PhRv...77..838T. doi:10.1103/PhysRev.77.838.2.
- ^ Thompson, S.; Ghiorso, A.; Seaborg, G. (1950). "The New Element Berkelium (Atomic Number 97)". Physical Review. 80 (5): 781–789. Bibcode:1950PhRv...80..781T. doi:10.1103/PhysRev.80.781.
- ^ S. G. Thompson; K. Street Jr.; A. Ghiorso; G. T. Seaborg (1950). "Element 98". Physical Review. 78 (3): 298–299. Bibcode:1950PhRv...78..298T. doi:10.1103/PhysRev.78.298.2.
- ^ S. G. Thompson; K. Street Jr.; A. Ghiorso; G. T. Seaborg (1950). "The New Element Californium (Atomic Number 98)" (PDF). Physical Review. 80 (5): 790–796. Bibcode:1950PhRv...80..790T. doi:10.1103/PhysRev.80.790.
- ^ K. Street Jr.; S. G. Thompson; G. T. Seaborg (1950). "Chemical Properties of Californium". J. Am. Chem. Soc. 72 (10): 4832–4835. doi:10.1021/ja01166a528. hdl:2027/mdp.39015086449173. Archived from the original on 15 May 2016. Retrieved 23 October 2010.
- ^ S. G. 톰슨, B. 커닝햄: "베르켈륨과 캘리포늄의 화학적 성질에 대한 첫 번째 거시적 관찰", 두 번째 Intl에 제시된 용지 P/825의 보충판.콘프, 1958년 제네바, 원자력을 평화적으로 이용
- ^ 달레인 C.호프만, 알베르 기오르소, 글렌 테오도르 시보르그(2000) 트란투라늄족: 내막, 임페리얼 칼리지 프레스, ISBN 1-86094-087-0, 페이지 141–142
- ^ a b A. Ghiorso; S. G. Thompson; G. H. Higgins; G. T. Seaborg; M. H. Studier; P. R. Fields; S. M. Fried; H. Diamond; J. F. Mech; G. L. Pyle; J. R. Huizenga; A. Hirsch; W. M. Manning; C. I. Browne; H. L. Smith; R. W. Spence (1955). "New Elements Einsteinium and Fermium, Atomic Numbers 99 and 100". Phys. Rev. 99 (3): 1048–1049. Bibcode:1955PhRv...99.1048G. doi:10.1103/PhysRev.99.1048.
- ^ S. Thompson; A. Ghiorso; B. G. Harvey; G. R. Choppin (1954). "Transcurium Isotopes Produced in the Neutron Irradiation of Plutonium". Physical Review. 93 (4): 908. Bibcode:1954PhRv...93..908T. doi:10.1103/PhysRev.93.908.
- ^ G. R. Choppin; S. G. Thompson; A. Ghiorso; B. G. Harvey (1954). "Nuclear Properties of Some Isotopes of Californium, Elements 99 and 100". Physical Review. 94 (4): 1080–1081. Bibcode:1954PhRv...94.1080C. doi:10.1103/PhysRev.94.1080.
- ^ Albert Ghiorso (2003). "Einsteinium and Fermium". Chemical and Engineering News. 81 (36).
- ^ A. Ghiorso; B. Harvey; G. Choppin; S. Thompson; G. Seaborg (1955). New Element Mendelevium, Atomic Number 101. Physical Review. Vol. 98. pp. 1518–1519. Bibcode:1955PhRv...98.1518G. doi:10.1103/PhysRev.98.1518. ISBN 978-981-02-1440-1.
- ^ a b c d e f g h Audi, G.; Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S. (2017). "The NUBASE2016 evaluation of nuclear properties" (PDF). Chinese Physics C. 41 (3): 030001. Bibcode:2017ChPhC..41c0001A. doi:10.1088/1674-1137/41/3/030001.
- ^ a b c d e f g h i "Table of nuclides, IAEA". Retrieved 7 July 2010.
- ^ 미아소에도프, 페이지 19-21
- ^ 특정 활성도는 표 반감기와 자발적 핵분열 확률에 의해 계산된다.
- ^ a b 그린우드, 페이지 1254
- ^ a b c d e f g E.S. Palshin (1968). Analytical chemistry of protactinium. Moscow: Nauka.
- ^ I.P. Alimarin (1962). A.P. Vinogradov (ed.). Analytical chemistry of uranium. Moscow: Publisher USSR Academy of Sciences.
- ^ a b 미아소에도프, 페이지 18
- ^ a b c 미아소에도프, 페이지 22
- ^ 미아소에도프, 페이지 25
- ^ "Table of elements, compounds, isotopes" (in Russian). Archived from the original on 12 July 2010. Retrieved 7 July 2010.
- ^ 표준 원자 무게 2013.동위원소 겸용량 및 원자중량 위원회
- ^ JANIS 4.0 / N. Soppera, M. Bossant, E.듀퐁, "JANIS 4: NEA 기반 핵 데이터 정보 시스템의 개선된 버전", 핵 데이터 시트, 제120권(2014년 6월), 페이지 294-296. [1]
- ^ 매슈 W. 프랜시스 외:원자로 연료 동위원소 및 핵 적용을 위한 코드 검증.ORLL/TM-2014/464, 오크 리지, 테네시 2014, S. 11
- ^ Jay H. Lehr; Janet K. Lehr (2000). Standard handbook of environmental science, health, and technology. McGraw-Hill Professional. pp. 2–38. ISBN 978-0-07-038309-8.
- ^ Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ a b c d e f g h i Yu.D. Tretyakov, ed. (2007). Non-organic chemistry in three volumes. Chemistry of transition elements. Vol. 3. Moscow: Academy. ISBN 978-5-7695-2533-9.
- ^ "World Uranium Mining". World Nuclear Association. Archived from the original on 26 June 2010. Retrieved 11 June 2010.
- ^ a b c F. Weigel; J. Katz; G. Seaborg (1997). The Chemistry of the Actinide Elements. Vol. 2. Moscow: Mir. ISBN 978-5-03-001885-0.
- ^ 토륨, USGS 광물자원
- ^ a b c d e f g 골럽, 페이지 215-217
- ^ 그린우드, 페이지 1255, 1261
- ^ a b c d e 그린우드, 페이지 1255
- ^ A. E. van Arkel; de Boer, J. H. (1925). "Darstellung von reinem Titanium-, Zirkonium-, Hafnium- und Thoriummetall". Zeitschrift für Anorganische und Allgemeine Chemie (in German). 148 (1): 345–350. doi:10.1002/zaac.19251480133.
- ^ I.L. Knunyants (1961). Short Chemical Encyclopedia. Vol. 1. Moscow: Soviet Encyclopedia.
- ^ 골럽, 페이지 218–219
- ^ a b c 그린우드, 페이지 1263
- ^ a b John Emsley (2011). Nature's Building Blocks: An A-Z Guide to the Elements (New ed.). New York, NY: Oxford University Press. ISBN 978-0-19-960563-7.
- ^ Peterson, Ivars (7 December 1991). "Uranium displays rare type of radioactivity". Science News. Archived from the original on 18 January 2012.
- ^ 그린우드, 페이지 1265
- ^ Domanov, V. P.; Lobanov, Yu. V. (October 2011). "Formation of volatile curium(VI) trioxide CmO3". Radiochemistry. 53 (5): 453–456. doi:10.1134/S1066362211050018. ISSN 1066-3622.
- ^ a b 그린우드, 페이지 1264
- ^ "많은 액티나이드 금속, 하이드라이드, 탄화수소, 합금 및 기타 화합물이 미세하게 분할된 상태에서 실온에서 발화할 수 있다." [2] 액티나이드, 리브레텍스/화학(액티나이드, 리브레텍스/화학)의 일반 특성 및 반응(2021년 2월 3일 접속)
- ^ 미아소에도프, 페이지 30~31
- ^ a b c d e f g h i j k l 골럽, 222-227쪽
- ^ 그린우드, 페이지 1278
- ^ a b B.A. Nadykto; L.F.Timofeeva, eds. (2003). Plutonium. Fundamental Problems. Vol. 1. Sarov: VNIIEF. ISBN 978-5-9515-0024-3.
- ^ M. S. Milyukova (1965). Analytical chemistry of plutonium. Moscow: Nauka. ISBN 978-0-250-39918-5.
- ^ a b 미아소에도프, 페이지 25-29
- ^ Deblonde, Gauthier J.-P.; Sturzbecher-Hoehne, Manuel; Jong, Wibe A. de; Brabec, Jiri; Corie Y. Ralston; Illy, Marie-Claire; An, Dahlia D.; Rupert, Peter B.; Strong, Roland K. (September 2017). "Chelation and stabilization of berkelium in oxidation state +IV". Nature Chemistry. 9 (9): 843–849. Bibcode:2017NatCh...9..843D. doi:10.1038/nchem.2759. ISSN 1755-4349. PMID 28837177.
- ^ 미아소에도프, 페이지 88
- ^ a b "Таблица Inorganic and Coordination compounds" (in Russian). Retrieved 11 July 2010.
- ^ 다른 출처에 따르면 큐륨의 세제곱 세키옥시드는 올리브-녹색이다.참조
- ^ 합성 중 대기는 격자 매개변수에 영향을 미치는데, 이는 삼발성 캘리포늄의 산화 또는 감소로 인한 비스토리치 측정 때문일 수 있다.주 형태는 캘리포니아산소(III)의 입방산화물이다.
- ^ a b c 그린우드, 페이지 1268
- ^ L.R. Morss; Norman M. Edelstein; Jean Fuger (2011). The Chemistry of the Actinide and Transactinide Elements (Set Vol.1–6). Springer. p. 2139. ISBN 978-94-007-0210-3.
- ^ a b Krivovichev, Sergei; Burns, Peter; Tananaev, Ivan (2006). "Chapter 3". Structural Chemistry of Inorganic Actinide Compounds. Elsevier. pp. 67–78. ISBN 978-0-08-046791-7.
- ^ a b 그린우드, 페이지 1270
- ^ 미아소에도프, 페이지 96-99
- ^ Nave, S.; Haire, R.; Huray, Paul (1983). "Magnetic properties of actinide elements having the 5f6 and 5f7 electronic configurations". Physical Review B. 28 (5): 2317–2327. Bibcode:1983PhRvB..28.2317N. doi:10.1103/PhysRevB.28.2317.
- ^ 그린우드, 페이지 1269
- ^ 연기 감지기와 아메리슘, 핵 문제 브리핑 페이퍼 35, 2002년 5월
- ^ a b c 그린우드, 페이지 1262
- ^ a b 골럽, 페이지 220–221
- ^ G. G. Bartolomei; V. D. Baybakov; M. S. Alkhutov; G. A. Bach (1982). Basic theories and methods of calculation of nuclear reactors. Moscow: Energoatomizdat.
- ^ 그린우드, 페이지 1256–1261
- ^ Sergey Popov; Alexander Sergeev (2008). "Universal Alchemy". Vokrug Sveta (in Russian). 2811 (4).
- ^ David L. Heiserman (1992). "Element 94: Plutonium". Exploring Chemical Elements and their Compounds. New York: TAB Books. p. 338. ISBN 978-0-8306-3018-9.
- ^ John Malik (September 1985). The Yields of the Hiroshima and Nagasaki Explosions (PDF). Los Alamos. p. Table VI. LA-8819. Archived (PDF) from the original on 24 February 2009. Retrieved 15 February 2009.
- ^ "Nuclear Weapon Design". Federation of American Scientists. 1998. Archived from the original on 26 December 2008. Retrieved 7 December 2008.
- ^ 존 홀드렌과 매튜 번 핵 무기 설계 & 재료.NTI를 위한 원자관리 프로젝트 2002년 11월 25일
- ^ 아폴로 14 프레스 키트 – 01/11/71, NASA, 페이지 38–39
- ^ a b B.E. Burakov; M.I Ojovan; W.E. Lee (2010). Crystalline Materials for Actinide Immobilisation. World Scientific. ISBN 978-1-84816-418-5.
- ^ M. I. Ojovan; W.E. Lee (2005). An Introduction to Nuclear Waste Immobilisation. Amsterdam: Elsevier. ISBN 978-0-08-044462-8.
- ^ "Half-lives and branching fractions for actinides and natural decay products". www-nds.iaea.org. IAEA. Retrieved 29 September 2018.
참고 문헌 목록
- Golub, A. M. (1971). Общая и неорганическая химия (General and Inorganic Chemistry). Vol. 2.
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- Myasoedov, B. (1972). Analytical chemistry of transplutonium elements. Moscow: Nauka. ISBN 978-0-470-62715-0.
외부 링크
| 위키미디어 커먼즈에는 액티니데스 관련 미디어가 있다. |
![{\displaystyle {\ce {{^{238}_{92}U}+{}_{0}^{1}n->{}_{92}^{239}U->[\beta ^{-}][23.5\ {\ce {min}}]{}_{93}^{239}Np->[\beta ^{-}][2.3\ {\ce {days}}]{}_{94}^{239}Pu}}\left({\ce {->[\alpha ][2.4\cdot 10^{4}\ {\ce {years}}]}}\right){\ce {^{235}_{92}U}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e7a95dee843f1cf5e9156013e8ca01c30870d896)




![{\displaystyle {\begin{array}{l}{}\\{\ce {2AmF3{}+3Ba->[{\ce {1150-1350^{\circ }C}}]3BaF2{}+2Am}}\\{\ce {PuF4{}+2Ba->[{\ce {1200^{\circ }C}}]2BaF2{}+Pu}}\\{\ce {UF4{}+2Mg->[{\ce {>500^{\circ }C}}]U{}+2MgF2}}\\{}\end{array}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/057c8209f7427fca3331e574fa79f36c0e2a81db)










![{\displaystyle {\ce {Th{}+O2->[{\ce {1000^{\circ }C}}]\overbrace {ThO2} ^{Thorium~dioxide}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/13e4a27b9ed3d03fc5420ed4a04020bf77562406)





