마그네사이트
Magnesite| 마그네사이트 | |
|---|---|
 브라질산 마그네사이트 결정(11.4×9.2×3.6cm) | |
| 일반 | |
| 카테고리 | 탄산염 광물 |
| 공식 (유닛) | MgCO3 |
| IMA 기호 | MGS[1] |
| 스트룬츠 분류 | 5. AB.05 |
| 수정계 | 삼각형의 |
| 크리스털 클래스 | 육각형 사각형 (3m) H-M 기호: (3 2/m) |
| 스페이스 그룹 | R3c |
| 신분증 | |
| 색. | 무색, 흰색, 옅은 노란색, 옅은 갈색, 은은한 분홍색, 라일락 장미 |
| 수정 습관 | 보통 육면체나 육각 프리즘처럼 질량이 크며 드물게는 육각 프리즘처럼 보인다. |
| 갈라짐 | [1011] 완벽 |
| 골절 | 원추형 |
| 고집 | 부서지기 쉽다 |
| 모스 척도 경도 | 3.5 – 4.5 |
| 광택 | 유리체 |
| 스트릭 | 하얀색 |
| 명료성 | 투명에서 반투명 |
| 비중 | 3.0 – 3.2 |
| 광학적 특성 | 단축(-) |
| 굴절률 | nω=1.508 – 1.510ε n=1.700 |
| 복굴절 | 0.191 |
| 가용성 | 주입할 수 없다 |
| 용해성 | Hot HCl의 거품 |
| 기타 특징 | 자외선 아래에서 옅은 녹색에서 옅은 파란색 형광 및 인광을 나타낼 수 있음; 삼발광 |
| 레퍼런스 | [2][3][4][5] |
마그네사이트는 화학식이
3 MgCO(탄산 마그네슘)인 광물이다.철, 망간, 코발트 및 니켈은 혼합물로 발생할 수 있지만 소량만 발생합니다.
발생.
마그네사이트는 접촉 및 국소 변성 지형 모두에서 초산암, 뱀석 및 기타 마그네슘이 풍부한 암석의 변화 생성물로 발생합니다.이러한 마그네슘은 종종 크립토크리스탈린이며 오팔 또는 샤트의 형태로 실리카를 함유하고 있습니다.
마그네사이트는 또한 토양과 토양의 2차 탄산염으로 초산암 위 레골리스 안에 존재하며 지하수에서 이산화탄소에 의해 마그네슘이 함유된 광물이 용해된 결과로 퇴적된다.
동위원소 구조: 뭉친 동위원소
안정적인 동위원소 지구화학 분야의 최근 발전은 광물과 분자의 동위원소 구조에 대한 연구이다.이를 위해서는 결합 시나리오(동위원소가 서로 어떻게 결합되는가)를 검토하는 고해상도 분자에 대한 연구가 필요하며, 이는 동위원소 구조에 따라 분자의 안정성에 대한 지식으로 이어진다.
산소는 3개의 안정 16동위원소(O, O, O)를 가지며, 탄소는 132개의 안정 동위원소(C, C)를 가집니다.CO 분자(가장 풍부한 구성 요소 동위원소로만 구성됨)를162 '단일 이성질' 종이라고 한다.하나의 원자만 구성 요소(즉, CO162)의 무거운 동위원소로 대체될 때, 그것은 '단일 치환' 종이라고 불린다.마찬가지로, 두 원자가 동시에 더 무거운 동위원소(예1618: COO)로 대체되면, '이중 치환' 종이라고 불린다.CO에2 대한 '클라우드' 종(13COO)1618은 이중으로 치환된2 CO 분자이다.동위원소로 치환된 분자는 질량이 높다.그 결과, 분자 진동이 감소하고 분자는 낮은 영점 에너지를 발생시킨다(운동 동위원소 효과 참조).
특정 분자의 특정 결합의 함량은 형성 시 온도에 민감하다(예: C-O18 결합으로서의 탄산염[6] COO의1618 함량).이 정보는 뭉친 동위원소 지구화학의 기초를 형성하기 위해 이용되었다.돌로마이트,[7][8] 칼사이트,[9] 사이더라이트[10] 등과 같은 탄산염 광물과 메탄과 [12]산소와 같은[11] 비탄산염 화합물에 대해 뭉친 동위원소 온도계가 확립되었다.카티온-카보네이트 산소(즉, Mg-O, Ca-O) 결합의 강도에 따라 다른 탄산염 광물이 응집된 동위원소 신호를 형성하거나 보존할 수 있습니다.
측정 및 보고
응집된 동위원소 분석에는 특정한 측면이 있다.다음과 같습니다.
소화, 분석 및 산분획 보정
응집된 동위원소 분석은 보통 가스원 질량분석법에 의해 이루어지며, 여기서 인산소화에 의해 마그네사이트에서 방출된 CO는2 동위원소비 질량분석계에 공급된다.이러한 시나리오에서는 마그네사이트로부터의 CO2 방출이 완료되어야 한다.마그네사이트 소화는 시간이 오래 걸리고 실험실마다 소화 시간과 온도가 다르기 때문에 어렵다(100°C에서[13] 12시간에서 90°C에서[14] 1시간).이 고온에서의 소화로 인해 방출된2 CO의 일부 C-O18 결합은 탄산염의 인산 소화 중에 끊어집니다('응집2' CO의 풍부함 감소로 이어집니다.이 추가(분석적 인공물)를 설명하기 위해 소화 온도에서 얻은 마그네사이트 덩어리 동위원소 값에 '산분획 보정'이라는 보정을 추가한다.
산성2 소화 시 탄산염 미네랄로부터 CO가스가 해방되므로 1 O를 남기기 때문에 분화가 발생하며, 이를 위해2 분석된 CO가스의 동위원소 조성을 보정해야 한다.마그네사이트의 경우 가장 신뢰할 수 있는 분화 계수(α) 방정식은 다음과 같다.[15]
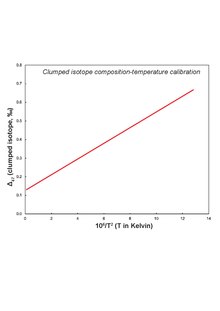
10ln3(α) = [(6.845 ± 0.475)µ105/T2] + (4.22 ± 0.08); T in K
다른 연구자들은 돌로마이트 [16]분획인자와 같은 다른 분획인자를 사용했다.
표준
미지의 성분 시료를 측정할 때에는 표준물질의 측정이 필요하다(안정적인 동위원소 분석을 위한 기준물질 참조).내부 표준 및 표준 자료를 사용하여 분석 세션을 정기적으로 모니터링합니다.표준 재료는 주로 석회석과 대리석입니다.
δ - 온도교정47
응집된 동위원소 데이터를 온도로 변환하려면 응집된 동위원소 조성의 온도 의존성의 기능적 형태를 나타내는 검정 곡선이 필요하다.마그네사이트에 대한 광물별 보정은 없습니다.광물 침전 온도와 덩어리 동위원소 유도 온도가 일치하지 않는 일부 실험 데이터를 바탕으로[14] 광물 특이 보정의 필요성이 대두된다.마그네사이트의 결합이 칼사이트/돌로마이트와 다르거나 높은 온도에서 산소화가 이루어지기 때문에 불일치가 발생합니다.
마그네사이트-물 및 CO-마그네사이트2 동위원소 분획 계수
분획은 온도에 따라 달라지기 때문에 부모 유체의 C 및 O 동위원소 조성은 알려진 마그네사이트-유체 동위원소 분획 인자를 사용하여 계산할 수 있다.문헌에 보고된 마그네사이트-유체 O 및 C 동위원소 분류 인자가 [14]서로 일치하지 않는다.분류 행동은 실험 관찰에 의해 입증되지 않았다.
마그네사이트의 동위원소 구조 제어 요인
수성 Mg-Carbonate에서 마그네사이트로 변환
따라서 저온에서는 함수성 Mg-카보네이트(히드로마그네사이트, 네스퀘호나이트 등)가 형성된다.이러한 상은 미네랄 용해-침전 또는 탈수에 의해 온도를 변화시킴으로써 마그네사이트로 변환될 수 있다.이와 동시에 관련된 동위원소 효과는 침전 마그네사이트의 동위원소 조성을 제어할 수 있다.
불균형
탈가스, 신속한2 CO흡수 등과 같은 불균형 과정은 특히 저온에서 탄산염 광물의 덩어리 동위원소 조성을 수정한다.이들은 C와 O의 무거운 동위원소로 시스템을 가변적으로 농축하거나 고갈시킨다.응집된 동위원소 농도는 C와 O의 동위원소 농도에 따라 달라지기 때문에 수정되기도 한다.또 다른 두드러진 영향은 침전 유체의 [17]pH이다.침전 유체의 pH가 변화함에 따라 DIC 풀이 영향을 받고 침전 탄산염의 동위원소 조성이 변화한다.
광물구조 및 후발 열효과
결정질 마그네슘과 크립토크리스탈린 마그네슘은 매우 다른 광물 구조를 가지고 있다.결정성 마그네사이트는 결정 구조가 잘 발달한 반면, 크립토크리스탈린 마그네사이트는 비정질이며 대부분 미세 입자의 집합체입니다.응집된 동위원소 조성은 특정 결합에 의존하기 때문에 결정 구조의 차이는 이러한 다른 구조에서 응집된 동위원소 시그니처가 기록되는 방식에 영향을 미칠 가능성이 매우 높다.이로 인해 나중에 발생하는 디아제네시스/매몰 가열 등의 열 이벤트에 의해 초기 신호가 다르게 수정될 수 있습니다.
형성
마그네사이트는 주변석 및 기타 초미세 암석의 탈크 탄산염 메타소마티즘을 통해 형성될 수 있다.마그네사이트는 녹지층의 전형적인 고온 및 고압에서 물과 이산화탄소가 존재하는 상태에서 올리빈의 탄산을 통해 형성된다.
마그네사이트는 마그네슘 서펜틴(리자라이트)의 탄산화 작용으로 다음과 같은 반응을 통해 형성될 수도 있습니다.
- 2325 MgSiO(OH)4 + 3 CO2 → MgSiO3410(OH)2 + 33 MgCO + 3 HO2
그러나 실험실에서 이 반응을 수행하면 상온에서 [18]3수화 형태의 탄산마그네슘(네스크호나이트)이 형성됩니다.바로 이러한 관찰은 무수 [19]탄산 마그네슘의 저온 형성에 관여하는 "탈수 장벽"의 가정으로 이어졌다.물과 비슷한 액체인 포름아미드를 사용한 실험실 실험은 어떻게 그러한 탈수 장벽이 개입되지 않을 수 있는지를 보여주었다.무수 탄산 마그네슘을 핵으로 만드는 근본적인 어려움은 이 비수성 용액을 사용할 때 남는다.양이온 탈수가 아니라 탄산 음이온의 공간적 구성이 마그네사이트의 [20]저온 핵 생성에 장벽을 만듭니다.
마그네사이트는 현대의 퇴적물, 동굴, 토양에서 발견되었다.저온(약 40°C [104°F]) 형성은 강수 [21][22][23]간격과 용해 간격을 번갈아 사용해야 하는 것으로 알려져 있다.마그네사이트의 저온 형성은 대규모 탄소 [24]격리에 매우 중요할 수 있다.Vandeginste는 [25][26]대기압과 316 K의 온도에서 마그네사이트를 산업적으로 생산하기 위한 큰 진전을 설명했습니다.이러한 실험에서 소량의 염산을 탄산나트륨 용액과 주기적으로 번갈아 가며 첨가했다.또한 새로운 것은 용해 주기와 강수 주기를 번갈아 가며 몇 시간밖에 지속되지 않는 매우 짧은 지속시간이었다.
마그네사이트는 운석 ALH84001과 화성 자체에서 검출됐다.마그네사이트는 위성 [27]궤도에서의 적외선 분광법을 사용하여 화성에서 확인되었다.제로 분화구 부근에서 Mg-carbonate가 검출되어 [28]라쿠스트린 환경에서 형성된 것으로 보고되고 있다.이들 탄산염의 형성 온도에 대한 논란은 여전히 존재한다.화성에서 유래한 ALH84001 [29][30]운석의 마그네사이트는 저온 형성이 제안되고 있다.
마그네슘이 풍부한 올리빈(포르스테라이트)은 페리도타이트에서 마그네사이트를 생산하는 것을 선호한다.철분이 풍부한 올리빈(파야라이트)은 마그네사이트-마그네사이트-실리카 조성물의 생산을 선호합니다.
마그네사이트는 또한 울라스토나이트, 페리클라아제 및 탈크와 관련된 스카른 퇴적물, 돌로마이트의 메타소마티즘에 의해 형성될 수 있다.
고온에 강하고 고압에도 견딜 수 있는 마그네사이트는 지구 맨틀의[31] 주요 탄산염 베어링 단계 중 하나이며, 깊은 탄소 [32]저장소의 운반체일 가능성이 있는 것으로 제안되었습니다.비슷한 이유로, 그것은 스위스 중앙 알프스의 변성된 주변암과 중국 [34]톈산의 고압 에클로기이트암에서 발견된다.
마그네사이트는 또한 함수성 Mg-카보네이트 [35][36]또는 마그네사이트로 박테리아가 존재하는 호수에서 침전될 수 있다.
동위원소 구조로부터의 정보
응집된 동위원소는 마그네사이트 생성 조건과 침전 유체의 동위원소 구성을 해석하는 데 사용되어 왔다.초산복합체 내에서는 마그네사이트가 크립토크리스탈린 형태의 정맥 및 목공소 내 및 결정 형태의 탄산주위타이트 단위 내에서 발견된다.이러한 크립토크리스탈린의 형태는 대부분 가변적인 풍화작용을 하며 낮은 [37]생성온도를 산출합니다.반면, 굵은 마그네슘은 매우 높은 온도를 나타내며, 열수 발생원을 나타낸다.거친 고온 마그네슘은 맨틀에서 파생된 유체로 형성되는 반면 크립토크리스탈린은 운석수를 순환시켜 침전되어 용해된 무기 탄소 풀, 토양 탄소로부터 탄소를 흡수하고 불균형 동위원소 효과의 영향을 받는 것으로 추측된다.
호수와 플레이아 환경에서 형성되는 마그네사이트는 증발과 CO2 탈가스 때문에 일반적으로 C와 O의 무거운 동위원소로 농축된다.이는 응집된 동위원소 유도 온도가 매우 낮음을 반영한다.이것들은 pH 효과, 생물학적 활성 및 탈가스와 관련된 운동 동위원소 효과의 영향을 받는다.마그네사이트는 이러한 조건에서 표면 곰팡이로 형성되지만, 일반적으로 강수량이 동태적으로 유리하기 때문에 함수성 Mg-카보네이트로 더 많이 발생한다.대부분의 경우, C는 DIC 또는 인근 초산복합체(예: 캐나다 브리티시 컬럼비아의[38] Altin Playa)에서 파생된다.
반면에 변성암에 있는 마그네슘은 매우 높은 생성 온도를 나타낸다.부모 유체의 동위원소 구성 또한 무겁고 일반적으로 변성 유체이다.이는 유체 포함 유도 온도와 공동 침전성 석영 마그네사이트를 포함하는 전통적인 O 동위원소 온도 측정법에 의해 검증되었다.
마그네사이트는 종종 관련된 돌로마이트,[39] 칼사이트보다 낮은 응집된 동위원소 온도를 기록한다.그 이유는 석회석, 돌로마이트가 더 높은 온도(맨틀 유사 유체로부터)에서 일찍 형성되어 마그네사이트를 침전시킬 수 있을 정도로 유체 중의 Mg/Ca 비율을 증가시키기 때문일 수 있다.시간이 지날수록 유체는 냉각되고 다른 유체와 혼합되면서 진화하며 마그네사이트를 형성하면 온도가 낮아진다.따라서 관련 탄산염의 존재는 마그네사이트 동위원소 조성을 제어합니다.
화성 탄산염의 기원은 뭉친 동위원소를 적용하면 디콘볼루션될 수 있다.CO의2 근원, 화성의 기후 수문학적 조건은 이 암석들로부터 평가할 수 있다.ALH84001의 탄산이 지표수에서 저온 증발 상태로 형성되고 화성 [40]대기에서 CO가2 유도되는 것을 나타내는 최근의 연구(응집 동위원소 온도계 구현)가 나타났다.
사용하다
내화재

석회 생산과 유사하게 마그네사이트는 숯 앞에서 연소하여 MgO를 생성할 수 있습니다. MgO는 광물의 형태로 페리클라아제라고 알려져 있습니다.산화 마그네슘을 만들기 위해 대량의 마그네슘을 연소시킵니다. 산화 마그네슘은 용광로, 가마 및 소각로에서 라이닝으로 사용되는 중요한 내열성(내열성) 물질입니다.
소성온도에 따라 산화물 생성물의 반응성이 결정되며, 연소광과 사연광의 분류는 제품의 표면적과 반응성을 나타냅니다(이는 일반적으로 요오드 수치의 산업 지표에 의해 결정됩니다).
'약하게 탄' 제품은 일반적으로 450°C에서 소성되기 시작하여 900°C의 상한까지 진행되므로 표면적과 반응성이 우수합니다.
900°C를 넘으면 재료는 반응성 결정 구조를 잃고 화학적으로 비활성화된 '데드 연소' 제품으로 되돌아갑니다. 이 제품은 용해로 라이닝과 같은 내화 재료에 사용하는 것이 좋습니다.
화재 분석에서는 마그네사이트 큐펠이 고온에 견디기 때문에 마그네사이트 큐펠을 큐페레이션에 사용할 수 있습니다.
기타 용도
마그네사이트는 바닥재(마그네사이트 스크리드)[41]의 바인더로도 사용할 수 있습니다.또한 합성고무의 제조 및 마그네슘 화학 및 비료의 제조에 촉매 및 충전재로 사용되고 있다.
마그네사이트 내 온실가스 이산화탄소를 대규모로 [42]격리하는 연구가 진행되고 있다.이것은 이산화탄소가 이 암석과 반응함으로써 마그네사이트가 생성될 수 있는 오피올라이트(지각의 맨틀암)의 주변암에 초점을 맞추고 있다.오만산 [43]오피올라이트는 어느 정도 진전이 있었다.그러나 가장 큰 문제는 이러한 인공적인 과정이 충분한 다공성 투과성을 필요로 하기 때문에 액체가 흐를 수 있다는 것이지만, 이는 주변 돌기에서는 거의 해당되지 않는다.
아트웍스
마그네사이트는 보석 제조에 사용되는 구슬을 만들기 위해 자르고, 구멍을 내고, 연마할 수 있습니다.마그네사이트 비즈는 청록색의 외관을 모방한 밝은 파란색을 포함한 다양한 대담한 색상으로 염색할 수 있습니다.
일본계 미국인 예술가 노구치 이사무는 마그네사이트를 자신의 [44]작품 중 일부의 조각 재료로 사용했다.
산업안전보건
작업장에서 마그네사이트를 흡입, 피부 접촉, 아이컨택 등을 통해 노출될 수 있다.
미국
산업안전보건국(OSHA)은 작업장 내 마그네사이트 노출에 대한 법적 한도(허용 노출 한도)를 8시간 근무일 동안 총 노출량 15mg3/m와 호흡 노출량 5mg3/m로 설정했다.국립산업안전보건연구소(NIOSH)는 권장 노출 한도([45]REL)를 8시간 근무일에 걸쳐 총 노출 10mg/m와3 5mg/m3 호흡 노출로 설정했다.
레퍼런스
- ^ Warr, L.N. (2021). "IMA–CNMNC approved mineral symbols". Mineralogical Magazine. 85 (3): 291–320. doi:10.1180/mgm.2021.43. S2CID 235729616.
- ^ http://rruff.geo.arizona.edu/doclib/hom/magnesite.pdf 광물학 핸드북
- ^ http://www.mindat.org/min-2482.html Mindat.org
- ^ http://webmineral.com/data/Magnesite.shtml 웹미네랄 데이터
- ^ 클라인, 코넬리스, 코넬리우스 S.Hurlbut, Jr., Wiley, 광물학 매뉴얼, 제20호, 332 ISBN 0-471-80580-7페이지
- ^ Ghosh, Prosenjit; Adkins, Jess; Affek, Hagit; Balta, Brian; Guo, Weifu; Schauble, Edwin A.; Schrag, Dan; Eiler, John M. (2006-03-15). "13C–18O bonds in carbonate minerals: A new kind of paleothermometer". Geochimica et Cosmochimica Acta. 70 (6): 1439–1456. Bibcode:2006GeCoA..70.1439G. doi:10.1016/j.gca.2005.11.014. ISSN 0016-7037.
- ^ Lloyd, Max K.; Ryb, Uri; Eiler, John M. (2018-12-01). "Experimental calibration of clumped isotope reordering in dolomite". Geochimica et Cosmochimica Acta. 242: 1–20. Bibcode:2018GeCoA.242....1L. doi:10.1016/j.gca.2018.08.036. ISSN 0016-7037. S2CID 134613845.
- ^ Winkelstern, Ian Z.; Kaczmarek, Stephen E.; Lohmann, Kyger C; Humphrey, John D. (2016-12-02). "Calibration of dolomite clumped isotope thermometry". Chemical Geology. 443: 32–38. Bibcode:2016ChGeo.443...32W. doi:10.1016/j.chemgeo.2016.09.021. ISSN 0009-2541.
- ^ Stolper, D. A.; Eiler, J. M. (2015-05-01). "The kinetics of solid-state isotope-exchange reactions for clumped isotopes: A study of inorganic calcites and apatites from natural and experimental samples". American Journal of Science. 315 (5): 363–411. Bibcode:2015AmJS..315..363S. doi:10.2475/05.2015.01. ISSN 0002-9599. S2CID 131728569.
- ^ van Dijk, Joep; Fernandez, Alvaro; Storck, Julian C.; White, Timothy S.; Lever, Mark; Müller, Inigo A.; Bishop, Stewart; Seifert, Reto F.; Driese, Steven G.; Krylov, Alexey; Ludvigson, Gregory A. (June 2019). "Experimental calibration of clumped isotopes in siderite between 8.5 and 62 °C and its application as paleo-thermometer in paleosols". Geochimica et Cosmochimica Acta. 254: 1–20. Bibcode:2019GeCoA.254....1V. doi:10.1016/j.gca.2019.03.018. hdl:1874/387681. ISSN 0016-7037. S2CID 134142123.
- ^ Stolper, D. A.; Lawson, M.; Davis, C. L.; Ferreira, A. A.; Neto, E. V. Santos; Ellis, G. S.; Lewan, M. D.; Martini, A. M.; Tang, Y.; Schoell, M.; Sessions, A. L. (2014-06-27). "Formation temperatures of thermogenic and biogenic methane". Science. 344 (6191): 1500–1503. Bibcode:2014Sci...344.1500S. doi:10.1126/science.1254509. ISSN 0036-8075. PMID 24970083. S2CID 31569235.
- ^ Yeung, Laurence Y.; Young, Edward D.; Schauble, Edwin A. (2012). "Measurements of 18O18O and 17O18O in the atmosphere and the role of isotope-exchange reactions". Journal of Geophysical Research: Atmospheres. 117 (D18): n/a. Bibcode:2012JGRD..11718306Y. doi:10.1029/2012JD017992. ISSN 2156-2202.
- ^ Śliwiński, Maciej G.; Kitajima, Kouki; Spicuzza, Michael J.; Orland, Ian J.; Ishida, Akizumi; Fournelle, John H.; Valley, John W. (2017-11-22). "SIMS Bias on Isotope Ratios in Ca-Mg-Fe Carbonates (Part III): δ18O and δ13C Matrix Effects Along the Magnesite-Siderite Solid-Solution Series". Geostandards and Geoanalytical Research. 42 (1): 49–76. doi:10.1111/ggr.12194. ISSN 1639-4488.
- ^ a b c García del Real, Pablo; Maher, Kate; Kluge, Tobias; Bird, Dennis K.; Brown, Gordon E.; John, Cédric M. (November 2016). "Clumped-isotope thermometry of magnesium carbonates in ultramafic rocks". Geochimica et Cosmochimica Acta. 193: 222–250. Bibcode:2016GeCoA.193..222G. doi:10.1016/j.gca.2016.08.003. hdl:10044/1/40256. ISSN 0016-7037. OSTI 1360188. S2CID 132651895.
- ^ Sharma, S.Das; Patil, D.J; Gopalan, K (February 2002). "Temperature dependence of oxygen isotope fractionation of CO2 from magnesite-phosphoric acid reaction". Geochimica et Cosmochimica Acta. 66 (4): 589–593. Bibcode:2002GeCoA..66..589D. doi:10.1016/s0016-7037(01)00833-x. ISSN 0016-7037.
- ^ Rosenbaum, J; Sheppard, S.M.F (June 1986). "An isotopic study of siderites, dolomites and ankerites at high temperatures". Geochimica et Cosmochimica Acta. 50 (6): 1147–1150. Bibcode:1986GeCoA..50.1147R. doi:10.1016/0016-7037(86)90396-0. ISSN 0016-7037.
- ^ Guo, Weifu (January 2020). "Kinetic clumped isotope fractionation in the DIC-H2O-CO2 system: Patterns, controls, and implications". Geochimica et Cosmochimica Acta. 268: 230–257. Bibcode:2020GeCoA.268..230G. doi:10.1016/j.gca.2019.07.055.
- ^ Leitmeier, H.(1916):Einige Bemerkungen über die Entstehung von Magnetsit und Sideritlagerstetten, 빈의 Mitteilungen der Geologischen Gesellschaft, vol.9–166.
- ^ 리프만, F.(1973년):퇴적 탄산염 광물.스프링거 벨라그, 베를린, 228시
- ^ Xu, J; Yan, C.; Zhang, F.; Konishi, H., Xu, H. & Teng, H. (2013):Ca – Mg- CO3 시스템의 결정화에 대한 양이온 수화 효과 시험.검사님, Natl.아카데미, 과학.US, vol.110 (44), 페이지 17750-17755.
- ^ Deelman, J.C.(1999년): "마그네사이트와 돌로마이트의 저온 핵 생성", Neues Jahrbuch für Mineralogie, Monatshefte, 페이지 289–302.
- ^ Aves dos Anjos et al. (2011):저온에서 마그네사이트 합성.탄산염 및 증발광, vol.26, 페이지 213-215.[1]
- ^ 홉스, F. W. C. 및 쉬, H. (2020):석호 및 플레이아 환경의 대용물로 온도 및 pH 순환을 통한 마그네사이트 생성.Geochimica et Cosmochimica Acta, vol.269, 페이지 101-116.
- ^ Oelkers, E. H.; Gislason, S. R. and Matter, J. (2008) :CO2의 미네랄 탄산화.요소, vol.4, 페이지 333-337.
- ^ V. Vandeginste (2021) :저온에서 식염수 용액에서 칼슘과 탄산마그네슘 형성에 미치는 pH 순환 및 아연 이온의 영향.광물, vol.11, 페이지 723-734.
- ^ V. V. V. V.; Snell, O.; Hall, M. R.; Steer, E. 및 Vandeginste, A.(2019):염수에서 아연에 의한 돌로미트화 촉진.Nature Communications, vol.10, 1851.
- ^ 엘만, B. L. 등(2008):화성에서 탄산염이 함유된 암석의 궤도 확인.과학, 제322권, 제5909호, 페이지 1828-1832.
- ^ Horgan, Briony H.N.; Anderson, Ryan B.; Dromart, Gilles; Amador, Elena S.; Rice, Melissa S. (March 2020). "The mineral diversity of Jezero crater: Evidence for possible lacustrine carbonates on Mars". Icarus. 339: 113526. Bibcode:2020Icar..33913526H. doi:10.1016/j.icarus.2019.113526. ISSN 0019-1035.
- ^ McSween Jr., H. Y.와 Harvey, R. P.(1998):ALH84001 화성 운석의 탄산염 형성을 위한 증발 모델.국제지질검토, 제49권, 페이지 774-783.
- ^ Warren, P. H. (1998):ALH84001 운석의 저온, 홍수 증발 기원에 대한 암석학적 증거.지구물리학 연구 저널 제103권, 아니요E7, 16759-16773.
- ^ Isshiki, Maiko; Irifune, Tetsuo; Hirose, Kei; Ono, Shigeaki; Ohishi, Yasuo; Watanuki, Tetsu; Nishibori, Eiji; Takata, Masaki; Sakata, Makoto (January 2004). "Stability of magnesite and its high-pressure form in the lowermost mantle". Nature. 427 (6969): 60–63. Bibcode:2004Natur.427...60I. doi:10.1038/nature02181. ISSN 0028-0836. PMID 14702083. S2CID 4351925.
- ^ Marcondes, M. L.; Justo, J. F.; Assali, L. V. C. (2016-09-23). "Carbonates at high pressures: Possible carriers for deep carbon reservoirs in the Earth's lower mantle". Physical Review B. 94 (10): 104112. Bibcode:2016PhRvB..94j4112M. doi:10.1103/PhysRevB.94.104112.
- ^ FERRY, JOHN M.; RUMBLE, DOUGLAS; WING, BOSWELL A.; PENNISTON-DORLAND, SARAH C. (2005-04-22). "A New Interpretation of Centimetre-scale Variations in the Progress of Infiltration-driven Metamorphic Reactions: Case Study of Carbonated Metaperidotite, Val d'Efra, Central Alps, Switzerland". Journal of Petrology. 46 (8): 1725–1746. doi:10.1093/petrology/egi034. ISSN 1460-2415.
- ^ Zhang, Lifei; Ellis, David J.; Williams, Samantha; Jiang, Wenbo (July 2002). "Ultra-high pressure metamorphism in western Tianshan, China: Part II. Evidence from magnesite in eclogite". American Mineralogist. 87 (7): 861–866. Bibcode:2002AmMin..87..861Z. doi:10.2138/am-2002-0708. ISSN 0003-004X. S2CID 101814149.
- ^ Mavromatis, Vasileios; Pearce, Christopher R.; Shirokova, Liudmila S.; Bundeleva, Irina A.; Pokrovsky, Oleg S.; Benezeth, Pascale; Oelkers, Eric H. (2012-01-01). "Magnesium isotope fractionation during hydrous magnesium carbonate precipitation with and without cyanobacteria". Geochimica et Cosmochimica Acta. 76: 161–174. Bibcode:2012GeCoA..76..161M. doi:10.1016/j.gca.2011.10.019. ISSN 0016-7037.
- ^ Shirokova, Liudmila S.; Mavromatis, Vasileios; Bundeleva, Irina A.; Pokrovsky, Oleg S.; Bénézeth, Pascale; Gérard, Emmanuelle; Pearce, Christopher R.; Oelkers, Eric H. (2013-01-01). "Using Mg Isotopes to Trace Cyanobacterially Mediated Magnesium Carbonate Precipitation in Alkaline Lakes". Aquatic Geochemistry. 19 (1): 1–24. doi:10.1007/s10498-012-9174-3. ISSN 1573-1421. S2CID 129854388.
- ^ Quesnel, Benoît; Boulvais, Philippe; Gautier, Pierre; Cathelineau, Michel; John, Cédric M.; Dierick, Malorie; Agrinier, Pierre; Drouillet, Maxime (June 2016). "Paired stable isotopes (O, C) and clumped isotope thermometry of magnesite and silica veins in the New Caledonia Peridotite Nappe" (PDF). Geochimica et Cosmochimica Acta. 183: 234–249. Bibcode:2016GeCoA.183..234Q. doi:10.1016/j.gca.2016.03.021. hdl:10044/1/33108. ISSN 0016-7037.
- ^ Power, Ian M.; Harrison, Anna L.; Dipple, Gregory M.; Wilson, Siobhan A.; Barker, Shaun L.L.; Fallon, Stewart J. (June 2019). "Magnesite formation in playa environments near Atlin, British Columbia, Canada". Geochimica et Cosmochimica Acta. 255: 1–24. Bibcode:2019GeCoA.255....1P. doi:10.1016/j.gca.2019.04.008. ISSN 0016-7037. S2CID 146307705.
- ^ Streit, Elisabeth; Kelemen, Peter; Eiler, John (2012-06-17). "Coexisting serpentine and quartz from carbonate-bearing serpentinized peridotite in the Samail Ophiolite, Oman". Contributions to Mineralogy and Petrology. 164 (5): 821–837. Bibcode:2012CoMP..164..821S. doi:10.1007/s00410-012-0775-z. ISSN 0010-7999. S2CID 12595278.
- ^ Halevy, Itay; Fischer, Woodward W.; Eiler, John M. (2011-10-11). "Carbonates in the Martian meteorite Allan Hills 84001 formed at 18 ± 4 °C in a near-surface aqueous environment". Proceedings of the National Academy of Sciences. 108 (41): 16895–16899. doi:10.1073/pnas.1109444108. ISSN 0027-8424. PMC 3193235. PMID 21969543.
- ^ 마그네사이트 바닥판, 서해안 갑판 방수공법 정보
- ^ "Scientists find way to make mineral which can remove CO2 from atmosphere". phys.org/news. Retrieved 2018-08-15.
- ^ Kelemen, Peter B.; Matter, Juerg; Streit, Elisabeth E.; Rudge, John F.; Curry, William B.; Blusztajn, Jerzy (2011-05-30). "Rates and Mechanisms of Mineral Carbonation in Peridotite: Natural Processes and Recipes for Enhanced, in situ CO2Capture and Storage". Annual Review of Earth and Planetary Sciences. 39 (1): 545–576. Bibcode:2011AREPS..39..545K. doi:10.1146/annurev-earth-092010-152509. ISSN 0084-6597.
- ^ "Ford Fountain for the New York World's Fair". The Noguchi Museum. Retrieved 2022-01-02.
- ^ "CDC – NIOSH Pocket Guide to Chemical Hazards – Magnesite". www.cdc.gov. Retrieved 2015-11-19.
- Smithsonian Rock and Gem ISBN 0-7566-0962-3