유비퀴틴카르복시말단가수분해효소L1
Ubiquitin carboxy-terminal hydrolase L1| UCHL1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| 식별자 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| 에일리어스 | UCHL1, HEL-117, NDGOA, PARK5, PGP 9.5, PGP95, Uch-L1, HEL-S-53, 유비퀴틴 C단말기 가수분해효소 L1, SPG79, UCHL-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| 외부 ID | OMIM: 191342 MGI: 103149 HomoloGene: 37894 GenCard: UCHL1 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| 위키데이터 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
유비퀴틴 카르복시 말단 가수분해효소 L1(EC 3.1.2.15, 유비퀴틴 C 말단 가수분해효소, UCH-L1)은 탈유비퀴틴화효소이다.
| 유비퀴틴카르복시말단 가수분해효소L1(UCH-L1) | |
|---|---|
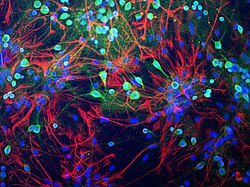 항체로 녹색을 띠는 쥐의 뇌조직에서 세포체를 강하게 부각시키고 세포는 더 약하게 처리하는 유비퀴틴 C 말단 가수분해효소 L1(UCH-L1)에 이르는 뉴런.성상세포는 세포질 필라멘트에서 발견되는 GFAP 단백질에 대한 항체로 붉은색으로 염색된다.모든 종류의 세포핵은 DNA결합염료로 파란색으로 염색된다.EnCor Biotechnology Inc.에 의해 생성된 항체, 세포 제제 및 이미지. | |
| 미세해부술의 해부학적 용어 |
기능.
UCH-L1은 유비퀴틴의 소량 C 말단 부가물을 가수분해하여 유비퀴틴 단량체를 생성하는 유전자군의 구성원이다.UCH-L1의 발현은 뉴런, 확산신경내분비계 세포 및 그 종양에 매우 특이적이다.특히 뉴런과 고환/[5][6]난소에서 발현되는 모든 뉴런(전체 뇌 단백질의 1~2%)에 풍부하게 존재한다.
UCH-L1의 촉매 삼합체는 90번 위치의 시스테인, 176번 위치의 아스파르트산 및 161번 위치의 히스티딘을 포함하고 있으며, 이는 가수분해효소 활성을 [7]담당한다.
신경변성 장애와의 관련성
이 단백질을 코드하는 유전자의 포인트 돌연변이(I93M)는 독일 한 가족에서 파킨슨병의 원인으로 관련되지만, 이 돌연변이를 가진 다른 파킨슨병 환자는 [8][9]발견되지 않아 논란이 되고 있다.
또한 이 유전자의 다형성(S18Y)은 파킨슨병 [10]위험 감소와 관련이 있는 것으로 밝혀졌다.이 다형은 특히 항산화 [11]활성을 가지고 있는 것으로 나타났다.
UCH-L1의 또 다른 잠재적인 보호 기능은 유비퀴틴 프로테아솜 시스템의 중요한 성분인 모노비퀴틴을 안정화시키는 것으로 보고된 능력이다.유비퀴틴의 단량체를 안정화시켜 이들의 분해를 방지함으로써 단백질에 [12]의해 분해되는 단백질에 태그되는 유비퀴틴의 가용 풀을 증가시킨다고 생각된다.
이 유전자는 알츠하이머 병과도 관련이 있으며, 정상적인 시냅스 및 인지 [13]기능에 필요합니다.Uchl1의 상실은 프로그램된 세포사에 대한 췌장 베타 세포의 감수성을 증가시키고, 이 단백질이 신경 내분비 세포에서 보호 역할을 하고 당뇨병과 신경 변성 [14]질환 사이의 관계를 보여줍니다.
원인 돌연변이가 UCHL1 유전자(구체적으로 유비퀴틴 결합 도메인, E7A)에 있었던 조기 신경변성 환자는 실명, 소뇌실조증, 안진, 등주 기능 장애 및 상부 운동 뉴런 장애를 [15]보인다.
이소성 발현
UCH-L1 단백질 발현은 뉴런 및 고환/난소 조직에 특이하지만 특정 폐종양 세포주에서는 [16]발현되는 것으로 밝혀졌다.이러한 UCH-L1의 이상발현은 암과 관련이 있으며, UCH-L1을 종양유전자로 [17]지정하게 되었다.또한 인간 mGN의 [18]랫드 모델인 PHN에서 팟구 내 UCH-L1 de novo 발현을 보였기 때문에 막성 사구체신염의 병인에 UCH-L1이 관여할 수 있다는 증거가 있다.이 UCH-L1 발현은 적어도 부분 팟구 [19]비대를 유도하는 것으로 생각된다.
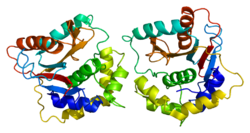
단백질 구조
인간 UCH-L1과 밀접하게 관련된 단백질 UCHL3은 5개의 매듭 교차가 있는 단백질로서 지금까지 발견된 가장 복잡한 매듭 구조 중 하나를 가지고 있다.매듭 구조가 [20][21]프로테아솜의 분해에 대한 단백질의 저항성을 증가시킬 수 있다고 추측된다.
또한 UCH-L1 단백질의 배치는 신경 보호 또는 병리학의 중요한 지표가 될 수 있다.예를 들어, UCH-L1 이합체는 잠재적으로 병원성 리가아제 활성을 나타내며, 앞에서 언급한 α-시뉴클린의 [22]응집 증가를 초래할 수 있다.UCH-L1의 S18Y 다형성은 [12]이량화되기 쉬운 것으로 나타났다.
상호 작용
유비퀴틴 카르복시 말단 가수분해효소 L1은 COP9 구성 광형성 호몰로지 서브유닛 [23]5와 상호작용하는 것으로 나타났다.
UCH-L1은 또한 파킨슨병의 병리학에 관여하는 또 다른 단백질인 α-시뉴클린과 상호작용하는 것으로 나타났다.이 활성은 유전자의 [22]I93M 병원성 돌연변이와 관련될 수 있는 유비퀴틸 리가아제 활성의 결과로 보고되었다.
가장 최근에, UCH-L1은 E3 연결효소인 파킨과 상호작용하는 것으로 입증되었다.파킨은 UCH-L1의 [24]리소좀 분해를 촉진하기 위해 UCH-L1과 결합 및 유비퀴티닐산염으로 입증되었다.
「 」를 참조해 주세요.
- 유비퀴틴 카르복실 말단 에스테라아제 L3-유전자 UCHL3
- 알파 시뉴클레인
- 파킨슨병
- 프로테아솜
레퍼런스
- ^ a b c GRCh38: 앙상블 릴리즈 89: ENSG00000154277 - 앙상블, 2017년 5월
- ^ a b c GRCm38: 앙상블 릴리즈 89: ENSMUSG000029223 - 앙상블, 2017년 5월
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ Doran JF, Jackson P, Kynoch PA, Thompson RJ (Jun 1983). "Isolation of PGP 9.5, a new human neurone-specific protein detected by high-resolution two-dimensional electrophoresis". Journal of Neurochemistry. 40 (6): 1542–7. doi:10.1111/j.1471-4159.1983.tb08124.x. PMID 6343558. S2CID 24386913.
- ^ "Entrez Gene: UCHL1 ubiquitin carboxyl-terminal esterase L1 (ubiquitin thiolesterase)".
- ^ Das C, Hoang QQ, Kreinbring CA, Luchansky SJ, Meray RK, Ray SS, Lansbury PT, Ringe D, Petsko GA (Mar 2006). "Structural basis for conformational plasticity of the Parkinson's disease-associated ubiquitin hydrolase UCH-L1". Proceedings of the National Academy of Sciences of the United States of America. 103 (12): 4675–80. Bibcode:2006PNAS..103.4675D. doi:10.1073/pnas.0510403103. PMC 1450230. PMID 16537382.
- ^ Leroy E, Boyer R, Auburger G, Leube B, Ulm G, Mezey E, Harta G, Brownstein MJ, Jonnalagada S, Chernova T, Dehejia A, Lavedan C, Gasser T, Steinbach PJ, Wilkinson KD, Polymeropoulos MH (Oct 1998). "The ubiquitin pathway in Parkinson's disease". Nature. 395 (6701): 451–2. Bibcode:1998Natur.395..451L. doi:10.1038/26652. PMID 9774100. S2CID 204997455.
- ^ Harhangi BS, Farrer MJ, Lincoln S, Bonifati V, Meco G, De Michele G, Brice A, Dürr A, Martinez M, Gasser T, Bereznai B, Vaughan JR, Wood NW, Hardy J, Oostra BA, Breteler MM (Jul 1999). "The Ile93Met mutation in the ubiquitin carboxy-terminal-hydrolase-L1 gene is not observed in European cases with familial Parkinson's disease". Neuroscience Letters. 270 (1): 1–4. doi:10.1016/s0304-3940(99)00465-6. PMID 10454131. S2CID 26352360.
- ^ Wang J, Zhao CY, Si YM, Liu ZL, Chen B, Yu L (Jul 2002). "ACT and UCH-L1 polymorphisms in Parkinson's disease and age of onset". Movement Disorders. 17 (4): 767–71. doi:10.1002/mds.10179. PMID 12210873. S2CID 23026015.
- ^ Kyratzi E, Pavlaki M, Stefanis L (Jul 2008). "The S18Y polymorphic variant of UCH-L1 confers an antioxidant function to neuronal cells". Human Molecular Genetics. 17 (14): 2160–71. doi:10.1093/hmg/ddn115. PMID 18411255.
- ^ a b Osaka H, Wang YL, Takada K, Takizawa S, Setsuie R, Li H, Sato Y, Nishikawa K, Sun YJ, Sakurai M, Harada T, Hara Y, Kimura I, Chiba S, Namikawa K, Kiyama H, Noda M, Aoki S, Wada K (Aug 2003). "Ubiquitin carboxy-terminal hydrolase L1 binds to and stabilizes monoubiquitin in neuron". Human Molecular Genetics. 12 (16): 1945–58. doi:10.1093/hmg/ddg211. PMID 12913066.
- ^ Gong B, Cao Z, Zheng P, Vitolo OV, Liu S, Staniszewski A, Moolman D, Zhang H, Shelanski M, Arancio O (Aug 2006). "Ubiquitin hydrolase Uch-L1 rescues beta-amyloid-induced decreases in synaptic function and contextual memory". Cell. 126 (4): 775–88. doi:10.1016/j.cell.2006.06.046. PMID 16923396. S2CID 10916274.
- ^ Chu KY, Li H, Wada K, Johnson JD (Jan 2012). "Ubiquitin C-terminal hydrolase L1 is required for pancreatic beta cell survival and function in lipotoxic conditions". Diabetologia. 55 (1): 128–40. doi:10.1007/s00125-011-2323-1. PMID 22038515.
- ^ Bilguvar K, Tyagi NK, Ozkara C, Tuysuz B, Bakircioglu M, Choi M, Delil S, Caglayan AO, Baranoski JF, Erturk O, Yalcinkaya C, Karacorlu M, Dincer A, Johnson MH, Mane S, Chandra SS, Louvi A, Boggon TJ, Lifton RP, Horwich AL, Gunel M (Feb 2013). "Recessive loss of function of the neuronal ubiquitin hydrolase UCHL1 leads to early-onset progressive neurodegeneration". Proceedings of the National Academy of Sciences of the United States of America. 110 (9): 3489–94. Bibcode:2013PNAS..110.3489B. doi:10.1073/pnas.1222732110. PMC 3587195. PMID 23359680.
- ^ Liu Y, Lashuel HA, Choi S, Xing X, Case A, Ni J, Yeh LA, Cuny GD, Stein RL, Lansbury PT (Sep 2003). "Discovery of inhibitors that elucidate the role of UCH-L1 activity in the H1299 lung cancer cell line". Chemistry & Biology. 10 (9): 837–46. doi:10.1016/j.chembiol.2003.08.010. PMID 14522054.
- ^ Hussain S, Foreman O, Perkins SL, Witzig TE, Miles RR, van Deursen J, Galardy PJ (Sep 2010). "The de-ubiquitinase UCH-L1 is an oncogene that drives the development of lymphoma in vivo by deregulating PHLPP1 and Akt signaling". Leukemia. 24 (9): 1641–55. doi:10.1038/leu.2010.138. PMC 3236611. PMID 20574456.
- ^ Meyer-Schwesinger C, Meyer TN, Münster S, Klug P, Saleem M, Helmchen U, Stahl RA (Feb 2009). "A new role for the neuronal ubiquitin C-terminal hydrolase-L1 (UCH-L1) in podocyte process formation and podocyte injury in human glomerulopathies". The Journal of Pathology. 217 (3): 452–64. doi:10.1002/path.2446. PMID 18985619. S2CID 23851206.
- ^ Lohmann F, Sachs M, Meyer TN, Sievert H, Lindenmeyer MT, Wiech T, Cohen CD, Balabanov S, Stahl RA, Meyer-Schwesinger C (Jul 2014). "UCH-L1 induces podocyte hypertrophy in membranous nephropathy by protein accumulation". Biochimica et Biophysica Acta (BBA) - Molecular Basis of Disease. 1842 (7): 945–58. doi:10.1016/j.bbadis.2014.02.011. PMID 24583340.
- ^ Peterson, Ivars (2006-10-14). "Knots in proteins". Science News. Archived from the original on 2008-04-21. Retrieved 2008-09-11.
- ^ Virnau P, Mirny LA, Kardar M (Sep 2006). "Intricate knots in proteins: Function and evolution". PLOS Computational Biology. 2 (9): e122. Bibcode:2006PLSCB...2..122V. doi:10.1371/journal.pcbi.0020122. PMC 1570178. PMID 16978047.
- ^ a b Liu Y, Fallon L, Lashuel HA, Liu Z, Lansbury PT (Oct 2002). "The UCH-L1 gene encodes two opposing enzymatic activities that affect alpha-synuclein degradation and Parkinson's disease susceptibility". Cell. 111 (2): 209–18. doi:10.1016/s0092-8674(02)01012-7. PMID 12408865. S2CID 6849108.
- ^ Caballero OL, Resto V, Patturajan M, Meerzaman D, Guo MZ, Engles J, Yochem R, Ratovitski E, Sidransky D, Jen J (May 2002). "Interaction and colocalization of PGP9.5 with JAB1 and p27(Kip1)". Oncogene. 21 (19): 3003–10. doi:10.1038/sj.onc.1205390. PMID 12082530.
- ^ McKeon JE, Sha D, Li L, Chin LS (May 2015). "Parkin-mediated K63-polyubiquitination targets ubiquitin C-terminal hydrolase L1 for degradation by the autophagy-lysosome system". Cellular and Molecular Life Sciences. 72 (9): 1811–24. doi:10.1007/s00018-014-1781-2. PMC 4395523. PMID 25403879.
추가 정보
- Healy DG, Abou-Sleiman PM, Wood NW (Oct 2004). "Genetic causes of Parkinson's disease: UCHL-1". Cell and Tissue Research. 318 (1): 189–94. doi:10.1007/s00441-004-0917-3. PMID 15221445. S2CID 22530636.
- Rasmussen HH, van Damme J, Puype M, Gesser B, Celis JE, Vandekerckhove J (Dec 1992). "Microsequences of 145 proteins recorded in the two-dimensional gel protein database of normal human epidermal keratinocytes". Electrophoresis. 13 (12): 960–9. doi:10.1002/elps.11501301199. PMID 1286667. S2CID 41855774.
- Edwards YH, Fox MF, Povey S, Hinks LJ, Thompson RJ, Day IN (Oct 1991). "The gene for human neurone specific ubiquitin C-terminal hydrolase (UCHL1, PGP9.5) maps to chromosome 4p14". Annals of Human Genetics. 55 (Pt 4): 273–8. doi:10.1111/j.1469-1809.1991.tb00853.x. PMID 1840236. S2CID 25763146.
- Honoré B, Rasmussen HH, Vandekerckhove J, Celis JE (Mar 1991). "Neuronal protein gene product 9.5 (IEF SSP 6104) is expressed in cultured human MRC-5 fibroblasts of normal origin and is strongly down-regulated in their SV40 transformed counterparts". FEBS Letters. 280 (2): 235–40. doi:10.1016/0014-5793(91)80300-R. PMID 1849484. S2CID 40473683.
- Day IN, Hinks LJ, Thompson RJ (Jun 1990). "The structure of the human gene encoding protein gene product 9.5 (PGP9.5), a neuron-specific ubiquitin C-terminal hydrolase". The Biochemical Journal. 268 (2): 521–4. doi:10.1042/bj2680521. PMC 1131465. PMID 2163617.
- Day IN, Thompson RJ (Jan 1987). "Molecular cloning of cDNA coding for human PGP 9.5 protein. A novel cytoplasmic marker for neurones and neuroendocrine cells". FEBS Letters. 210 (2): 157–60. doi:10.1016/0014-5793(87)81327-3. PMID 2947814. S2CID 39218297.
- Doran JF, Jackson P, Kynoch PA, Thompson RJ (Jun 1983). "Isolation of PGP 9.5, a new human neurone-specific protein detected by high-resolution two-dimensional electrophoresis". Journal of Neurochemistry. 40 (6): 1542–7. doi:10.1111/j.1471-4159.1983.tb08124.x. PMID 6343558. S2CID 24386913.
- Onno M, Nakamura T, Mariage-Samson R, Hillova J, Hill M (Mar 1993). "Human TRE17 oncogene is generated from a family of homologous polymorphic sequences by single-base changes". DNA and Cell Biology. 12 (2): 107–18. doi:10.1089/dna.1993.12.107. PMID 8471161.
- Larsen CN, Price JS, Wilkinson KD (May 1996). "Substrate binding and catalysis by ubiquitin C-terminal hydrolases: identification of two active site residues". Biochemistry. 35 (21): 6735–44. doi:10.1021/bi960099f. PMID 8639624.
- Best CL, Pudney J, Welch WR, Burger N, Hill JA (Apr 1996). "Localization and characterization of white blood cell populations within the human ovary throughout the menstrual cycle and menopause". Human Reproduction. 11 (4): 790–7. doi:10.1093/oxfordjournals.humrep.a019256. PMID 8671330.
- D'Andrea V, Malinovsky L, Berni A, Biancari F, Biassoni L, Di Matteo FM, Corbellini L, Falvo L, Santoni F, Spyrou M, De Antoni E (Oct 1997). "The immunolocalization of PGP 9.5 in normal human kidney and renal cell carcinoma". Il Giornale di Chirurgia. 18 (10): 521–4. PMID 9435142.
- Larsen CN, Krantz BA, Wilkinson KD (Mar 1998). "Substrate specificity of deubiquitinating enzymes: ubiquitin C-terminal hydrolases". Biochemistry. 37 (10): 3358–68. doi:10.1021/bi972274d. PMID 9521656.
- Leroy E, Boyer R, Auburger G, Leube B, Ulm G, Mezey E, Harta G, Brownstein MJ, Jonnalagada S, Chernova T, Dehejia A, Lavedan C, Gasser T, Steinbach PJ, Wilkinson KD, Polymeropoulos MH (Oct 1998). "The ubiquitin pathway in Parkinson's disease". Nature. 395 (6701): 451–2. Bibcode:1998Natur.395..451L. doi:10.1038/26652. PMID 9774100. S2CID 204997455.
- Wada H, Kito K, Caskey LS, Yeh ET, Kamitani T (Oct 1998). "Cleavage of the C-terminus of NEDD8 by UCH-L3". Biochemical and Biophysical Research Communications. 251 (3): 688–92. doi:10.1006/bbrc.1998.9532. PMID 9790970.
- Leroy E, Boyer R, Polymeropoulos MH (Dec 1998). "Intron-exon structure of ubiquitin c-terminal hydrolase-L1". DNA Research. 5 (6): 397–400. doi:10.1093/dnares/5.6.397. PMID 10048490.
- Lincoln S, Vaughan J, Wood N, Baker M, Adamson J, Gwinn-Hardy K, Lynch T, Hardy J, Farrer M (Feb 1999). "Low frequency of pathogenic mutations in the ubiquitin carboxy-terminal hydrolase gene in familial Parkinson's disease". NeuroReport. 10 (2): 427–9. doi:10.1097/00001756-199902050-00040. PMID 10203348.
- Harhangi BS, Farrer MJ, Lincoln S, Bonifati V, Meco G, De Michele G, Brice A, Dürr A, Martinez M, Gasser T, Bereznai B, Vaughan JR, Wood NW, Hardy J, Oostra BA, Breteler MM (Jul 1999). "The Ile93Met mutation in the ubiquitin carboxy-terminal-hydrolase-L1 gene is not observed in European cases with familial Parkinson's disease". Neuroscience Letters. 270 (1): 1–4. doi:10.1016/S0304-3940(99)00465-6. PMID 10454131. S2CID 26352360.
- Saigoh K, Wang YL, Suh JG, Yamanishi T, Sakai Y, Kiyosawa H, Harada T, Ichihara N, Wakana S, Kikuchi T, Wada K (Sep 1999). "Intragenic deletion in the gene encoding ubiquitin carboxy-terminal hydrolase in gad mice". Nature Genetics. 23 (1): 47–51. doi:10.1038/12647. PMID 10471497. S2CID 34253163.
- Mellick GD, Silburn PA (Oct 2000). "The ubiquitin carboxy-terminal hydrolase-L1 gene S18Y polymorphism does not confer protection against idiopathic Parkinson's disease". Neuroscience Letters. 293 (2): 127–30. doi:10.1016/S0304-3940(00)01510-X. PMID 11027850. S2CID 25234210.
- Sharma N, McLean PJ, Kawamata H, Irizarry MC, Hyman BT (Oct 2001). "Alpha-synuclein has an altered conformation and shows a tight intermolecular interaction with ubiquitin in Lewy bodies". Acta Neuropathologica. 102 (4): 329–34. doi:10.1007/s004010100369. PMID 11603807. S2CID 33892290.