NADPH 산화효소
NADPH oxidase| NAD(P)H 산화효소 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| 식별자 | |||||||||
| EC 번호 | 1.6.3.1 | ||||||||
| CAS 번호. | 77106-92-4 | ||||||||
| 데이터베이스 | |||||||||
| 인텐츠 | IntEnz 뷰 | ||||||||
| 브렌다 | 브렌다 입력 | ||||||||
| 엑스퍼시 | 나이스자이메 뷰 | ||||||||
| 케그 | KEG 입력 | ||||||||
| 메타사이크 | 대사통로 | ||||||||
| 프리암 | 프로필 | ||||||||
| PDB 구조 | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
| 철분해효소 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| 식별자 | |||||||||
| 기호 | NADPH 산화효소 | ||||||||
| Pfam | PF01794 | ||||||||
| 인터프로 | IPR013130 | ||||||||
| TCDB | 5.B.1 | ||||||||
| OPM 슈퍼 패밀리 | 464 | ||||||||
| OPM단백질 | 5o05 | ||||||||
| |||||||||
NADPH 산화효소(Nicotinamide adenine dinucleotide phosphate oxidase, NADPH oxidase)는 세포외 공간에 면해 있는 막 결합 효소 복합체다.중성미자 백혈구가 미생물을 집어삼킬 때 사용하는 파고솜의 막뿐만 아니라 혈장막에서도 발견될 수 있다.복합체의 촉매 성분의 인간 등소 형태로는 NOX1, NOX2, NOX3, NOX4, NOX5, DUOX1, DUOX2가 있다.[1]
반응
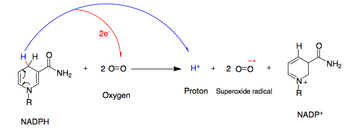
NADPH 산화효소는 NADPH에서 산소로 전자 1개를 전달하여 과산화수소 프리라디칼의 생성을 촉진한다.이 과정에서 O는2 세포외 공간에서 세포 내부로 운반되고 H는+ 내보내진다[citation needed].
- NADPH+ + 2O2 £ + 2O2−+ + H
생물 함수
NADPH 산화(NOXes)는 세포반응산소종(ROS)의 주요 발생원 중 하나이며, 정상적인 생리학적 조건에서 ROS를 생산하는 독점적 기능 때문에 여전히 광범위한 연구 관심의 초점이 되고 있다.NADPH 산화효소 복합체는 정상적인 상황에서 휴면 상태지만 호흡기 폭발 시 막에 조립할 수 있도록 활성화된다.활성 NADPH 산화효소는 동물 면역 반응과 식물 신호 전달에 역할을 하는 과산화수소를 생성한다.
과산화수소는 박테리아와 곰팡이를 섭취한 포고솜에서 생성되거나 세포 밖에서 생성될 수 있다.[2]대식세포에서 과산화수소는 아직 완전히 이해되지 않은 메커니즘에 의해 박테리아와 곰팡이를 죽인다.[3][4]과산화수소는 자연적으로 분해되어 과산화수소를 형성하고, 과산화수소를 생산하기 위해 양성된다.산화제가 중성미자의 미생물을 어떻게 죽이는지에 대한 의견은 양극화된다.한편 과산화수소는 미엘로페록시디제(myeloperoxidase)가 차아염소산을 생산하는 기질 역할을 한다고 생각된다.[5]또한 임계 대사 효소를 불활성화하고 지질 과산화, 철-설퍼 군집 손상,[6] 하이드록실 라디칼과 같은 무차별 산화제의 생성을 가능하게 하는 리독스 활성 철을 해방시킬 수도 있다.[4]또 다른 관점은 산화효소가 바쿠올의 pH를 약 9.0으로 상승시켜 세포질 과립(pH~5.5에서 활동하지 않는 곳)에서 분해되는 중성 단백질에 최적이며, 바쿠올에 칼륨을 펌핑하여 효소를 용해하는 활성 단백질로서 마이크로b를 죽이고 소화하는 것이다.es.[7]
곤충의 경우, NOX는 몇 가지 기능을 명확히 했다.절지동물은 3가지 NOX 유형(NOX4-art, 절지동물의 고유 p22-phox 독립 NOX4, 칼슘 의존 효소 2종 DUOX)[8][9]이 있다.내장에서 박테리아 자극 드로필라 멜라노가스터 점막에서 나오는 DUOX 의존형 ROS 생산은 중요한 병원균 죽이기 메커니즘으로[10] 방어반응으로 배변을 증가시킬 수 있다.[11]Aedes aegygeti에서 DUOX는 내장의 토착 마이크로바이오타의 통제에 관여한다.[12]로드니우스 프릭서스는 달걀 껍질 경화에 관여하는 칼슘 활성 DUOX와 [13]장 운동성 및 혈액 소화 조절에 관여하는 NOX5가 있다.[14][15]
규정
NADPH 산화효소 활성의 세심한 조절은 신체의 건강한 ROS 수준을 유지하기 위해 중요하다.이 효소는 휴식 세포에서 휴면하지만 박테리아 제품과 사이토카인을 포함한 여러 자극에 의해 빠르게 활성화된다.[16]혈관 NADPH 산화는 다양한 호르몬과 혈관 리모델링과 질병에 중요한 역할을 하는 것으로 알려진 요인에 의해 조절된다.여기에는 트롬빈, 혈소판 유도성장인자(PDGF), 종양 괴사인자(TNFa), 락토실세라마이드, 인터루킨-1, 산화 LDL 등이 포함된다.[17]또한 작용제와 아라키돈산에도 자극을 받는다.[17]반대로 복합체의 조립은 아포시닌과 디페닐렌 요오드늄에 의해 억제될 수 있다.아포시닌은 체내 생쥐의 인플루엔자로 인한 폐 염증을 줄여주기 때문에 인플루엔자 치료에서 임상적 이점이 있을 수 있다.[18]
종류들
포유류에서 NADPH 산화효소는 백혈구(중성세포)와 혈관세포의 두 가지 유형으로 생화학 구조와 기능이 다르다.[19]중성미 NADPH 산화효소는 거의 즉각적으로 과산화수소를 생성하는 반면 혈관 효소는 몇 분에서 몇 시간 사이에 과산화수소를 생성한다.[20]더욱이 백혈구에서는 과산화수소가 전자를 세포외 산소로 전자를 전달해 주는 것으로 나타났으며, 혈관세포에서는 급진 음이온이 주로 세포내 산소로 방출되는 것으로 나타났다.[21][22]
병리학
슈퍼옥시드는 인체의 이질적인 박테리아를 죽이는 데 매우 중요하다.결과적으로, 활동이 부족하면 카탈라아제 양성 미생물과 같은 유기체에 대한 민감성이 증가될 수 있고, 과잉 활동은 산화 스트레스와 세포 손상을 초래할 수 있다.
혈관 세포에서 ROS가 과다하게 생성되면 고혈압, 아테롬성 동맥경화증, 심근경색, 허혈성 뇌졸중 등 여러 형태의 심혈관 질환이 발생한다.[23]아테롬성 경화증은 동맥벽(인티마 내)에 콜레스테롤(포암세포)이 함유된 대식세포가 축적되면서 발생한다.NADPH 산화효소에 의해 생성된 ROS는 대식세포가 동맥벽에 달라붙게 하는 효소를 활성화시킨다(액틴섬유를 중합하여).이 과정은 NADPH 산화효소 억제제와 항산화제에 의해 균형을 이룬다.ROS에 찬성하는 불균형은 아테롬성 동맥경화를 일으킨다.체외 연구 결과 NADPH 산화효소 억제제 아포시닌, 디페닐렌오도늄과 함께 항산화제 N-아세틸-시스테인, 레스베라트롤과 함께 액틴을 분해하고 접착을 깨뜨리고 발포세포가 인티마 밖으로 이동하도록 한 것이 밝혀졌다.[24][25]
한 연구는 케타민에 의한 뉴런 파발부민 손실과 GAD67 표현에서 NADPH 산화효소에 대한 역할을 제안한다.[26]조현병에서도 비슷한 손실이 관찰되며, 그 결과는 NADPH 산화효소를 질병의 병태생리학에서 가능한 한 주체로 지목할 수 있다.[27]Nitro blue tetrazolium은 특히 NADPH 산화효소에 결함이 있는 만성 과립성 질환의 경우 진단검사에서 사용되므로, 포고세포는 박테리아 살해에 필요한 활성산소종이나 활성산소를 만들지 못해 포고세포 내에서 세균이 번성하게 된다.파란 점수가 높을수록 세포는 활성산소를 더 잘 생산한다.
또한 NADPH 산화효소는 sFlt-1 형성의 매개자로 의심받는 반응성 산소종의 형성을 촉진하여 태반발달에 역할을 하는 특정 프로앙지제인자를 비활성화하는 단백질인 sFlt-1의 형성을 유도하는 메커니즘의 역할을 하는 것으로 나타났다.이러한 효과는 임산부의[28] 임신 전 에클램피아를 유발하는 데 부분적으로 책임이 있다.
돌연변이
NADPH 산화효소 서브유닛 유전자의 돌연변이는 여러 만성 과립성 질환(CGD)을 유발하는데, 이 질환은 감염에 극도로 민감하다는 특징이 있다.[17]여기에는 다음이 포함된다.
이러한 질병에서 세포는 포식세포증(Pagocytosis)에 대한 수용력이 낮고, 지속적인 세균감염이 발생한다.감염된 세포의 영역은 흔한 그라눌로마 입니다.중성미자 면역결핍증후군이라는 유사한 질환은 복합체의 일부인 RAC2의 돌연변이와도 관련이 있다.
억제
NADPH 산화효소는 아포시닌, 질소산화물(NO), 다이페닐렌 요오드늄에 의해 억제될 수 있다.아포시닌은 NADPH 산화효소 서브유닛의 조립을 방지하는 작용을 한다.아포시닌은 체내 생쥐의 인플루엔자로 인한 폐 염증을 줄여주기 때문에 인플루엔자 치료에서 임상적 이점이 있을 수 있다.[18]
NO에 의한 NADPH 산화효소의 억제는 혈관 내 산화 응력의 근원을 차단한다.따라서 관상동맥질환, 고혈압, 심부전 등을 치료하기 위해 1세기 이상 어떤 기증 약품(니트로바소딜러)도 건강한 혈관 세포가 악화되는 것을 방지하여 사용하지 않았다.[19]
보다 진보된 NADPH 산화효소 억제제로는 2007년에 특허를 획득한 이소폼 NOX4 및 NOX1의[29] 이중 억제제인 GKT-831(이전의 GKT137831)이 있다.[30]이 화합물은 초기에 특발성 폐섬유화용으로 개발되었으며 2010년 말 FDA와 EMA에 의해 고아 약물로 지정되었다.[31]
구조
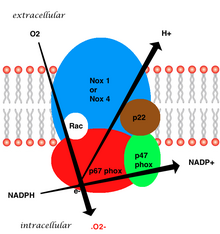
멤브레인 결합 혈관 효소의 전체 구조는 두 개의 세포질 보조유닛(p47pox와 p67pox), gp91pox, p22pox, 작은 G단백질 Rac로 구성된 사이토크롬 b558 등 다섯 부분으로 구성된다.[19]혈관 NADPH에서 과산화수소 생성은 감소된 NADPH를 전자 공여자로 사용하여 gp91pox 하위 장치를 통한 1전자의 산소 감소에 의해 발생한다.작은 G단백질은 GDP결합(비활성)과 GTP연계(활성)형태로 전환함으로써 산화효소의 활성화에 필수적인 역할을 한다.[32]
중성미자형
중성미자에서 발견되는 등소형태는 6개의 서브유닛으로 이루어져 있다.이러한 하위 단위는 다음과 같다.
혈관형
복합체에는 NOX2 하위 유닛의 파라로그를 사용하는 몇 가지 혈관 ISO 형식이 있다.
갑상선형
갑상선 내 NOX2 소단위에는 다음과 같은 두 가지 추가 파라로그가 있다.
참조
- ^ Sahoo S, Meijles DN, Pagano PJ (March 2016). "NADPH oxidases: key modulators in aging and age-related cardiovascular diseases?". Clinical Science. 130 (5): 317–35. doi:10.1042/CS20150087. PMC 4818578. PMID 26814203.
- ^ Herb M, Gluschko A, Wiegmann K, Farid A, Wolf A, Utermöhlen O, et al. (February 2019). "Mitochondrial reactive oxygen species enable proinflammatory signaling through disulfide linkage of NEMO". Science Signaling. 12 (568): eaar5926. doi:10.1126/scisignal.aar5926. PMID 30755476.
- ^ Herb M, Schramm M (February 2021). "Functions of ROS in Macrophages and Antimicrobial Immunity". Antioxidants. 10 (2): 313. doi:10.3390/antiox10020313. PMC 7923022. PMID 33669824.
- ^ a b Slauch JM (May 2011). "How does the oxidative burst of macrophages kill bacteria? Still an open question". Molecular Microbiology. 80 (3): 580–3. doi:10.1111/j.1365-2958.2011.07612.x. PMC 3109634. PMID 21375590.
- ^ Klebanoff SJ, Kettle AJ, Rosen H, Winterbourn CC, Nauseef WM (February 2013). "Myeloperoxidase: a front-line defender against phagocytosed microorganisms". J Leukoc Biol. 93 (2): 185–198. doi:10.1189/jlb.0712349. PMC 3545676. PMID 23066164.
- ^ Djaman O, Outten FW, Imlay JA (October 2004). "Repair of oxidized iron-sulfur clusters in Escherichia coli". The Journal of Biological Chemistry. 279 (43): 44590–9. doi:10.1074/jbc.M406487200. PMID 15308657.
- ^ Segal AW, Levine AP (2016). "The NADPH Oxidase and Microbial Killing by Neutrophils, With a Particular Emphasis on the Proposed Antimicrobial Role of Myeloperoxidase within the Phagocytic Vacuole". Microbiol Spectr. 4 (4). doi:10.1128/microbiolspec.MCHD-0018-2015. PMID 27726789.
- ^ Gandara AC, Torres A, Bahia AC, Oliveira PL, Schama R (March 2017). "Evolutionary origin and function of NOX4-art, an arthropod specific NADPH oxidase". BMC Evolutionary Biology. 17 (1): 92. doi:10.1186/s12862-017-0940-0. PMC 5372347. PMID 28356077.
- ^ Kawahara T, Quinn MT, Lambeth JD (July 2007). "Molecular evolution of the reactive oxygen-generating NADPH oxidase (Nox/Duox) family of enzymes". BMC Evolutionary Biology. 7 (1): 109. doi:10.1186/1471-2148-7-109. PMC 1940245. PMID 17612411.
- ^ Ha EM, Oh CT, Bae YS, Lee WJ (November 2005). "A direct role for dual oxidase in Drosophila gut immunity". Science. 310 (5749): 847–50. Bibcode:2005Sci...310..847H. doi:10.1126/science.1117311. PMID 16272120. S2CID 12476863.
- ^ Du EJ, Ahn TJ, Kwon I, Lee JH, Park JH, Park SH, et al. (January 2016). Miguel-Aliaga I (ed.). "TrpA1 Regulates Defecation of Food-Borne Pathogens under the Control of the Duox Pathway". PLOS Genetics. 12 (1): e1005773. doi:10.1371/journal.pgen.1005773. PMC 4699737. PMID 26726767.
- ^ Oliveira JH, Gonçalves RL, Lara FA, Dias FA, Gandara AC, Menna-Barreto RF, et al. (March 2011). Schneider DS (ed.). "Blood meal-derived heme decreases ROS levels in the midgut of Aedes aegypti and allows proliferation of intestinal microbiota". PLOS Pathogens. 7 (3): e1001320. doi:10.1371/journal.ppat.1001320. PMC 3060171. PMID 21445237.
- ^ Dias FA, Gandara AC, Queiroz-Barros FG, Oliveira RL, Sorgine MH, Braz GR, Oliveira PL (December 2013). "Ovarian dual oxidase (Duox) activity is essential for insect eggshell hardening and waterproofing". The Journal of Biological Chemistry. 288 (49): 35058–67. doi:10.1074/jbc.M113.522201. PMC 3853258. PMID 24174530.
- ^ Montezano AC, De Lucca Camargo L, Persson P, Rios FJ, Harvey AP, Anagnostopoulou A, et al. (June 2018). "NADPH Oxidase 5 Is a Pro-Contractile Nox Isoform and a Point of Cross-Talk for Calcium and Redox Signaling-Implications in Vascular Function". Journal of the American Heart Association. 7 (12). doi:10.1161/JAHA.118.009388. PMC 6220544. PMID 29907654.
- ^ Gandara AC, Dias FA, de Lemos PC, Stiebler R, Bombaça AC, Menna-Barreto R, Oliveira PL (2021-02-25). ""Urate and NOX5 Control Blood Digestion in the Hematophagous Insect Rhodnius prolixus"". Frontiers in Physiology. 12: 633093. doi:10.3389/fphys.2021.633093. PMC 7947236. PMID 33716782.
- ^ Geiszt M (July 2006). "NADPH oxidases: new kids on the block". Cardiovascular Research. 71 (2): 289–99. doi:10.1016/j.cardiores.2006.05.004. PMID 16765921.
- ^ a b c Griendling KK, Sorescu D, Ushio-Fukai M (March 2000). "NAD(P)H oxidase: role in cardiovascular biology and disease". Circulation Research. 86 (5): 494–501. doi:10.1161/01.res.86.5.494. PMID 10720409.
- ^ a b Vlahos R, Stambas J, Bozinovski S, Broughton BR, Drummond GR, Selemidis S (February 2011). "Inhibition of Nox2 oxidase activity ameliorates influenza A virus-induced lung inflammation". PLOS Pathogens. 7 (2): e1001271. doi:10.1371/journal.ppat.1001271. PMC 3033375. PMID 21304882.
- ^ a b c Dusting GJ, Selemidis S, Jiang F (March 2005). "Mechanisms for suppressing NADPH oxidase in the vascular wall". Memórias do Instituto Oswaldo Cruz. 100 (Suppl 1): 97–103. doi:10.1590/S0074-02762005000900016. PMID 15962105.
- ^ Pagano PJ, Chanock SJ, Siwik DA, Colucci WS, Clark JK (August 1998). "Angiotensin II induces p67phox mRNA expression and NADPH oxidase superoxide generation in rabbit aortic adventitial fibroblasts". Hypertension. 32 (2): 331–7. doi:10.1161/01.hyp.32.2.331. PMID 9719063.
- ^ Griendling KK, Minieri CA, Ollerenshaw JD, Alexander RW (June 1994). "Angiotensin II stimulates NADH and NADPH oxidase activity in cultured vascular smooth muscle cells". Circulation Research. 74 (6): 1141–8. doi:10.1161/01.res.74.6.1141. PMID 8187280.
- ^ Zafari AM, Ushio-Fukai M, Akers M, Yin Q, Shah A, Harrison DG, et al. (September 1998). "Role of NADH/NADPH oxidase-derived H2O2 in angiotensin II-induced vascular hypertrophy". Hypertension. 32 (3): 488–95. doi:10.1161/01.hyp.32.3.488. PMID 9740615.
- ^ Wattanapitayakul SK, Bauer JA (February 2001). "Oxidative pathways in cardiovascular disease: roles, mechanisms, and therapeutic implications". Pharmacology & Therapeutics. 89 (2): 187–206. doi:10.1016/S0163-7258(00)00114-5. PMID 11316520.
- ^ Park YM, Febbraio M, Silverstein RL (January 2009). "CD36 modulates migration of mouse and human macrophages in response to oxidized LDL and may contribute to macrophage trapping in the arterial intima". The Journal of Clinical Investigation. 119 (1): 136–45. doi:10.1172/JCI35535. PMC 2613464. PMID 19065049.
- ^ Curtiss LK (March 2009). "Reversing atherosclerosis?". The New England Journal of Medicine. 360 (11): 1144–6. doi:10.1056/NEJMcibr0810383. PMID 19279347.
- ^ Behrens MM, Ali SS, Dao DN, Lucero J, Shekhtman G, Quick KL, Dugan LL (December 2007). "Ketamine-induced loss of phenotype of fast-spiking interneurons is mediated by NADPH-oxidase". Science. 318 (5856): 1645–7. Bibcode:2007Sci...318.1645B. doi:10.1126/science.1148045. PMID 18063801. S2CID 41932041.
- ^ 톰 페이건.산화적 응력이 조현병의 NMDA와 GABA 가설을 연결시키는가? 웨이백 머신 정신분열증 연구 포럼에 2007-12-30으로 보관.2007년 12월 9일.
- ^ Huang QT, Zhang M, Zhong M, Yu YH, Liang WZ, Hang LL, et al. (December 2013). "Advanced glycation end products as an upstream molecule triggers ROS-induced sFlt-1 production in extravillous trophoblasts: a novel bridge between oxidative stress and preeclampsia". Placenta. 34 (12): 1177–82. doi:10.1016/j.placenta.2013.09.017. PMID 24144948.
- ^ Aoyama T, Paik YH, Watanabe S, Laleu B, Gaggini F, Fioraso-Cartier L, et al. (December 2012). "Nicotinamide adenine dinucleotide phosphate oxidase in experimental liver fibrosis: GKT137831 as a novel potential therapeutic agent". Hepatology. 56 (6): 2316–27. doi:10.1002/hep.25938. PMC 3493679. PMID 22806357.
- ^ "Espacenet - Bibliographic data". worldwide.espacenet.com. Retrieved 2017-05-04.
- ^ "FDA granting Genkyotex Orphan Drug Designation of GKT137831 for IPF - Genkyotex S.A." pauahosting.co.nz. Retrieved 2017-05-04.[영구적 데드링크]
- ^ Heyworth PG, Knaus UG, Settleman J, Curnutte JT, Bokoch GM (November 1993). "Regulation of NADPH oxidase activity by Rac GTPase activating protein(s)". Molecular Biology of the Cell. 4 (11): 1217–23. doi:10.1091/mbc.4.11.1217. PMC 275755. PMID 8305740.
외부 링크
- 미국 국립 의학 도서관의 NADPH+옥시다제(MesH)
- EC 1.6.3.1