시 에폭시디화
Shi epoxidation시 에폭시드는 옥소네(과산화칼륨 과산화모노황산염)와 과당유발촉매(1)를 사용한 알케네의 비대칭 에폭시드로 기술된 화학반응이다.이러한 반응은 옥소(과산화모노황산칼륨)에 의해 촉매 케톤에서 생성된 다이옥시레인 중간을 통해 진행되는 것으로 생각된다.황산염에 의한 황산염군을 첨가하면 링 클로징 시 좋은 이탈군 역할을 하여 다이옥시레인 형성을 용이하게 한다.비금속 촉매의 사용으로 주목할 만하며, 유기물 투석의 초기 예를 나타낸다.[1][2]그 반응은 이안시(安一安, 핀인:1996년 콜로라도 주립대학의 Shǐ Yī-an).
역사
효율적인 비금속 촉매의 합성에 대한 많은 시도가 발견되기 전에 이루어졌다.이전 촉매들의 문제는 다이옥시레인 중간체의 빠른 분해/산소화와 반응성 케톤에 대한 전기영양성의 부족이었다.방향제 케톤이 제안되었고, 후속적으로 많은 옥소암모늄염의 변형이 사용되었지만, 아미드 그룹의 산화적 불안정성과 7메모리 고리의 높은 유연성 때문에 신기원을 촉진하는 데는 효과가 없었다.비대칭 서브유닛과 반응 중심 사이의 거리가 멀기 때문에 이러한 초기 촉매의 항항성 또한 낮아져 항항성 초과에서 10% 미만이 나왔다.[1]
1996년 이안시 그룹이 발견한 촉매는 D-프락토스로부터 유래되었으며, 반응 중심(케톤)에 가까운 입체 중심(촉매와 인접한 쿼터나리 링 그룹의 경직된 6-membed 링 구조)을 가지고 있어 이 입체적인 입자를 최소화한다.능동 다이옥시레인 촉매에 의한 산화는 반대면 재면(re-face)의 강직한 방해로 인해 시면(si-face(si-face)이 촉매는 무작동 트랜스올레핀의 비대칭 촉매로서 효율적으로 기능한다.[2]
다이옥시레인 촉매 형성
정상적인 pH 조건에서는 높은 분해율로 인해 케톤 촉매가 3계수 이상 필요하다.기본 pH 조건에서 10 (pH 10.5) 이상의 하위계측량(0.2–0.3)은 에폭시드를 위해 필요하며, 배이어-빌라이거 측반응을 거부하여 시약의 분해량을 낮춘다.온도가 높을수록 더 많은 분해가 발생하기 때문에 섭씨 0도의 낮은 온도가 사용된다.
시약 분해는 양분자(2차 반응률)이기 때문에 적은 양의 옥소와 촉매가 사용된다.
반응은 D-프락토스 유도 촉매에 의해 매개되며, 이 촉매에서는 에폭시드의 (R,R) 에반토머가 생성된다.올레핀 유기질 기질과 산화제(옥소)의 용해도가 다르기 때문에 비파하스 배지가 필요하다.활성 촉매 종의 생성은 수성층에서 발생하며, 황산염 사트라부틸람모늄에 의해 반응 물질과 유기 층으로 격리된다.케톤 촉매는 촉매 사이클에서 지속적으로 재생되기 때문에 적은 양의 에폭시드를 촉매로 만들 수 있다.
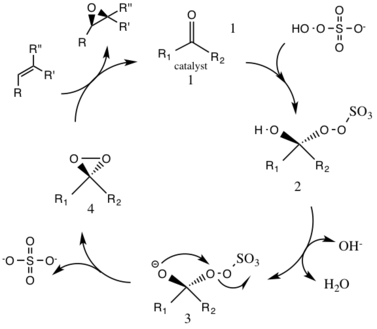
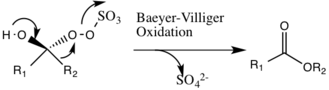
촉매 사이클 반응의 첫 번째 단계는 촉매에 케톤 그룹(중간 1)을 가진 옥소의 핵포함 반응이다.이것은 반응성 중간 2종인 Criegee 중간 종을 형성하며, Baeyer-Villiger 반응(아래 참조)과 같이 잠재적으로 원하지 않는 측면 반응을 일으킬 수 있다.중간종 3번 생성은 기본 조건에서 발생하며, 히드록시 그룹에서 수소를 제거하여 핵포질산소 음이온을 형성한다.황산염군은 3 exo-tet 사이클링 동안 좋은 이탈군 역할을 함으로써 중간종 4호인 다이옥시레인의 후속 형성을 용이하게 한다.활성화된 다이옥시란 촉매 종은 그 후 산소 원자를 알켄에 전달하여 원래의 촉매의 재생으로 이어진다.[3]
사이드 리액션
발생할 수 있는 잠재적인 부작용은 중간 2의 배이어 빌라이거 반응으로, 과산화 집단의 재배열이 있어 상대 에스테르가 형성된다.이러한 측반응의 범위는 pH의 상승에 따라 감소하며, 옥소의 핵소독성을 증가시켜 촉매종의 전체 에폭시드 및 반응성에 유리한 기본 조건을 만든다.
에폭시디화 메커니즘
비록 S2 메커니즘을n 통한 산소 음이온 중간의 존재는 전이될 수 있지만 유기 촉매에서 생성된 다이옥시레인 그룹의 산소는 알켄으로 전달된다.
D-프락토스파생상품
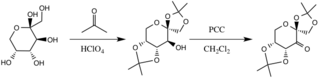
촉매는 과당 링의 히드록실 그룹이 핵포자 역할을 하면서 기본 조건 하에서 아세톤과의 반응에 의해 형성되며, 이들의 핵포자성은 탄산칼륨에 의해 생성된 기본 조건에 의해 증가한다.전자 인출 대체물(알파 에더 그룹)은 카보닐 카본의 전기생성을 증가시켜 산화제 피리디늄 클로로크롬산염으로부터 케톤 형성을 촉진하며, π C-C 결합의 형성을 인접 에테르들의 c* C-O 결합으로 안정화시킨다.[3]
전환 상태 및 항항성 선택성
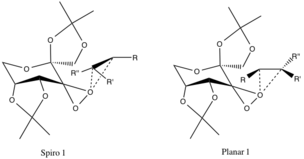
두 개의 제안된 전환 상태가 있는데, 이 두 상태는 기하학적 형상이 추측되고 실험 증거에 의해 확증되지 않지만 스테레오 전자 효과에 기인한다.스피로 전환 상태는 반응 알켄의 π* 반결합 C-C 궤도에 기증되는 우수한 산소의 비결합 궤도 때문에 평면보다 선호되며, 전자의 안정적 탈색화를 제공한다.
이러한 전자를 에폭시드 결합의 형성 C-O σ 결합에 기증하는 것 또한 스피로-제품의 형성을 촉진한다(제품의 기하학도 정렬된다).평면 구성은 촉매 링의 큰 알킬 기능 그룹을 가진 알킬 그룹의 파이 백본딩 부족 및 강직 장애로 인해 바람직하지 않다.[4]
앞서 언급한 구성은 R-alkyl 그룹(아래 참조)과 촉매 링의 에테르-alkyl 기능 그룹 사이의 불리한 강직 상호작용 때문에 반대되는 에노모머의 전환 상태보다 선호된다.
이 에폭시드의 항산화 성공은 금속 촉매에 비해 상대적으로 높으며, 일반적으로 80%를 초과하는 높은 항산화제 과잉을 초래한다.[2]
반응수율 및 입체도
이 절차는 전분해성 연골과 삼분해성 연골에서 높은 항산화물 과다를 가진 에폭시드를 생성한다.시스 분화 연금술과[3] 스타일리스는[4] 유사한 촉매를 사용하여 비대칭적으로 에폭시화된다.(R,R) 에폭시드의 생성은 대체 R 그룹의 견고한 부피가 증가함에 따라 입체감이 증가한다(특히 트랜스올레핀의 경우).
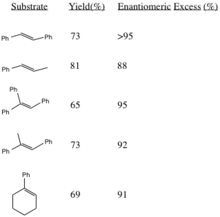
참조
- ^ Denmark, Scott E. (13 April 1999). "The Development of Chiral, Non-Racemic Dioxiranes for the Catalytic, Enantioselective Epoxidation of Alkenes" (PDF). Synlett. 1999: 847–859. doi:10.1055/s-1999-3123.
- ^ a b c Shi, Yian (1996). "An Efficient Asymmetric Epoxidation Method for trans-olefins mediated by a Fructose-Derived Ketone". Journal of the American Chemical Society. 118 (40): 9806–9807. doi:10.1021/ja962345g.
- ^ a b c "Organic Chemistry Portal".
- ^ Shi, Yian (July 8, 1997). "An Efficient Asymmetric Epoxidation Method". Journal of the American Chemical Society. 119 (46): 11224–11235. doi:10.1021/ja972272g.
- ^효율 촉매 비대칭 에폭시딩 방법 Zhi-Xian Wang, Yong Tu, Michael Frohn, Gian-Rong Zhang, Yian Si J. Am. 화학. Soc.197, 119(46), 11224-11235.(doi:10.1021/ja972272g)
- ^ Frohn, M.; Si, Y. 합성 2000, 14, 1979-2000 doi:10.1055/s-2000-8715.(검토)
- ^Tian, H.; She, X.; Shu, L.; Yu, H.; Si, Y. J. Am. 화학. Soc. 2000, 122, 11551-11552(doi:10.1021/ja003049d)
- ^Tian, H.; She, X.; 쉬, J.; Si, Y. Org. 2001년 3월 1929년-1931년.(doi:10.1021/ol010066e)
- Si Epoxidation https://www.organic-chemistry.org/namedreactions/shi-epoxidation.shtm
- 덴마크, 우 등"치랄, 촉매용 비마세성 다이옥시레인 개발, 알케네스의 항저항성 에폭시디화" (13, 1999년 4월) <https://www.thieme-connect.de/products/ejournals/pdf/10.1055/s-1999-3123.pdf>
- 프로언, 시, 투, 왕, 장 등「효율적인 비대칭 에폭시드법」(1997년 7월 8일) http://pubs.acs.org/doi/pdf/10.1021/ja972272g
- 시, 왕, 기타."A New Type of Ketone Catalyst for Nymmetric Epoxidation" (1997년 9월 12일)<http://pubs.acs.org/doi/pdf/10.1021/jo971701q>