양서류
Amphibian| 양서류 시간 범위:초기 석탄기 – 현재 Pre O N | |
|---|---|
 | |
| 오른쪽 위에서 시계 방향으로:시모우리아, 멕시코 굴속 케실리안, 동부 느타리, 잎청개구리 | |
| 과학적 분류 | |
| 왕국: | 애니멀리아 |
| 문: | 챠다타 |
| Clade: | 바트라코모르파스과 |
| 클래스: | 양서류 그레이 1825[2] |
| 서브클래스 | |
양서류는 양서류에 속하는 외온성 4족 척추동물이다.모든 살아있는 양서류는 진양서류에 속한다.그들은 다양한 서식지에서 서식하며, 대부분의 종은 육상, 수중, 수상 또는 민물 수생 생태계에 서식합니다.따라서 양서류는 일반적으로 물속에 사는 애벌레로 시작하지만, 일부 종은 이를 우회하기 위해 행동 적응을 발달시켰다.
어린 것들은 일반적으로 아가미를 가진 애벌레에서 폐와 함께 공기를 호흡하는 성체로 변모한다.양서류는 피부를 2차 호흡기 표면으로 사용하고 일부 작은 육생 도롱뇽과 개구리는 폐가 없어 피부에 전적으로 의존한다.그들은 표면적으로는 도마뱀과 같은 파충류와 비슷하지만, 포유류나 조류와 함께 파충류는 양수 동물이며 번식하는데 수체가 필요하지 않습니다.그들의 복잡한 생식 욕구와 투과성 피부로, 양서류는 종종 생태학적 지표가 된다; 최근 수십 년 동안 전 세계의 많은 종들의 양서류 개체 수가 극적으로 감소해왔다.
최초의 양서류는 데본기에 폐와 뼈가 있는 지느러미를 가진 육지 물고기로부터 진화했고, 건조한 땅에 적응하는데 도움이 되었다.그들은 다양해졌고 석탄기와 페름기에 지배적이 되었지만, 나중에 파충류와 다른 척추 동물들에 의해 대체되었다.약 2억 5천만 년 전 트라이아스기 초기에 처음 등장한 리삼피비아에 속하는 현생 양서류의 기원은 오랫동안 논란이 되어왔다.그러나 페름기의 [4]가장 다양한 선사시대 양서류 집단인 템노스폰딜에서 유래했을 가능성이 높다는 의견이 대두되고 있다.
현대 양서류의 세 목은 아누라(개구리), 우로델라(도롱뇽), 아포다(개구리)로 네 번째 집단인 알바네르페톤과(Albanerpetontidae)는 약 200만년 전에 멸종했다.알려진 양서류의 수는 약 8,000종이며, 그 중 거의 90%가 개구리이다.세계에서 가장 작은 양서류(및 척추동물)는 길이가 7.7mm(0.30인치)에 불과한 뉴기니(Paedophryne amauensis)의 개구리입니다.현존하는 양서류 중 가장 큰 것은 1.8m(5피트 11인치)의 남중국 거대 도롱뇽(안드리아스 슬리고이)이지만,[5] 이것은 마스토돈사우루스 같은 선사시대 분추류에 비해 길이가 최대 6m에 달할 정도로 작다.양서류에 대한 연구는 파충류와 양서류 둘 다에 대한 연구는 파충류학이라고 불린다.
분류
양서류라는 단어는 '두 종류의 생명체'를 뜻하는 고대 그리스어 μμββγο(암피오스), '두 종류의 생명체'를 뜻하는 μμα, 그리고 '생명'을 뜻하는 ββγογ에서 유래했다.이 용어는 처음에는 바다표범과 [6]수달을 포함하여 땅이나 물에서 살 수 있는 동물들을 가리키는 일반적인 형용사로 사용되었다.전통적으로 양막류는 양막이 아닌 모든 네발 척추동물을 포함한다.가장 넓은 의미의 양서류(sensu lato)는 세 개의 아강으로 나뉘었고, 그 중 두 개는 [7]멸종되었다.
- 아강 Lepospondyli ((리삼피비아보다 양막과 더 가까운 작은 고생대 그룹)
- 아강 템노스폰딜리(다양한 고생대 및 초기 중생대 등급)
- 리삼피비아아강(개구리, 두꺼비, 도롱뇽, 도롱뇽, 도롱뇽, 도롱뇽을 포함한 현대의 모든 양서류)

각 그룹의 실제 종의 수는 이어지는 분류학적 분류에 따라 달라집니다.가장 일반적인 두 가지 시스템은 Camphibian Web, 캘리포니아 대학교 버클리 웹사이트에서 채택한 분류와 파충류학자 대럴 프로스트와 미국 자연사 박물관의 분류로, 온라인 참조 데이터베이스인 "Amphibian Classion of the World"[9]로 이용 가능하다.상기에 언급된 종의 수는 프로스트에 이어 2019년 3월 31일 현재 알려진 양서류의 총 수는 정확히 [10]8,000종이며, 그 중 거의 90%가 [11]개구리이다.
계통발생학적 분류를 통해, 미로결핍증은 공유된 원시적 특징과는 별도로 고유한 정의적 특징이 없는 폴리파라필레틱 군이기 때문에 폐기되었다.분류는 저자가 선호하는 계통발생학 및 이들이 줄기 기반 분류를 사용하는지 노드 기반 분류를 사용하는지에 따라 달라집니다.전통적으로, 양서류는 유충 단계를 가진 모든 네발동물로 정의되는 반면, 살아있는 모든 양서류(개구리, 도롱뇽, 그리고 그 후손들)의 공통 조상을 포함하는 집단은 리삼피비아라고 불린다.고생대 양서류의 계통 발생은 불확실하며, 진양서류는 Temnospondyli (전통적으로 미로아강에 위치하는) 또는 Lepospondyli와 같은 멸종된 그룹에 속할 수 있으며, 일부 분석에서는 양서류에도 속할 수 있다.이는 계통발생학적 명명법의 지지자들이 이전에 린네 분류학의 양서류에 속했던 많은 기초 데본기와 석탄기 양서류 유형의 4족류 그룹을 제거하고 분지 [2]분류법에 따라 다른 곳에 포함시켰다는 것을 의미한다.만약 양서류와 양수류의 공통 조상이 양서류에 포함된다면, 그것은 측문군이 [12]된다.
현대의 모든 양서류는 보통 공통의 조상으로부터 진화한 종군인 분지류로 여겨지는 리삼피비아 아강에 포함된다.현대의 세 가지 목은 아누라(개구리), 카우다타(또는 도롱뇽 우로델라), 그리고 나체피오나(또는 아포다, 카에시아)[13]입니다.도롱뇽은 템노스폰딜과 비슷한 조상과는 별개로 생겨났으며, 심지어 케실리안도 진보한 파충류 양서류의 자매 집단이며, 따라서 양막류의 [14]자매 집단이라는 주장이 제기되었다.비록 원시적인 특징을 가진 몇몇 오래된 원생 개구리의 화석이 알려져 있지만, 가장 오래된 "진짜 개구리"는 애리조나 주 쥐라기 초기 카옌타 층의 프로살리러스 비티스입니다.그것은 해부학적으로 현대의 [15]개구리와 매우 유사하다.가장 오래된 것으로 알려진 케실리언은 또 다른 쥐라기 초기 종인 에오케실리아 마이크로오디아로,[16] 역시 애리조나에서 왔다.최초의 도롱뇽은 중국 [17]북동부 쥐라기 후기의 베이야네르페톤 지안핑엔시스입니다.
당국은 돌기가 아누라목(Anura)을 포함하는 초목인지, 돌기목(Anura)의 아목인지에 대해 의견이 엇갈리고 있다.리삼피비아목은 전통적으로 세 개의 목으로 나뉘지만, 멸종한 도롱뇽과 비슷한 과인 알바네르페톤과(Albanerpetontidae)는 이제 돌기목과 함께 리삼피비아목의 일부로 여겨진다.게다가, 돌기아목은 최근 3개 목과 더불어 트라이아스기 원생 개구리인 트라이아도바트라쿠스를 [18]포함하고 있다.
진화사
최초의 양서류 그룹은 약 3억 7천만 년 전 데본기에 현대의 실라칸스나 [19]폐어와 비슷한 잎 지느러미 물고기로부터 발전했습니다.이 고대 엽지느러미 물고기는 바다 밑바닥을 기어 다닐 수 있게 해주는 손가락이 달린 다관절 다리 같은 지느러미를 진화시켰다.몇몇 물고기들은 데본 늪의 정체된 웅덩이에서 산소가 부족할 때 공기를 마시도록 도와주는 원시적인 폐를 발달시켰다.그들은 또한 그들의 강한 지느러미를 물 밖으로, 그리고 필요하다면 마른 땅 위로 끌어올리기 위해 사용할 수 있었다.결국, 그들의 뼈 지느러미는 사지로 진화했고 그들은 현대의 양서류, 파충류, 조류, 그리고 포유류를 포함한 모든 네발동물의 조상이 되었다.육지에서 기어 다닐 수 있었음에도 불구하고, 이 선사시대 4족류 물고기들 중 많은 것들이 여전히 대부분의 시간을 물에서 보냈다.그들은 폐가 발달하기 시작했지만 여전히 [20]아가미로 숨을 쉬었다.
과도기적 특징을 보이는 종의 많은 예가 발견되었다.Ichthyostega는 콧구멍과 더 효율적인 폐를 가진 최초의 원시 양서류 중 하나였다.그것은 4개의 튼튼한 팔다리, 목, 지느러미가 달린 꼬리, 그리고 유스테놉테론과 [19]매우 유사한 두개골을 가지고 있었다.양서류는 물 밖에 더 오랫동안 머물 수 있도록 적응을 진화시켰다.그들의 폐는 개선되었고, 뼈는 더 무겁고 튼튼해졌고, 육지에서 그들의 몸의 무게를 더 잘 지탱할 수 있었다.그들은 다섯 [21]개 이상의 숫자를 가진 "손"과 "발"을 발달시켰다; 피부는 체액을 유지하고 [20]건조에 저항할 수 있게 되었다.아가미 뒤의 설골 부분에 있는 물고기의 설골 뼈는 크기가 줄어들었고 건조한 [22]땅에서 듣는 데 필요한 적응인 양서류 귀의 등뼈가 되었다.양서류와 텔레오스트 물고기 사이의 친화력은 이빨과 머리 뒤쪽에 있는 쌍으로 이루어진 상후두골의 다중 접힌 구조이며, 이러한 특징들은 동물의 [23]왕국에서는 찾아볼 수 없다.

데본기 말기(3억 6천만 년 전)에는 바다, 강, 호수가 생명체로 가득 차 있었고, 육지는 초기 식물의 영역이었고 [23]척추동물이 없는 상태였지만, Ichthyostega와 같은 일부는 때때로 물에서 스스로 건져냈을 수도 있다.코끼리 [21]물개가 사용하는 것과 비슷한 방식으로 뒷다리를 끌면서 앞다리로 스스로 움직였을 것으로 생각된다.초기 석탄기에 기후는 습하고 따뜻해졌다.이끼, 양치류, 말발톱, 재난으로 발전한 광대한 늪지.공기를 마시는 절지동물은 육식성 양서류에게 먹이를 제공하는 육식성 양서류에서 진화하여 육식성 양서류에게 육식성 양서류에게 먹이를 제공하게 되었다.이 땅에는 다른 네발동물이 없었고 양서류들은 먹이 사슬의 꼭대기에 있어 현재 악어가 가지고 있는 생태학적 위치를 차지하고 있었다.팔다리와 숨을 쉴 수 있는 능력을 갖추고 있었지만, 대부분은 여전히 가늘어지는 긴 몸과 강한 [23]꼬리를 가지고 있었다.그들은 육지 포식자로, 때로는 몸길이가 수 미터까지 이르기도 했고, 그 시대의 큰 곤충들과 물 속의 많은 종류의 물고기들을 잡아먹기도 했다.그들은 껍데기가 없는 알을 낳기 위해 여전히 물로 돌아갈 필요가 있었고, 심지어 대부분의 현대 양서류들은 물고기 조상들처럼 아가미를 가진 완전한 수중 유충 단계를 가지고 있다.발육 중인 배아가 마르는 것을 막고 파충류가 육지에서 번식할 수 있게 한 것은 양수란의 발달이었다.[19]
석탄기 열대우림의 붕괴 이후 양서류의 우위는 [24]파충류에게 넘어갔고, 양서류는 페름기-트리아스기 멸종 사건으로 [25]더욱 황폐해졌다.트라이아스기 (2억 5천만 년 전에서 2억 년 전) 동안, 파충류들은 양서류를 계속해서 앞지르며, 양서류의 크기와 생물권에서의 그들의 중요성을 감소시켰다.화석 기록에 따르면, 현대의 모든 양서류를 포함하며 유일하게 살아남은 혈통인 리삼피비아는 석탄기 후기와 트라이아스기 초기 사이에 멸종된 Temnospondyli와 Lepospondyli에서 갈라졌을 수 있다.화석 증거의 상대적 부족 때문에 정확한 [20]연대를 알 수 없지만, 다초점 배열에 기초한 가장 최근의 분자 연구는 현존하는 [26]양서류에게 석탄기 후기/페름기 초기 기원을 제시한다.

양서류의 세 가지 주요 집단 사이의 기원과 진화적 관계는 논쟁의 문제이다.rDNA 분석에 기초한 2005년 분자 계통학에서는 도롱뇽과 개코원숭이가 개구리보다 서로 더 밀접하게 관련되어 있다고 한다.또한 이 세 그룹의 분리는 고생대 또는 초기 중생대(약 2억 5천만 년 전)에서 일어났으며, 초대륙 판게아가 해체되기 이전과 곧 엽지느러미 물고기로부터 분리가 일어난 것으로 보인다.이 시기의 간결함과 방사선의 발생의 신속성은 원시 양서류 [27]화석이 상대적으로 부족한 이유를 설명하는데 도움이 될 것이다.화석 기록에는 큰 차이가 있는데, 2008년 텍사스에서 초기 페름기에 살았던 디소로포비아 분추인 제로바트라쿠스의 발견은 [14]현대 개구리의 특징 중 많은 부분과 잃어버린 연결고리를 제공했다.분자 분석에 따르면 개구리-샐러맨더 간 분산은 고생물학적 증거가 [14]나타내는 것보다 상당히 일찍 일어났다고 한다.한 연구는 모든 현생 양서류의 마지막 공통 조상이 약 3억 1천 5백만 년 전에 살았고 스테레오스폰딜 분추류는 케시안과 [28]가장 가까운 친척이라고 제안했다.하지만, 대부분의 연구는 디소로포비아 분추류에 [4]속하는 모든 현생 양서류의 단일 단통 기원을 뒷받침한다.
폐어로부터 진화하면서, 양서류는 새로운 이동 수단을 개발할 필요성을 포함하여 육지에서 살기 위해 특정한 적응을 해야 했다.물에서는 꼬리가 옆으로 밀리면서 앞으로 나아갔지만 육지에서는 상당히 다른 메커니즘이 필요했습니다.그들의 척추, 사지, 사지 대들, 그리고 근육 구조는 이동과 먹이를 위해 지상에서 끌어올릴 수 있을 만큼 튼튼해야 했다.육지 성인들은 그들의 측선 체계를 버리고 그들의 감각 체계를 공기를 매개로 자극을 받기 위해 적응시켰다.그들은 주위 온도 변화에 대처하기 위해 체온을 조절하는 새로운 방법을 개발할 필요가 있었다.그들은 지상 환경에서의 번식에 적합한 행동을 개발했다.그들의 피부는 이전에 물에 흡수되었던 해로운 자외선에 노출되었다.피부는 더 보호되고 과도한 수분 [29]손실을 막기 위해 변했습니다.
특성.
슈퍼클래스 네발동물은 네 개의 [30]다리를 가진 척추동물의 4개 클래스로 나뉜다.파충류, 조류, 포유류는 암컷에 의해 알을 낳거나 운반하는 양막류이며, 그 중 일부는 [31]불침투성인 여러 개의 막으로 둘러싸여 있다.일부 종은 취약한 수생 유충 [29]단계를 보호하거나 우회하는 다양한 전략을 개발했지만, 이러한 막이 없기 때문에 양서류는 번식을 위해 수체를 필요로 한다.그들은 맹그로브 [32]늪의 기수에서 사는 개구리 한두 마리를 제외하고는 바다에서 발견되지 않는다; 앤더슨 도롱뇽은 기수 또는 소금물 [33]호수에서 발견된다.육지에서 양서류는 피부를 [29]축축하게 유지해야 하기 때문에 습한 서식지에 제한된다.
현대 양서류는 소형화와 다른 척추동물에 [34][35]비해 성장과 발달 속도가 느린 유전체라는 두 가지 진화 추세에 의해 야기된 소아동물로 인해 그들의 조상들에 비해 간단한 구조를 가지고 있다.그들의 크기에 대한 또 다른 이유는 그들의 빠른 변성과 관련이 있는데, 이것은 진화의 조상들에서만 진화한 것으로 보인다; 다른 알려진 모든 계통에서 그 발달은 훨씬 더 점진적이었다.먹이를 주는 장치를 개조하는 것은 변성 중에 먹이를 먹지 않는다는 것을 의미하기 때문에 개체 크기가 작을수록 변성이 빨라야 하기 때문에 애벌레가 아직 작은 초기 단계에서 변성되지 않는다.[36]육지에 알을 낳는 양서류는 종종 알 안에서 모든 변형을 겪는다.무생물 육란은 확산 문제로 지름이 1cm 미만으로 부화 후 [37]성장량을 제한한다.
세계에서 가장 작은 양서류(및 척추동물)는 2012년에 처음 발견된 뉴기니(Paedophryne amauensis)의 마이크로에틸리드 개구리이다.그것은 평균 길이가 7.7mm이고 세계에서 가장 작은 개구리 [38]10종 중 4종을 포함하고 있는 속이다.현존하는 가장 큰 양서류는 1.8미터(5피트 11인치)의 중국 거대 도롱뇽(안드리아스 다비디아누스)[39]이지만,[40] 이것은 지금까지 존재했던 가장 큰 양서류인 브라질 페름 중부에서 2억 7천만 년 전에 멸종된 9미터(30피트)의 프리오노스폰딜보다 훨씬 더 작은 양서류이다.가장 큰 개구리는 아프리카 골리앗 개구리이며, 몸길이는 32cm이고 몸무게는 3kg입니다.[39]
양서류는 체온을 유지하지 않는 외온성(냉혈성) 척추동물이다.그들의 신진대사율은 낮고 그 결과, 그들의 음식과 에너지 요구량은 제한되어 있다.성체 상태에서는 눈꺼풀과 눈꺼풀이 움직이며, 대부분의 종은 공기나 지면의 진동을 감지할 수 있는 귀를 가지고 있다.그들은 근육질의 혀를 가지고 있으며, 많은 종에서 튀어나올 수 있다.현대의 양서류는 관절돌기가 있는 척추뼈가 완전히 골화되어 있다.그들의 갈비뼈는 대개 짧고 척추뼈와 결합되어 있을 수 있다.그들의 두개골은 대부분 넓고 짧으며 종종 불완전하게 골화된다.그들의 피부는 케라틴을 거의 포함하고 있지 않으며, 일부 케라틴의 물고기 같은 비늘을 제외하고는 비늘이 없다.피부는 많은 점액샘을 가지고 있고 어떤 종에서는 독샘을 가지고 있다.양서류의 심장은 3개의 방, 2개의 심방과 1개의 심실을 가지고 있다.방광이 있고 질소 폐기물은 주로 요소로 배출됩니다.대부분의 양서류는 물 속에 알을 낳고 수생 애벌레를 가지고 있으며, 수생 애벌레는 육생 성충이 된다.양서류는 펌프 작용을 통해 숨을 쉬는데, 공기가 콧구멍을 통해 먼저 구강 인두 영역으로 흡입됩니다.이것들은 닫히고 [41]목의 수축에 의해 공기가 폐로 들어가게 된다.그들은 [29]피부를 통한 가스 교환으로 이것을 보충한다.
아누라
아누라목(고대 그리스어로 "없음"을 뜻하는 a(n)와 "꼬리"를 뜻하는 ora)은 개구리와 두꺼비로 이루어져 있습니다.그들은 보통 아래쪽으로 접히는 긴 뒷다리, 짧은 앞다리, 발톱이 없는 물갈퀴가 있는 발가락, 꼬리도 없고 큰 눈, 그리고 선질의 촉촉한 [13]피부를 가지고 있다.매끄러운 피부를 가진 이 목의 일원들은 보통 개구리라고 불리는 반면 사마귀 같은 피부를 가진 일원들은 두꺼비라고 알려져 있다.그 차이는 분류학적으로 정식적인 것이 아니며 이 규칙에는 수많은 예외가 있다.두꺼비과의 일원들은 "진짜 두꺼비"[42]로 알려져 있다.개구리의 크기는 서아프리카의[43] 30cm(12인치) 골리앗 개구리부터 2012년 파푸아뉴기니에서 처음 기술된 7.7mm(0.30인치) 파에도프린 아마우엔시스까지 다양하며, 이 역시 가장 작은 척추동물이다.[44]대부분의 종이 물과 습한 서식지와 연관되어 있지만, 어떤 종은 나무나 사막에서 살도록 특화되어 있다.그들은 극지를 [45]제외한 전 세계에서 발견된다.
아누라는 과학계에서 널리 받아들여지고 있는 3개의 아목으로 나뉘지만, 일부 과의 관계는 아직 불분명하다.미래의 분자 연구는 그들의 진화 [46]관계에 대한 더 많은 통찰력을 제공할 것이다.시조개구리아목은 원시개구리과 4개 과를 포함하고 있다.이들은 아스카프과, 봄비나토루스과, 디스코글로스과, 라이오펠마티스과로, 파생된 특징이 거의 없고 다른 개구리 [47]계통과 관련하여 측문증일 수 있다.더 진화적으로 발전한 아목인 메소바트라키아목의 6개 과는 메고프리과, 펠로바티스과, 펠로디과, 스카피오포스과, 라이노프리니과와 의무수생피피피피과이다.이것들은 다른 2개의 서브오더 [47]사이의 중간적인 특성을 가지고 있습니다.네오바트라키아는 단연코 가장 큰 아목이며 가장 흔한 종을 포함한 현생 개구리의 나머지 과를 포함하고 있다.현존하는 5,000종 이상의 개구리 중 96%가 네오바트라키아이다.[48]
카우다타
카우다목(Caudata order)은 도롱뇽으로 이루어져 있는데, 도롱뇽은 모양이 도마뱀과 흡사하고 털이 낮은 동물이다.이것은 상징적 특성이고 그들은 [49]포유류와 마찬가지로 도마뱀과 밀접하게 관련되어 있지 않다.도롱뇽은 발톱이 없고, 비늘이 없는 피부, 매끄럽거나 결절로 덮여 있으며, 꼬리는 보통 좌우로 납작하고 지느러미가 많다.몸길이가 1.8미터(5피트 11인치)[50]까지 자라는 것으로 보고된 중국의 거대 도롱뇽(안드리아스 다비디아누스)부터 길이가 [51]20mm(0.8인치)를 거의 넘지 않는 멕시코산 작은 토리우스 판나툴루스까지 크기가 다양하다.도롱뇽은 북반구 전북극 지역의 대부분에서 볼 수 있는 로라시아 지역에 분포하고 있다.플레토돈과(Pethodontidae)는 중앙아메리카와 아마존 [45]분지 북쪽의 남미에서도 발견된다.남미 대륙은 약 [52]2300만년 전 마이오세가 시작될 무렵 중앙아메리카에서 침입한 것으로 보인다.우로델라는 현존하는 [53]도롱뇽의 모든 종에 사용되는 이름이다.몇몇 도롱뇽 과의 구성원들은 소아형상이 되어 그들의 변형을 완료하지 못하거나 [54]성충이 되었을 때 유충의 특징을 유지한다.대부분의 도롱뇽은 길이가 15cm 미만이다.그들은 육상 또는 수중 동물일 수 있으며, 많은 동물들이 1년 중 일부를 각 서식지에서 보낸다.육지에 있을 때, 그들은 주로 돌이나 통나무 아래 또는 울창한 초목 속에 숨어 지내며, 저녁과 밤에 지렁이, 곤충, 그리고 다른 무척추동물을 [45]찾아다니며 시간을 보낸다.
크립토브란초아목은 원시 도롱뇽을 포함하고 있다.많은 화석 분지류가 발견됐지만 현존하는 종은 중국 거대 도롱뇽(안드리아스 다비디아누스), 일본 거대 도롱뇽(안드리아스 자포닉스), 북미산 헬벤더(크립토브란쿠스 알레가니엔시스) 등 3종뿐이다.이 큰 양서류는 성충 상태에서도 여러 가지 애벌레 특성을 가지고 있다; 아가미 틈이 있고 눈은 벗겨져 있다.독특한 특징은 그들의 아래턱의 왼쪽이나 [55]오른쪽을 누르면서 흡인하여 먹이를 주는 능력이다.수컷들은 둥지를 파서 암컷들에게 그들의 알을 낳도록 설득하고 보호한다.폐로 숨을 쉴 뿐만 아니라, 그들은 [56]표면에 모세혈관이 있는 얇은 피부의 여러 주름으로 호흡합니다.
살라만드로아목은 발달된 도롱뇽을 포함하고 있다.이들은 아래턱에 관절 전골 융해와 내부 수정에 의해 크립토브랜치드와 다르다.도롱뇽류에서 수컷은 정자 다발인 정자를 퇴적시키고 암컷은 정자를 집어서 정자가 저장되는 자신의 정자에 알을 [57]낳을 때까지 집어넣는다.도롱뇽과의 가장 큰 과는 폐가 없는 도롱뇽으로 전체 도롱뇽 종의 60%를 포함하고 있다.도롱뇽과에는 진짜 도롱뇽이 포함되며, "뉴트"라는 이름은 도롱뇽 아과의 [13]일원에 붙여졌다.
세 번째 아목인 사이렌아목은 사이렌과의 한 과에 속하는 4종의 사이렌을 포함하고 있다.뱀장어목은 앞다리가 많이 줄어들고 뒷다리가 없는 뱀장어 같은 수생도롱뇽이다.그들의 특징 중 일부는 원시적인 반면 다른 것들은 [58]파생된 것이다.수컷 도롱뇽이 정자세포를 생성하기 위해 사용하는 쇄토샘이 부족하고 암컷은 정자 저장을 위한 정자세포가 부족하기 때문에 수정은 외부적일 수 있다.그럼에도 불구하고 알은 한 개만 낳아 외부 [57]수정에 도움이 되지 않는 행동이다.
나체비오나

나체피오나 목은 "벌거벗은"을 뜻하는 그리스 나체목과 "서비스된"을 뜻하는 오피스에서 유래했다.이것은 뱀이나 벌레와 같은 형태를 가진 긴 원통형의 팔다리가 없는 동물입니다.성충은 길이가 8~75cm(3~30인치)로 다양하지만, 150cm(4.9피트)에 달할 수 있는 톰슨 케이실리아 톰슨(Caecilia thompsoni)은 예외입니다.고래의 피부는 많은 수의 가로주름을 가지고 있고 어떤 종에서는 작은 피부 비늘이 내장되어 있다.그것은 피부로 덮인 기본적인 눈을 가지고 있는데, 이것은 아마도 빛의 강도의 차이를 구별하는 것으로 제한될 것이다.또한 눈 근처에 촉각과 후각 기능을 가진 한 쌍의 짧은 촉수를 가지고 있다.대부분의 케시안은 습한 토양, 썩은 나무, 식물 잔해 아래 굴 속 지하에서 살지만 일부는 [59]수생이다.대부분의 종은 땅속에 알을 낳고 유충이 부화하면 인접한 수역으로 이동한다.다른 것들은 알을 낳고 애벌레는 알이 부화하기 전에 변형을 겪는다.몇몇 종들은 [60]난소에 있는 동안 선 분비물로 영양분을 공급하면서 새끼를 낳는다.아프리카, 아시아, 중남미의 [61]열대지방에 서식하고 있는 곤드와나족에 주로 분포한다.
해부학과 생리학
피부.
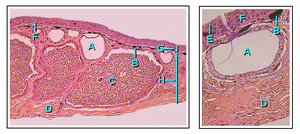
피막 구조는 뇌하수체와 갑상선에 의해 제어되는 탈피 과정을 통해 주기적으로 갱신되는 고도로 옥수수화된 외부 층의 존재와 같은 육생 척추 동물에게 공통적인 몇 가지 전형적인 특징을 포함한다.두꺼비에서 볼 수 있는 것과 같이 국소 증점(종종 사마귀라고 함)이 일반적입니다.피부의 바깥쪽은 포유류나 조류와 달리 대부분 한 조각으로 주기적으로 벗겨진다.양서류는 종종 거친 [45]피부를 먹는다.양서류는 피부 고랑 사이의 진피 속에 미네랄화된 피부 비늘이 박혀 있는 점에서 양서류들 사이에서 독특하다.이것들은 가시가 많은 물고기의 비늘과 유사성은 대부분 표면적이다.도마뱀과 몇몇 개구리는 진피에서 뼈 퇴적물을 형성하는 다소 유사한 골엽을 가지고 있지만, 이것은 다양한 척추동물의 [62]계통에서 독립적으로 유사한 구조를 가진 수렴 진화의 한 예이다.
양서류의 피부는 물에 침투한다.가스 교환은 피부를 통해 일어날 수 있고, 이것은 성인 양서류가 수면 위로 떠오르지 않고 숨을 쉴 수 있게 하고 [45]연못 바닥에서 동면할 수 있게 해줍니다.얇고 섬세한 피부를 보완하기 위해 양서류는 주로 머리, 등, 꼬리에 점액선을 발달시켰다.이러한 분비물은 피부를 촉촉하게 유지하는데 도움을 줍니다.게다가, 대부분의 양서류 종들은 불쾌하거나 독성이 있는 물질을 분비하는 입상샘을 가지고 있다.어떤 양서류 독소들은 인간에게 치명적일 수 있는 반면 다른 것들은 거의 [63]효과가 없다.독을 만드는 주요 분비샘인 파로토이드는 신경독소인 부포톡신을 생성하며 두꺼비 귀 뒤, 개구리 등, 도롱뇽 눈 뒤, 그리고 케키아의 [64]윗면에 위치하고 있습니다.
양서류의 피부색은 색소 세포라고 불리는 세 층의 색소 세포에 의해 만들어집니다.이 세 개의 세포 층은 흑색세포(가장 깊은 층을 차지하고 있는 층), 구아노포(중간 층을 형성하고 많은 과립을 포함하며 청록색을 생성함), 그리고 리포포(노란색, 가장 표면적인 층)로 구성됩니다.많은 종에 의해 나타나는 색의 변화는 뇌하수체에서 분비되는 호르몬에 의해 시작된다.경골어류와는 달리, 신경계에 의한 색소세포의 직접적인 조절은 없으며, 이것은 물고기에서 일어나는 것보다 더 느리게 색의 변화가 일어나는 결과를 낳는다.생생한 색상의 피부는 보통 그 종이 독성이 있다는 것을 나타내며 [65]포식자들에게 경고의 표시이다.
골격계 및 이동
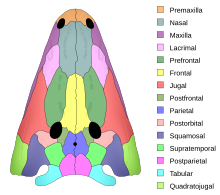
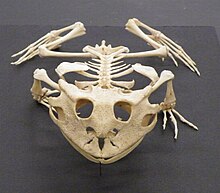
양서류는 구조적으로 다른 네발동물과 상동하는 골격계를 가지고 있지만, 여러 가지 변이가 있다.다리가 없는 카에실리안과 사지가 줄어들거나 없는 몇몇 도롱뇽 종을 제외하고는 모두 네 개의 사지를 가지고 있다.뼈는 속이 비어 있고 가볍습니다.근골격계는 머리와 몸을 지탱할 수 있도록 튼튼하다.뼈는 완전히 골화되고 척추는 겹치는 과정을 통해 서로 맞물린다.가슴 대들보는 근육으로 지지되고 잘 발달된 골반 대들보는 한 쌍의 천골 늑골에 의해 등뼈에 부착된다.장골은 앞으로 기울어져 있고 몸은 [66]포유동물보다 땅에 더 가까이 붙어 있다.
대부분의 양서류에서, 앞발에 4개의 손가락과 뒷발에 5개의 손가락이 있지만, 어느 쪽에도 발톱이 없다.일부 도롱뇽은 손가락이 적고 암피움아는 작고 뭉툭한 다리를 가진 뱀장어처럼 생겼다.사이렌은 물도롱뇽으로 앞다리가 뭉툭하고 뒷다리가 없다.케시안은 사지가 없다.그들은 지렁이처럼 몸을 따라 움직이는 근육 수축 구역을 가지고 굴을 판다.지표면이나 물속에서 그들은 몸을 [67]좌우로 흔들면서 움직인다.
개구리에서 뒷다리는 앞다리보다 크며, 특히 주로 점프나 수영으로 움직이는 종에서 그렇습니다.보행자와 달리기 선수들에게 뒷다리는 크지 않고 굴을 파는 사람들은 대부분 짧은 다리와 넓은 몸을 가지고 있다.발은 수영하기 위한 발가락 사이의 물갈퀴, 기어오르기 위한 넓은 접착성 발가락 패드, 그리고 땅을 파기 위해 뒷발의 각질화된 결절과 같은 생활 방식에 적응하고 있습니다.대부분의 도롱뇽은 팔다리가 짧고 길이가 비슷하며 몸으로부터 직각으로 돌출되어 있다.육지에서의 이동은 걷기에 의한 것이고 꼬리는 종종 좌우로 흔들리거나, 특히 클라이밍할 때 버팀목으로 사용됩니다.보통 걸음걸이에서는 한 번에 한 발만 그들의 조상인 지느러미 [66]물고기들이 채택한 방식으로 전진한다.아네이데스속 일부 도롱뇽과 일부 다치류는 나무에 올라가고 긴 팔다리와 큰 발톱, 그리고 손에 잡힐 수 있는 [57]꼬리를 가지고 있다.수생도롱뇽과 개구리 올챙이에서 꼬리는 등지느러미와 복지느러미를 가지고 있으며 추진 수단으로 좌우로 움직인다.다 자란 개구리는 꼬리가 없고, 고양이들은 아주 짧은 꼬리만 [67]가지고 있습니다.

도롱뇽은 꼬리를 방어하기 위해 사용하며 일부는 자기 절개라고 알려진 과정에서 그들의 목숨을 구하기 위해 꼬리를 버릴 준비를 하고 있다.쐐기풀과의 특정 종들은 꼬리 밑부분에 약한 영역을 가지고 있어 이 전략을 쉽게 사용한다.꼬리는 종종 분리된 후에도 계속 경련을 일으키는데, 이것은 공격자의 주의를 분산시키고 도롱뇽이 도망치게 할 수 있다.꼬리와 사지는 모두 [68]재생이 가능합니다.다 자란 개구리는 사지를 다시 자라게 할 수 없지만 올챙이는 [67]그렇게 할 수 있다.
순환계
양서류는 청소년기와 성인기를 가지며, 두 동물의 순환계는 구별된다.어린(또는 올챙이) 단계에서, 순환은 물고기의 순환과 유사하다; 두 개의 방이 있는 심장은 산소가 공급되는 아가미를 통해 혈액을 펌프질하고, 몸 주변으로 퍼지고, 하나의 고리로 심장으로 돌아간다.성숙한 단계에서 양서류(특히 개구리)는 아가미를 잃고 폐를 발달시킨다.그들은 하나의 심실과 두 개의 심방으로 구성된 심장을 가지고 있다.심실이 수축하기 시작하면 탈산소 혈액이 폐동맥을 통해 폐로 보내진다.그리고 나서 지속적인 수축은 산소가 들어간 혈액을 몸의 다른 부분들에 펌프질한다.두 혈류의 혼합은 [69]챔버의 구조에 의해 최소화됩니다.
신경계 및 감각계
신경계는 기본적으로 다른 척추동물과 동일하며, 몸 전체에 중추 뇌, 척수, 신경이 있다.양서류의 뇌는 비교적 단순하지만 파충류, 조류, 포유류와 구조적으로 대체로 같다.그들의 뇌는 긴 몸으로 되어 있고, 족제비에게 기대되며,[70] 트레트라포드의 일반적인 운동과 감각 영역을 포함하고 있습니다.인간의 수면 패턴을 조절하는 것으로 알려진 송과체는 양서류에서 [71]동면과 미각에 관여하는 호르몬을 생성하는 것으로 생각됩니다.
올챙이는 조상 물고기의 가로줄 체계를 유지하지만, 이것은 육생 양서류에서는 사라집니다.일부 케시안은 물에 잠겼을 때 주변의 물체를 찾을 수 있는 전기 수용체를 가지고 있다.개구리는 귀가 잘 발달되어 있다.외이는 없지만, 큰 고막이 눈 바로 뒤에 있는 머리 표면에 있습니다.이것은 진동하고 소리는 하나의 뼈인 등골을 통해 내이로 전달됩니다.이렇게 하면 짝짓기 소리와 같은 고주파 소리만 들리지만 저주파 소음은 다른 메커니즘을 [66]통해 감지할 수 있다.내이에는 유두 양서류라고 불리는 특수한 모세포가 있어 더 깊은 소리를 감지할 수 있다.개구리와 도롱뇽에게 독특한 또 다른 특징은 청각 캡슐에 인접한 대기와 지진 [72]신호의 전달에 관여하는 뇌막-오퍼큘럼 복합체이다.도롱뇽과 케실리안의 귀는 개구리의 귀보다 발달이 덜 되어 있는데,[73] 이는 보통 소리를 매개로 서로 의사소통을 하지 않기 때문이다.
올챙이의 눈은 눈꺼풀이 없지만, 변성 시 각막이 더 돔 모양이 되고 수정체가 편평해지고 눈꺼풀과 연관된 분비샘과 [66]도관이 발달합니다.성인의 눈은 무척추동물의 눈을 개선한 것으로 척추동물의 눈이 발달하는 첫 단계였다.색각과 초점 깊이를 실현합니다.망막에는 다양한 파장에 수용되는 녹색 [73]막대가 있습니다.
소화 및 배설계통
많은 양서류들은 끈적끈적한 끝이 있는 길쭉한 혀를 튕겨내고 턱으로 물건을 잡기 전에 다시 입으로 끌어당김으로써 먹이를 잡는다.어떤 사람들은 먹이를 삼키기 위해 관성 먹이를 사용하며, 반복적으로 먹이를 앞쪽으로 날카롭게 내밀어 관성에 의해 입안에서 음식이 뒤로 움직이게 합니다.대부분의 양서류는 먹이를 많이 씹지 않고 통째로 삼키기 때문에 그들은 풍만한 위장을 가지고 있다.짧은 외식도에는 음식물을 위장으로 이동시키는 섬모와 입 속 분비선에서 생성되는 점액과 인두의 통행을 용이하게 하는 점액이 줄지어 있다.위에서 생성되는 키티나아제는 절지동물 [74]먹잇감의 키틴 큐티클의 소화를 돕는다.
양서류는 췌장, 간, 담낭을 가지고 있다.간은 보통 두 개의 잎으로 커요.이것의 크기는 글리코겐과 지방 저장 단위로서의 기능에 따라 결정되며, 이러한 저장량이 쌓이거나 소진됨에 따라 계절에 따라 달라질 수 있습니다.지방 조직은 에너지를 저장하는 또 다른 중요한 수단이고 이것은 복부, 피부 아래 그리고 일부 도롱뇽의 [75]꼬리에 발생합니다.
두 개의 신장이 등뒤로, 체강 지붕 근처에 위치해 있습니다.그들의 일은 신진대사 노폐물의 혈액을 여과하고 소변을 요관을 통해 방광으로 운반하는 것인데, 방광은 방광 통풍구를 통해 주기적으로 배출되기 전에 요관을 통해 소변이 저장된다.유충과 대부분의 수생 양서류는 많은 양의 희석된 소변에서 질소를 암모니아로 배출하는 반면, 육생 종은 물을 보존해야 하는 필요성이 더 큰 만큼 덜 독성이 있는 생성물 요소를 배출한다.물에 대한 접근이 제한된 일부 나무 개구리는 대사 폐기물의 대부분을 요산으로 [76]배출합니다.
호흡계

양서류의 폐는 양막의 폐에 비해 원시적이며, 내부 중격과 큰 폐포를 가지고 있으며, 결과적으로 혈액으로 들어가는 산소의 확산 속도가 비교적 느리다.통풍은 [77]볼 펌핑에 의해 이루어집니다.그러나 대부분의 양서류는 그들의 피부를 통해 물이나 공기와 가스를 교환할 수 있다.충분한 피부 호흡이 가능하려면 혈관이 높은 피부 표면을 촉촉하게 유지하여 산소가 충분히 높은 [74]속도로 확산되도록 해야 합니다.물의 산소 농도가 낮은 온도와 높은 유속 모두에서 증가하기 때문에, 이러한 상황에 있는 수생 양서류는 티티카카 물개구리와 헬벤더 도롱뇽처럼 주로 피부 호흡에 의존할 수 있습니다.산소가 더 집중된 공기 중에서, 몇몇 작은 종들은 피부 가스 교환에만 의존할 수 있는데, 가장 유명한 것은 폐도 아가미도 없는 다치류 도롱뇽이다.많은 도롱뇽과 올챙이들은 애벌레 단계에서 아가미를 가지고 있으며,[74] 일부 (악솔로틀 같은)는 아가미를 가지고 있다.
재생산
육지에 알을 낳고 습기를 유지하는 다양한 방법을 개발했지만 대부분의 양서류는 번식을 위해 민물을 필요로 한다.일부(예: Fejervarya raja)는 기수가 많은 물에서 서식할 수 있지만, 진정한 해양 [78]양서류는 없습니다.그러나 특정 양서류 개체군이 예기치 않게 바닷물을 침범했다는 보고가 있다.2010년에 [79]보고된 자연 잡종 Pelophylax esculentus의 흑해 침공이 그런 경우였다.
그러나 적응 방사선에 노출되는 수백 종의 개구리(예: Eleuthero dactylus, Pacific Platimantis, Australo-Papuan Microylids 및 많은 다른 열대 개구리)는 야생에서 번식하기 위해 물이 필요하지 않습니다.그들은 직접 개발을 통해 번식하는데, 생태학적, 진화적 적응을 통해 자유수로부터 완전히 독립할 수 있게 되었다.이 개구리들 대부분은 습한 열대 우림에서 살고 그들의 알은 알 속의 올챙이 단계를 거쳐 성충의 축소판으로 바로 부화한다.많은 양서류들의 번식 성공은 강우량뿐만 아니라 계절적 [80]시기에 달려있다.
열대 지방에서는 많은 양서류들이 1년 중 언제든지 또는 지속적으로 번식한다.온대 지방에서는 주로 봄철에 번식하며, 낮의 길이 증가, 기온 상승 또는 강우로 인해 번식이 시작된다.실험은 기온의 중요성을 보여주었지만, 특히 건조한 지역에서 촉발되는 사건은 종종 폭풍이다.아누란에서 수컷은 보통 암컷보다 먼저 번식지에 도착하고, 그들이 만들어내는 성악은 암컷의 배란과 아직 생식 [81]활동을 하지 않은 수컷의 내분비 활동을 자극할 수 있다.
caecilians에서, 수정은 내적이고, 수컷은 내적 기관을 압출하고,팔로데움, 그리고 그것을 암컷 클로아카에 삽입한다.수컷 클로아카 안에 있는 쌍으로 이루어진 뮐러샘은 포유류의 전립선에 의해 생성된 것과 비슷한 액체를 분비하며 정자를 운반하고 영양을 공급합니다.수정은 아마 [82]난소에서 이루어질 것이다.
도롱뇽의 대부분은 또한 체내 수정에 관여한다.대부분의 경우 수컷은 젤라틴 모양의 원뿔 위에 정자의 작은 덩어리인 정자 포자를 땅 위나 물 위에 퇴적시킨다.암컷은 정자 덩어리를 클로아카의 입술로 잡고 통풍구로 밀어 넣음으로써 집는다.정자는 정자낭의 지붕에 있는 정자낭으로 이동하며, 몇 달 후에 배란할 때까지 남아 있다.구애 의식과 정자세포의 이동 방법은 종마다 다르다.어떤 경우에는 정조세포가 암컷 클로아카에 직접 배치될 수 있는 반면, 다른 경우에는 암컷이 정조세포로 유도되거나 앰플렉서스라고 불리는 포옹으로 억제될 수 있습니다.흰도롱뇽과, 흰도롱뇽과, 크립토브란치과의 일부 원시 도롱뇽은 개구리와 비슷한 방식으로 외부 수정을 행하는데, 암컷은 물에 알을 낳고 수컷은 알 [82]덩어리에 정자를 방출한다.
몇 가지 예외를 제외하고 개구리는 외부 수정을 사용한다.수컷은 팔 뒤나 뒷다리 앞, 또는 에피페도바테스 삼색기의 경우 목 둘레에서 앞다리로 암컷을 꽉 움켜잡습니다.그들은 암컷이 알을 낳고 수컷이 정자로 알을 덮는 동안 클로아카에 가까이 위치한 상태로 앰플렉서스에 남아 있다.남성의 손에 거칠어진 결혼용 패드가 그립 유지에 도움이 됩니다.종종 수컷은 뒷발로 일종의 바구니를 형성하면서 달걀 덩어리를 모아 보관한다.수컷과 암컷이 서로 반대 방향을 바라보면서 클로아카에 가까운 곳에 배치한 뒤 알과 정자를 동시에 방출하는 입상 독개구리(Oophaga granulifera)는 예외다.꼬리개구리(Ascaphus truei)는 체내 수정을 나타낸다."꼬리"는 수컷만 가지고 있으며, 클로아카의 연장선이며 암컷을 수정하는 데 사용됩니다.이 개구리는 빠르게 흐르는 개울에 살고 내부 수정은 수정이 [83]일어나기 전에 정자가 씻겨나가는 것을 막는다.정자는 다음 [84]봄까지 배관에 부착된 저장관에 보관될 수 있다.
대부분의 개구리는 장기 사육종 또는 폭발성 사육종으로 분류될 수 있다.일반적으로 장기 사육자들은 번식지에 모여 수컷들이 먼저 도착해 지역을 형성한다.다른 위성 남성들은 영토를 차지할 기회를 기다리며 조용히 근처에 남아 있다.암컷은 산발적으로 도착하며 짝짓기를 하고 알을 낳는다.암컷이 떠나고 영역이 바뀔 수 있습니다.더 많은 암컷들이 나타나며, 시간이 지나면 번식기가 끝나게 된다.반면 폭약 증식기는 비가 온 후 건조한 지역에 임시 웅덩이가 나타나는 곳에서 발견됩니다.이 개구리들은 전형적으로 폭우 후에 나타나 번식지에 모이는 움푹 패인 종이다.그들은 적절한 장소, 아마도 장마철마다 같은 장소에 형성되는 수영장을 찾는 첫 번째 수컷의 부름에 이끌린다.모인 개구리들은 일제히 울부짖을 수 있고, 수컷들은 보통 [83]적은 수의 암컷들과 앞다퉈 짝짓기를 하는 광란의 활동이 뒤따른다.
도롱뇽과 도롱뇽을 입은 암컷들의 관심을 끌기 위한 수컷들 간의 직접적인 경쟁이 있고, 암컷들이 [85]짝짓기를 할 수 있도록 관심을 오래 끌기 위한 정교한 구애 전시가 있다.어떤 종들은 긴 번식기를 통해 정자를 저장하는데, 이는 여분의 시간이 경쟁 [86]정자와의 상호작용을 허용할 수 있기 때문이다.
대부분의 양서류들은 출생 후 상당한 형태학적 변화 과정인 변성 과정을 거친다.전형적인 양서류 발달에서 알은 물에 낳고 애벌레는 수중 생활에 적응한다.개구리, 두꺼비, 도롱뇽은 모두 알에서 외부 아가미를 가진 유충으로 부화한다.양서류에서의 변성은 변성을 자극하는 혈중 티록신 농도와 티록신 효과를 상쇄하는 프로락틴에 의해 조절된다.특정 이벤트는 다른 [87]조직의 임계값에 따라 달라집니다.태아의 발육은 대부분 부모의 신체 밖에 있기 때문에 특정 환경적 상황으로 인해 많은 적응을 하게 된다.이러한 이유로 올챙이는 이빨, 수염 같은 피부 연장이나 지느러미 대신 각질성 능선을 가질 수 있다.그들은 또한 물고기와 비슷한 감각적인 외측선 기관을 이용한다.변성 후, 이 장기들은 중복되어 세포사멸이라고 불리는 조절된 세포사멸에 의해 재흡수될 것이다.양서류들 사이에서 특정 환경 환경에 대한 적응의 다양성은 광범위하며, 아직도 많은 발견들이 이루어지고 [88]있다.
계란
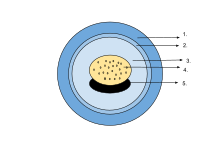
- 젤리 캡슐
- 비텔린막
- 페리비텔린액
- 노른자 플러그
- 배아
배아는 주비텔린액에 현탁되어 있으며, 반투과성 젤라틴 캡슐로 둘러싸여 있으며, 노른자 덩어리는 영양분을 제공한다.유충이 부화하면,[73] 주둥이의 끝부분의 샘에서 분비되는 효소에 의해 모세혈관이 용해된다.일부 도롱뇽과 개구리의 알에는 단세포 녹조가 들어 있습니다.이것들은 알을 낳은 후에 젤리 외피를 뚫고 들어가 광합성을 통해 태아에 대한 산소 공급을 증가시킬 수 있다.둘 다 유충의 발육을 가속화하고 [89]사망률을 낮추는 것으로 보입니다.나무개구리(라나 실바티카)는 구상란 군락 내부가 주변보다 최대 6°C(11°F) 더 따뜻한 것으로 밝혀져 시원한 북부 [90]서식지의 장점이다.
알은 한 개, 군집 또는 긴 가닥으로 퇴적될 수 있다.알을 낳는 장소에는 물, 진흙, 굴, 잔해, 식물 위나 통나무 밑이나 [91]돌 등이 포함된다.온실 개구리(Eleuthero dactylus planirostris)는 땅 속에서 작은 무리를 지어 알을 낳으며, 약 2주 후에 유충 단계 없이 [92]어린 개구리로 직접 성장한다.툰가라 개구리(Physalaemus pustulosus)는 알을 보호하기 위해 거품으로부터 둥지를 튼다.먼저 뗏목을 만들고, 그 다음에 중앙에 알을 낳고, 마지막으로 폼 캡을 씌웁니다.이 폼은 항균성을 가지고 있습니다.그것은 세제를 포함하지 않고 [93][94]암컷이 분비하는 단백질과 렉틴을 첨가하여 만들어집니다.
유충

양서류의 알은 일반적으로 물에 낳고 자유롭게 사는 유충으로 부화하며, 유충은 물에서 발육을 완료하고 나중에 수생 또는 육생 성체로 변한다.많은 종의 개구리와 대부분의 폐가 없는 도롱뇽(Plethodontidae)에서는 직접적인 발육이 이루어지며, 애벌레는 알 안에서 자라고 작은 성체로 성장한다.많은 고양이과 동물들과 다른 양서류들은 땅 위에 알을 낳고, 새로 부화한 유충들은 꿈틀거리거나 수역으로 옮겨진다.일부 고양이과 동물, 고산도롱뇽(살라만드라 아트라), 아프리카산 살아있는 두꺼비(넥토프리노이데스)는 태생동물이다.그들의 애벌레는 분비물을 먹고 암컷의 난관 안에서, 종종 오랜 기간 동안 자란다.나는 그 문제에 대해 잘 알고 있다.알은 부모의 몸 안이나 위에 유지되지만, 애벌레는 알의 노른자를 먹고 살며 성체로부터 영양분을 받지 않습니다.유충은 [95]종에 따라 변성 전이나 후에 다양한 성장 단계에서 나타납니다.두꺼비속인 Nectophrynoides는 12여 [11]종 중에서 이러한 모든 발달 패턴을 보인다.양서류 애벌레는 올챙이로 알려져 있다.그들은 강하고 근육질의 꼬리와 [76]함께 두껍고 둥근 몸을 가지고 있습니다.
개구리
다른 양서류들과 달리 개구리 올챙이는 [96]성인과 닮지 않았다.자유생활을 하는 애벌레는 보통 완전한 수생이지만, 일부 종(예를 들어 난노프리 실로넨시스)의 올챙이는 반지상성으로 [97]습한 바위 틈에 살고 있습니다.올챙이는 연골 골격, 호흡을 위한 아가미(처음에는 외부 아가미, 나중에는 내부 아가미), 수영할 [98]때 사용하는 가로줄 체계와 큰 꼬리를 가지고 있습니다.갓 부화한 올챙이들은 곧 아가미를 덮는 아가미 주머니가 생깁니다.폐는 일찍 발달하여 보조 호흡 기관으로 사용되며, 올챙이는 공기를 삼키기 위해 수면으로 올라갑니다.어떤 종들은 알 안에서 발육을 완료하고 작은 개구리로 직접 부화한다.이 유충들은 아가미를 가지고 있지 않지만 대신 호흡이 이루어지는 특수한 피부 영역을 가지고 있습니다.올챙이는 진정한 이빨을 가지고 있지 않지만, 대부분의 종에서, 턱은 각질 부리로 [99]둘러싸인 케라돈트라고 불리는 길고 평행한 각질화된 구조를 가지고 있습니다.아가미 주머니 아래에 앞다리가 생기고 며칠 후 뒷다리가 보인다.
요오드는, T4(에 대한 유생은 아가미, 꼬리와 지느러미 내장의 세포들의 극적인 세포[예정 세포사]를 자극)또한 신경 체계의 진화 사냥을 위해 더 나은 신경, 후각 및 인지적 시공간적 능력을 가진 지상파, 육식성 개구리로 수생면 실지로 채식 주의자 올챙이를 변화시키고 자극한다.[100][101]
사실, 연못과 개울에서 자라는 올챙이는 전형적으로 초식동물이다.연못 올챙이는 깊은 몸, 큰 꼬리지느러미, 작은 입을 가지고 있는 경향이 있다; 그들은 자라고 있거나 느슨한 식물의 파편을 먹고 조용한 물에서 헤엄친다.하천에 사는 사람들은 대부분 큰 입, 얕은 몸, 꼬리 지느러미를 가지고 있다; 그들은 식물과 돌에 달라붙어 조류와 박테리아 [102]표면막을 먹고 산다.그들은 또한 아가미를 통해 물에서 걸러진 규조류를 먹고 연못 바닥의 침전물을 휘저으며 먹을 수 있는 조각들을 섭취한다.그들은 비교적 길고 나선형의 내장을 가지고 있어서 이 음식을 [102]소화시킬 수 있다.어떤 종들은 올챙이 단계에서 육식성으로 곤충, 작은 올챙이, 물고기를 먹는다.쿠바산 청개구리(Osteopilus Septentrionalis)의 어린 올챙이들은 때때로 식인종일 수 있으며,[103] 어린 올챙이는 변신을 할 때 더 크고 발달된 올챙이를 공격한다.
변태 시, 개구리의 생활습관이 완전히 바뀌면서 신체에 급격한 변화가 일어난다.각질치대가 있는 나선형의 입을 나선형의 내장과 함께 재흡수한다.이 동물은 큰 턱을 발달시키고 아가미 주머니와 함께 아가미가 사라집니다.눈과 다리는 빨리 자라며 혀가 형성된다.입체시력 발달과 횡선 시스템의 상실과 같은 신경망에 관련된 변화가 있다.이 모든 것은 하루에 일어날 수 있다.며칠 후, 꼬리는 재흡수되는데,[102] 이는 티록신 농도가 더 높기 때문입니다.
도롱뇽류
부화할 때, 전형적인 도롱뇽 애벌레는 뚜껑이 없는 눈, 위턱과 아래턱의 이빨, 깃털 같은 외부 아가미 세 쌍, 그리고 등지느러미와 배지느러미가 있는 긴 꼬리를 가지고 있다.앞다리는 부분적으로 발달할 수 있고 뒷다리는 연못에 사는 종에서는 기초적이지만, 움직이는 물에서 번식하는 종에서는 오히려 더 발달할 수 있다.연못형 애벌레는 종종 머리 양쪽에 아가미가 [104][105]침전물로 막히는 것을 막을 수 있는 막대기 모양의 한 쌍의 밸런서를 가지고 있습니다.둘 다 [106]번식할 수 있습니다.어떤 것들은 완전히 성장하지 않는 유충을 가지고 있는데, 이것은 네오테니라고 [107]알려져 있습니다.네오테니는 동물의 성장률이 매우 낮을 때 발생하며 보통 티록신 [108]호르몬에 대한 조직의 반응을 바꿀 수 있는 낮은 수온과 같은 불리한 조건과 관련이 있다.식량이 부족할 수도 있습니다.의무적인 네오텐성 도롱뇽은 넥추루스, 프로테우스, 암피우마 종을 포함하여 15종이 있으며, 적절한 환경 [107]조건 하에서 이 전략을 채택하는 북서부 도롱뇽과 호랑이 도롱뇽과 같은 많은 수의 수의 수의 수의 수의 예들이 있다.
무폐도롱뇽은 육생 동물로 젖은 잎사귀 사이에 소량의 색소화되지 않은 알을 군생한다.각각의 알에는 큰 노른자 주머니가 있고 애벌레는 알 안에서 자라나면서 이를 먹고 살며 어린 도롱뇽으로 성장한다.암컷 도롱뇽은 종종 알을 품는다.엔사티나스속은 암컷이 그들 주위를 휘감고 그들의 목 부위를 눌러서 점액 [109]분비물로 효과적으로 마사지하는 것이 관찰되었습니다.
도롱뇽이나 도롱뇽에서 변신은 개구리보다 덜 극적이다.이것은 애벌레가 이미 육식동물이고 그들이 성충이 되었을 때 포식자로 계속 먹이를 먹기 때문에 그들의 소화기 계통에 거의 변화가 필요하지 않기 때문입니다.그들의 폐는 일찍 기능하지만, 애벌레는 올챙이만큼 폐를 많이 사용하지 않습니다.그들의 아가미는 결코 아가미 주머니로 덮여있지 않고 동물들이 물을 떠나기 직전에 재흡수된다.다른 변화로는 꼬리 지느러미의 크기 감소 또는 손실, 아가미 구멍의 폐쇄, 피부의 두꺼움, 눈꺼풀의 발달, 그리고 치아와 혀 구조의 특정한 변화가 있다.도롱뇽은 수영 속도가 떨어지고 꼬리가 변형되는 것이 [110]육지의 장애물이기 때문에 변태에 가장 취약하다.다 자란 도롱뇽은 봄과 여름에 수생기와 겨울에 육상기가 있는 경우가 많다.물기 적응을 위해 프로락틴은 필수 호르몬이고, 육상 적응을 위해 티록신은 필수 호르몬이다.외부 아가미는 처음 [104]물을 떠날 때 완전히 흡수되기 때문에 이후의 수생 단계에서는 다시 돌아오지 않습니다.
알을 낳는 대부분의 육생동물들은 굴이나 수역 근처의 습한 장소에서 알을 낳는다.스리랑카의 한 종인 Ichthyophis glutinosus의 어린 개체들의 발육은 많은 연구가 되어왔다.뱀장어 같은 애벌레는 알에서 부화해 물가로 이동한다.그들은 세 쌍의 붉은 깃털 모양의 아가미, 두 개의 초보적인 눈을 가진 둔한 머리, 옆줄 체계, 지느러미가 있는 짧은 꼬리를 가지고 있다.그들은 몸을 좌우로 흔들며 헤엄친다.그들은 주로 밤에 활동하며 곧 아가미를 잃고 육지로 출격한다.변태는 서서히 일어난다.생후 약 10개월이 되면 입가에 촉수가 있는 뾰족한 머리가 발달해 눈과 옆줄, 꼬리를 잃게 된다.피부는 두꺼워지고, 내장된 비늘은 발달하며, 몸은 여러 조각으로 나뉩니다.이때쯤이면, 케실리언은 굴을 만들어 [111]육지에 살고 있다.
대부분의 종족에서, 어린 것들은 태생에 의해 생산된다.남미에서 온 티프로넥테스 압축이 대표적이다.한 번에 최대 9마리의 애벌레가 난소에서 자랄 수 있다.그들은 길쭉하고 한 쌍의 주머니 모양의 아가미, 작은 눈 그리고 특별한 긁힘 이빨을 가지고 있다.처음에, 그들은 계란의 노른자를 먹고 살지만, 이 영양 공급원이 감소함에 따라, 그들은 난관에 늘어선 섬모상피세포에 대고 쉰소리를 내기 시작합니다.이것은 지방과 무코프로틴이 풍부한 액체의 분비를 자극하여 배관벽의 긁힘과 함께 섭취한다.그들은 태어나기 전의 어미보다 몸길이가 6배 늘어나고 5분의 2가 될 수 있다.이때쯤이면 그들은 변신을 겪었고 눈과 아가미를 잃었고, 피부와 입의 촉수가 두꺼워졌고, 치아를 다시 흡수했다.영구치 [112][113]세트는 태어난 지 얼마 되지 않아 자란다.
고리가 달린 게실리안(Siphonops Annulatus)은 번식을 목적으로 한 독특한 적응을 개발했습니다.자손은 모성피부파지로 알려진 현상으로 성인에 의해 특별히 발달된 피부층을 먹고 산다.알은 약 3일 간격으로 약 7분간 한 묶음으로 먹이로 피부의 재생 기회를 준다.한편, 그들은 모성 클로아카에서 [114]흘러나온 액체를 섭취하는 것이 관찰되었다.
부모의 보살핌

양서류 사이에서 자손을 돌보는 것은 거의 연구되지 않았지만 일반적으로 한 묶음의 알의 수가 많을수록 부모의 보살핌이 이루어질 가능성은 낮아진다.그럼에도 불구하고, 양서류 종의 최대 20%에서 성체 한 명 또는 두 명이 [115]새끼를 돌보는 데 어느 정도 역할을 하는 것으로 추정됩니다.작은 수역이나 다른 전문 서식지에서 번식하는 종들은 새끼를 [116]돌볼 때 복잡한 행동 패턴을 보이는 경향이 있다.
많은 도롱뇽들은 육지의 죽은 통나무나 돌 밑에 알을 낳는다.검은 산도롱뇽(Desmognathus welteri)은 이것을 하고, 어미는 알을 낳고 배아가 알의 노른자를 먹이로 삼을 때 그들을 포식으로부터 보호한다.완전히 성장하면 알 캡슐을 깨고 나와 어린 [117]도롱뇽으로 흩어진다.원시 도롱뇽인 수컷 헬벤더는 물속에 둥지를 파서 암컷들이 그곳에 눕도록 유도한다.수컷은 알이 부화하기 전 두세 달 동안 알을 부채질하고 [56]산소의 공급을 늘리기 위해 몸의 물결을 이용하면서 그 장소를 지킨다.
작은 개구리인 수컷 콜로스테투스 아포시타투스는 돌이나 통나무 아래에 숨겨진 알 군집을 보호한다.알이 부화하면 수컷은 점액 분비에 의해 등에 있는 올챙이를 임시 웅덩이로 옮기고 거기서 올챙이는 물에 몸을 담그고 떨어진다.[118]수컷 조산사 두꺼비는 그의 허벅지에 달걀줄을 감아 최대 8주 동안 알을 가지고 다닙니다.그는 그들을 촉촉하게 유지시키고 부화할 준비가 되면 연못이나 도랑으로 가서 올챙이를 [119]풀어준다.암컷 위부화개구리(Rheobatrachus spp.)는 알이나 부화를 삼킨 후 뱃속에서 유충을 키웠다. 그러나 이 단계는 멸종되기 전에는 관찰된 적이 없었다.올챙이는 매우 큰 노른자 [120]공급을 소비함으로써 발달하는 동안 어미에서 소화를 방해하는 호르몬을 분비한다.웅크린 개구리는 땅 위에 알을 낳는다.올챙이가 부화하면 수컷은 뒷다리에 올챙이를 [121]부화 주머니로 가지고 다닙니다.수리남 수생 두꺼비(Pipa pipa)는 등에 있는 모공에서 새끼를 기르는데,[122] 이 모공은 변형이 일어날 때까지 남아 있습니다.과립형 독개구리(Oophaga granulifera)는 독개구리과의 많은 나무개구리 중 전형적인 종류이다.그것의 알은 숲 바닥에 낳고 부화하면 올챙이는 성충의 등에 잎의 축이나 브로멜리아드의 로제트와 같은 적당한 물이 차 있는 틈으로 하나씩 옮겨진다.암컷은 정기적으로 사육장을 방문하며 미인증 알을 물에 담그고 올챙이가 [123]먹는다.
유전학 및 유전학
양서류는 염색체와 게놈의 다양성으로 척추동물들 사이에서 유명하다.핵형(염색체)은 아누란 963종, 도롱뇽 209종, 케실리안 21종을 포함한 약 8,200종의 알려진 (이배체) 종 중 최소 1,193종(14.5%)에 대해 확인되었다.일반적으로, 이배체 양서류의 핵형은 20-26개의 쌍팔 염색체로 특징지어진다.양서류는 또한 척추동물의 다른 분류군에 비해 매우 큰 게놈과 그에 따른 게놈 크기 변화(C-값: 반수체 핵에서 DNA의 사진그램)를 가지고 있다.게놈 크기는 개구리의 경우 0.95~11.5pg, 도롱뇽의 경우 13.89~120.56pg, 고양이과 [124]동물의 경우 2.94~11.78pg이다.
최근 많은 게놈이 발표되었지만 게놈 크기가 커서 양서류의 전체 유전자 염기서열 분석을 할 수 없었다.1.72010년에 [124]양서류에게 보고된 것은 제노푸스 트로피컬리스의 GB 초안 게놈이었다.몇몇 도롱뇽과 비교하면 이 개구리 게놈은 아주 작다.예를 들어 멕시코 액솔로틀의 게놈은 32Gb로 인간 게놈(3GB)[125]의 10배가 넘는 것으로 밝혀졌다.
섭식 및 다이어트
몇몇 예외를 제외하고, 성인 양서류는 포식자이며, 그들이 삼킬 수 있는 거의 모든 것을 먹고 삽니다.식단은 대부분 딱정벌레, 애벌레, 지렁이, 거미와 같이 너무 빨리 움직이지 않는 작은 먹이로 구성되어 있다.사이렌(Siren spp.)은 종종 그들이[126] 먹는 무척추동물과 함께 수생식물 물질을 섭취하고 브라질산 청개구리(Xenohyla truncata)는 [127]식단에 많은 양의 과일을 포함하고 있다.멕시코 굴 두꺼비(Rhinophrynus dorsalis)는 개미와 흰개미를 잡는데 특별히 적합한 혀를 가지고 있습니다.다른 개구리들은 [128]앞부분에서 혀가 경첩으로 되어 있는 반면, 앞부분은 앞부분으로 돌출되어 있습니다.
음식은 빛이 희미한 환경에서도 대부분 눈으로 선택된다.먹이의 움직임은 먹이 반응을 일으킨다.개구리는 붉은 플란넬을 미끼로 낚은 낚싯바늘에 잡혔고,[129] 초록개구리(라나클라미탄)는 그들이 지나쳐 떠다니는 느릅나무 씨앗으로 배를 가득 채운 채 발견되었다.두꺼비, 도롱뇽, 그리고 고양이과 동물들 또한 먹이를 찾기 위해 냄새를 사용합니다.도롱뇽은 냄새가 나는 먹이 근처에서 움직이지 않고 있다가 움직여야만 먹이를 먹는 것이 관찰되었기 때문에 이러한 반응은 대부분 이차적인 것이다.동굴에 사는 양서류는 보통 냄새로 사냥을 한다.어떤 도롱뇽들은 심지어 완전히 어두운 [130]곳에서도 움직이지 않는 먹이를 알아보는 법을 배운 것으로 보인다.
양서류는 보통 음식을 통째로 삼키지만 그것을 [45]가라앉히기 위해 먼저 가볍게 씹을 수도 있다.그들은 전형적으로 양서류 특유의 특징인 경첩이 달린 작은 이빨을 가지고 있다.이들 베이스와 크라운은 석회화되지 않은 층에 의해 분리된 상아질로 구성되어 있으며 정기적으로 교체됩니다.도롱뇽, 케실리안 그리고 몇몇 개구리들은 양쪽 턱에 이빨이 하나 또는 두 줄로 있지만, 몇몇 개구리들은 아래턱에 이빨이 없고 두꺼비들은 이빨이 없다.많은 양서류에서 [131]입천장의 얼굴 뼈에 보메린 이빨이 붙어 있다.
호랑이 도롱뇽은 무지한 무척추동물을 매복하기 위해 숨어있는 개구리와 도롱뇽의 전형이다.부포프리스 두꺼비와 같은 다른 양서류들은 적극적으로 먹이를 찾는 반면, 아르헨티나 뿔개구리(Ceratophrys Ornata)는 뒷발을 등 뒤로 올리고 노란 [132]발가락을 진동시켜 호기심 많은 먹이를 더 가까이 유인한다.파나마의 잎개구리 중에서 먹이를 적극적으로 사냥하는 개구리는 입이 좁고 얇고, 종종 밝은 색깔과 독성이 있는 반면, 양귀비들은 입이 넓고 넓고 위장이 [133]잘 되어 있다.케시안은 혀를 날름거리지 않고 약간 뒷쪽을 가리키는 이빨로 먹이를 잡는다.먹잇감의 몸부림이나 턱의 움직임 때문에 먹잇감은 안쪽으로 움직이며 보통 굴 속으로 물러난다.가라앉은 먹이를 [134]통째로 삼키다.
개구리의 애벌레는 새로 부화하면 알의 노른자를 먹고 삽니다.이것이 소진되면 일부는 박테리아, 녹조 껍질, 물에 잠긴 식물에서 나오는 찌꺼기, 잡초를 먹기 위해 움직인다.물은 보통 머리 아래쪽에 있는 입을 통해 빨려 들어가 입과 아가미 사이에 있는 아가미 모양의 음식 트랩을 통과하여 미세한 입자들이 점액에 갇혀 걸러진다.다른 것들은 여러 줄의 순치로 모서리가 난 각질 부리로 구성된 특별한 입 부분을 가지고 있다.그들은 입가에 있는 유두와 함께 더 큰 입자를 걸러내면서 바닥의 침전물을 휘저을 뿐만 아니라 많은 종류의 음식을 긁어 물어요.스페이드풋 두꺼비와 같은 어떤 것들은 강하게 물어뜯는 턱을 가지고 있으며 육식성이거나 [135]식인종이다.
발성

도롱뇽과 도롱뇽의 울음소리는 이따금씩 끽끽거리는 소리, 투덜거림, 쉿하는 소리로 제한되며 많은 연구가 이루어지지 않았다.때때로 고양이들이 내는 딸깍 소리는 박쥐처럼 방향을 잡는 수단일 수도 있고 의사소통의 한 형태일 수도 있다.대부분의 도롱뇽은 목소리가 없는 것으로 여겨지지만, 캘리포니아 거대 도롱뇽(Dicamptodon ensatus)은 성대를 가지고 있고 덜컹거리거나 짖는 소리를 낼 수 있다.어떤 종류의 도롱뇽은 [136]공격을 받으면 조용히 꽥꽥거리거나 비명을 지릅니다.

개구리는 특히 짝짓기를 유혹하기 위해 목소리를 사용하는 번식기에 훨씬 더 큰 목소리를 낸다.특정 종의 존재는 동물 자체를 잠깐 보는 것보다 특징적인 호출로 더 쉽게 식별할 수 있다.대부분의 종에서 소리는 폐에서 성대를 통해 목구멍이나 입가에 있는 공기 주머니로 공기를 배출함으로써 발생한다.이것은 풍선처럼 팽창하여 공명기 역할을 할 수 있으며, 소리를 대기로 전달하거나 동물이 물에 [136]잠길 때 물을 전달하는데 도움을 준다.주된 발성은 수컷이 큰 소리로 광고하는 것으로, 암컷이 자신의 영역에 접근하도록 격려하는 동시에 다른 수컷이 자신의 영역을 침범하지 않도록 하는 것입니다.이 통화는 여성의 접근에 대한 조용한 구애 통화 또는 남성 침입자가 접근하면 보다 공격적인 통화로 변경됩니다.호출은 포식자를 유인할 위험을 수반하며 많은 [137]에너지를 소비합니다.기타 콜에는 애드버타이즈콜에 대한 응답으로 여성이 발신한 콜과 암플렉서스에서 원치 않는 시도 중에 남성 또는 여성이 발신한 릴리스 콜이 포함됩니다.개구리가 공격을 받으면, 종종 [138]비명을 지르는 것과 같은 조난이나 공포의 소리가 납니다.보통 야행성 쿠바산 청개구리(Osteopilus Septentrionalis)는 낮에 비가 [139]올 때 비소리를 낸다.
영토적 행동
카에시안의 영토적 행동에 대해서는 거의 알려져 있지 않지만, 일부 개구리와 도롱뇽은 서식지를 방어한다.이곳은 보통 먹이, 번식 또는 피난처입니다.수컷은 보통 그러한 행동을 보이지만, 일부 종에서는 암컷과 심지어 청소년도 관련되어 있다.비록 많은 개구리 종에서 암컷이 수컷보다 크지만, 이것은 수컷이 영토 방어에 적극적으로 관여하는 대부분의 종에서는 해당되지 않습니다.이들 중 일부는 이빨을 물어뜯기 위한 확대나 가슴, 팔 또는 엄지손가락의 [140]가시와 같은 특정한 적응을 가지고 있다.

도롱뇽에서 영토 방어는 공격적인 자세를 취하고 필요하면 침입자를 공격하는 것을 포함한다.이것은 때때로 꼬리를 잃는 것을 야기하는 스냅, 추격, 그리고 때로는 물고기와 관련이 있을 수 있습니다.붉은등도롱뇽(Plethodon cineereus)의 행동은 많이 연구되어 왔다.나중에 탈환된 표식된 개체 중 91%는 통나무나 [141]바위 밑에서 원래 낮의 은신처에서 1미터(야드) 이내에 있었다.비슷한 비율로 30미터(98피트)의 거리를 실험적으로 이동했을 때 본거지로 [141]되돌아왔다.도롱뇽은 평균 0.16~0.33평방미터(1.7~3.6평방피트) 크기의 영역 주변에 냄새 자국을 남겼으며 때로는 수컷과 암컷 [142]쌍이 서식하기도 했다.이것들은 다른 사람들의 침입을 막고 이웃 지역들 사이의 경계를 묘사했다.그들의 행동 대부분은 틀에 박힌 것처럼 보였고 개인들 간의 실제 접촉과 관련이 없었다.공격적 자세는 몸을 땅바닥에서 들어 올리고 종종 굴종적으로 몸을 돌리는 상대를 노려보는 것이었다.침입자가 계속 침입하면 보통 꼬리 부분이나 비음순 홈에서 날카로운 돌출부가 발사됩니다.이들 부위 중 하나에 손상을 입으면 [141]조직을 재생해야 하는 필요성이나 음식을 탐지하는 능력을 손상시키기 때문에 경쟁상대의 체력을 떨어뜨릴 수 있다.
개구리에서 수컷의 영역 행동은 종종 번식지에서 관찰된다; 울음소리는 이 자원의 일부에 대한 소유권 선언이자 잠재적인 짝짓기 광고이다.일반적으로, 더 깊은 목소리는 더 무겁고 더 강한 개인을 나타내며, 이것은 더 작은 남성의 침입을 막기에 충분합니다.많은 에너지가 발성에 사용되며, 만약 그가 지치면 더 적합한 경쟁자에 의해 대체될 수도 있는 영토 보유자에게 피해를 준다.남성들은 이웃 영토의 소유자들을 용인하면서 알려지지 않은 침입자들을 강하게 공격하는 경향이 있다.영토 소유자들은 "가정적 이점"을 가지고 있으며, 보통 비슷한 크기의 개구리 두 마리가 만났을 때 더 잘 어울립니다.위협이 불충분하면 가슴과 가슴 사이의 몸싸움이 일어날 수 있다.싸움 방법으로는 밀고 밀기, 상대의 성낭 빼기, 상대의 머리 잡기, 등치기, 물고 쫓기, 튀기, 그리고 [143]물 속에 몸을 숨기는 것이 있다.
방어 메커니즘
양서류는 얇은 피부를 가진 부드러운 몸을 가지고 있으며 발톱, 방어 갑옷 또는 가시가 없다.그럼에도 불구하고 그들은 생존을 위해 다양한 방어 메커니즘을 발전시켜 왔다.도롱뇽과 개구리의 첫 번째 방어선은 그들이 만들어내는 점액 분비물이다.이것은 그들의 피부를 촉촉하게 유지시켜주고 미끄럽고 잡기 어렵게 만듭니다.그 분비물은 종종 끈적거리고 불쾌하거나 [144]독성이 있다.뱀은 아프리카 발톱이 있는 개구리(제노푸스 라에비스)를 삼키려고 할 때 하품을 하고 입을 벌리는 것이 관찰되어 개구리들이 [144][145]탈출할 수 있는 기회를 준다.케이실리언은 이런 점에서 거의 연구되지 않았지만,[146] 카이엔 케이실리언은 브라질에서 먹이 실험에서 포식성 물고기를 죽인 독성 점액을 생산한다.어떤 도롱뇽에서는 피부에 독이 있다.북미산 거친피부의 멧돼지(Taricha granulosa)와 그 밖의 속은 알려진 것 중 가장 독성이 강한 비단백질 물질인 TTX(Neuroxin tetrodotoxin)를 포함하고 있으며 복어에서 생산되는 것과 거의 동일하다.엉겅퀴를 다루는 것은 해를 끼치지 않지만, 피부를 아주 조금만 섭취해도 치명적입니다.먹이 실험에서 물고기, 개구리, 파충류, 조류, 포유류는 모두 감염되기 [147][148]쉬운 것으로 밝혀졌다.독에 어느 정도 내성이 있는 유일한 포식자는 일반적인 가터뱀의 특정 집단이다.뱀과 도롱뇽이 공존하고 있는 지역에서는 유전적 변화를 통해 면역력이 발달해 양서류를 [149]벌받지 않고 먹고 산다.공진화는 [148]뱀이 면역력을 더 발달시키는 것과 같은 속도로 독성을 증가시키는 것과 함께 일어난다.일부 개구리와 두꺼비는 독성이 있는데, 주요 독샘은 목 옆과 등에 있는 사마귀 아래에 있습니다.이러한 부위는 공격 동물에게 나타나며, 이들의 분비물은 악취가 나거나 다양한 신체적 또는 신경학적 증상을 일으킬 수 있다.총 200개 이상의 독소가 [150]조사된 제한된 수의 양서류 종으로부터 분리되었다.

독성이 있는 종들은 종종 그들의 독성을 잠재적 포식자들에게 경고하기 위해 밝은 색을 사용한다.이러한 경고 색상은 붉은색 또는 노란색과 검은색을 조합하는 경향이 있는데, 불도롱뇽(살라만드라 도롱뇽)이 그 예입니다.일단 포식자가 이것들 중 하나를 표본으로 삼으면, 다음에 비슷한 동물을 만났을 때 그 색깔을 기억할 것이다.불배두꺼비(Bombina spp.)와 같은 몇몇 종에서는, 경고색이 배에 있고, 이 동물들은 공격받았을 때 방어 자세를 취하며 포식자에게 밝은 색을 보여줍니다.개구리 알로바테스 사파로는 독이 없지만,[152] 포식자를 속일 수 있는 전략으로 그 지역에 있는 다른 독성 종들의 모습을 모방한다.
많은 양서류들은 야행성이고 낮에 숨어있기 때문에 육안으로 사냥하는 주행성 포식자들을 피한다.다른 양서류들은 발각되지 않기 위해 위장을 사용한다.얼룩덜룩한 갈색, 회색, 올리브 등 다양한 색감이 배경과 어우러집니다.일부 도롱뇽은 북미 북부짧은꼬리쥐(Blarina brevicauda)와 같은 잠재적 포식자에 직면했을 때 방어 자세를 취한다.그들의 몸은 비틀리고 꼬리를 세우고 채찍질을 하는데, 이는 포식자가 독을 생성하는 입상샘과의 접촉을 [153]피하기 어렵게 만든다.몇몇 도롱뇽들은 공격을 받았을 때 꼬리를 자동 절제하고, 탈출하기 위해 몸의 이 부분을 희생합니다.꼬리는 쉽게 분리할 수 있도록 밑부분에 협착이 있을 수 있습니다.꼬리는 나중에 재생되지만, 꼬리를 교체하는 데 드는 에너지 비용은 [68]상당합니다.어떤 개구리와 두꺼비는 크고 사나워 보이기 위해 몸을 부풀리고, 어떤 삽발 두꺼비들은 소리를 지르며 [45]공격자를 향해 뛰어오릅니다.안드리아스속 거대 도롱뇽과 케라토프린, 팍시체팔루스 개구리는 날카로운 이빨을 가지고 있으며 방어용 물고기로 피를 뽑을 수 있다.검은배도롱뇽(Desmognathus quadramaculatus)은 공격하는 일반 가터뱀(Thamnophis sirtalis)을 머리에 두세 배 정도 물 수 있으며 종종 [154]탈출에 성공한다.
인지
양서류에서는, 습관화, 고전과 기악 학습을 통한 연상 학습, 그리고 변별 [155]능력의 증거가 있다.
한 실험에서, 살아있는 초파리(Drosophila virilis)를 제공했을 때, 도롱뇽은 1 대 2와 2 대 3 중에서 더 큰 것을 선택했습니다.개구리는 낮은 숫자(1 대 2, 2 대 3, 그러나 3 대 4는 아님)와 큰 숫자(3 대 6, 4 대 8, 그러나 4 대 6은 아님)를 구별할 수 있습니다.이는 표면적,[156] 부피, 중량 및 이동과 같은 다른 특징과 무관하지만, 큰 숫자의 구별은 표면적에 기초할 수 있다.
보존.

1980년대 후반부터 전 세계 각지에서 개체수의 급격한 감소와 대량 국지적 멸종을 포함한 양서류 개체수의 급격한 감소는 지구 생물 [157]다양성에 대한 가장 중요한 위협 중 하나로 인식되고 있다.2004년, 국제자연보전연맹(IUCN)은 현재 조류,[158] 포유류, 양서류 멸종률이 자연멸종률보다 최소 48배, 아마도 1,024배 더 높다고 보고했다.2006년, 수륙양서류 중 한 단계에서 물에 의존한 4,035종의 양서류가 존재한다고 믿어졌다.이 중 1,356종(33.6%)이 멸종위기에 처한 것으로 간주되었으며,[159] 이 수치는 그들의 상태를 평가할 자료가 충분하지 않은 1,427종을 제외했기 때문에 과소평가될 가능성이 높다.서식지 파괴와 변경, 과잉 개발, 오염, 도입된 종, 지구 온난화, 내분비 교란 오염 물질, 오존층 파괴 (자외선 방사선이 양서류의 피부, 눈, 그리고 알에 특히 해를 끼치는 것으로 보여짐), 그리고 ch와 같은 질병들을 포함한 많은 원인들이 관련되어 있는 것으로 여겨진다.이트리디균증그러나, 양서류 감소의 원인 중 많은 것들이 여전히 잘 알려져 있지 않고,[160] 현재 논의되고 있는 주제이다.

먹이사슬 및 포식자
양서류 개체수의 감소는 포식 패턴에 영향을 미칠 것이다.먹이사슬의 꼭대기 근처에서 육식동물의 상실은 섬세한 생태계의 균형을 깨뜨릴 것이고 기회주의적인 종들의 급격한 증가를 야기할 것이다.
양서류를 먹는 포식자들은 그들의 감소에 영향을 받는다.캘리포니아에 있는 서부 육생 가터 뱀은 대부분 수생이고 수가 줄어들고 있는 두 종의 개구리, 즉 요세미티 두꺼비와 산의 노란 다리 개구리에게 크게 의존하고 있어 뱀의 미래가 위험에 처해 있다.만약 뱀이 희귀해진다면, 이것은 맹금류와 [161]뱀을 먹고 사는 다른 포식자들에게 영향을 미칠 것이다.한편, 연못과 호수에서는 개구리가 적다는 것은 올챙이가 적다는 것을 의미한다.이들은 보통 조류의 성장을 조절하는 데 중요한 역할을 하며 바닥에 퇴적물로 쌓인 잔해물도 찾아냅니다.올챙이 수의 감소는 조류의 과잉 성장을 초래할 수 있으며, 조류가 나중에 죽고 분해될 때 물 속의 산소가 고갈될 수 있다.수생 무척추동물과 물고기는 죽을 수 있고 예측할 수 없는 생태학적 [162]결과를 초래할 수 있다.
오염 및 살충제
양서류와 파충류 개체수의 감소는 파충류와 [163]양서류에 대한 살충제의 영향에 대한 인식을 가져왔다.과거에, 양서류나 파충류가 어떤 육상 수생 척추동물보다 화학 오염에 더 취약하다는 주장은 [163]최근까지 연구에 의해 뒷받침되지 않았다.양서류와 파충류는 복잡한 생명 주기를 가지고 있고, 다른 기후와 생태 지역에 살며, 화학 물질에 노출되기 더 쉽습니다.유기인산염, 네오니코티노이드, 카르바메이트와 같은 특정 살충제는 콜린에스테라아제 억제를 통해 반응한다.콜린에스테라아제는 신경계에 풍부한 흥분성 신경전달물질인 아세틸콜린의 가수분해를 일으키는 효소다.ACHE 억제제는 가역적이거나 되돌릴 수 없으며, 카르바메이트는 콜린 중독을 일으킬 가능성이 높은 유기인 살충제보다 안전하다.ACHE 억제 농약에 파충류가 노출되면 파충류에서 신경 기능이 저하될 수 있습니다.이러한 억제 효과가 식품 소비 및 기타 활동과 같은 운동 성능에 미치는 영향의 축적.
Conservation and protection strategies
The Amphibian Specialist Group of the IUCN is spearheading efforts to implement a comprehensive global strategy for amphibian conservation.[164] Amphibian Ark is an organization that was formed to implement the ex-situ conservation recommendations of this plan, and they have been working with zoos and aquaria around the world, encouraging them to create assurance colonies of threatened amphibians.[164] One such project is the Panama Amphibian Rescue and Conservation Project that built on existing conservation efforts in Panama to create a country-wide response to the threat of chytridiomycosis.[165]
Another measure would be to stop exploitation of frogs for human consumption. In the Middle East, a growing appetite for eating frog legs and the consequent gathering of them for food was already linked to an increase in mosquitoes and thus has direct consequences for human health.[166]
See also
- Cultural depictions of amphibians
- List of amphibians
- List of amphibian genera
- List of threatened reptiles and amphibians of the United States
References
- ^ "Amphibia". paleobiodb.org. Retrieved May 24, 2022.
- ^ a b Blackburn, D. C.; Wake, D. B. (2011). "Class Amphibia Gray, 1825. In: Zhang, Z.-Q. (Ed.) Animal biodiversity: An outline of higher-level classification and survey of taxonomic richness" (PDF). Zootaxa. 3148: 39–55. doi:10.11646/zootaxa.3148.1.8. Archived (PDF) from the original on May 18, 2016. Retrieved November 29, 2012.
- ^ Jennifer Y. Lamb; Matthew P. Davis (February 27, 2020). "Salamanders and other amphibians are aglow with biofluorescence". Scientific Reports. 10 (1): 2821. doi:10.1038/S41598-020-59528-9. ISSN 2045-2322. PMC 7046780. PMID 32108141. Wikidata Q89930490.
- ^ a b Atkins, Jade B.; Reisz, Robert R.; Maddin, Hillary C. (March 22, 2019). "Braincase simplification and the origin of lissamphibians". PLOS ONE. 14 (3): e0213694. doi:10.1371/journal.pone.0213694. ISSN 1932-6203. PMC 6430379. PMID 30901341.
...there has been a growing consensus that lissamphibians are a monophyletic assemblage derived from within Temnospondyli, and more specifically from within the amphibamid dissorophoids.
- ^ "Back to school: temno superlatives". Bryan Gee, PhD. Retrieved June 29, 2022.
- ^ Skeat, Walter W. (1897). A Concise Etymological Dictionary of the English Language. Clarendon Press. p. 39.
- ^ Baird, Donald (May 1965). "Paleozoic lepospondyl amphibians". Integrative and Comparative Biology. 5 (2): 287–294. doi:10.1093/icb/5.2.287.
- ^ a b c "Species by number". AmphibiaWeb. Archived from the original on January 12, 2021. Retrieved January 11, 2021.
- ^ Frost, Darrel (2013). "American Museum of Natural History: Amphibian Species of the World 5.6, an Online Reference". The American Museum of Natural History. Archived from the original on June 14, 2012. Retrieved October 24, 2013.
- ^ "Amphibiaweb". Archived from the original on November 25, 2019. Retrieved April 1, 2019.
- ^ a b Crump, Martha L. (2009). "Amphibian diversity and life history" (PDF). Amphibian Ecology and Conservation. A Handbook of Techniques: 3–20. Archived from the original (PDF) on July 15, 2011.
- ^ Speer, B. W.; Waggoner, Ben (1995). "Amphibia: Systematics". University of California Museum of Paleontology. Archived from the original on March 7, 2013. Retrieved December 13, 2012.
- ^ a b c Stebbins & Cohen 1995, p. 3.
- ^ a b c Anderson, J.; Reisz, R.; Scott, D.; Fröbisch, N.; Sumida, S. (2008). "A stem batrachian from the Early Permian of Texas and the origin of frogs and salamanders". Nature. 453 (7194): 515–518. Bibcode:2008Natur.453..515A. doi:10.1038/nature06865. PMID 18497824. S2CID 205212809. Archived from the original on July 14, 2021. Retrieved November 10, 2016.
- ^ Roček, Z. (2000). "14. Mesozoic Amphibians" (PDF). In Heatwole, H.; Carroll, R. L. (eds.). Amphibian Biology: Paleontology: The Evolutionary History of Amphibians. Vol. 4. Surrey Beatty & Sons. pp. 1295–1331. ISBN 978-0-949324-87-0. Archived (PDF) from the original on July 18, 2011. Retrieved September 29, 2012.
- ^ Jenkins, Farish A. Jr.; Walsh, Denis M.; Carroll, Robert L. (2007). "Anatomy of Eocaecilia micropodia, a limbed caecilian of the Early Jurassic". Bulletin of the Museum of Comparative Zoology. 158 (6): 285–365. doi:10.3099/0027-4100(2007)158[285:AOEMAL]2.0.CO;2. S2CID 86379456.
- ^ Gaoa, Ke-Qin; Shubin, Neil H. (2012). "Late Jurassic salamandroid from western Liaoning, China". Proceedings of the National Academy of Sciences of the United States of America. 109 (15): 5767–5772. Bibcode:2012PNAS..109.5767G. doi:10.1073/pnas.1009828109. PMC 3326464. PMID 22411790.
- ^ Cannatella, David (2008). "Salientia". Tree of Life Web Project. Archived from the original on April 22, 2019. Retrieved August 31, 2012.
- ^ a b c "Evolution of amphibians". University of Waikato: Plant and animal evolution. Archived from the original on June 27, 2016. Retrieved September 30, 2012.
- ^ a b c Carroll, Robert L. (1977). Hallam, Anthony (ed.). Patterns of Evolution, as Illustrated by the Fossil Record. Elsevier. pp. 405–420. ISBN 978-0-444-41142-6. Archived from the original on April 14, 2021. Retrieved October 15, 2020.
- ^ a b Clack, Jennifer A. (2006). "Ichthyostega". Tree of Life Web Project. Archived from the original on June 14, 2020. Retrieved September 29, 2012.
- ^ Lombard, R. E.; Bolt, J. R. (1979). "Evolution of the tetrapod ear: an analysis and reinterpretation". Biological Journal of the Linnean Society. 11 (1): 19–76. doi:10.1111/j.1095-8312.1979.tb00027.x. Archived from the original on October 4, 2018. Retrieved November 10, 2016.
- ^ a b c Spoczynska, J. O. I. (1971). Fossils: A Study in Evolution. Frederick Muller Ltd. pp. 120–125. ISBN 978-0-584-10093-8.
- ^ Sahney, S.; Benton, M.J. & Ferry, P.A. (2010). "Links between global taxonomic diversity, ecological diversity and the expansion of vertebrates on land". Biology Letters. 6 (4): 544–547. doi:10.1098/rsbl.2009.1024. PMC 2936204. PMID 20106856.
- ^ Sahney, S.; Benton, M.J. (2008). "Recovery from the most profound mass extinction of all time". Proceedings of the Royal Society B: Biological Sciences. 275 (1636): 759–65. doi:10.1098/rspb.2007.1370. PMC 2596898. PMID 18198148.
- ^ San Mauro, D. (2010). "A multilocus timescale for the origin of extant amphibians". Molecular Phylogenetics and Evolution. 56 (2): 554–561. doi:10.1016/j.ympev.2010.04.019. PMID 20399871. Archived from the original on December 12, 2019. Retrieved November 10, 2016.
- ^ San Mauro, Diego; Vences, Miguel; Alcobendas, Marina; Zardoya, Rafael; Meyer, Axel (2005). "Initial diversification of living amphibians predated the breakup of Pangaea". The American Naturalist. 165 (5): 590–599. doi:10.1086/429523. PMID 15795855. S2CID 17021360. Archived from the original on February 7, 2017. Retrieved November 10, 2016.
- ^ "Tiny fossils reveal backstory of the most mysterious amphibian alive". ScienceDaily. Archived from the original on November 5, 2019. Retrieved June 28, 2017.
- ^ a b c d Dorit, Walker & Barnes 1991, pp. 843–859.
- ^ Laurin, Michel (2011). "Terrestrial Vertebrates". Tree of Life Web Project. Archived from the original on March 1, 2011. Retrieved September 16, 2012.
- ^ Laurin, Michel; Gauthier, Jacques A. (2012). "Amniota". Tree of Life Web Project. Archived from the original on June 1, 2020. Retrieved September 16, 2012.
- ^ Sumich, James L.; Morrissey, John F. (2004). Introduction to the Biology of Marine Life. Jones & Bartlett Learning. p. 171. ISBN 978-0-7637-3313-1. Archived from the original on April 14, 2021. Retrieved October 15, 2020.
- ^ Brad Shaffer; Oscar Flores-Villela; Gabriela Parra-Olea; David Wake (2004). "Ambystoma andersoni". IUCN Red List of Threatened Species. Version 2013.2. International Union for Conservation of Nature
- ^ Wells, Kentwood D. (February 15, 2010). The Ecology and Behavior of Amphibians. University of Chicago Press. ISBN 9780226893334. Archived from the original on June 25, 2020. Retrieved June 19, 2020 – via Google Books.
- ^ Levy, Daniel L.; Heald, Rebecca (January 20, 2016). "Biological Scaling Problems and Solutions in Amphibians". Cold Spring Harbor Perspectives in Biology. 8 (1): a019166. doi:10.1101/cshperspect.a019166. PMC 4691792. PMID 26261280.
- ^ Schoch, Rainer R. (March 19, 2014). Amphibian Evolution: The Life of Early Land Vertebrates. John Wiley & Sons. ISBN 9781118759134. Archived from the original on July 25, 2020. Retrieved July 21, 2020 – via Google Books.
- ^ Michel Laurin (2004). "The evolution of body size, Cope's rule and the origin of amniotes". Systematic Biology. 53 (4): 594–622. doi:10.1080/10635150490445706. PMID 15371249. Archived from the original on July 14, 2021. Retrieved July 21, 2020.
- ^ Rittmeyer, Eric N.; Allison, Allen; Gründler, Michael C.; Thompson, Derrick K.; Austin, Christopher C. (2012). "Ecological guild evolution and the discovery of the world's smallest vertebrate". PLOS ONE. 7 (1): e29797. Bibcode:2012PLoSO...729797R. doi:10.1371/journal.pone.0029797. PMC 3256195. PMID 22253785.
- ^ a b Nguyen, Brent; Cavagnaro, John (July 2012). "Amphibian Facts". AmphibiaWeb. Archived from the original on January 23, 2014. Retrieved November 9, 2012.
- ^ Price, L. I. (1948). "Um anfibio Labirinthodonte da formacao Pedra de Fogo, Estado do Maranhao". Boletim. Ministerio da Agricultura, Departamento Nacional da Producao ineral Divisao de Geologia e Mineralogia. 24: 7–32.
- ^ Stebbins & Cohen 1995, pp. 24–25.
- ^ Cannatella, David; Graybeal, Anna (2008). "Bufonidae, True Toads". Tree of Life Web Project. Archived from the original on June 14, 2020. Retrieved December 1, 2012.
- ^ "Frog fun facts". American Museum of Natural History. January 12, 2010. Archived from the original on February 24, 2013. Retrieved August 29, 2012.
- ^ Challenger, David (January 12, 2012). "World's smallest frog discovered in Papua New Guinea". CNN. Archived from the original on April 20, 2012. Retrieved August 29, 2012.
- ^ a b c d e f g Arnold, Nicholas; Ovenden, Denys (2002). Reptiles and Amphibians of Britain and Europe. Harper Collins Publishers. pp. 13–18. ISBN 978-0-00-219318-4.
- ^ Faivovich, J.; Haddad, C. F. B.; Garcia, P. C. A.; Frost, D. R.; Campbell, J. A.; Wheeler, W. C. (2005). "Systematic review of the frog family Hylidae, with special reference to Hylinae: Phylogenetic analysis and revision". Bulletin of the American Museum of Natural History. 294: 1–240. CiteSeerX 10.1.1.470.2967. doi:10.1206/0003-0090(2005)294[0001:SROTFF]2.0.CO;2. S2CID 83925199.
- ^ a b Ford, L. S.; Cannatella, D. C. (1993). "The major clades of frogs". Herpetological Monographs. 7: 94–117. doi:10.2307/1466954. JSTOR 1466954. Retrieved November 10, 2016.[dead link]
- ^ San Mauro, Diego; Vences, Miguel; Alcobendas, Marina; Zardoya, Rafael; Meyer, Axel (2005). "Initial diversification of living amphibians predated the breakup of Pangaea". American Naturalist. 165 (5): 590–599. doi:10.1086/429523. PMID 15795855. S2CID 17021360. Archived from the original on February 7, 2017. Retrieved November 10, 2016.
- ^ Baum, David (2008). "Trait Evolution on a Phylogenetic Tree: Relatedness, Similarity, and the Myth of Evolutionary Advancement". Nature Education. Archived from the original on March 8, 2014. Retrieved December 1, 2012.
- ^ Sparreboom, Max (February 7, 2000). "Andrias davidianus Chinese giant salamander". AmphibiaWeb. Archived from the original on December 26, 2012. Retrieved December 1, 2012.
- ^ Wake, David B. (November 8, 2000). "Thorius pennatulus". AmphibiaWeb. Archived from the original on May 15, 2012. Retrieved August 25, 2012.
- ^ Elmer, K. R.; Bonett, R. M.; Wake, D. B.; Lougheed, S. C. (March 4, 2013). "Early Miocene origin and cryptic diversification of South American salamanders". BMC Evolutionary Biology. 13 (1): 59. doi:10.1186/1471-2148-13-59. PMC 3602097. PMID 23497060.
- ^ Larson, A.; Dimmick, W. (1993). "Phylogenetic relationships of the salamander families: an analysis of the congruence among morphological and molecular characters". Herpetological Monographs. 7 (7): 77–93. doi:10.2307/1466953. JSTOR 1466953.
- ^ Dorit, Walker & Barnes 1991, p. 852.
- ^ Heying, Heather (2003). "Cryptobranchidae". Animal Diversity Web. University of Michigan. Archived from the original on October 21, 2012. Retrieved August 25, 2012.
- ^ a b Mayasich, J.; Grandmaison, D.; Phillips, C. (June 1, 2003). "Eastern Hellbender Status Assessment Report" (PDF). U.S. Fish and Wildlife Service. Archived (PDF) from the original on September 4, 2012. Retrieved August 25, 2012.
- ^ a b c Wake, David B. "Caudata". Encyclopædia Britannica. Archived from the original on May 16, 2013. Retrieved August 25, 2012.
- ^ Cogger, H. G. (1998). Zweifel, R. G (ed.). Encyclopedia of Reptiles and Amphibians. Academic Press. pp. 69–70. ISBN 978-0-12-178560-4.
- ^ Stebbins & Cohen 1995, p. 4.
- ^ Dorit, Walker & Barnes 1991, p. 858.
- ^ Duellman, William E. "Gymnophiona". Encyclopædia Britannica. Archived from the original on January 14, 2012. Retrieved September 30, 2012.
- ^ Zylberberg, Louise; Wake, Marvalee H. (1990). "Structure of the scales of Dermophis and Microcaecilia (Amphibia: Gymnophiona), and a comparison to dermal ossifications of other vertebrates". Journal of Morphology. 206 (1): 25–43. doi:10.1002/jmor.1052060104. PMID 29865751. S2CID 46929507. Archived from the original on December 16, 2017. Retrieved November 10, 2016.
- ^ Biodiversity Institute of Ontario; Hebert, Paul D. N. (October 12, 2008). "Amphibian morphology and reproduction". Encyclopedia of Earth. Archived from the original on February 1, 2008. Retrieved August 15, 2012.
- ^ Stebbins & Cohen 1995, pp. 10–11.
- ^ Spearman, R. I. C. (1973). The Integument: A Textbook of Skin Biology. Cambridge University Press. p. 81. ISBN 978-0-521-20048-6.
Amphibian skin colour.
- ^ a b c d Dorit, Walker & Barnes 1991, p. 846.
- ^ a b c Stebbins & Cohen 1995, pp. 26–36.
- ^ a b Beneski, John T. Jr. (September 1989). "Adaptive significance of tail autotomy in the salamander, Ensatina". Journal of Herpetology. 23 (3): 322–324. doi:10.2307/1564465. JSTOR 1564465.
- ^ Dorit, Walker & Barnes 1991, p. 306.
- ^ González, A.; López, J. M.; Morona, R.; Morona, N. (2020). "The Organization of the Central Nervous System of Amphibians". In Hass, J. H. (ed.). Evolutionary Neuroscience. p. 127. ISBN 978-0-12-820584-6.
- ^ Stebbins & Cohen 1995, p. 100.
- ^ Stebbins & Cohen 1995, p. 69.
- ^ a b c Duellman, William E.; Zug, George R. (2012). "Amphibian". Encyclopædia Britannica. Archived from the original on March 8, 2012. Retrieved March 27, 2012.
- ^ a b c Dorit, Walker & Barnes 1991, p. 847.
- ^ Stebbins & Cohen 1995, p. 66.
- ^ a b Dorit, Walker & Barnes 1991, p. 849.
- ^ Brainerd, E. L. (1999). "New perspectives on the evolution of lung ventilation mechanisms in vertebrates". Experimental Biology Online. 4 (2): 1–28. doi:10.1007/s00898-999-0002-1. S2CID 35368264.
- ^ Hopkins Gareth R.; Brodie Edmund D. Jr (2015). "Occurrence of Amphibians in Saline Habitats: A Review and Evolutionary Perspective". Herpetological Monographs. 29 (1): 1–27. doi:10.1655/HERPMONOGRAPHS-D-14-00006. S2CID 83659304.
- ^ Natchev, Nikolay; Tzankov, Nikolay; Geme, Richard (2011). "Green frog invasion in the Black Sea: habitat ecology of the Pelophylax esculentus complex (Anura, Amphibia) population in the region of Shablenska Tuzla lagoon in Bulgaria" (PDF). Herpetology Notes. 4: 347–351. Archived from the original (PDF) on September 24, 2015. Retrieved August 17, 2012.
- ^ Hogan, C. Michael (July 31, 2010). "Abiotic factor". Encyclopedia of Earth. National Council for Science and the Environment. Archived from the original on June 8, 2013. Retrieved September 30, 2012.
- ^ Stebbins & Cohen 1995, pp. 140–141.
- ^ a b Duellman, Willia E.; Trueb, Linda (1994). Biology of Amphibians. JHU Press. pp. 77–79. ISBN 978-0-8018-4780-6. Archived from the original on February 3, 2021. Retrieved October 15, 2020.
- ^ a b Stebbins & Cohen 1995, pp. 154–162.
- ^ Adams, Michael J.; Pearl, Christopher A. (2005). "Ascaphus truei". AmphibiaWeb. Archived from the original on November 4, 2012. Retrieved November 23, 2012.
- ^ Romano, Antonio; Bruni, Giacomo (2011). "Courtship behaviour, mating season and male sexual interference in Salamandrina perspicillata". Amphibia-Reptilia. 32 (1): 63–76. doi:10.1163/017353710X541878.
- ^ Adams, Erika M.; Jones, A. G.; Arnold, S. J. (2005). "Multiple paternity in a natural population of a salamander with long-term sperm storage". Molecular Ecology. 14 (6): 1803–1810. doi:10.1111/j.1365-294X.2005.02539.x. PMID 15836651. S2CID 18899524. Archived from the original on October 4, 2018. Retrieved November 10, 2016.
- ^ Kikuyama, Sakae; Kawamura, Kousuke; Tanaka, Shigeyasu; Yamamoto, Kakutoshi (1993). "Aspects of amphibian metamorphosis: Hormonal control". International Review of Cytology: A Survey of Cell Biology. Academic Press. pp. 105–126. ISBN 978-0-12-364548-7. Archived from the original on April 14, 2021. Retrieved October 15, 2020.
- ^ Newman, Robert A. (1992). "Adaptive plasticity in amphibian metamorphosis". BioScience. 42 (9): 671–678. doi:10.2307/1312173. JSTOR 1312173.
- ^ Gilbert, Perry W. (1942). "Observations on the eggs of Ambystoma maculatum with especial reference to the green algae found within the egg envelopes". Ecology. 23 (2): 215–227. doi:10.2307/1931088. JSTOR 1931088.
- ^ Waldman, Bruce; Ryan, Michael J. (1983). "Thermal advantages of communal egg mass deposition in wood frogs (Rana sylvatica)". Journal of Herpetology. 17 (1): 70–72. doi:10.2307/1563783. JSTOR 1563783. Archived from the original on July 14, 2021. Retrieved November 10, 2016.
- ^ Alder, Kraig; Trueb (2002). "Amphibians". In Halliday, Tim; Adler, Kraig (eds.). The Firefly Encyclopedia of Reptiles and Amphibians. Firefly Books. p. 17. ISBN 978-1-55297-613-5.
- ^ Meshaka, Walter E. Jr. "Eleutherodactylus planirostris". AmphibiaWeb. Archived from the original on June 9, 2013. Retrieved December 12, 2012.
- ^ Dalgetty, Laura; Kennedy, Malcolm W. (2010). "Building a home from foam: túngara frog foam nest architecture and three-phase construction process". Biology Letters. 6 (3): 293–296. doi:10.1098/rsbl.2009.0934. PMC 2880057. PMID 20106853.
- ^ "Proteins of frog foam nests". School of Life Sciences, University of Glasgow. Archived from the original on June 3, 2013. Retrieved August 24, 2012.
- ^ Stebbins & Cohen 1995, pp. 6–9.
- ^ Vitt, Laurie J.; Caldwell, Janalee P. (2013). Herpetology: An Introductory Biology of Amphibians and Reptiles. Academic Press. p. 42. ISBN 978-0123869197.
- ^ Janzen, Peter (May 10, 2005). "Nannophrys ceylonensis". AmphibiaWeb. Archived from the original on June 7, 2022. Retrieved July 20, 2012.
- ^ Duellman, W. E.; Zug, G. R. "Anura: From tadpole to adult". Encyclopædia Britannica. Archived from the original on November 2, 2012. Retrieved July 13, 2012.
- ^ Stebbins & Cohen 1995, pp. 179–181.
- ^ Venturi, Sebastiano (2011). "Evolutionary Significance of Iodine". Current Chemical Biology. 5 (3): 155–162. doi:10.2174/187231311796765012. ISSN 1872-3136. Archived from the original on December 9, 2019. Retrieved November 10, 2016.
- ^ Venturi, Sebastiano (2014). "Iodine, PUFAs and Iodolipids in Health and Disease: An Evolutionary Perspective". Human Evolution. 29 (1–3): 185–205. ISSN 0393-9375.
- ^ a b c Duellman, William E.; Zug, George R. (2012). "Anura". Encyclopædia Britannica. Archived from the original on November 2, 2012. Retrieved March 26, 2012.
- ^ Crump, Martha L. (1986). "Cannibalism by younger tadpoles: another hazard of metamorphosis". Copeia. 1986 (4): 1007–1009. doi:10.2307/1445301. JSTOR 1445301.
- ^ a b Wake, David B. (2012). "Caudata". Encyclopædia Britannica. Archived from the original on May 16, 2013. Retrieved March 26, 2012.
- ^ Valentine, Barry D.; Dennis, David M. (1964). "A comparison of the gill-arch system and fins of three genera of larval salamanders, Rhyacotriton, Gyrinophilus, and Ambystoma". Copeia. 1964 (1): 196–201. doi:10.2307/1440850. JSTOR 1440850.
- ^ Shaffer, H. Bradley (2005). "Ambystoma gracile". AmphibiaWeb. Archived from the original on December 26, 2012. Retrieved November 21, 2012.
- ^ a b Duellman, William E.; Trueb, Linda (1994). Biology of Amphibians. JHU Press. pp. 191–192. ISBN 978-0-8018-4780-6. Archived from the original on January 26, 2021. Retrieved October 15, 2020.
- ^ Kiyonaga, Robin R. "Metamorphosis vs. neoteny (paedomorphosis) in salamanders (Caudata)". Archived from the original on August 20, 2012. Retrieved November 21, 2012.
- ^ Stebbins & Cohen 1995, p. 196.
- ^ Shaffer, H. Bradley; Austin, C. C.; Huey, R. B. (1991). "The consequences of metamorphosis on salamander (Ambystoma) locomotor performance" (PDF). Physiological Zoology. 64 (1): 212–231. doi:10.1086/physzool.64.1.30158520. JSTOR 30158520. S2CID 87191067. Archived from the original (PDF) on February 10, 2020.
- ^ Breckenridge, W. R.; Nathanael, S.; Pereira, L. (1987). "Some aspects of the biology and development of Ichthyophis glutinosus". Journal of Zoology. 211 (3): 437–449. doi:10.1111/jzo.1987.211.3.437.
- ^ Wake, Marvalee H. (1977). "Fetal maintenance and its evolutionary significance in the Amphibia: Gymnophiona". Journal of Herpetology. 11 (4): 379–386. doi:10.2307/1562719. JSTOR 1562719. Archived from the original on October 4, 2018. Retrieved November 10, 2016.
- ^ Duellman, William E. (2012). "Gymnophiona". Encyclopædia Britannica. Archived from the original on January 14, 2012. Retrieved March 26, 2012.
- ^ Wilkinson, Mark; Kupfer, Alexander; Marques-Porto, Rafael; Jeffkins, Hilary; Antoniazzi, Marta M.; Jared, Carlos (2008). "One hundred million years of skin feeding? Extended parental care in a Neotropical caecilian (Amphibia: Gymnophiona)". Biology Letters. 4 (4): 358–361. doi:10.1098/rsbl.2008.0217. PMC 2610157. PMID 18547909.
- ^ Crump, Martha L. (1996). "Parental care among the Amphibia". Parental Care: Evolution, Mechanisms, and Adaptive Significance. Advances in the Study of Behavior. Vol. 25. pp. 109–144. doi:10.1016/S0065-3454(08)60331-9. ISBN 978-0-12-004525-9.
- ^ Brown, J. L.; Morales, V.; Summers, K. (2010). "A key ecological trait drove the evolution of biparental care and monogamy in an amphibian". American Naturalist. 175 (4): 436–446. doi:10.1086/650727. PMID 20180700. S2CID 20270737. Archived from the original on July 29, 2020. Retrieved November 10, 2016.
- ^ Dorit, Walker & Barnes 1991, pp. 853–854.
- ^ Fandiño, María Claudia; Lüddecke, Horst; Amézquita, Adolfo (1997). "Vocalisation and larval transportation of male Colostethus subpunctatus (Anura: Dendrobatidae)". Amphibia-Reptilia. 18 (1): 39–48. doi:10.1163/156853897X00297.
- ^ van der Meijden, Arie (January 18, 2010). "Alytes obstetricans". AmphibiaWeb. Archived from the original on December 25, 2012. Retrieved November 29, 2012.
- ^ Semeyn, E. (2002). "Rheobatrachus silus". Animal Diversity Web. University of Michigan Museum of Zoology. Archived from the original on July 6, 2012. Retrieved August 5, 2012.
- ^ Hero, Jean-Marc; Clarke, John; Meyer, Ed (2004). "Assa darlingtoni". IUCN Red List of Threatened Species. 2004. Retrieved October 2, 2019.
- ^ La Marca, Enrique; Azevedo-Ramos, Claudia; Silvano, Débora; Coloma, Luis A.; Ron, Santiago; Hardy, Jerry; Beier, Manfred (2010). "Pipa pipa (Suriname Toad)". IUCN Red List of Threatened Species. 2010. Retrieved October 2, 2019.
- ^ van Wijngaarden, René; Bolaños, Federico (1992). "Parental care in Dendrobates granuliferus (Anura: Dendrobatidae), with a description of the tadpole". Journal of Herpetology. 26 (1): 102–105. doi:10.2307/1565037. JSTOR 1565037. Archived from the original on October 4, 2018. Retrieved November 10, 2016.
- ^ a b Uno, Yoshinobu (2021). "Inference of evolution of vertebrate genomes and chromosomes from genomic and cytogenetic analyses using amphibians". Chromosome Science. 24 (1–2): 3–12. doi:10.11352/scr.24.3. Archived from the original on September 6, 2021. Retrieved September 6, 2021.
- ^ Nowoshilow, Sergej; Schloissnig, Siegfried; Fei, Ji-Feng; Dahl, Andreas; Pang, Andy W. C.; Pippel, Martin; Winkler, Sylke; Hastie, Alex R.; Young, George; Roscito, Juliana G.; Falcon, Francisco (2018). "The axolotl genome and the evolution of key tissue formation regulators". Nature. 554 (7690): 50–55. Bibcode:2018Natur.554...50N. doi:10.1038/nature25458. ISSN 0028-0836. PMID 29364872.
- ^ Gabbard, Jesse (2000). "Siren intermedia: Lesser Siren". Animal Diversity Web. University of Michigan Museum of Zoology. Archived from the original on January 2, 2010. Retrieved August 11, 2012.
- ^ Da Silva, H. R.; De Britto-Pereira, M. C. (2006). "How much fruit do fruit-eating frogs eat? An investigation on the diet of Xenohyla truncata (Lissamphibia: Anura: Hylidae)". Journal of Zoology. 270 (4): 692–698. doi:10.1111/j.1469-7998.2006.00192.x. Archived from the original on June 23, 2019. Retrieved November 10, 2016.
- ^ Trueb, Linda; Gans, Carl (1983). "Feeding specializations of the Mexican burrowing toad, Rhinophrynus dorsalis (Anura: Rhinophrynidae)" (PDF). Journal of Zoology. 199 (2): 189–208. doi:10.1111/j.1469-7998.1983.tb02090.x. hdl:2027.42/74489. Archived (PDF) from the original on July 27, 2020. Retrieved August 27, 2019.
- ^ Hamilton, W. J. Jr. (1948). "The food and feeding behavior of the green frog, Rana clamitans Latreille, in New York State". Copeia. American Society of Ichthyologists and Herpetologists. 1948 (3): 203–207. doi:10.2307/1438455. JSTOR 1438455.
- ^ Stebbins & Cohen 1995, p. 56.
- ^ Stebbins & Cohen 1995, pp. 57–58.
- ^ Radcliffe, Charles W.; Chiszar, David; Estep, Karen; Murphy, James B.; Smith, Hobart M. (1986). "Observations on pedal luring and pedal movements in Leptodactylid frogs". Journal of Herpetology. 20 (3): 300–306. doi:10.2307/1564496. JSTOR 1564496.
- ^ Toft, Catherine A. (1981). "Feeding ecology of Panamanian litter anurans: patterns in diet and foraging mode". Journal of Herpetology. 15 (2): 139–144. doi:10.2307/1563372. JSTOR 1563372. Archived from the original on July 30, 2020. Retrieved November 10, 2016.
- ^ Bemis, W. E.; Schwenk, K.; Wake, M. H. (1983). "Morphology and function of the feeding apparatus in Dermophis mexicanus (Amphibia: Gymnophiona)". Zoological Journal of the Linnean Society. 77 (1): 75–96. doi:10.1111/j.1096-3642.1983.tb01722.x. Archived from the original on July 30, 2020. Retrieved November 10, 2016.
- ^ Stebbins & Cohen 1995, pp. 181–185.
- ^ a b Stebbins & Cohen 1995, pp. 76–77.
- ^ Sullivan, Brian K. (1992). "Sexual selection and calling behavior in the American toad (Bufo americanus)". Copeia. 1992 (1): 1–7. doi:10.2307/1446530. JSTOR 1446530.
- ^ Toledo, L. F.; Haddad, C. F. B. (2007). "Capitulo 4" (PDF). When frogs scream! A review of anuran defensive vocalizations (Thesis). Instituto de Biociências, São Paulo. Archived (PDF) from the original on September 4, 2012. Retrieved August 13, 2012.
- ^ Johnson, Steve A. (2010). "The Cuban Treefrog (Osteopilus septentrionalis) in Florida". EDIS. University of Florida. Archived from the original on August 20, 2012. Retrieved August 13, 2012.
- ^ Shine, Richard (1979). "Sexual selection and sexual dimorphism in the Amphibia". Copeia. 1979 (2): 297–306. doi:10.2307/1443418. JSTOR 1443418.
- ^ a b c Gergits, W. F.; Jaeger, R. G. (1990). "Site attachment by the red-backed salamander, Plethodon cinereus". Journal of Herpetology. 24 (1): 91–93. doi:10.2307/1564297. JSTOR 1564297.
- ^ Casper, Gary S. "Plethodon cinereus". AmphibiaWeb. Archived from the original on June 9, 2013. Retrieved September 25, 2012.
- ^ Wells, K. D. (1977). "Territoriality and male mating success in the green frog (Rana clamitans)". Ecology. 58 (4): 750–762. doi:10.2307/1936211. JSTOR 1936211.
- ^ a b Barthalmus, G. T.; Zielinski W. J. (1988). "Xenopus skin mucus induces oral dyskinesias that promote escape from snakes". Pharmacology Biochemistry and Behavior. 30 (4): 957–959. doi:10.1016/0091-3057(88)90126-8. PMID 3227042. S2CID 25434883.
- ^ Crayon, John J. "Xenopus laevis". AmphibiaWeb. Archived from the original on October 9, 2014. Retrieved October 8, 2012.
- ^ Moodie, G. E. E. (1978). "Observations on the life history of the caecilian Typhlonectes compressicaudus (Dumeril and Bibron) in the Amazon basin". Canadian Journal of Zoology. 56 (4): 1005–1008. doi:10.1139/z78-141. Archived from the original on July 5, 2020. Retrieved November 10, 2016.
- ^ Brodie, Edmund D. Jr. (1968). "Investigations on the skin toxin of the adult rough-skinned newt, Taricha granulosa". Copeia. 1968 (2): 307–313. doi:10.2307/1441757. JSTOR 1441757.
- ^ a b Hanifin, Charles T.; Yotsu-Yamashita, Mari; Yasumoto, Takeshi; Brodie, Edmund D.; Brodie, Edmund D. Jr. (1999). "Toxicity of dangerous prey: variation of tetrodotoxin levels within and among populations of the newt Taricha granulosa". Journal of Chemical Ecology. 25 (9): 2161–2175. doi:10.1023/A:1021049125805. S2CID 543221. Archived from the original on July 5, 2020. Retrieved November 10, 2016.
- ^ Geffeney, Shana L.; Fujimoto, Esther; Brodie, Edmund D.; Brodie, Edmund D. Jr.; Ruben, Peter C. (2005). "Evolutionary diversification of TTX-resistant sodium channels in a predator–prey interaction". Nature. 434 (7034): 759–763. Bibcode:2005Natur.434..759G. doi:10.1038/nature03444. PMID 15815629. S2CID 4426708.
- ^ Stebbins & Cohen 1995, p. 110.
- ^ Patocka, Jiri; Wulff, Kräuff; Palomeque, MaríaVictoria (1999). "Dart Poison Frogs and Their Toxins". ASA Newsletter. 5 (75). ISSN 1057-9419. Archived from the original on March 23, 2014. Retrieved January 29, 2013.
- ^ Darst, Catherine R.; Cummings, Molly E. (March 9, 2006). "Predator learning favours mimicry of a less-toxic model in poison frogs". Nature. 440 (7081): 208–211. Bibcode:2006Natur.440..208D. doi:10.1038/nature04297. PMID 16525472.
- ^ Brodie, Edmund D. Jr.; Nowak, Robert T.; Harvey, William R. (1979). "Antipredator secretions and behavior of selected salamanders against shrews". Copeia. 1979 (2): 270–274. doi:10.2307/1443413. JSTOR 1443413.
- ^ Brodie, E. D. Jr. (1978). "Biting and vocalisation as antipredator mechanisms in terrestrial salamanders". Copeia. 1978 (1): 127–129. doi:10.2307/1443832. JSTOR 1443832.
- ^ Hloch, A. (2010). What Does a Salamander Remember After Winter? (PDF). University of Vienna. Fakultät für Lebenswissenschaften. Archived (PDF) from the original on October 4, 2018. Retrieved November 15, 2015.
- ^ Stancher, G.; Rugani, R.; Regolin, L.; Vallortigara, G. (2015). "Numerical discrimination by frogs (Bombina orientalis)". Animal Cognition. 18 (1): 219–229. doi:10.1007/s10071-014-0791-7. PMID 25108417. S2CID 16499583. Archived from the original on July 14, 2021. Retrieved November 10, 2016.
- ^ McCallum, M. L. (2007). "Amphibian decline or extinction? Current declines dwarf background extinction rate". Journal of Herpetology. 41 (3): 483–491. doi:10.1670/0022-1511(2007)41[483:ADOECD]2.0.CO;2. S2CID 30162903.
- ^ "What does it mean to be human?". Smithsonian National Museum of Natural History. Archived from the original on November 22, 2013. Retrieved November 19, 2013.
- ^ Hoekstra, J. M.; Molnar, J. L.; Jennings, M.; Revenga, C.; Spalding, M. D.; Boucher, T. M.; Robertson, J. C.; Heibel, T. J.; Ellison, K. (2010). "Number of Globally Threatened Amphibian Species by Freshwater Ecoregion". The Atlas of Global Conservation: Changes, Challenges, and Opportunities to Make a Difference. The Nature Conservancy. Archived from the original on October 27, 2012. Retrieved September 5, 2012.
- ^ "Amphibian Specialist Group". IUCN SSC Amphibian Specialist Group. Archived from the original on February 22, 2011. Retrieved March 30, 2012.
- ^ Jennings, W. Bryan; Bradford, David F.; Johnson, Dale F. (1992). "Dependence of the garter snake Thamnophis elegans on amphibians in the Sierra Nevada of California". Journal of Herpetology. 26 (4): 503–505. doi:10.2307/1565132. JSTOR 1565132. Archived from the original on October 4, 2018. Retrieved November 10, 2016.
- ^ Stebbins & Cohen 1995, p. 249.
- ^ a b Hall, J.R.; Henry, F.P.P. (1992). "Review: Assessing Effects of Pesticide on Amphibians and Reptiles: Status and needs". Herpetological Journal. 2: 65–71.
- ^ a b "Amphibian Conservation Action Plan". IUCN. Archived from the original on April 27, 2012. Retrieved March 30, 2012.
- ^ "Panama Amphibian Rescue and Conservation Project". Amphibian Ark. Archived from the original on June 14, 2010. Retrieved March 30, 2012.
- ^ Regier, Henry A.; Baskerville, Gordon, L. (1996). "Sustainability Issues for Resource Managers". Sustainable redevelopment of regional ecosystems degraded by exploitive development. DIANE Publishing. pp. 36–38. ISBN 978-0-7881-4699-2. Archived from the original on April 14, 2021. Retrieved October 15, 2020.
Cited texts
- Dorit, R. L.; Walker, W. F.; Barnes, R. D. (1991). Zoology. Saunders College Publishing. ISBN 978-0-03-030504-7.
- Stebbins, Robert C.; Cohen, Nathan W. (1995). A Natural History of Amphibians. Princeton University Press. ISBN 978-0-691-03281-8.
Further reading
- Carroll, Robert L. (1988). Vertebrate Paleontology and Evolution. W. H. Freeman. ISBN 978-0-7167-1822-2.
- Carroll, Robert L. (2009). The Rise of Amphibians: 365 Million Years of Evolution. Johns Hopkins University Press. ISBN 978-0-8018-9140-3.
- Duellman, William E.; Linda Trueb (1994). Biology of Amphibians. Johns Hopkins University Press. ISBN 978-0-8018-4780-6.
- Frost, Darrel R.; Grant, Taran; Faivovich, Julián; Bain, Raoul H.; Haas, Alexander; Haddad, Célio F.B.; De Sá, Rafael O.; Channing, Alan; Wilkinson, Mark; Donnellan, Stephen C.; Raxworthy, Christopher J.; Campbell, Jonathan A.; Blotto, Boris L.; Moler, Paul; Drewes, Robert C.; Nussbaum, Ronald A.; Lynch, John D.; Green, David M.; Wheeler, Ward C. (2006). "The Amphibian Tree of Life". Bulletin of the American Museum of Natural History. 297: 1–291. doi:10.1206/0003-0090(2006)297[0001:TATOL]2.0.CO;2. hdl:2246/5781. S2CID 86140137.
- Pounds, J. Alan; Bustamante, Martín R.; Coloma, Luis A.; Consuegra, Jamie A.; Fogden, Michael P. L.; Foster, Pru N.; La Marca, Enrique; Masters, Karen L.; Merino-Viteri, Andrés; Puschendorf, Robert; Ron, Santiago R.; Sánchez-Azofeifa, G. Arturo; Still, Christopher J.; Young, Bruce E. (2006). "Widespread amphibian extinctions from epidemic disease driven by global warming". Nature. 439 (7073): 161–167. Bibcode:2006Natur.439..161A. doi:10.1038/nature04246. PMID 16407945. S2CID 4430672.
- Stuart, Simon N.; Chanson, Janice S.; Cox, Neil A.; Young, Bruce E.; Rodrigues, Ana S. L.; Fischman, Debra L.; Waller, Robert W. (2004). "Status and trends of amphibian declines and extinctions worldwide". Science. 306 (5702): 1783–1786. Bibcode:2004Sci...306.1783S. CiteSeerX 10.1.1.225.9620. doi:10.1126/science.1103538. PMID 15486254. S2CID 86238651.
- Stuart, S. N.; Hoffmann, M.; Chanson, J. S.; Cox, N. A.; Berridge, R. J.; Ramani, P.; Young, B. E., eds. (2008). Threatened Amphibians of the World. Published by Lynx Edicions, in association with IUCN-The World Conservation Union, Conservation International and NatureServe. ISBN 978-84-96553-41-5. Archived from the original on October 30, 2014. Retrieved October 30, 2014.
External links
- Amphibians – AnimalSpot.net
- ArchéoZooThèque : Amphibians skeletons drawings : available in vector, image and PDF formats
- Amphibian Specialist Group
- Amphibian Ark
- AmphibiaWeb
- Global Amphibian Assessment Archived April 12, 2011, at the Wayback Machine
- Amphibian vocalisations on Archival Sound Recordings