다배체
Polyploidy다배체는 유기체의 세포들이 한 쌍 이상의 (상동) 염색체를 가지고 있는 상태입니다.세포에 핵이 있는 대부분의 종은 2배체인데, 이것은 그들이 2쌍의 염색체를 가지고 있다는 것을 의미하며, 각 염색체는 하나 이상의 염색체를 포함하고 두 부모로부터 각각 유래하여, 집합 사이에 상동 염색체 쌍이 생기게 됩니다.그러나 어떤 생물들은 배수체이다.다배체는 식물에서 특히 흔하다.대부분의 진핵 생물은 이배체 체세포를 가지고 있지만 감수분열로 반배체 생식체(난자와 정자)를 생산한다.단배체는 오직 한 세트의 염색체를 가지고 있고, 이 용어는 보통 이배체인 세포나 유기체에만 적용된다.예를 들어, 꿀벌과 다른 꿀벌의 수컷은 단층동물이다.동물과 달리, 식물과 다세포 조류는 두 개의 다세포 세대를 번갈아 가며 생활한다.배우체 생성은 반수체이고, 유사분열로 배우체를 생성하며, 포자체 생성은 이배체이며 감수분열로 포자를 생성한다.
다배체는 유사분열 중 또는 감수분열 중 염색체가 분리되지 못하거나 둘 이상의 [1]정자에 의한 난자의 수정으로 인해 비정상적인 세포분열로 인해 발생할 수 있다.게다가, 그것은 식물과 세포 배양에 의해 유발될 수 있다: 가장 잘 알려진 것은 콜히틴으로, 염색체가 두 배로 증가하게 될 수 있다. 비록 그것의 사용이 다른 덜 명백한 결과를 가져올 수도 있다.오리잘린은 또한 기존 염색체 함량을 두 배로 늘릴 것이다.
다배체는 간, 심장 근육, 골수, [2]태반의 고도로 분화된 인체 조직에서 발생한다.금붕어,[3] 연어, 도롱뇽과 같은 일부 동물의 체세포에서 발생하지만 야생종과 재배종 모두를 포함한 고사리와 꽃식물(Hibiscus rosa-sinensis 참조)에서 특히 흔하다.예를 들어, 사람에 의해 수천 년 동안 교배되고 변형된 밀은 두릅 또는 마카로니 밀의 일반적인 이름을 가진 2배체, 4배체, 그리고 빵 밀의 일반적인 이름을 가진 헥사플로이드(6배체)의 변종을 가지고 있다.Brassica속의 농업적으로 중요한 식물들 또한 사배체이다.사탕수수는 [4]8배체보다 높은 배수성을 가질 수 있다.
다중배체는 보통 그들의 이중배체 조상들과 교배할 수 없기 때문에 다중배체화는 교배체 분화의 메커니즘이 될 수 있다.예를 들어 에리트란테 페레그리나가 있다.염기서열 분석 결과, 이 종은 영국에서 도입되어 귀화한 E. guttata와 E. lutea 사이의 무균 3배체 잡종인 E. × robertsi에서 유래한 것으로 확인되었다.E. peregrina의 새로운 개체군은 E. × [5]robertsi의 지역 개체군의 게놈 복제를 통해 스코틀랜드 본토와 오크니 군도에서 발생했다.희귀한 유전자 돌연변이로 인해 E. peregrina는 [6]불임이 아니다.
용어.
종류들
다배체 유형은 핵 내 염색체 세트의 수에 따라 라벨이 지정됩니다.문자 x는 단일 세트의 염색체 수를 나타내기 위해 사용됩니다.
- 반수체(1세트, 1x)
- 이배체(2세트, 2배)
- 삼배체(3세트; 3배), 예를 들어 무균 샤프란 크로커스 또는 씨 없는 수박으로 타디그라다[7] 문에서도 흔히 볼 수 있는
- 사배체(4세트;[8] 4배), 예를 들어 연어과 물고기, 면화고시피움 히르수툼[9]
- 펜타플로이드(5세트; 5배), 예를 들어 케나이 버치(베툴라 케나이카)
- 헥사플로이드(6세트; 6배), 예를 들어 [10]밀의 일부 종인 키위프루트[11]
- 헵타플로이드 또는 셉타플로이드(7개 세트; 7배)
- 옥타플로이드 또는 옥토플로이드(8세트; 8배), 예를 들어 아시펜서(철갑상어속), 달리아스
- 데카플로이드(10세트; 10배), 예를 들어 특정 딸기
- 도데카플로이드 또는 두오데카플로이드(12세트, 12배), 예를 들어 셀로시아 아르젠테아 및 스파르타니앵클리카 식물 또는 양서류 크세노푸스 루웬조리엔시스.
분류
자동 용배체
자동고분배체는 단일 분류군에서 파생된 여러 염색체 세트를 가진 다중배체이다.
자연 자동 폴리올로이드의 두 가지 예는 피기백 식물인 Tolmiea menzisii와[13] 흰 철갑상어인 Acipenser [14]transontanum이다.자동복수의 대부분의 예는 감소하지 않은 (2n) 배우자의 융합에서 비롯되며, 이는 3배체([15]n + 2n = 3n) 또는 4배체(2n + 2n = 4n) 자손을 낳는다.삼배체 자손은 전형적으로 무균이지만(삼배체 블록의 현상과 같이) 어떤 경우에는 감소하지 않은 생식체를 많이 만들어 사배체 형성을 도울 수 있다.사배체로의 이 경로는 삼배체 [15]교량이라고 불린다.트리플로이드는 또한 무성 번식을 통해서도 지속될 수 있다.사실, 식물의 안정적인 자기배배체는 종종 원점성 짝짓기 시스템과 [16]관련이 있다.농업 시스템에서는 수박이나 [17]바나나처럼 자가배양이 씨앗이 없는 결과를 초래할 수 있습니다.삼배체는 또한 연어나 송어 양식에서 [18][19]무균을 유도하기 위해 사용된다.
드물게, 자동 폴리노이드는 사과(Malus domestus)[20] 싹 스포츠에서 관찰된 자발적인 체세포 게놈 두 배에서 발생한다.이것은 또한 인공적으로 유도되는 다배체의 가장 일반적인 경로이며, 여기서 원형질 융합이나 코르히틴, 오리잘린 또는 유사분열 억제제를 통한 치료와 같은 방법이 정상적인 유사분열을 방해하기 위해 사용되어 다배체 세포의 생성을 초래한다.이 과정은 식물 번식에 유용하며, 특히 플라스미드 [21]레벨에 걸쳐 생식질을 진행하려고 할 때 유용합니다.
자동 폴리노이드는 적어도 3개의 상동 염색체 세트를 가지고 있으며, 감수 분열 중(특히 최근에 형성된 자동 폴리플로이드에서도 신 폴리플로이드로 알려져 있음) 및 무배체 생식체 [22]생성으로 인한 다가 짝의 높은 비율과 관련된 생식력 저하를 초래할 수 있다.자연적 또는 인위적 번식 선택은 감수분열 중 2가 쌍을 복원함으로써 자기고분열에서 빠르게 감수분열을 안정시킬 수 있지만, 중복 염색체 간의 높은 상동성은 자기고분열로 인해 다염색체 [23]유전성을 나타낸다.이 특성은 종종 자동 폴리플로이드가 신 폴리플로이드 [24]단계를 통과한 후 일반적으로 이염색체 유전을 보이는 알로폴리플로이드와 구별하기 위한 진단 기준으로 사용된다.대부분의 다배체 종은 자기다중배체 또는 이질다중배체로 명확하게 특징지어지지만, 이러한 범주는 부모 하위 유전자 사이의 발산 스펙트럼의 끝을 나타낸다.종종 세그먼트형 알로폴리로이드라고 불리는 이 두 극단 사이에 있는 폴리플로이드는 [25][26]궤적에 따라 다른 중간 수준의 폴리염색체 유전을 나타낼 수 있다.
많은 요소들이 이 [29]비율을 추정하기 어렵게 하지만, 모든 폴리플로이드의 약 절반은 [27][28]자기다중배수의 결과라고 생각됩니다.
동종 다배체
알로폴리플로이드, 양성폴리플로이드 또는 헤테로폴리플로이드는 둘 이상의 분산분류에서 유래한 염색체를 가진 폴리플로이드이다.
자가다배체에서와 마찬가지로, 이는 주로 교배 전후에 발생할 수 있는 환원되지 않은 (2n) 생식체의 융합을 통해 발생한다.전자의 경우, 각 이배체 분류군의 환원되지 않은 배우자 또는 두 개의 자동사상 분류군의 환원된 배우자가 결합되어 알로폴리배체 자손을 형성한다.후자의 경우, 하나 이상의 이배체1 F 하이브리드는 융합하여 알로폴리배체 [30]자손을 형성하는 환원되지 않은 배우자를 생성한다.유전자 복제를 수반하는 교배는 이종다배체로의 보다 일반적인 경로일 수 있다. 왜냐하면1 분류군 사이의 F 교배체는 종종 감소되지 않은 생식체 형성의 비율이 높기 때문이다. 즉, 두 분류군의 게놈 간의 분리는 감수분열 [30]동안 동종 염색체 간의 비정상적인 쌍을 초래한다.이 경우에, 동종 다배체는 각각의 동종 염색체에 그들만의 상동 염색체를 제공함으로써 실제로 정상적이고 2가의 감수생물학적 쌍을 회복시킬 수 있다.만약 상동 염색체 사이의 차이가 두 하위 유전자에 걸쳐 있다면, 이것은 이론적으로 2가의 쌍과 이염색체 유전의 빠른 회복을 야기할 수 있다.그러나 다가 쌍은 최근에 형성된 많은 알로폴리로이드에서 공통적이기 때문에 감수생물 안정화의 대부분은 [22][24]선택을 통해 점진적으로 발생할 수 있다.
확립된 알로폴로이드에서 상동 염색체 간의 쌍은 드물기 때문에, 상동 대립 [31]유전자의 고정된 헤테로 접합으로부터 이익을 얻을 수 있다.어떤 경우에, 그러한 헤테로 접합은 자연적 맥락에서의 적합성 또는 농업적 맥락에서의 바람직한 특성 측면에서 유익한 이질적 효과를 가질 수 있다.이것은 농작물 종들 사이에서 이질 용배수의 유행을 부분적으로 설명할 수 있다.빵밀과 트리티칼레는 모두 6개의 염색체 세트를 가진 동종 폴리노이드의 예이다.면, 땅콩, 키노아는 여러 기원을 가진 동소체이다.황동식물에서, U의 삼각형은 이배체 종들 사이의 교배에서 파생된 세 개의 일반적인 이배체 황동식물(B. oleracea, B. rapa, B. nigra)과 세 개의 동배체 동물(B. napus, B. juncea, B. carinata) 사이의 관계를 설명한다.T. dubius, T. pratensis 및 T. porrifolius의 3가지 이배체 종과 2개의 동소체종(T. mirus 및 T. miscellus)[32] 사이에는 유사한 관계가 존재한다.개구리속 [33]Xenopus와 같이 동물에서도 알로폴리배체 진화의 복잡한 패턴이 관찰되었다.
무배수
특정 염색체 또는 염색체 세그먼트가 과소 또는 과다하게 표현된 유기체는 ("불량", "좋지 않음", "접힘"을 의미하는 그리스 단어에서 유래한) 유배체라고 한다.무배수성은 염색체 집합의 일부에서 수치적인 변화를 의미하는 반면, 다배수성은 염색체 [34]집합 전체의 수치적인 변화를 의미한다.
내분배체
다배체증은 인간의 [35]근육 조직과 같이 이배체인 동물의 일부 조직에서 발생한다.이것은 내분배체라고 알려져 있다.세포에 핵이 없는 종, 즉 원핵생물은 대형 박테리아인 Epulopiscium fishelsoni에서 [36]볼 수 있듯이 다배체일 수 있다.따라서 세포에 대해 배수성이 정의된다.
모노플로이드
단배체는 오직 한 세트의 염색체를 가지고 있고 이 용어는 보통 이배체 세포나 유기체에만 적용된다.그러한 유기체에 대한 더 일반적인 용어는 반수체이다.
시간 용어
신다중배체
새로 형성된 배수체입니다.
중복배체
그것은 보다 최근의 역사에서 다중배체가 되었다; 그것은 신다중배체만큼 새롭지도 않고 고다중배체만큼 오래되지도 않았다.이것은 중년 다배체입니다.종종 이것은 전체 게놈 복제에 이어 중간 수준의 이배체를 언급한다.
고생다배체
고대 게놈 복제는 아마도 모든 생명체의 진화 역사에서 일어났을 것이다.다양한 진화적 계통의 역사에서 오래 전에 일어난 복제 사건은 돌연변이와 유전자 번역이 다른 복제와 달리 각 염색체의 복사본을 점차 만들기 때문에 이후의 이배체화(시간에 따라 다배체로서 세포유전학적으로 행동하기 시작함) 때문에 발견하기가 어려울 수 있다.시간이 지남에 따라 유전자의 중복 복사가 돌연변이를 축적하여 비활성 의사유전자가 [37]되는 것이 일반적이다.
대부분의 경우, 이러한 사건들은 배열된 게놈을 비교해야만 추론할 수 있다.예기치 않지만 최근에 확인된 고대 게놈 복제의 예로는 빵집 효모(Saccharomyces cerevisiae), 겨자 잡초/탈레 크레스(Arabidopsis thaliana), 쌀(Oryza sativa), 그리고 척추동물의 초기 진화 조상(인간 혈통을 포함)과 텔레오스트 물고기의 [38]기원에 가까운 또 다른 것이 있다.앤지오스포이드(꽃피는 식물)는 그들의 조상에 고분배체를 가지고 있다.모든 진핵생물은 아마도 진화 역사의 어느 시점에 다배체 현상을 경험했을 것이다.
기타 유사 용어
핵형
핵형은 진핵생물 [39][40]종의 특징적인 염색체 보체이다.핵형의 준비와 연구는 세포학, 구체적으로는 세포유전학의 일부이다.
DNA의 복제와 전사는 진핵생물에서 고도로 표준화 되어 있지만, 동일한 고분자로 구성되었음에도 불구하고 염색체 수와 세부적인 조직에서의 종에 따라 매우 가변적인 핵형이라고 말할 수 없다.어떤 경우에는, 심지어 종에 따라 상당한 차이가 있다.이러한 변화는 진화 세포학이라고 불릴 수 있는 연구의 기초를 제공한다.
상동 염색체
상동 염색체는 종간 교배와 이질 다배체화를 거쳐 모인 염색체이며, 조상 종에서 그 관계는 완전히 상동체였다.예를 들어, 듀럼 밀은 두 개의 이배체 풀 종인 트리티쿰 우라르투와 애길롭스 스펠토이드의 종간 교배 결과물이다.두 이배체 조상은 크기와 유전자가 비슷한 7개의 염색체를 가지고 있었다.두럼 밀은 트리티쿰 우라르투에서 파생된 두 세트의 염색체와 애길롭스 스펙토이드에서 파생된 두 세트의 염색체를 가진 하이브리드 게놈을 포함하고 있다.트리티쿰 우라르투 부모로부터 파생된 각 염색체 쌍은 Aegilops speltoides 부모로부터 파생된 반대 염색체 쌍과 상동성이지만, 각 염색체 쌍 자체는 상동성이다.
예
동물
동물의 예는 편형동물, 거머리, 소금물 새우와 같은 비버티[41] 동물에서 더 흔하다.척추동물 내에서 안정적인 다배체의 예로는 연어과와 많은 잉어과(잉어과)[42]가 있다.어떤 물고기들은 400개나 되는 [42]염색체를 가지고 있다.다배체증은 또한 양서류에서 흔히 발생한다; 예를 들어, 생물의학적으로 중요한 제노푸스속은 12세트의 염색체를 가진 많은 다른 종을 포함한다.[43]다배체 도마뱀 또한 꽤 흔하다.대부분은 무균이고 [citation needed]처녀생식에 의해 번식한다; Liolaemus chiliensis와 같은 다른 것들은 성적 번식을 유지한다.다배체 두더지 도롱뇽은 모두 암컷이고 절취생식에 [44]의해 번식하며, 난자의 발달을 유발하기 위해 관련된 종의 이배체 수컷의 정자세포를 "도둑질"하지만 수컷의 DNA를 자손에게 통합하지는 않는다.
포유류의 간세포가 다배체인 반면, 다배체 포유류의 드문 예가 알려져 있지만, 대부분 태아 사망을 초래한다.플레인 비스카차쥐(Tympanoctomys barreae)로 알려진 아르헨티나의 거친 사막 지역에 사는 팔지동물 설치류가 이 '규칙'[45]의 예외로 보고되었다.그러나 염색체 페인트를 사용한 세심한 분석 결과 T. Barrerae의 각 염색체 복사본은 2개뿐이며, 이것이 진짜 [46]사질체라면 예상된 4개가 아니다.이 설치류는 쥐가 아니라 기니피그와 친칠라의 친척이다.그것의 "새로운" 이배체(2n) 숫자는 102이고, 그래서 그것의 세포는 대략 정상 크기의 두 배이다.가장 가까운 생존 관계는 같은 과의 안데스 비스카차-랫인 옥토미스 미맥스로, 2n=56이다.따라서 Octomys와 유사한 조상은 2배 염색체 때문에 부모로부터 생식적으로 격리된 사배체(즉, 2n = 4x = 112) 자손을 낳은 것으로 추정되었다.
Har Swarup(1956)은 수정 시기에 가까운 난자를 냉간 충격 처리하여 3배체 배아를 성공적으로 성숙시킨 [47][48]어류에서 다배체를 유도했다.추위나 열충격은 양서류의 생식체가 감소하지 않는 결과를 낳는 것으로 나타났지만, 이것은 [49]정자보다 난자에서 더 흔하게 발생한다.존 거든(1958)은 체세포에서 온전한 핵을 이식해 개구리 Xenopus(1952년 Brigs and King의 연구의 연장선)에서 올챙이 [50]단계로 발전할 수 있었다.영국의 과학자인 J. B. S. 홀데인은 이 연구가 의학적으로 응용될 수 있다는 점을 환영했고, 그 결과를 설명하면서 동물에 대해 "복제"라는 단어를 처음으로 사용한 사람 중 하나가 되었다.이후 야마나카 신야의 연구는 성숙한 세포가 어떻게 다능해지도록 재프로그래밍될 수 있는지 보여주었고, 그 가능성을 비줄기 세포로 확장시켰다.구르돈과 야마나카는 이 [50]공로로 2012년 노벨상을 공동 수상했다.
인간
진정한 다배체 세포는 간 실질 조직, 심장 근육, 태반 및 [2][51]골수와 같은 고도로 분화된 조직에서 발생하지만, 사람에게서는 거의 발생하지 않는다.이배수가 더 흔하다.
다배체는 69개의 염색체와 92개의 염색체를 가진 4배체 형태로 사람에게 발생한다.삼배체증은 보통 다배체 때문에 발생하며, 모든 인간 임신의 약 2~3%와 [citation needed]유산의 약 15%에서 발생한다.삼배체 개념의 대부분은 유산으로 끝난다; 오래 살아남은 것들은 보통 태어난 직후에 죽는다.경우에 따라서는 이배체 및 삼배체 세포군이 모두 존재하는 혼합로이디가 있으면 출생 후의 생존이 연장될 수 있다.완전한 삼배체 증후군을 가진 생후 7개월까지 생존한 아이에 대한 보고가 있었다.그는 정신적으로나 육체적으로나 정상적인 신생아 발육을 보이지 못했고 [52]면역력이 약한 기흉성 카리니 감염으로 사망했다.
삼배체는 두배체(여분의 반수체 세트는 어미에게서) 또는 두배체(여분의 반수체 세트는 어미에게서)의 결과일 수 있습니다.이안드리는 대부분 단일 정자에서 부성 반수체 집합의 복제에 의해 발생하지만, 또한 [53]난자의 분열 수정의 결과일 수도 있다.디지니는 이배체 난모세포로 이어지는 난모세포 생성 중 하나의 감수분열 실패 또는 난모세포에서 하나의 극체를 밀어내지 못함으로써 가장 흔하게 발생한다.디안드리는 초기 유산에서 우세한 것으로 보이는 반면 디안드리는 태아기에 [54]살아남은 3배체 접합자에서 우세한 것으로 보인다.하지만, 초기 유산들 중에서, 디지니는 또한 더 흔한 경우입니다. 임신 8+1⁄2주 또는 태아가 있는 경우.삼배체 태반과 태아에는 또한 여분의 반배체 세트의 기원에 의존하는 두 개의 뚜렷한 표현형이 있다.Digny에는 전형적으로 부신저형성과 매우 작은 [citation needed]태반을 가진 비대칭의 저성장 태아가 있다.디안드리에서는 부분하수체형 점이 [53]발달한다.이러한 원산지 부모 효과는 게놈 [citation needed]각인의 효과를 반영한다.
완전한 사배체는 삼배체보다 더 드물게 진단되지만, 초기 유산의 1~2%에서 관찰된다.그러나, 일부 사지방 세포는 태아 진단 시 염색체 분석에서 흔히 발견되며 일반적으로 '무해'로 간주됩니다.이러한 사배체 세포가 단순히 시험관내 세포 배양 중에 발생하는 경향이 있는지, 또는 그것들이 체내 태반 세포에도 존재하는지는 명확하지 않다.어쨌든, 사배체 모자이즘으로 진단된 태아/유아에 대한 임상 보고는 거의 없다.
혼합로이디는 인간의 이식 전 배아에서 매우 일반적으로 관찰되며, 단배체/이배체 및 이배체/사배체 혼합 세포군을 포함한다.이러한 배아가 착상되지 않아 진행 중인 임신에서 거의 발견되지 않는지 아니면 단순히 이배체 세포를 선호하는 선택적 과정이 있는지는 알려지지 않았다.
물고기
뇌척수어 [38]줄기 계통 내에서 다배체 현상이 발생했다.
식물
식물에서 다배체는 자주 발생하며, 일부 추정치는 살아있는 식물 종의 30-80%가 다배체이며, 많은 계통들은 그들의 [55][56][57][58]게놈에서 고대 다배체(paleopolyploidy)의 증거를 보여준다.앤지오즈팜 종의 다양성에 있어서의 거대한 폭발은 많은 [59]종들이 공유하는 고대 게놈 복제의 시기와 일치한 것으로 보인다.안지오스의 15%, 양치류 종양의 31%가 [60]배수성 증가를 동반하는 것으로 확인되었다.
다배체 식물은 감수성 또는 유사분열 기능 상실 및 환원되지 않은 (2n)[61] 생식체의 융합을 포함한 몇 가지 메커니즘에 의해 자연에서 자연적으로 발생할 수 있다.자동 폴리플로이드(예: 감자[62])와 동종 폴리플로이드(예: 유채, 밀 및 면)는 모두 야생 및 길들여진 식물 종에서 발견될 수 있다.
대부분의 폴리플로이드는 부모 종에 대한 새로운 변이 또는 형태를 나타내며, 이는 분화 과정과 생태적 [56][61]착취 과정에 기여할 수 있다.새롭게 형성된 알로폴리로이드의 새로운 변화를 이끄는 메커니즘은 유전자 용량 효과(게놈 내용의 더 많은 복사본에서 비롯됨), 서로 다른 유전자 조절 계층의 재결합, 염색체 재배열 및 후생유전학적 리모델링을 포함할 수 있으며, 이 모든 것이 유전자 함량 및/[63][64][65][66]또는 발현 수준에 영향을 미칠 수 있다.이러한 급격한 변화의 대부분은 생식 분리 및 분화에 기여할 수 있습니다.그러나 폴리플로이드와 그 모종 사이와 같이 중간배체 교잡에서 생성된 종자는 보통 비정상적인 내배엽 발달을 가지며,[67][68] 이는 그들의 생존력을 손상시키고, 따라서 폴리플로이드 분화에 기여한다.
어떤 식물은 3배체이다.감수분열이 교란됨에 따라 이 식물들은 모든 식물들이 동일한 유전적 구성을 가지고 있는 무균 상태가 된다.그 중에서도 식물적으로 번식하는 샤프란 크로커스(Crocus sativus).또, 극히 희귀한 태즈메이니아 관목 로마티아 태즈메이니카도 3배체 무균종이다.
자연적으로 발생하는 배수성 침엽수는 거의 없다.기원은 불분명하지만 [69]66개의 염색체를 가진 육각형(6배)인 코스트 레드우드 세쿼이아 세미퍼비렌스가 한 예다.
수생 식물, 특히 외떡잎식물에는 많은 수의 배수체가 [70]포함되어 있다.
농작물.
다배체 유도는 식물 번식 중 잡종의 불임증을 극복하기 위한 일반적인 기술이다.예를 들어, 삼중수소는 밀(Triticum Turgidum)과 호밀(Secale creale)의 잡종이다.그것은 부모의 인기 있는 특성을 결합하지만, 초기 하이브리드는 무균이다.다배체화 후 하이브리드는 비옥해지고, 따라서 더욱 전파되어 삼중수소화 될 수 있다.
어떤 상황에서는 다배체 작물이 무균이기 때문에 선호된다.예를 들어, 많은 씨앗이 없는 과일 품종들은 다배체의 결과로 씨앗이 없다.이러한 작물은 이식 같은 무성 기술을 사용하여 번식한다.
농작물 식물의 다배체는 화학적인 코르히틴으로 씨앗을 처리함으로써 가장 일반적으로 유발된다.
예
- 삼배체 작물: 일부 사과 품종(Belle de Boskoop, Jonagold, Mutsu, Ribston Pippin 등), 바나나, 감귤류, 생강, 수박,[71] 샤프란 크로커스, 코코넛의 하얀 과육
- 테트라플로이드 작물: 매우 적은 사과 품종, 듀럼 또는 마카로니 밀, 면화, 감자, 유채, 유채, 부추, 담배, 땅콩, 키노우, 펠라르고늄
- 헥사플로이드 작물 : 국화, 빵밀, 트리티칼레, 귀리, 키위프루트[11]
- 옥타플로이드 작물 : 딸기, 달리아, 팬지, 사탕수수, 오카(Oxalis tuberosa)[72]
- 도데카플로이드 작물: 일부 사탕수수[73] 잡종
어떤 작물들은 다양한 배수로 발견됩니다: 튤립과 백합은 보통 2배체와 3배체 둘 다로 발견됩니다; 백합은 2배체 또는 4배체로 사용 가능합니다; 사과와 킨노우 만다린은 2배체, 3배체 또는 4배체입니다.
곰팡이
식물과 동물 외에도, 다양한 진균 종의 진화 역사는 과거와 최근의 전체 유전자 복제 사건에 의해 점점이 찍혀 있다(검토는 Albertin과 Marullo 2012[74] 참조).폴리플로이드의 몇 가지 예가 알려져 있습니다.
- 자동다배체:[75] 알로미세스속의 수생균류, [76]빵집에서 사용되는 사카로미세스 세레비시아 균주 등
- 동종 다배체: 널리 분포하는 Cyathus stercoreus,[77] 동종 다배체 라거 효모 Saccharomyces pastorianus,[78] 동종 다배체 와인 부패 효모 Dekera bluxellensis [79]등
- 고생다배체: 인간의 병원체 뿌리줄기,[80][81] 사카로미세스속 등
또한, 다배체는 종종 몇몇 균류 분류군에서 매우 널리 퍼진 것으로 보이는 잡종화 및 망상 진화와 관련된다.실제로, 균질 분화(염색체 번호의 변화가 없는 잡종 분화)는 일부 곰팡이 종(담자균류 미크로보트리움 비올라세움[82] 등)에 대해 입증되었다.
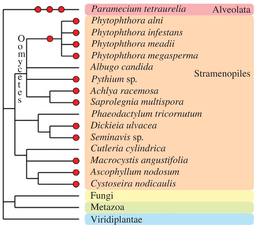
식물과 동물에 대해서는 균류의 잡종과 폴리플로이드는 그 조상이나 이배체에 비해 구조 및 기능상의 변화를 나타낸다.특히, 다배체 사카로미세스 게놈의 구조적, 기능적 결과는 식물 다배체 게놈의 진화적 운명을 현저하게 반영한다.유전자 손실과[84] [85]같은 보다 정확한 유전자 변형뿐만[83] 아니라 키메라 염색체로 이어지는 큰 염색체 배열이 설명되었습니다.동소체성 효모 S. pastorianus의 동질체는 전사체에 [86]대한 불평등한 기여도를 보여준다.표현형 다양화는 또한 [87]균류의 다배체화 및/또는 교배 후에 관찰되며, 자연선택 및 후속 적응 및 분화를 위한 연료를 생산한다.
크로마베올라타
다른 진핵생물 분류군은 진화 역사 동안 하나 이상의 다중배체 현상을 경험했다(검토는 Albertin and Marullo, 2012[74] 참조).진균류가 아닌 균류인 이 균류는 [88]피토프토라속과 같은 고생다배체 및 다배체 종의 몇 가지 예를 포함하고 있다.갈색 조류의 일부 종(Fucales, Laminariaes[89], diatoms[90])은 명백한 다중배체 게놈을 가지고 있습니다.알베올라타 그룹에서는 주목할 만한 종인 파라메슘 테트라우렐리아가 3회 연속 전유전자 복제를[91] 거치면서 고생다배체 연구의 주요 모델로 자리매김했다.
박테리아
각각의 데이노코커스 방사두란 박테리아는 4-8개의 [92]염색체를 가지고 있다.D. radioduran이 X선 조사 또는 건조에 노출되면 게놈이 수백 개의 짧은 랜덤 조각으로 분쇄될 수 있습니다.그럼에도 불구하고 D. radiodurans는 그러한 피폭에 대해 높은 내성을 가지고 있다.게놈이 정확하게 복원되는 메커니즘은 RecA 매개 상동 재조합과 확장 합성 의존성 가닥 어닐링(SDSA)[93]이라고 불리는 과정을 포함한다.
Azotobacter vinelandii는 [94]세포당 최대 80개의 염색체 복사본을 포함할 수 있다.그러나 이것은 빠르게 성장하는 문화에서만 관찰되는 반면, 합성 최소 배지에서 자란 문화는 다배체가 [95]아니다.
고세균
고균 할로박테륨 살리나륨은 다배체이며[96], 데이노코커스 방사선 요오드란스처럼 DNA 이중 가닥 [97]파손을 유발하는 X선 조사와 건조에 매우 저항성이 있습니다.염색체는 여러 조각으로 산산조각 나지만, 겹치는 조각들을 이용하여 완전한 염색체를 재생시킬 수 있다.이 메커니즘은 단일 가닥 DNA 결합 단백질을 사용하며 상동 재조합 [98]수복일 가능성이 높다.
「 」를 참조해 주세요.
레퍼런스
- ^ Solomon, Eldra (2014). Solomon/Martin/Martin/Berg, BIOLOGY. Cengage Learning. p. 344. ISBN 978-1285423586.
- ^ a b Velicky, P.; Meinhardt, G.; Plessl, K.; Vondra, S.; Weiss, T.; Haslinger, P.; Lendl, T.; Aumayr, K.; Mairhofer, M.; Zhu, X.; Schütz, B.; Hannibal, R. L.; Lindau, R.; Weil, B.; Ernerudh, J.; Neesen, J.; Egger, G.; Mikula, M.; Röhrl, C.; Urban, A. E.; Baker, J.; Knöfler, M.; Pollheimer, J. (2018). "Genome amplification and cellular senescence are hallmarks of human placenta development". PLOS Genetics. 14 (10): e1007698. doi:10.1371/journal.pgen.1007698. PMC 6200260. PMID 30312291.
- ^ Ohno, S.; Muramoto, J.; Christian, L.; Atkin, N. B. (1967). "Diploid-tetraploid relationship among old-world members of the fish family Cyprinidae". Chromosoma. 23 (1): 1–9. doi:10.1007/BF00293307. S2CID 1181521.
- ^ Vilela, Mariane de Mendonça; Del Bem, Luiz Eduardo; Van Sluys, Marie-Anne; de Setta, Nathalia; Kitajima, João Paulo; Cruz, Guilherme Marcelo Queiroga; Sforça, Danilo Augusto; de Souza, Anete Pereira; Ferreira, Paulo Cavalcanti Gomes; Grativol, Clícia; Cardoso-Silva, Claudio Benicio (2017-02-01). "Analysis of Three Sugarcane Homo/Homeologous Regions Suggests Independent Polyploidization Events of Saccharum officinarum and Saccharum spontaneum". Genome Biology and Evolution. 9 (2): 266–278. doi:10.1093/gbe/evw293. ISSN 1759-6653. PMC 5381655. PMID 28082603.
- ^ Vallejo Marín, M.; Buggs, R. J. A.; Cooley, A. M.; Puzey, J. R. (2015). "Speciation by genome duplication: Repeated origins and genomic composition of the recently formed allopolyploid species Mimulus peregrinus". Evolution. 69 (6): 1487–1500. doi:10.1111/evo.12678. PMC 5033005. PMID 25929999.
- ^ Fessenden, M. "Make Room for a New Bloom: New Flower Discovered". Scientific American. Retrieved 22 February 2017.
- ^ Bertolani, R. (2001). "Evolution of the reproductive mechanisms in Tardigrades: a review". Zoologischer Anzeiger. 240 (3–4): 247–252. doi:10.1078/0044-5231-00032.
- ^ Stouder, D. J.; Bisson, P. A.; Naiman, R. J. (1997). Pacific Salmon and Their Ecosystems: Status and Future Options. Springer. pp. 30–31. ISBN 978-0-412-98691-8. Retrieved 9 July 2013.
- ^ Adams, K. L.; Wendel, J. F. (2005). "Polyploidy and genome evolution in plants". Current Opinion in Plant Biology. 8 (2): 135–141. doi:10.1016/j.pbi.2005.01.001. PMID 15752992.
- ^ "Triticum - an overview ScienceDirect Topics".
- ^ a b Crowhurst, R. N.; Whittaker, D.; Gardner, R. C. "The genetic origin of kiwifruit".
- ^ Ainouche, M. L.; Fortune, P. M.; Salmon, A.; Parisod, C.; Grandbastien, M.-A.; Fukunaga, K.; Ricou, M.; Misset, M.-T. (2008). "Hybridization, polyploidy and invasion: Lessons from Spartina (Poaceae)". Biological Invasions. 11 (5): 1159–1173. doi:10.1007/s10530-008-9383-2. S2CID 25522023.
- ^ Soltis, D. E. (1984-01-01). "Autopolyploidy in Tolmiea menziesii (Saxifragaceae)". American Journal of Botany. 71 (9): 1171–1174. doi:10.2307/2443640. JSTOR 2443640.
- ^ Drauch Schreier, A.; Gille, D.; Mahardja, B.; May, B. (2011-11-01). "Neutral markers confirm the octoploid origin and reveal spontaneous autopolyploidy in white sturgeon, Acipenser transmontanus". Journal of Applied Ichthyology. 27: 24–33. doi:10.1111/j.1439-0426.2011.01873.x. ISSN 1439-0426.
- ^ a b Bretagnolle, F.; Thompson, J. D. (1995-01-01). "Gametes with the somatic chromosome number: mechanisms of their formation and role in the evolution of autopolyploid plants". New Phytologist. 129 (1): 1–22. doi:10.1111/j.1469-8137.1995.tb03005.x. ISSN 1469-8137. PMID 33874422.
- ^ Müntzing, Arne (March 1936). "The Evolutionary Significance of Autopolyploidy". Hereditas. 21 (2–3): 363–378. doi:10.1111/j.1601-5223.1936.tb03204.x. ISSN 1601-5223.
- ^ Varoquaux, F.; Blanvillain, R.; Delseny, M.; Gallois, P. (June 2000). "Less is better: new approaches for seedless fruit production". Trends in Biotechnology. 18 (6): 233–242. doi:10.1016/s0167-7799(00)01448-7. ISSN 0167-7799. PMID 10802558.
- ^ Cotter, D.; O'Donovan, V.; Ó Maoiléidigh, N.; Rogan, G.; Roche, N.; Wilkins, N. P. (June 2000). "An evaluation of the use of triploid Atlantic salmon (Salmo salar L.) in minimising the impact of escaped farmed salmon on wild populations". Aquaculture. 186 (1–2): 61–75. doi:10.1016/S0044-8486(99)00367-1.
- ^ Lincoln, R. F.; Scott, A. P. (1983). "Production of all-female triploid rainbow trout". Aquaculture. 30 (1–4): 375–380. doi:10.1016/0044-8486(83)90179-5.
- ^ Dermen, H. (May 1951). "Tetraploid and Diploid Adventitious Shoots: From a Giant Sport of McIntosh Apple". Journal of Heredity. 42 (3): 145–149. doi:10.1093/oxfordjournals.jhered.a106189. ISSN 0022-1503.
- ^ Dwivedi, S. L.; Upadhyaya, H. D.; Stalker, H. T.; Blair, M. W.; Bertioli, D. J.; Nielen, S.; Ortiz, R. (January 2007). Janick, Jules (ed.). Plant Breeding Reviews (PDF). John Wiley & Sons. pp. 179–230. doi:10.1002/9780470380130.ch3. ISBN 9780470380130.
- ^ a b Justin, R. (January 2002). "Neopolyploidy in Flowering Plants". Annual Review of Ecology and Systematics. 33 (1): 589–639. doi:10.1146/annurev.ecolsys.33.010802.150437. S2CID 41689384.
- ^ Parisod, C.; Holderegger, R.; Brochmann, C. (April 2010). "Evolutionary consequences of autopolyploidy". The New Phytologist. 186 (1): 5–17. doi:10.1111/j.1469-8137.2009.03142.x. ISSN 1469-8137. PMID 20070540.
- ^ a b Le Comber, S. C.; Ainouche, M. L.; Kovarik, A.; Leitch, A. R. (April 2010). "Making a functional diploid: from polysomic to disomic inheritance". The New Phytologist. 186 (1): 113–122. doi:10.1111/j.1469-8137.2009.03117.x. ISSN 1469-8137. PMID 20028473.
- ^ Stebbins, G. L. (1947). Types of Polyploids: Their Classification and Significance. Advances in Genetics. Vol. 1. pp. 403–429. doi:10.1016/s0065-2660(08)60490-3. ISBN 9780120176014. PMID 20259289.
- ^ Stebbins, G. L. (1950). Variation and Evolution in Plants. Oxford University Press.[페이지 필요]
- ^ Ramsey, J.; Schemske, D. W. (1998-01-01). "Pathways, Mechanisms, and Rates of Polyploid Formation in Flowering Plants". Annual Review of Ecology and Systematics. 29 (1): 467–501. doi:10.1146/annurev.ecolsys.29.1.467. S2CID 31637733.
- ^ Barker, M. S.; Arrigo, N.; Baniaga, A. E.; Li, Z.; Levin, D. A. (2016-04-01). "On the relative abundance of autopolyploids and allopolyploids". New Phytologist. 210 (2): 391–398. doi:10.1111/nph.13698. ISSN 1469-8137. PMID 26439879.
- ^ Doyle, J. J.; Sherman-Broyles, S. (2017-01-01). "Double trouble: taxonomy and definitions of polyploidy". New Phytologist. 213 (2): 487–493. doi:10.1111/nph.14276. ISSN 1469-8137. PMID 28000935.
- ^ a b Ramsey, J. (January 1998). "Pathways, Mechanisms, and Rates of Polyploid Formation in Flowering Plants". Annual Review of Ecology and Systematics. 29 (1): 467–501. doi:10.1146/annurev.ecolsys.29.1.467. S2CID 31637733.
- ^ Comai, L. (November 2005). "The advantages and disadvantages of being polyploid". Nature Reviews Genetics. 6 (11): 836–846. doi:10.1038/nrg1711. ISSN 1471-0056. PMID 16304599. S2CID 3329282.
- ^ Ownbey, M. (January 1950). "Natural Hybridization and Amphiploidy in the Genus Tragopogon". American Journal of Botany. 37 (7): 487–499. doi:10.2307/2438023. JSTOR 2438023.
- ^ Schmid, M.; Evans, B. J.; Bogart, J. P. (2015). "Polyploidy in Amphibia". Cytogenetic and Genome Research. 145 (3–4): 315–330. doi:10.1159/000431388. PMID 26112701.
- ^ Griffiths, A. J. F. (1999). An Introduction to genetic analysis. San Francisco, CA: W.H. Freeman. ISBN 978-0-7167-3520-5.[페이지 필요]
- ^ Parmacek, M. S.; Epstein, J. A. (2009). "Cardiomyocyte Renewal". New England Journal of Medicine. 361 (1): 86–88. doi:10.1056/NEJMcibr0903347. PMC 4111249. PMID 19571289.
- ^ Mendell, J. E.; Clements, K. D.; Choat, J. H.; Angert, E. R. (2008). "Extreme polyploidy in a large bacterium". Proceedings of the National Academy of Sciences. 105 (18): 6730–6734. Bibcode:2008PNAS..105.6730M. doi:10.1073/pnas.0707522105. PMC 2373351. PMID 18445653.
- ^ Edger, P. P.; Pires, C. J. (2009). "Gene and genome duplications: the impact of dosage-sensitivity on the fate of nuclear genes". Chromosome Research. 17 (5): 699–717. doi:10.1007/s10577-009-9055-9. PMID 19802709.
- ^ a b Clarke, John T.; Lloyd, Graeme T.; Friedman, Matt (2016-10-11). "Little evidence for enhanced phenotypic evolution in early teleosts relative to their living fossil sister group". Proceedings of the National Academy of Sciences. 113 (41): 11531–11536. doi:10.1073/pnas.1607237113. ISSN 0027-8424. PMC 5068283. PMID 27671652.
- ^ White, M. J. D. (1973). The Chromosomes (6th ed.). London: Chapman & Hall. p. 28.
- ^ Stebbins, G. L. (1950). "Chapter XII: The Karyotype". Variation and Evolution in Plants. New York, NY: Columbia University Press.[페이지 필요]
- ^ Otto, S. P.; Whitton, J. (2000). "Polyploid incidence and evolution" (PDF). Annual Review of Genetics. 34 (1): 401–437. CiteSeerX 10.1.1.323.1059. doi:10.1146/annurev.genet.34.1.401. PMID 11092833.
- ^ a b Leggatt, R. A.; Iwama, G. K. (2003). "Occurrence of polyploidy in the fishes". Reviews in Fish Biology and Fisheries. 13 (3): 237–246. doi:10.1023/B:RFBF.0000033049.00668.fe. S2CID 11649126.
- ^ Cannatella, D. C.; De Sa, R. O. (1993). "Xenopus laevis as a Model Organism". Society of Systematic Biologists. 42 (4): 476–507. doi:10.1093/sysbio/42.4.476.
- ^ Bonen, L.; Bi, J. P.; Fu, K.; Noble, J.; Niedzwiecki, D. W. A.; Niedzwiecki, J. (2007). "Unisexual salamanders (genus Ambystoma) present a new reproductive mode for eukaryotes". Genome. 50 (2): 119–136. doi:10.1139/g06-152. PMID 17546077. S2CID 42528911.
- ^ Gallardo, M. H.; González, C. A.; Cebrián, I. (2006). "Molecular cytogenetics and allotetraploidy in the red vizcacha rat, Tympanoctomys barrerae (Rodentia, Octodontidae)". Genomics. 88 (2): 214–221. doi:10.1016/j.ygeno.2006.02.010. PMID 16580173.
- ^ Svartman, M.; Stone, G.; Stanyon, R. (2005). "Molecular cytogenetics discards polyploidy in mammals". Genomics. 85 (4): 425–430. doi:10.1016/j.ygeno.2004.12.004. PMID 15780745.
- ^ Swarup, H. (1956). "Production of Heteroploidy in the Three-Spined Stickleback, Gasterosteus aculeatus (L.)". Nature. 178 (4542): 1124–1125. Bibcode:1956Natur.178.1124S. doi:10.1038/1781124a0. S2CID 4226624.
- ^ Swarup, H. (1959). "Production of triploidy in Gasterosteus aculeatus (L.)". Journal of Genetics. 56 (2): 129–142. doi:10.1007/BF02984740. S2CID 42913498.
- ^ Mable, B. K.; Alexandrou, M. A.; Taylor, M. I. (2011). "Genome duplication in amphibians and fish: an extended synthesis". Journal of Zoology. 284 (3): 151–182. doi:10.1111/j.1469-7998.2011.00829.x. S2CID 58937352.
- ^ a b "Nobel Prize in Physiology or Medicine 2012 Awarded for Discovery That Mature Cells Can Be Reprogrammed to Become Pluripotent". ScienceDaily. 8 Oct 2012.
- ^ Winkelmann, M.; Pfitzer, P.; Schneider, W. (1987). "Significance of polyploidy in megakaryocytes and other cells in health and tumor disease". Klinische Wochenschrift. 65 (23): 1115–1131. doi:10.1007/BF01734832. PMID 3323647. S2CID 23496028.
- ^ "Triploidy". National Organization for Rare Disorders. Retrieved 2018-12-23.
- ^ a b Baker, P.; Monga, A.; Baker, P. (2006). Gynaecology by Ten Teachers. London: Arnold. ISBN 978-0-340-81662-2.
- ^ Brancati, Francesco; Mingarelli, Rita; Dallapiccola, Bruno (2003-09-24). "Recurrent triploidy of maternal origin". European Journal of Human Genetics. 11 (12): 972–974. doi:10.1038/sj.ejhg.5201076. PMID 14508508. S2CID 28009278.
- ^ Meyers, L. A.; Levin, D. A. (2006). "On the Abundance of Polyploids in Flowering Plants". Evolution. 60 (6): 1198–1206. doi:10.1111/j.0014-3820.2006.tb01198.x. PMID 16892970.
- ^ a b Rieseberg, L. H.; Willis, J. H. (2007). "Plant Speciation". Science. 317 (5840): 910–914. Bibcode:2007Sci...317..910R. doi:10.1126/science.1137729. PMC 2442920. PMID 17702935.
- ^ Otto, S. P. (2007). "The Evolutionary Consequences of Polyploidy". Cell. 131 (3): 452–462. doi:10.1016/j.cell.2007.10.022. PMID 17981114. S2CID 10054182.
- ^ One Thousand Plant Transcriptomes Initiative (2019). "One thousand plant transcriptomes and the phylogenomics of green plants". Nature. 574 (7780): 679–685. doi:10.1038/s41586-019-1693-2. PMC 6872490. PMID 31645766.
- ^ Debodt, S.; Maere, S.; Vandepeer, Y. (2005). "Genome duplication and the origin of angiosperms". Trends in Ecology & Evolution. 20 (11): 591–597. doi:10.1016/j.tree.2005.07.008. PMID 16701441.
- ^ Wood, T. E.; Takebayashi, N.; Barker, M. S.; Mayrose, I.; Greenspoon, P. B.; Rieseberg, L. H. (2009). "The frequency of polyploid speciation in vascular plants". Proceedings of the National Academy of Sciences. 106 (33): 13875–13879. Bibcode:2009PNAS..10613875W. doi:10.1073/pnas.0811575106. JSTOR 40484335. PMC 2728988. PMID 19667210.
- ^ a b Comai, L. (2005). "The advantages and disadvantages of being polyploid". Nature Reviews Genetics. 6 (11): 836–846. doi:10.1038/nrg1711. PMID 16304599. S2CID 3329282.
- ^ Xu, X.; Xu, S.; Pan, S.; Cheng, B.; Zhang, D.; Mu, P.; Ni, G.; Zhang, S.; Yang, R.; Li, J.; Wang, G.; Orjeda, F.; Guzman, M.; Torres, R.; Lozano, O.; Ponce, D.; Martínez, G.; De La Cruz, S. K.; Chakrabarti, V. U.; Patil, K. G.; Skryabin, B. B.; Kuznetsov, N. V.; Ravin, T. V.; Kolganova, A. V.; Beletsky, A. V.; Mardanov, A.; Di Genova, D. M.; Bolser, D. M. A.; Martin, G.; Li, Y. (2011). "Genome sequence and analysis of the tuber crop potato". Nature. 475 (7355): 189–195. doi:10.1038/nature10158. PMID 21743474.
- ^ Osborn, T. C.; Pires, J.; Birchler, J. A.; Auger, D. L.; Chen, Z.; Lee, H.-S.; Comai, L.; Madlung, A.; Doerge, R. W.; Colot, V.; Martienssen, R. A. (2003). "Understanding mechanisms of novel gene expression in polyploids". Trends in Genetics. 19 (3): 141–147. doi:10.1016/S0168-9525(03)00015-5. PMID 12615008.
- ^ Chen, Z. J.; Ni, Z. (2006). "Mechanisms of genomic rearrangements and gene expression changes in plant polyploids". BioEssays. 28 (3): 240–252. doi:10.1002/bies.20374. PMC 1986666. PMID 16479580.
- ^ Chen, Z. J. (2007). "Genetic and Epigenetic Mechanisms for Gene Expression and Phenotypic Variation in Plant Polyploids". Annual Review of Plant Biology. 58: 377–406. doi:10.1146/annurev.arplant.58.032806.103835. PMC 1949485. PMID 17280525.
- ^ Albertin, W.; Balliau, T.; Brabant, P.; Chèvre, A. M.; Eber, F.; Malosse, C.; Thiellement, H. (2006). "Numerous and Rapid Nonstochastic Modifications of Gene Products in Newly Synthesized Brassica napus Allotetraploids". Genetics. 173 (2): 1101–1113. doi:10.1534/genetics.106.057554. PMC 1526534. PMID 16624896.
- ^ Pennington, P. D.; Costa, L. M.; Gutiérrez Marcos, J. F.; Greenland, A. J.; Dickinson, H. G. (Apr 2008). "When genomes collide: aberrant seed development following maize interploidy crosses". Annals of Botany. 101 (6): 833–843. doi:10.1093/aob/mcn017. PMC 2710208. PMID 18276791.
- ^ Von Wangenheim, K.-H.; Peterson, H.-P. (2004). "Aberrant endosperm development in interploidy crosses reveals a timer of differentiation". Developmental Biology. 270 (2): 277–289. doi:10.1016/j.ydbio.2004.03.014. PMID 15183714.
- ^ Ahuja, M. R.; Neale, D. B. (2002). "Origins of Polyploidy in Coast Redwood (Sequoia sempervirens (D. Don) Endl.) and Relationship of Coast Redwood to other Genera of Taxodiaceae". Silvae Genetica. 51: 2–3.
- ^ Les, D. H.; Philbrick, C. T. (1993). "Studies of hybridization and chromosome number variation in aquatic angiosperms: Evolutionary implications". Aquatic Botany. 44 (2–3): 181–228. doi:10.1016/0304-3770(93)90071-4.
- ^ "Seedless Fruits Make Others Needless". Archived from the original on 2019-02-03. Retrieved 2022-03-07.
- ^ Emshwiller, E. (2006). "Origins of polyploid crops: The example of the octaploid tuber crop Oxalis tuberosa". In Zeder, M. A.; Decker-Walters, D.; Emshwiller, E.; Bradley, D.; Smith, B. D. (eds.). Documenting Domestication: New Genetic and Archaeological Paradigms. Berkeley, CA: University of California Press. pp. 153–168.
- ^ Le Cunff, L.; Garsmeur, O.; Raboin, L. M.; Pauquet, J.; Telismart, H.; Selvi, A.; Grivet, L.; Philippe, R.; Begum, D.; Deu, M.; Costet, L.; Wing, R.; Glaszmann, J. C.; D'Hont, A. (2008). "Diploid/Polyploid Syntenic Shuttle Mapping and Haplotype-Specific Chromosome Walking Toward a Rust Resistance Gene (Bru1) in Highly Polyploid Sugarcane (2n ∼ 12x ∼ 115)". Genetics. 180 (1): 649–660. doi:10.1534/genetics.108.091355. PMC 2535714. PMID 18757946.
- ^ a b c Albertin, W.; Marullo, P. (2012). "Polyploidy in fungi: Evolution after whole-genome duplication". Proceedings of the Royal Society B. 279 (1738): 2497–2509. doi:10.1098/rspb.2012.0434. PMC 3350714. PMID 22492065.
- ^ Emerson, R.; Wilson, C. M. (1954). "Interspecific Hybrids and the Cytogenetics and Cytotaxonomy of Euallomyces". Mycologia. 46 (4): 393–434. doi:10.1080/00275514.1954.12024382. JSTOR 4547843.
- ^ Albertin, W.; Marullo, P.; Aigle, M.; Bourgais, A.; Bely, M.; Dillmann, C.; De Vienne, D.; Sicard, D. (2009). "Evidence for autotetraploidy associated with reproductive isolation in Saccharomyces cerevisiae: Towards a new domesticated species". Journal of Evolutionary Biology. 22 (11): 2157–2170. doi:10.1111/j.1420-9101.2009.01828.x. PMID 19765175.
- ^ Lu, B. C. (1964). "Polyploidy in the Basidiomycete Cyathus stercoreus". American Journal of Botany. 51 (3): 343–347. doi:10.2307/2440307. JSTOR 2440307.
- ^ Libkind, D.; Hittinger, C. T.; Valerio, E.; Gonçalves, C.; Dover, J.; Johnston, M.; Gonçalves, P.; Sampaio, J. P. (2011). "Microbe domestication and the identification of the wild genetic stock of lager-brewing yeast". Proceedings of the National Academy of Sciences. 108 (35): 14539–14544. Bibcode:2011PNAS..10814539L. doi:10.1073/pnas.1105430108. PMC 3167505. PMID 21873232.
- ^ Borneman, A. R.; Zeppel, R.; Chambers, P. J.; Curtin, C. D. (2014). "Insights into the Dekkera bruxellensis Genomic Landscape: Comparative Genomics Reveals Variations in Ploidy and Nutrient Utilisation Potential amongst Wine Isolates". PLOS Genetics. 10 (2): e1004161. doi:10.1371/journal.pgen.1004161. PMC 3923673. PMID 24550744.
- ^ Ma, L.-J.; Ibrahim, A. S.; Skory, C.; Grabherr, M. G.; Burger, G.; Butler, M.; Elias, M.; Idnurm, A.; Lang, B. F.; Sone, T.; Abe, A.; Calvo, S. E.; Corrochano, L. M.; Engels, R.; Fu, J.; Hansberg, W.; Kim, J.-M.; Kodira, C. D.; Koehrsen, M. J.; Liu, B.; Miranda Saavedra, D.; O'Leary, S.; Ortiz Castellanos, L.; Poulter, R.; Rodríguez Romero, J.; Ruiz Herrera, J.; Shen, Y.-Q.; Zeng, Q.; Galagan, J.; Birren, B. W. (2009). Madhani, H. D. (ed.). "Genomic Analysis of the Basal Lineage Fungus Rhizopus oryzae Reveals a Whole-Genome Duplication". PLOS Genetics. 5 (7): e1000549. doi:10.1371/journal.pgen.1000549. PMC 2699053. PMID 19578406.
- ^ Wong, S.; Butler, G.; Wolfe, K. H. (2002). "Gene order evolution and paleopolyploidy in hemiascomycete yeasts". Proceedings of the National Academy of Sciences. 99 (14): 9272–9277. Bibcode:2002PNAS...99.9272W. doi:10.1073/pnas.142101099. JSTOR 3059188. PMC 123130. PMID 12093907.
- ^ Devier, B.; Aguileta, G.; Hood, M. E.; Giraud, T. (2009). "Using phylogenies of pheromone receptor genes in the Microbotryum violaceum species complex to investigate possible speciation by hybridization". Mycologia. 102 (3): 689–696. doi:10.3852/09-192. PMID 20524600. S2CID 9072505.
- ^ Dunn, B.; Sherlock, G. (2008). "Reconstruction of the genome origins and evolution of the hybrid lager yeast Saccharomyces pastorianus". Genome Research. 18 (10): 1610–1623. doi:10.1101/gr.076075.108. PMC 2556262. PMID 18787083.
- ^ Nakao, Y.; Kanamori, T.; Itoh, T.; Kodama, Y.; Rainieri, S.; Nakamura, N.; Shimonaga, T.; Hattori, M.; Ashikari, T. (2009). "Genome Sequence of the Lager Brewing Yeast, an Interspecies Hybrid". DNA Research. 16 (2): 115–129. doi:10.1093/dnares/dsp003. PMC 2673734. PMID 19261625.
- ^ Scannell, D. R.; Byrne, K. P.; Gordon, J. L.; Wong, S.; Wolfe, K. H. (2006). "Multiple rounds of speciation associated with reciprocal gene loss in polyploid yeasts". Nature. 440 (7082): 341–345. Bibcode:2006Natur.440..341S. doi:10.1038/nature04562. hdl:2262/22660. PMID 16541074. S2CID 94448.
- ^ Minato, T.; Yoshida, S.; Ishiguro, T.; Shimada, E.; Mizutani, S.; Kobayashi, O.; Yoshimoto, H. (2009). "Expression profiling of the bottom fermenting yeast Saccharomyces pastorianus orthologous genes using oligonucleotide microarrays". Yeast. 26 (3): 147–165. doi:10.1002/yea.1654. PMID 19243081. S2CID 23349682.
- ^ Lidzbarsky, G. A.; Shkolnik, T.; Nevo, E. (2009). Idnurm, A. (ed.). "Adaptive Response to DNA-Damaging Agents in Natural Saccharomyces cerevisiae Populations from "Evolution Canyon", Mt. Carmel, Israel". PLOS ONE. 4 (6): e5914. Bibcode:2009PLoSO...4.5914L. doi:10.1371/journal.pone.0005914. PMC 2690839. PMID 19526052.
- ^ Ioos, R.; Andrieux, A.; Marçais, B.; Frey, P. (2006). "Genetic characterization of the natural hybrid species Phytophthora alni as inferred from nuclear and mitochondrial DNA analyses". Fungal Genetics and Biology. 43 (7): 511–529. doi:10.1016/j.fgb.2006.02.006. PMID 16626980. S2CID 43275127.
- ^ Phillips, N.; Kapraun, D. F.; Gómez Garreta, A.; Ribera Siguan, M. A.; Rull, J. L.; Salvador Soler, N.; Lewis, R.; Kawai, H. (2011). "Estimates of nuclear DNA content in 98 species of brown algae (Phaeophyta)". AoB Plants. 2011: plr001. doi:10.1093/aobpla/plr001. PMC 3064507. PMID 22476472.
- ^ Chepurnov, V. A.; Mann, D. G.; Vyverman, W.; Sabbe, K.; Danielidis, D. B. (2002). "Sexual Reproduction, Mating System, and Protoplast Dynamics of Seminavis (Bacillariophyceae)". Journal of Phycology. 38 (5): 1004–1019. doi:10.1046/j.1529-8817.2002.t01-1-01233.x. S2CID 84299819.
- ^ Aury, J.-M.; Jaillon, O.; Duret, L.; Noel, B.; Jubin, C.; Porcel, B. M.; Ségurens, B.; Daubin, V.; Anthouard, V.; Aiach, N.; Arnaiz, O.; Billaut, A.; Beisson, J.; Blanc, I.; Bouhouche, K.; Câmara, F.; Duharcourt, S.; Guigo, R.; Gogendeau, D.; Katinka, M.; Keller, A.-M.; Kissmehl, R.; Klotz, C.; Koll, F.; Le Mouël, A.; Lepère, G.; Malinsky, S.; Nowacki, M.; Nowak, J. K.; Plattner, H.; et al. (2006). "Global trends of whole-genome duplications revealed by the ciliate Paramecium tetraurelia". Nature. 444 (7116): 171–178. Bibcode:2006Natur.444..171A. doi:10.1038/nature05230. PMID 17086204.
- ^ Hansen, M. T. (1978). "Multiplicity of genome equivalents in the radiation-resistant bacterium Micrococcus radiodurans". Journal of Bacteriology. 134 (1): 71–75. doi:10.1128/JB.134.1.71-75.1978. PMC 222219. PMID 649572.
- ^ Zahradka, K.; Slade, D.; Bailone, A.; Sommer, S.; Averbeck, D.; Petranovic, M.; Lindner, A. B.; Radman, M. (2006). "Reassembly of shattered chromosomes in Deinococcus radiodurans". Nature. 443 (7111): 569–573. Bibcode:2006Natur.443..569Z. doi:10.1038/nature05160. PMID 17006450. S2CID 4412830.
- ^ Nagpal, P.; Jafri, S.; Reddy, M. A.; Das, H. K. (1989). "Multiple chromosomes of Azotobacter vinelandii". Journal of Bacteriology. 171 (6): 3133–3138. doi:10.1128/jb.171.6.3133-3138.1989. PMC 210026. PMID 2785985.
- ^ Maldonado, R.; Jiménez, J.; Casadesús, J. (1994). "Changes of ploidy during the Azotobacter vinelandii growth cycle". Journal of Bacteriology. 176 (13): 3911–3919. doi:10.1128/jb.176.13.3911-3919.1994. PMC 205588. PMID 8021173.
- ^ Soppa, J. (2011). "Ploidy and gene conversion in Archaea". Biochemical Society Transactions. 39 (1): 150–154. doi:10.1042/BST0390150. PMID 21265763. S2CID 31385928.
- ^ Kottemann, M.; Kish, A.; Iloanusi, C.; Bjork, S.; DiRuggiero, J. (2005). "Physiological responses of the halophilic archaeon Halobacterium sp. strain NRC1 to desiccation and gamma irradiation" (PDF). Extremophiles. 9 (3): 219–227. doi:10.1007/s00792-005-0437-4. PMID 15844015. S2CID 8391234.
- ^ DeVeaux, L. C.; Müller, J. A.; Smith, J.; Petrisko, J.; Wells, D. P.; DasSarma, S. (2007). "Extremely radiation-resistant mutants of a halophilic archaeon with increased single-stranded DNA-binding protein (RPA) gene expression". Radiation Research. 168 (4): 507–514. Bibcode:2007RadR..168..507D. doi:10.1667/RR0935.1. PMID 17903038. S2CID 22393850.
추가 정보
- Snustad, D. P.; et al. (2006). Principles of Genetics (4th ed.). Hoboken, New Jersey: John Wiley & Sons. ISBN 978-0-471-69939-2.
- The Arabidopsis Genome Initiative (2000). "Analysis of the genome sequence of the flowering plant Arabidopsis thaliana". Nature. 408 (6814): 796–815. Bibcode:2000Natur.408..796T. doi:10.1038/35048692. PMID 11130711.
- Eakin, G. S.; Behringer, R. R. (2003). "Tetraploid development in the mouse". Developmental Dynamics. 228 (4): 751–766. doi:10.1002/dvdy.10363. PMID 14648853.
- Gaeta, R. T.; Pires, J. C.; Iniguez-Luy, F.; Leon, E.; Osborn, T. C. (2007). "Genomic Changes in Resynthesized Brassica napus and Their Effect on Gene Expression and Phenotype". The Plant Cell Online. 19 (11): 3403–3417. doi:10.1105/tpc.107.054346. PMC 2174891. PMID 18024568.
- Gregory, T. R.; Mable, B. K. (2005). "Polyploidy in animals". In Gregory, T. R. (ed.). The Evolution of the Genome. San Diego, California: Elsevier. pp. 427–517.
- Jaillon, O.; Aury, J.-M.; Brunet, F.; Petit, J.-L.; Stange-Thomann, N.; Mauceli, E.; Bouneau, L.; Fischer, C.; Ozouf-Costaz, C.; Bernot, A.; Nicaud, S.; Jaffe, D.; Fisher, S.; Lutfalla, G.; Dossat, C.; Segurens, B.; Dasilva, C.; Salanoubat, M.; Levy, M.; Boudet, N.; Castellano, S.; Anthouard, V.; Jubin, C.; Castelli, V.; Katinka, M.; Vacherie, B.; Biémont, C.; Skalli, Z.; Cattolico, L.; Poulain, J.; et al. (2004). "Genome duplication in the teleost fish Tetraodon nigroviridis reveals the early vertebrate proto-karyotype". Nature. 431 (7011): 946–957. Bibcode:2004Natur.431..946J. doi:10.1038/nature03025. PMID 15496914.
- Paterson, A. H.; Bowers, J. E.; Van De Peer, Y.; Vandepoele, K. (2005). "Ancient duplication of cereal genomes". New Phytologist. 165 (3): 658–661. doi:10.1111/j.1469-8137.2005.01347.x. PMID 15720677.
- Raes, J.; Vandepoele, K.; Simillion, C.; Saeys, Y.; Van De Peer, Y. (2003). "Investigating ancient duplication events in the Arabidopsis genome". Journal of Structural and Functional Genomics. 3 (1–4): 117–129. doi:10.1023/A:1022666020026. PMID 12836691. S2CID 9666357.
- Simillion, C.; Vandepoele, K.; Van Montagu, M. C.; Zabeau, M.; Van De Peer, Y. (2002). "The hidden duplication past of Arabidopsis thaliana". Proceedings of the National Academy of Sciences. 99 (21): 13627–13632. Bibcode:2002PNAS...9913627S. doi:10.1073/pnas.212522399. JSTOR 3073458. PMC 129725. PMID 12374856.
- Soltis, D. E.; Soltis, P. S.; Schemske, D. W.; Hancock, J. F.; Thompson, J. N.; Husband, B. C.; Judd, W. S. (2007). "Autopolyploidy in Angiosperms: Have We Grossly Underestimated the Number of Species?". Taxon. 56 (1): 13–30. JSTOR 25065732.
- Soltis, D. E.; Buggs, R. J. A.; Doyle, J. J.; Soltis, P. S. (2010). "What we still don't know about polyploidy". Taxon. 59 (5): 1387–1403. doi:10.1002/tax.595006. JSTOR 20774036.
- Taylor, J. S.; Braasch, I.; Frickey, T.; Meyer, A.; Van De Peer, Y. (2003). "Genome Duplication, a Trait Shared by 22,000 Species of Ray-Finned Fish". Genome Research. 13 (3): 382–390. doi:10.1101/gr.640303. PMC 430266. PMID 12618368.
- Tate, J. A.; Soltis, D. E.; Soltis, P. S. (2005). "Polyploidy in plants". In Gregory, T. R. (ed.). The Evolution of the Genome. San Diego, California: Elsevier. pp. 371–426.
- Van De Peer, Y.; Taylor, J. S.; Meyer, A. (2003). "Are all fishes ancient polyploids?". Journal of Structural and Functional Genomics. 3 (1–4): 65–73. doi:10.1023/A:1022652814749. PMID 12836686. S2CID 14092900.
- Van De Peer, Y. (2004). "Tetraodon genome confirms Takifugu findings: Most fish are ancient polyploids". Genome Biology. 5 (12): 250. doi:10.1186/gb-2004-5-12-250. PMC 545788. PMID 15575976.
- Van de Peer, Y.; Meyer, A. (2005). "Large-scale gene and ancient genome duplications". In Gregory, T. R. (ed.). The Evolution of the Genome. San Diego, California: Elsevier. pp. 329–368.
- Wolfe, K. H.; Shields, D. C. (1997). "Molecular evidence for an ancient duplication of the entire yeast genome". Nature. 387 (6634): 708–713. Bibcode:1997Natur.387..708W. doi:10.1038/42711. PMID 9192896. S2CID 4307263.
- Wolfe, K. H. (2001). "Yesterday's polyploids and the mystery of diploidization". Nature Reviews Genetics. 2 (5): 333–341. doi:10.1038/35072009. PMID 11331899. S2CID 20796914.
외부 링크
- 킴볼의 생물학 페이지에 있는 다중배체
- 다배체 포털은 다배체에 대한 정보, 연구, 교육 및 참고문헌이 포함된 커뮤니티 편집 가능한 프로젝트입니다.