고리형 뉴클레오티드 게이트 이온 채널
Cyclic nucleotide–gated ion channel고리형 뉴클레오티드 게이트 이온 채널 또는 CNG 채널은 고리형 뉴클레오티드의 결합에 반응하여 기능하는 이온 채널이다.CNG 채널은 다양한 조직 및 세포 유형의 막에서 발견되는 비선택적 양이온 채널이며, 감각 전달 및 세포 발달에서 유의합니다.이들의 기능은 고리형 뉴클레오티드(cGMP 및 cAMP)의 결합과 탈분극 또는 과분극 이벤트의 조합의 결과일 수 있다.눈의 망막을 구성하는 세포에서 처음 발견된 CNG 채널은 동물과 식물 왕국 모두에서 다양한 세포 유형에서 발견되었습니다.CNG 채널은 다양한 서브유닛과 그 기능에 중요한 역할을 하는 도메인을 가진 매우 복잡한 구조를 가지고 있습니다.CNG 채널은 시력과 후각을 포함한 다양한 감각 경로의 기능뿐만 아니라 호르몬 방출과 화학작용과 같은 다른 주요 세포 기능에서도 중요하다.CNG 채널은 세균 생리학에서 정확한 역할은 알려지지 않았지만 많은 스피로체타를 포함한 원핵생물에도 존재하는 것으로 밝혀졌다.
검출
CNG 채널의 발견은 망막 광수용체에서 반응의 매개 역할을 하는 세포 내 메신저의 발견과 관련이 있다.그들이 발견되기 전에는, 순환 뉴클레오티드가 인산화에서 역할을 한다고 생각되었다.1985년에는 개구리의 [1]빛에 적응한 망막 연구를 통해 cGMP가 막대이온 채널의 광의존적 반응을 직접적으로 활성화시킬 수 있다는 사실이 밝혀졌다.CNG 채널은 또한 콘 광수용체, 후각 감각 뉴런의 화학 요법에 민감한 섬모, 송과샘에서도 발견되었다.정제단백질에서 아미노산이 동정된 후 CNG 채널의 복제 및 기능적 발현을 수행하였다.분자 복제는 다른 많은 [2][3]조직에서도 유사한 채널을 발견할 수 있게 했다.2000년에 과학자들은 생쥐의 망막과 분자 복제를 사용하여 채널의 새로운 하위 단위인 CNG6를 [4]발견하는 연구를 수행했다.
기능.
CNG 채널은 망막 광수용체와 후각수용체 뉴런의 신호 전달에 중요한 기능을 한다.이들은 고리형 뉴클레오티드에 의해 직접 활성화되며, 각 채널을 활성화하기 위해서는 약 4개의 고리형 뉴클레오티드가 필요하다.CNG 채널은 선택성이 없으며 많은 알칼리 이온이 세포막의 CNG 채널을 나타내는 세포로 유입되거나 세포 밖으로 흐를 수 있습니다.이 이온의 흐름은 탈분극 또는 과분극을 일으킬 수 있습니다.CNG 채널은 cAMP 또는 cGMP에 의해서만 활성화 할 수 있습니다.또한 두 cNMP의 조합에 의해서 활성화 되는 경우도 있습니다.또한 다른 채널보다 선택성이 높은 채널도 있습니다.이러한 채널의 활동은 전압 의존성이 거의 없지만 여전히 전압 의존 채널로 간주됩니다.칼슘, 칼모듈린 및 인산화 작용은 CNG [3]채널의 개방을 조절합니다.
CNG 채널의 주요 역할은 다양한 조직에서의 감각 전달이다.많은 연구들이 막대기와 원추형 광수용체에서 CNG 채널을 보여주었고, 그것들은 뇌, 심장, 신장, 그리고 [3]생식선에서도 발견되었다.
Cenorhabditis Elegans, Drosophila melanogaster, Limulus polypemus의 CNG 채널 상동성체는 알려지지 않은 기능을 가지고 있다.연구 결과 C. 엘레강스의 호몰로그는 화학감각에서 [3]기능을 할 수 있다는 것이 밝혀졌다.
CNG 채널에 돌연변이가 있을 경우 색맹과 망막 변성이 발생합니다.특히 소단위 A와 B의 돌연변이는 완전하고 불완전한 색맹을 [3]초래한다.
구조.
CNG 채널은 중앙 모공 주위에 4개의 서브유닛으로 구성됩니다.각 단백질 서브유닛은 6개의 막 통과 세그먼트(S1~S6), P루프, 세포내 아미노 말단 영역 및 카르복시 말단 영역을 포함한다.P-루프와 S6는 이온 전도에 역할을 하는 모공 주위의 세그먼트입니다.카르복시 말단에는 고리형 뉴클레오티드 결합 도메인(CNBD)과 S6 세그먼트와의 연결 영역이 있다.아미노 [5]말단에는 CNDB 후 영역이 있습니다.
알파 서브 유닛
고리형 뉴클레오티드 게이트 채널 알파 서브유닛은 다음을 포함한다.
베타 서브유닛
고리형 뉴클레오티드 게이트 채널 베타 서브유닛은 다음과 같다.
모공
모공의 구조는 P-루프를 포함하는 다른 이온 채널과 유사합니다.P-루프는 세포 외측에서 모공의 막으로 들어가 세포 내측으로 빠져나갑니다.P 루프는 알파 나선으로 들어가 코일되지 않은 가닥으로 존재합니다.내부 막을 덮는 나선형 홈이 채널 라인을 이룹니다.또한 입구를 나타내는 6나선 다발을 형성합니다.모공을 개방하기 위해서는 내부 6나선 [5]다발에서 구조 변화가 일어나야 한다.
고리형 뉴클레오티드 결합 도메인
고리형 뉴클레오티드 결합 도메인은 C 말단 영역에 위치한 세포 내 도메인으로 다른 고리형 뉴클레오티드 결합 단백질과 유사한 배열을 가진다.도메인은 β-환영 시트와 2개의 α-헬리쉬로 구성되어 있는 것으로 생각된다.β-완성 시트는 8개의 역평행 가닥으로 구성되어 있습니다.α나선은 B나선 및 C나선이라고 불립니다.리간드는 처음에 β-완성 시트에 결합하고, 알로스테릭 조절에 의해 β-완성 시트를 향해 α-나선으로 이동한다.α-나선은 닫힌 채널에서 유연합니다.CNGA1 서브유닛의 α-나선이 다른 α-나선에 근접하면 서브유닛간 이황화결합을 형성한다.이는 주로 폐쇄된 채널에서 발생하며 β-완성 시트로의 α-나선의 움직임을 억제한다.리간드가 β-완성 시트에 결합할 때, 이 결합된 고리형 뉴클레오티드는 각 서브유닛에서 β-완성 시트로 향하는 α-헬릭스의 움직임을 안정화시켜 α-헬리스를 서로 [5]떼어낸다.[6]
C링커
C링커는 CNBD를 S6 세그먼트에 접속하는 영역입니다.C-링커 영역은 채널 서브유닛 간의 접촉에 기여하고 4중합화(테트라머 형성)를 촉진합니다.CNG 채널 변조에는 많은 잔류물이 있습니다.이 과정은 니켈, 아연, 구리, 마그네슘과 같은 금속을 사용한다.C-링커 영역은 모공의 개구부에 대한 리간드 결합의 결합에 관여합니다.C 링커 영역은 N 말단 영역과 디술피드 결합을 형성합니다.디술피드 결합은 채널 기능을 변화시키므로 3차 구조 근처에 있을 가능성이 높다.디술피드 결합은 닫힌 상태에 비해 열린 상태의 자유 에너지를 감소시킨다.C-링커 영역의 특정 시스테인 잔류물 C481은 결합 도메인에서 몇 개의 아미노산만 떨어져 있습니다.폐쇄 상태에서는 C481은 비반응적입니다.C481은 채널 오픈에 액세스 할 수 있도록 Configuration 변경을 실시할 필요가 있습니다.인접한 서브유닛과 C481 사이에 디술피드 결합이 형성된다.동시에 C-링커 영역의 N말단에는 2개의 C481잔기에 도달할 수 있는 C35 시스테인 잔기가 있어 C481-C481 [5]결합에 비해 양호한 디술피드 결합이 된다.[6]
S6 지역
자발적 디술피드 결합 형성은 상태에 따라 달라지며, 이는 나선 다발의 입체구조 변화가 채널 게이트와 관련이 있음을 의미한다.CNG 이온 채널이 닫히면 S6 헬리스의 세포질 단부는 서로 근접하게 된다.작은 양이온은 개구부를 통해 이동할 수 있으며, 이는 게이트가 나선 다발을 벗어나고 S6 나선이 선택성 [6]필터의 구조 변화와 연관되어 있음을 의미한다.
P영역
P 영역은 S5 및 S6 영역을 연결하는 루프를 형성하고, 모공 루프는 채널의 중심축까지 확장됩니다.이온 특성은 S5와 S6의 통과막 세그먼트 사이의 루프 내의 잔류물에 의해 결정된다.P 영역은 순환 뉴클레오티드 게이트 이온 채널의 이온 선택성을 지시하며, 또한 CNG 채널의 모공 직경을 결정합니다.P 영역은 닫힌 상태에서 이온 투과를 방지하므로 채널 게이트 역할을 합니다.모공은 이 영역의 작은 구조 변화로 인해 방해를 받을 수 있습니다.P영역은 오픈 컨피규레이션의 구조를 변경하는 이온 선택성 필터로서 기능합니다.오픈 상태에서는 4개의 동일한 서브유닛이 1개의 P루프 영역에 기여하고 이것이 선택성 [6]필터를 형성합니다.
CNG 채널 패밀리
척추동물에서 CNG 채널 유전자군은 6개의 구성원으로 구성되어 있다.이 유전자들은 배열 유사성에 기초하여 두 가지 아형 CNGA와 CNGB로 [7]나뉜다.CNG 채널을 코드하는 추가적인 유전자들은 케노하브디티스 엘레강스와 드로소필라 멜라노가스터에서 복제되었다.이전에는 로드α 서브유닛이라고 불리던 CNG 채널 CNGA1의 서브유닛은 로드 광수용체에서 발현되었으며 Xenopus 난모세포 또는 인간 배아 신장세포주(HEK293)에서 외부 발현될 때 cGMP에 의해 게이트된 기능 채널을 생성하였다.인간에서, 돌연변이된 CNGA1 유전자는 실명의 퇴행성 형태인 망막 색소증의 상염색소 열성 형태를 초래한다.이전에는 로드β 서브유닛으로 불렸던 CNGB1은 로드 채널의 두 번째 서브유닛입니다.CNGA1과는 달리 CNGB1 서브유닛만으로는 기능적인 CNG채널을 생성하지 않지만 CNGA1 서브유닛과 CNGB1 서브유닛의 공동발현에 의해 변조, 투과, 약리학 및 순환뉴클레오티드 특이성이 네이티브 [8]채널에 필적하는 헤테로머채널이 생성된다.
CNG 채널은 테트라머를 형성하고 있으며 최근 연구에 따르면 네이티브 로드 채널은 3개의 CNGA1 서브유닛과 1개의 CNGB1 서브유닛으로 구성되어 있습니다.CNGA3 서브유닛(이전에는 원뿔α 서브유닛이라고 불렸음)은 외부발현이 발생할 때 기능 채널을 형성합니다.반면, 이전에는 원추형 β 서브유닛으로 불렸던 CNGB3는 그렇지 않다.인간 CNGA3와 CNGB3의 돌연변이는 색감별의 [8]완전한 실패로 특징지어지는 희귀한 상염색체 열성 유전 및 선천성 질환인 완전 무색증에 관여한다.
이전에는 후각α 서브유닛으로 불렸던 CNGA2, 이전에는 후각β 서브유닛으로 불렸던 CnGA4, CnGB1b는 소단위 화학측정법 및 배열이 [8]불분명한 후각 감각뉴런에서의 후각신호 전달에 관여한다.
무척추동물에서는 CNG-P1이라고 불리는 CNG 채널 서브유닛이 D. melanogaster에서 복제되어 더듬이와 시각계로 표현되며, 이는 CNG 채널이 무척추동물에서 빛의 전달과 관련이 있을 수 있음을 나타낸다.D. melanogaster에서 복제된 CNGL이라고 불리는 두 번째 추정 CNG 유사 서브유닛이 뇌에서 발현되는 것으로 밝혀졌다.CNG 채널 서브 유닛인 Tax-2와 Tax-4는 C. elegans에서 복제되었으며 C.[8] elegans에서 일부 감각 뉴런의 화학감각, 열감각 및 정상적인 축삭 발육을 담당합니다.
바인딩 이벤트
리간드는 인산염 결합 카세트(PBC)와의 상호작용으로 인해 공동 하단에 배치될 수 있습니다.이 공동은 2-루프 β나선인 β롤에 의해 형성된 CNBD의 영역을 말한다.리간드 결합에 의해 유도되는 변화는 α나선(αA, αB, αC 및 PBC나선)에서 발생한다.β 롤은 결합 중에 작은 변화만 겪습니다.리간드 착좌 후 αB 및 αC나선은 캐비티 위에 캡을 형성하도록 배치된다.결합이 αA 나선에 어떤 영향을 미치는지 아직 불분명하다.[9]
협력 및 비협력 활성화
CNG 채널과 리간드 농도 사이의 가파른 농도는 적어도 두세 개의 고리형 뉴클레오티드가 필요하다는 것을 보여준다.채널이 폐쇄에서 개방으로 전환되기 위해서는 두 번째 배위자가 필요한 것으로 생각된다.세 번째, 네 번째 리간드가 결합하면 채널의 개방 상태가 [9]안정화된다.박테리아에서 CNG 채널의 개방은 비협력 결합의 [9]결과이다.리간드의 농도가 다르면 이러한 다른 환경에 적응하기 위해 협동결합과 비협조결합이 발생한다.낮은 리간드 농도의 경우, 낮은 농도의 공동 결합은 채널과 리간드 사이의 결합을 약화시켜 채널 [9]감도를 낮추기 때문에 리간드가 공동으로 결합하는 것은 드문 일이다.
배위자 선택성
다양한 리간드 농도의 피상화 시 절제된 내측막 패치로 활성화되는 전류를 측정하여 내인성 및 외인성 발현 CNG 채널의 리간드 감도 및 선택성을 연구하였다.모든 네이티브 CNG 채널은 cAMP와 cGMP 모두에 반응하지만 채널을 활성화 및 오픈하려면 cAMP보다 적은 농도의 cGMP가 필요합니다.CNG 채널은 로드와 원추형에서는 cGMP와 cAMP 사이에서 엄밀하게 선택되지만 OSN에서는 채널은 양쪽 리간드에 동등하게 반응합니다.OSN에서 볼 수 있는 CNG 채널은 광수용체 CNG 채널보다 cGMP와 cAMP 모두에 훨씬 민감합니다.선량 반응 관계 연구는 채널 활성화가 cGMP 농도에 크게 좌우된다는 것을 보여주었다. 여러 cGMP 분자는 협력적인 방식으로 채널에 결합한다.각 서브유닛은 단일 cNMP 결합부위를 포함하고 호모머 채널과 헤테로머 채널이 사분자 복합체를 형성할 가능성이 높기 때문에 최대 4개의 리간드 분자가 채널에 결합할 수 있다.선택성은 배위자의 결합에 대한 친화력, 게이트의 유효성 또는 둘의 조합에 대한 차등 제어에 의해 달성될 수 있다.결합 친화력은 순환 뉴클레오티드가 얼마나 단단하게 채널에 결합하는지를 의미한다.유효성은 리간드가 결합되면 채널을 활성화하고 열 수 있는 능력을 말한다.이러한 과정은 선택성을 이해하는 데 유용하지만,[3] 서로 불가분하게 결합되어 있어 실험적으로 서로 분리하는 것은 매우 어렵다.
CNG 채널은 Na 이온과+ K 이온을+ 구별하지 않으며, Ca2+ 및 Mg의 통과 속도도 느리지만 허용됩니다2+.이러한 2가 이온의 통과는 Na와+ K에 의해+ 전달되는 전류를 억제합니다.CNG 채널의 선택성 필터에서 글루탐산 고보존 잔기가 Ca의2+ 고친화성 결합 부위를 형성하는 것이 확인되었다.또한 NaK 채널이라고 불리는 세균 비선택성 양이온 채널은 CNG 채널과 유사한 선택성 필터 시퀀스를 호스트한다.NaK채널의 결정구조에서 모공의 세포외 개구부에서의 이산2+ Ca결합부위가 [9]동정되었다.
CNG 채널 억제
연구에 따르면 Xenopus 난모세포에서 디아실글리세롤(DAG)에 의한 CNG 채널의 차등 억제가 확인되었다.DAG는 폐쇄성 억제제로 사용할 수 있다.DAG를 사용하여 호모머릭 로드 채널 또는 둘 이상의 동일한 펩타이드 사슬을 포함하는 채널을 억제하는 것은 네이티브 로드 채널의 억제와 유사했다.DAG를 사용하여 동종 자극 후각 채널을 억제하는 것은 DAG의 고농도에도 불구하고 효과적이지 않았습니다.채널을 효과적으로 억제하려면 DAG 분자가 두 개 이상 필요합니다.DAG 분자는 채널에 결합하거나 세포막의 지질 이중층과 채널 사이의 상호작용을 변화시킴으로써 CNG 채널의 폐쇄 상태를 안정시키기 위해 그들 자신을 위치시킨다.키메라스 로드와 후각 채널을 사용한 연구는 DAG 억제의 차이가 막 통과 [10]세그먼트의 부착된 루프의 차이 때문이라는 것을 시사한다.
생리학적 의의
감광체
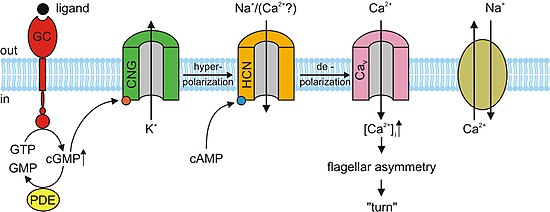
빛이 없을 때 cGMP는 광수용체 내의 CNG 채널에 결합합니다.이 결합은 채널을 열어 나트륨(Na+)과 칼슘(Ca2+) 이온이 세포로 흘러들어 감광체의 외부 부분이 탈분극되도록 합니다.이러한 이온의 탈분극 흐름을 암흑 전류라고 합니다.눈의 망막이 빛을 감지하면, 광전송 캐스케이드라고 알려진 반응이 일어난다.cGMP를 5'-GMP로 가수분해하여 cGMP의 농도를 감소시키는 포스포디에스테라아제 활성화로 이어지는 신호전달 경로이며, cGMP가 없을 경우 광수용체 내 CNG 채널이 닫혀 앞에서 설명한 암전류의 흐름을 방해한다.이것은 차례로 광수용체 외부 부분의 과분극을 유발하여 활동 전위의 전파와 [3][5]글루탐산염의 방출을 막는다.연구에 따르면 광수용체에서 cGMP 의존성 CNG 채널의 과다 활성화는 광수용체의 변성으로 이어질 수 있다.감광체상의 CNG채널이 연속적으로 활성화되면 감광체 외부로 들어가는 Ca 및+ Na 이온플럭스가 증가하여2+ 암전류를 넘어 탈분극된다.양의 피드백 루프를 통해, 이것은 셀에 Ca의 전류를2+ 증가시킵니다.광수용체 세포의 고농도 Ca는2+ 사망 프로그램된 세포사망 또는 아포토시스([11]apoptosis)를 초래할 수 있다.
색소망막염
색소성 망막염(RP)은 로드와 콘형 광수용체가 변성되는 유전병이다.환자의 말초 시력에서 시작하여 중심 시야로 진행되어 중년이 되면 실명하게 됩니다.
RP 환자의 약 1%가 cGMP 알파 서브유닛에 돌연변이를 가지고 있다.8개의 돌연변이가 확인되었다. 4개는 말도 안 되는 돌연변이이고, 1개는 대부분의 전사 단위를 포함하는 결실이다.나머지 세 가지는 미센스 돌연변이와 프레임시프트 돌연변이로, C 말단에서 아미노산 배열의 단축을 초래한다.cGMP 게이트 양이온 채널의 부재가 광수용체 열화를 일으키는 이유는 아직 밝혀지지 않았다.RP를 일으키는 돌연변이는 로돕신 유전자와 로드 광전송 캐스케이드를 코드하는 로드 포스포디에스테라아제의 알파 서브유닛과 베타 서브유닛에서도 발견되었다.이러한 서브유닛의 돌연변이는 간접적으로 로드 cGMP 게이트 채널 기능을 손상시키며, 이는 광수용체 [12]열화의 일반적인 메커니즘이 있음을 의미한다.
심박조절기 세포
신경계, 심장, 그리고 몇몇 내장기관에서, 세포는 기관의 리듬을 결정하는 순환적 뉴클레오티드 게이트 채널을 포함합니다.공식적으로 과분극 활성화 순환 뉴클레오티드 게이트 채널(HCN 채널)이라고 불리는 이러한 채널은 이러한 중요한 기능 때문에 "페이스메이커 채널"이라고도 불린다.이름에서 알 수 있듯이 과분극 상태에서는 열리고 탈분극 상태에서는 닫힙니다.동심원결절(및 방실결절)에서 이것의 중요성은 심장이 각 박동 후에 재설정되거나 과분극화되면 HCN 채널이 열려 양이온이 세포로 돌진하여 또 다른 탈분극 이벤트와 후속 심장 수축을 유발한다는 것이다.이것은 심장의 자동성을 부여한다.HCN 채널과 함께 작동하는 1차 고리형 뉴클레오티드는 cAMP이다.[13]
후각신경세포
후각 감각 뉴런(OSN)의 냄새제에 대한 거의 모든 반응은 CNG 채널에 의해 촉진된다.냄새제가 화학 감수성 섬모막의 특정 수용체에 결합하면, G단백질을 활성화시키고, 이것은 효소 아데닐릴 사이클라아제를 활성화시키는 하류 반응을 일으킨다.이 효소는 OSN 내 cAMP 농도 증가를 유발하며, cAMP는 OSN 막의 CNG 채널에 결합하여 Ca에 대한2+ 세포 투과성을 높입니다.칼슘 이온이 세포로 흘러들어 탈분극을 일으킨다.다른 모든 셀 타입과 마찬가지로 OSN의 CNG 채널에서도 Na가 셀로 흐를 수 있습니다+.또한 세포 내 Ca 농도가 증가하면2+ Ca 의존성 염화물(Cl−) 채널이 활성화되어2+ 세포− 내 Cl 이온도 흘러나와 탈분극 현상을 증가시킨다.이러한 탈분극은 궁극적으로 냄새제의 수신을 알리는 활동 전위를 자극합니다.cAMP 게이트 이온 채널 외에 OSN의 작은 서브셋에는 CNGA3 서브유닛을 [3]포함하는 cGMP 선택형 CNG 채널도 있습니다.
정자충
cAMP와 cGMP는 아크로좀 세포외세포증, 또는 수컷 정자의 암컷 난자에 대한 융합, 화학작용과 같은 여러 세포반응을 매개한다.성게종에서는 짧은 펩타이드인 정자(Strongylocentrotus purpuratus)가 연구됐다.Speract는 수용체형 구아닐산 시클라아제(GC)를 활성화하고 세포 내 cGMP 농도 상승을 자극한다.정자는 또한 칼슘의 농도를 높인다.직접적인 인과 관계가 아직 확립되지 않았지만, 앞서 언급한 관찰 결과에 따르면 cGMP는 칼슘 전도성을 활성화한다.CNG 채널은 칼슘 투과성이 높기 때문에 칼슘 유입 경로의 주요 후보입니다.CNG 채널은 아직 호몰로지 선별에서 검출되지 않았다.포유동물에서 발현되는 고환 CNG 채널 서브유닛은 A3, B1, B3이다.A3 서브유닛의 이종발현은 고환에서 복제되었으며, cGMP 민감하고 선택적인 채널을 생성하였다.이러한 채널은 정자에 대한 cGMP 자극 칼슘 플럭스에 관여할 수 있습니다.그러나 채널액티비티의 검출 성공률이 낮기 때문에 채널의 보다 광범위한 특성은 실현되지 않았습니다.A3 서브유닛 녹아웃 마우스는 가임성이 높기 때문에 CNG 채널은 어떤 형태의 운동성 제어에 관여할 수 있으며 심지어 화학요법적인 수영 행동이나 선체 외세포증에도 관여할 수 있다.그러나 포유류 정자의 수용체형 GC는 아직 확인되지 않았다.마우스 정자는 CatSper1과 같은 다른 채널을 표현합니다.수컷 불임은 CatSper1 유전자를 파괴함으로써 달성될 수 있으며, 또한 돌연변이 생쥐에서 cAMP 유도 칼슘 유입이 폐지된다.CatSper가 기능하려면 추가 서브유닛이 필요하지만 CatSper에는 cAMP/cGMP 바인딩 사이트가 없기 때문에 CNG 채널과는 관계가 없습니다.CNG와 CatSper 서브유닛이 모여 칼슘 투과성 및 고리형 뉴클레오티드 감수성 이온 [3]채널을 형성할 수 있습니다.
신장
cGMP 민감 채널은 신수질, 특히 인체의 전해질과 체액 균형에 영향을 미치는 덕트 세포 수집에서 분석되었습니다.CNG 채널 활성은 cGMP가 인산화 메커니즘에 관여하기 때문에 cGMP 의존성 단백질 키나제와 G1 단백질 사이의 상호작용에 의해 제어된다.CNG채널은 순환뉴클레오티드게이트이온채널과 매우 유사한 양이온선택성단위컨덕턴스, 칼슘투과성 및 약리학을 나타낸다.자극제 심방성 자연뇨인자(ANF)는 신장 내 cGMP 생성을 증가시키고, 이완 및 수축 동맥의 조합에 [14]의해 사구체의 기능을 증가시킨다.망막과 신장 cDNA의 차이는 이 두 조직의 [3]CNG 채널 사이의 기능적 차이와 관련이 있다.
고나도트로핀 방출 호르몬
고나도트로핀 방출 호르몬(GrH)을 분비하는 신경 세포주 내에서 CNG 이온 채널 서브유닛 A2, A4, B1이 확인되었다.3개의 서브유닛은 OSN의 화학감응 섬모에 관한 CNG 채널을 구성합니다.고세포외칼슘에서 막대 및 OSN에서 CNG 채널의 단위전도율은 신경라인에서 측정된 단위전도율보다 유의하게 작다.CNG 채널이 대규모 유닛 [3]컨덕턴스를 발생시킬지는 의문입니다.
식물
식물의 CNG 이온 채널은 아미노산 배열 및 구조가 동물의 비선택적 양이온 CNG 채널과 유사하며, 트랜스막 도메인 K 선택적+ 셰이커 패밀리 채널도 유사하다.그러나 공장 CNG 채널에서만 볼 수 있는 큰 차이가 있다.식물 CNG 채널의 모공 배열 아미노산 배열은 동물 CNG 채널에서 발견되는 선택성 필터가 없을 뿐만 아니라 K-선택성+ 필터 배열에서 글리신-티로신-글리신-아스파르트산(GGD) 모티브가 결여되어 있다.다른 배열 차이는 식물 CNG 채널, 특히 순환 뉴클레오티드 결합 도메인(CNBD)에서 나타난다.식물에서 칼모듈린 결합 도메인(CaMBD)은 CNG 채널의 CNBD에서 α-나선 C와 겹치는 것으로 밝혀졌다.동물에서 CaMBD는 CNBD에서 [15]멀리 떨어져 있습니다.CNG 채널은 식물 면역과 병원균 또는 외부 감염원에 대한 반응에 큰 역할을 한다.그들은 또한 식물의 아포토시스에도 관여하고 있다.CNG 이온 채널은 또한 식물의 꽃가루 발달에 관여하는 것으로 생각되지만, 이 메커니즘에서 그것의 정확한 역할은 [15]아직 알려지지 않았다.
동물성 CNG 채널과 달리, 식물성 CNG 채널은 [15]그 구조와 관련하여 생화학적으로 광범위하게 분석되지 않았다.
원핵생물
CNG 이온 채널은 포유류의 CNG [16]채널과 높은 수준의 배열 및 구조적 유사성을 공유합니다.포유류의 CNG 채널과 마찬가지로 CNBD에 대한 고리형 뉴클레오티드의 결합은 채널 활성을 조절하고 채널 구조 상태를 [16][17]변화시키는 것으로 나타났다.이러한 채널은 스피로체타와 렙토스피라 [16]종에서 최근에야 확인되었기 때문에, 그들의 정확한 생리 기능은 이들 유기체에서 알려지지 않았다.광활성 아데닐환원효소와의 조합으로, 그것들은 [18]뉴런에서 활동 전위 생성을 억제하는 광유전학적 도구로 사용되어 왔다.
현재 및 미래 연구
연구자들은 시력과 후각에서 CNG 이온 채널 기능에 관한 많은 중요한 질문에 답했습니다.다른 생리학적 영역에서는 CNG 채널의 역할이 덜 정의되어 있습니다.기술의 성장과 함께,[3] 이러한 메커니즘을 이해할 수 있는 더 많은 가능성이 존재합니다.
산화질소(NO)는 cGMP의 합성을 촉진하는 데 관여하기 때문에 특히 OSN의 [3]CNG 채널의 공유변형에서 NO와 CNG 채널의 생리학적 상호작용을 이해하기 위한 추가 연구가 진행되고 있다.
과학자들은 결합 부위와 서브유닛의 인터페이스의 상호작용에 관련된 메커니즘을 추가하고 있다.이것은 비협력적인 CNG 채널에서는 존재하지 않을 수 있습니다.결합 부위와 게이트가 단일 서브유닛에 부착될 수도 있습니다.이러한 아이디어를 발전시키기 위해서는 이중 전자 공명(DEER)과 신속한 고정 기술이 이러한 기계적 [9]움직임을 보여줄 수 있다.
2007년 연구에 따르면 플랜트 내 다수의 CNG 채널 외에 다양하고 복잡한 규제 특성 때문에 플랜트 CNG 채널을 연구하기 위한 다원적 연구가 수행되어야 [15]한다.2011년 3월의 또 다른 연구는 발전소의 CNG 채널을 더 잘 이해하는 데 도움이 된 최근의 역유전학 데이터를 인정하고,[19] 또한 발전소의 CNGC 매개 신호 전달의 업스트림 및 다운스트림 요인을 식별하기 위해 추가 연구가 수행되어야 한다고 제안한다.
과학자들은 억제 과정에서 DAG가 CNG 채널과 직접 결합하는지 여부를 추측하고 있다.DAG가 채널 내의 트랜스멤버 도메인에 삽입될 가능성이 있습니다.DAG가 채널과 양층 사이의 인터페이스에 삽입될 수도 있습니다.DAG 억제의 분자 메커니즘은 아직 완전히 [10]이해되지 않았다.
「 」를 참조해 주세요.
레퍼런스
- ^ Fesenko EE, Kolesnikov SS, Lyubarsky AL (1985). "Induction by cyclic GMP of cationic conductance in plasma membrane of retinal rod outer segment". Nature. 313 (6000): 310–3. Bibcode:1985Natur.313..310F. doi:10.1038/313310a0. PMID 2578616. S2CID 4315094.
- ^ Yau KW (April 1994). "Cyclic nucleotide-gated channels: an expanding new family of ion channels". Proc. Natl. Acad. Sci. U.S.A. 91 (9): 3481–3. Bibcode:1994PNAS...91.3481Y. doi:10.1073/pnas.91.9.3481. PMC 43603. PMID 7513422.
- ^ a b c d e f g h i j k l m Kaupp UB, Seifert R; Seifert (July 2002). "Cyclic nucleotide-gated ion channels". Physiol. Rev. 82 (3): 769–824. doi:10.1152/physrev.00008.2002. PMID 12087135.
- ^ Gerstner A, Zong X, Hofmann F, Biel M (February 2000). "Molecular Cloning and Functional Characterization of a New Modulator y Cyclic Nucleotide-Gated Channel Subunit from Mouse Retina". The Journal of Neuroscience. 20 (4): 1324–1332. doi:10.1523/JNEUROSCI.20-04-01324.2000. PMC 6772363. PMID 10662822.
- ^ a b c d e Matulef, Kimberly; Zagotta, William N. (2003). "Cyclic Nucleotide-Gated Ion Channels". Annual Review of Cell and Developmental Biology. 19 (1): 23–44. doi:10.1146/annurev.cellbio.19.110701.154854. PMID 14570562.
- ^ a b c d Wang, Zengchao; Jaing, Yongqing; Lizhi Lu; Ruihua Huang; Qingchao Hou; Fangxiong Shi (2007). "Molecular Mechanisms of Cyclic Nucleotide-Gated Ion Channel Gating". Journal of Genetics and Genomics. 34 (6): 477–485. doi:10.1016/S1673-8527(07)60052-6. PMID 17601606.
- ^ Bradley, Jonathan (2001). "Nomenclature for Ion Channel Subunits". Science. 294 (5549): 2095–2096. doi:10.1126/science.294.5549.2095. PMC 2901924. PMID 11764791.
- ^ a b c d Matulef K, Zagotta WN; Zagotta (2003). "Cyclic nucleotide-gated ion channels". Annu. Rev. Cell Dev. Biol. 19 (1): 23–44. doi:10.1146/annurev.cellbio.19.110701.154854. PMID 14570562.
- ^ a b c d e f Cukkamane A, Seifert R, Kaupp UB (January 2011). "Cooperative and uncooperative cyclic-nucleotide-gated ion channels". Trends in Biochemical Sciences. 36 (1): 55–64. doi:10.1016/j.tibs.2010.07.004. PMID 20729090.
- ^ a b Crary JI, Dean DM, Nguitragool W, Kurshan PT, Zimmerman AL (December 2000). "Mechanism of Inhibition of Cyclic Nucleotide-Gated Ion Channels by Diacylglycerol". The Journal of General Physiology. 116 (6): 755–768. doi:10.1085/jgp.116.6.755. PMC 2231817. PMID 11099345.
- ^ Vallazza-Deschamps, Géraldine; Cia, David; Gong, Jie; Jellali, Abdeljelil; Forster, Valérie; Sahel, Jose A; Tessier, Luc-Henri; Picaud, Serge (2005). "Excessive activation of cyclic nucleotide-gated channels contributes to neuronal degeneration of photoreceptors". European Journal of Neuroscience. 22 (5): 1013–1022. doi:10.1111/j.1460-9568.2005.04306.x. PMID 16176343. S2CID 36480526.
- ^ Ashcroft, Frances (1999). Ion Channels and Disease. Academic Press. ISBN 978-0-12-065310-2.
- ^ Larsson, H. P. (2010). "How is the heart rate regulated in the sinoatrial node? Another piece to the puzzle". The Journal of General Physiology. 136 (3): 237–241. doi:10.1085/jgp.201010506. PMC 2931147. PMID 20713549.
- ^ Biel, Martin; Zong, Xiangang; Distler, Madeleine; Bosse, Eva; Klugbauer, Norbert; Murakami, Manabu; Flockerzi, Veit; Hofmann, Franz (1994). "Another member of the cyclic nucleotide-gated channel family, expressed in testis, kidney, and heart". Proceedings of the National Academy of Sciences of the United States of America. 91 (9): 3505–3509. Bibcode:1994PNAS...91.3505B. doi:10.1073/pnas.91.9.3505. PMC 43608. PMID 8170936.
- ^ a b c d Kaplan B, Sherman T, Fromm H (May 2007). "Cyclic nucleotide-gated channels in plants". FEBS Lett. 581 (12): 2237–46. doi:10.1016/j.febslet.2007.02.017. PMID 17321525.
- ^ a b c Brams, M.; Kusch, J.; Spurny, R.; Benndorf, K.; Ulens, C. (2014). "Family of prokaryote cyclic nucleotide-modulated ion channels". Proceedings of the National Academy of Sciences. 111 (21): 7855–7860. Bibcode:2014PNAS..111.7855B. doi:10.1073/pnas.1401917111. ISSN 0027-8424. PMC 4040583. PMID 24821777.
- ^ James, Zachary M.; Borst, Andrew J.; Haitin, Yoni; Frenz, Brandon; DiMaio, Frank; Zagotta, William N.; Veesler, David (2017). "CryoEM structure of a prokaryotic cyclic nucleotide-gated ion channel". Proceedings of the National Academy of Sciences. 114 (17): 4430–4435. doi:10.1073/pnas.1700248114. ISSN 0027-8424. PMC 5410850. PMID 28396445.
- ^ Beck, Sebastian; Yu-Strzelczyk, Jing; Pauls, Dennis; Constantin, Oana M.; Gee, Christine E.; Ehmann, Nadine; Kittel, Robert J.; Nagel, Georg; Gao, Shiqiang (2018). "Synthetic Light-Activated Ion Channels for Optogenetic Activation and Inhibition". Frontiers in Neuroscience. 12: 643. doi:10.3389/fnins.2018.00643. ISSN 1662-453X. PMC 6176052. PMID 30333716.
- ^ Moeder, Wolfgang; Urquhart, William; Ung, Huoi; Yoshioka, Keiko (2011). "The Role of Cyclic Nucleotide-Gated Ion Channels in Plant Immunity". Molecular Plant. 4 (3): 442–452. doi:10.1093/mp/ssr018. PMID 21459831.