방광암
Bladder cancer| 방광암 | |
|---|---|
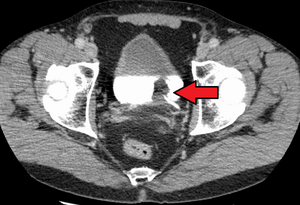 | |
| 방광의 전이성 세포암입니다방광의 하얀색은 대조적입니다. | |
| 전문 | 종양학, 비뇨기과 |
| 증상 | 소변에 피가 나고 소변을[1] 볼 때 통증이 있다. |
| 통상적인 개시 | 65[2]~84세 |
| 종류들 | 전이세포암, 편평세포암, 선암[1] |
| 위험요소 | 흡연, 가족력, 방사선 치료 전, 잦은 방광염, 특정 화학물질[1] |
| 진단 방법 | 조직 생체검사에[1] 의한 방광경 검사 |
| 치료 | 수술, 방사선 치료, 화학요법[1], 면역요법 |
| 예후 | 5년간 생존율~77% (미국)[2] |
| 빈도수. | 549,000건 신규 접수(2018년)[3] |
| 사망. | 200,000 (2018년)[3] |
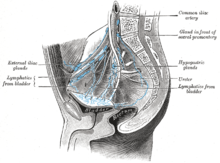
방광암은 [1]방광의 조직에서 발생하는 여러 종류의 암 중 하나이다.증상으로는 소변에 피가 나고 소변을 볼 때 통증이 있고 요통이 [1]있다.방광의 경계에 있는 상피세포가 [4]악성이 되어 발생합니다.
방광암의 위험 요소로는 흡연, 가족력, 이전의 방사선 치료, 잦은 방광 감염, 특정 [1]화학물질에 대한 노출 등이 있습니다.가장 흔한 유형은 전이성 세포암이다.[1]다른 유형으로는 편평상피암과 [1]선암을 포함한다.진단은 일반적으로 조직 생체검사와 [5]방광경 검사를 통해 이루어집니다.암의 병기는 경요도 절제술과 의료 [1][6][7]영상촬영에 의해 결정된다.
치료는 [1]암의 단계에 따라 다르다.그것은 수술, 방사선 치료, 화학 요법 또는 면역 [1]요법의 조합을 포함할 수 있다.외과적 방법으로는 경요도 절제, 방광 부분 또는 완전 제거, 소변 전환 등이 [1]있습니다.미국의 5년 생존율은 77%, 캐나다는 75%, 유럽은 68%[2][8][9]입니다.
2018년 현재 방광암은 전 세계 약 160만 명의 사람들에게 영향을 끼쳤고 549,000명의 새로운 환자들과 20만 명의 [3]사망자가 발생했다.발병 연령은 대부분 65세에서 84세 [2]사이이다.남성이 [2]여성보다 더 자주 영향을 받는다.2018년에는 남유럽과 서유럽에서 방광암 발병률이 가장 높았고,[3] 북미에서 인구 10만명당 15명, 13명, 12명의 환자가 발생했다.방광암 사망률이 가장 높은 지역은 북아프리카와 서유럽으로 [3]그 뒤를 이었다.
징후 및 증상
방광암은 특징적으로 소변에 피가 섞여 나오는데, 이것은 현미경으로만 보이거나 발견할 수 있다.소변 속의 피는 방광암에서 가장 흔한 증상이며 통증이 없다.소변의 눈에 보이는 혈액은 단지 짧은 기간일 수 있으며, 보이지 않는 혈액을 확인하기 위해 소변 검사가 필요할 수 있습니다.방광암에 걸린 사람들의 80-90%가 처음에는 눈에 보이는 [10]피를 보였다.소변의 혈액은 방광 또는 요관 결석, 감염, 신장병, 신장암 또는 혈관 기형과 같은 다른 조건에 의해 발생할 수 있지만, 이러한 상태(신장암 제외)는 일반적으로 [citation needed]고통스러울 수 있다.
다른 가능한 증상으로는 소변을 볼 때 통증이 있거나 소변을 자주 보거나 소변을 볼 수 없는 상태에서 소변을 볼 필요를 느끼는 경우가 있습니다.이러한 징후와 증상은 방광암에 특유하지 않으며 전립선 감염, 과잉 활동성 방광 또는 방광염을 포함한 비암성 질환에 의해 발생할 수도 있습니다.요추선암과 같은 몇몇 희귀한 형태의 방광암은 뮤신을 생성하는데,[11] 뮤신은 소변으로 배설되어 두꺼워집니다.
진행성 질환이 있는 사람들은 골반 또는 골반 통증, 하극성 종창 또는 옆구리 [12]통증을 가질 수 있다.신체 검사에서 [13]눈에 띄는 덩어리가 발견되는 경우는 거의 없습니다.
원인들
흡연은 방광암의 주요 원인으로 알려져 있다; 대부분의 인구에서 흡연은 남성의 경우 절반 이상 그리고 [14]여성의 경우 3분의 1과 관련되어 있다. 그러나 유럽과 [15]북미의 흡연자가 적기 때문에 이러한 비율은 최근 몇 년 동안 줄어들었다.흡연 기간(년 단위), 팩 연도 및 방광암 위험 사이에는 거의 선형적인 관계가 있습니다.하루에 약 15개비를 피우는 위험 고원을 관찰할 수 있다(즉, 하루에 15개비를 피우는 사람은 하루에 30개비를 피우는 사람과 거의 같은 위험이다).어떤 형태로든 흡연(담배,[16] 파이프, 이집트 수도관, 무연 담배)은 방광암의 위험을 증가시킨다.담배를 끊으면 위험이 줄어든다.방광암의 위험은 1~4년 이내에 30% 감소하며 금연 [17]후 25년 후에도 60% 감소한다.하지만, 흡연자였던 사람들은 담배를 [15]피우지 않은 사람들에 비해 방광암에 걸릴 위험이 항상 더 높을 것이다.간접흡연 또한 [18][19]위험으로 보인다.
아편 섭취는 방광암 위험을 3배 높이고 아편과 흡연을 병행하면 [20]방광암 위험이 일반인보다 5배 높아진다.
방광종양의 30%는 아마도 직장에서 발암물질에 대한 직업적인 노출에서 비롯될 것이다.방광암의 원인으로 다음 물질에 대한 직업적 또는 상황적 노출이 포함되었습니다. 벤지딘(눈물 제조), 4-아미노비페닐(고무 산업), 2-나프틸아민(아조 염료 제조, 주조 공장 가스, 고무 산업, 담배 연기 및 암 연구), 페나세틴(비소), 비소 및 염소화 알리파식수 속 틱 탄화수소, 오라민(석유 제조), 마젠타(석유 제조), 오르토톨루이딘(석유 제조), 에폭시 및 폴리우레탄 수지 경화제(석유 제조), 클로르나파진, 콜타르 피치.[21][22][23][24][25]위험한 직업은 버스 운전사, 고무 노동자, 페인트공, 자동차 정비공, 가죽(신발 포함) 노동자, 대장장이, 기계 세터, [26][27]정비공입니다.미용사들도 영구 [28]염색제에 자주 노출되기 때문에 위험하다고 여겨진다.
편평상피세포 타입의 [29]방광암을 일으킬 수 있는 것은 주혈흡충증(빌하르지아 또는 주혈흡충증) 감염이다.주혈흡충 난자는 방광벽에 만성 염증 상태를 유발하여 조직 [30]섬유화를 일으킨다.N-니트로소 화합물 수치가 높은 것은 좌혈흡충증 [31]환자의 소변 샘플에서 검출되었습니다.N-니트로소 화합물은 방광암과 관련된 주혈흡충증의 병인생성과 관련이 있다.그들은 알킬화 DNA 손상, 특히 HRAS와 p53 종양 억제 [32]유전자에서 구아닌에서 아데닌으로의 전이 돌연변이를 일으킨다.p53의 돌연변이는 종양의 73%, BCL-2 돌연변이는 32%, 두 돌연변이는 13%[33]에서 검출된다.방광 편평상피암의 다른 원인으로는 척수 손상을 입은 사람들의 만성 카테터 삽입과 시클로포스파미드에 [34][35]의한 치료 이력이 있다.
많은 한약재에 있는 아리스톨로키산의 섭취는 요로텔암과 [36]신부전을 일으키는 것으로 나타났다.아리스톨로키산은 요관에서 과산화효소를 활성화하고 TP53 종양억제유전자에서 [citation needed]전이변이를 일으킨다.
전립선암을 위해 외부선 방사선 치료를 받는 사람들은 침습성 방광암에 [37]걸릴 위험이 더 높다.
이러한 주요 위험 요인 외에도 방광암과 관련이 덜 강한(즉, 10-20% 위험 증가) 수정 가능한 수많은 다른 요인들도 있다. 예를 들어 [38]비만이다.이것들은 사소한 효과로 간주될 수 있지만, 여전히 다수의 더 작은 위험 인자의 유병률을 [39]함께 감소시킴으로써 일반 인구의 위험 감소를 달성할 수 있다.
유전학
FGFR3, TP53, PIK3CA, KDM6A, ARID1A, KMT2D, HRAS, TERT, KRAS, CREBP, RB1 및 TSC1 유전자의 돌연변이는 방광암의 [40][41][42]일부 사례와 관련될 수 있다.9번 [43]염색체의 일부 또는 전체가 결손되는 것은 방광암에서 흔히 볼 수 있다.저급암은 RAS 경로와 섬유아세포 성장인자 수용체 3(FGFR3) 유전자에 돌연변이가 있는 것으로 알려져 있으며, 둘 다 MAPK/ERK 경로에서 역할을 한다.p53 및 RB 유전자 돌연변이는 고급 근육 침습성 [44]종양에 관여한다.근침습성 암의 89%는 염색질 리모델링과 히스톤 수정 [45]유전자에 돌연변이를 가지고 있다.GSTM1 유전자의 두 복사본의 결실은 방광암의 위험을 약간 증가시킨다.GSTM1 유전자 생성물 글루타치온 S-전달효소 M1(GSTM1)은 담배연기에 [46]존재하는 다환방향족 탄화수소 등의 발암물질의 해독과정에 관여한다.마찬가지로 NAT2(N-아세틸전달효소)의 돌연변이는 방광암 위험 증가와 관련이 있다.N-아세틸전달효소는 방향족([47]담배 연기에도 있음)과 같은 발암물질의 해독을 돕는다.8번 염색체에 존재하는 PSCA 유전자의 다양한 단핵 다형성은 방광암의 위험을 증가시키는 것으로 나타났다.PSCA 유전자 프로모터 영역은 안드로겐 반응 영역을 가진다.안드로겐에 대한 이 부위의 반응성 상실은 여성에게서 더 많은 공격적인 종양의 원인으로 가정된다(안드로겐의 [48]양이 더 많은 남성들과는 달리).
근육침습성 방광암은 본질적으로 이질적이다.일반적으로, 그것들은 유전적으로 기저와 내강 아형으로 분류될 수 있다.기초 아형은 RB 및 NFE2L2와 관련된 변화를 나타내고, 내강형은 FGFR3 및 KDM6A [49]유전자의 변화를 나타낸다.기저 아형은 기저군과 클라우딘 저형군으로 세분되며 공격적이고 현재 전이를 보이지만 백금계 화학요법에 반응한다.내강 아형은 p53과 내강으로 나눌 수 있다. 내강 아형의 p53과 같은 종양은 기초형만큼 공격적이지는 않지만 화학요법에[50] 대한 내성을 보인다.
진단.
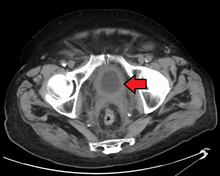
현재 방광 상태를 가장 잘 진단하는 방법은 방광경 검사로, 카메라와 각종 기구를 장착한 유연하거나 단단한 튜브(일명 방광경)를 요도를 통해 방광에 삽입하는 시술이다.유연한 절차를 통해 방광을 육안으로 검사하고, 사소한 교정 작업을 수행하며, 조직 검사를 위해 의심스러운 병변의 샘플을 채취할 수 있습니다.경직 방광경은 수술실에서 전신마취 하에 사용되며 교정작업과 생체검사는 물론 보다 광범위한 종양제거를 지원할 수 있습니다.방광강으로 자라서 잘 보이는 유두병변과 달리, 상황병변에서의 암은 평평하고 불분명하다.상황 병변에서 암을 발견하기 위해서는 방광 [51]내벽의 다른 영역에서 여러 생체 검진이 필요하다.광역학적 검출(청색광 방광경)은 현장에서의 암 검출에 도움이 될 수 있습니다.광역학적 검출에서는 카테터의 도움을 받아 방광에 염료를 주입한다.암세포는 이 염료를 흡수하고, 생물 검진이나 [52]절제해야 할 부위에 대한 시각적 단서를 제공하면서, 푸른 빛 아래에서도 볼 수 있다.
그러나 위에 열거된 어떤 형태의 시각적 검출도 병리학적 분류, 세포 유형 또는 현재 종양의 단계를 확립하기에 충분하지 않습니다.일반적인 방광경 검사(강성 또는 유연성) 중 소위 콜드컵 조직검사도 병리학적 단계에는 충분하지 않을 것이다.따라서 경요도 수술 후에 육안검출이 필요하다.그 절차는 경요도 방광종양 절제술이라고 불린다.또한 TURBT 전후에 직장 및 질 쌍안검사가 수행되어야 하며, 촉각성 덩어리가 있는지 또는 종양이 골반 벽에 고정되어 있는지("연결") 여부를 평가해야 합니다.TURBT 절차를 통해 얻어진 병리학적 분류 및 병기 정보는 후속 치료 및/또는 추적 [53]루틴의 적절한 선택을 위해 근본적으로 중요하다.
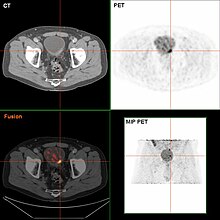
TURBT에서 침습성 또는 높은 등급(위치 암 포함) 암이 발견되면 질병 단계와 암 확산(메타시스)[54]을 위해 복부 및 골반 또는 요로그램 및 CT 흉부의 MRI 및/또는 CT 스캔을 수행해야 합니다.간질환의 증거가 없는 알칼리성 포스파타아제 수치 증가는 뼈 [55]스캔을 통해 뼈 전이를 평가해야 한다.F-불소옥시글루코스(FDG)-양성자 방출 단층촬영(PET)/CT가 스테이징을 위한 실행 가능한 방법으로 연구되었지만, 일상적인 임상 [52]평가에서 F-불소옥시글루코스의 역할을 뒷받침하는 합의는 없다.
소변 세포학은 소변을 보거나 방광경 검사("담낭 세척")를 할 때 얻을 수 있습니다.세포학은 저급 또는 1급 종양(음성 결과는 방광암을 확실하게 배제할 수 없음)에 대해서는 매우 민감하지 않지만 높은 특이성(양성 결과는 방광암을 [56]확실하게 발견함)을 가지고 있다.인간보완인자 H 관련 단백질, 고분자 카르시노 태아 항원 및 핵매트릭스 단백질 22(NMP22)[57]를 포함하여 방광암 진단에 도움이 되는 새로운 비침습성 소변 결합 마커가 있다.미국에서 FDA는 방광암의 검출 및 감시를 위한 NMP22, NMP22 Bladrecchek 및 UroVysion 테스트를 승인했으며, 면역세포, BTA-TRAK 및 BTA-STAT 테스트는 감시용으로만 승인되었습니다.BTA-STAT 및 BladChek은 클리닉에서 수행될 수 있으며 [58][59]다른 작업은 실험실에서 수행됩니다.다른 비침습적 소변 기반 검사로는 FGFR3 돌연변이를 검출하는 CertNDX 방광암 검사와 Cytokeratin 8/18 fragment에 대한 샌드위치 ELISA인 소변 방광암 검사(UBC)가 있습니다.마찬가지로 NMP22는 샌드위치 ELISA, NMP22 BraderCheck는 딥스틱 면역측정법이며 둘 다 NuMA(핵유도체단백질)[60] 종양표지자(핵매트릭스단백질의 일종)를 검출한다.UroVysion은 3, 7, 17번 염색체의 배수와 9p21 [61][62]자리의 상실을 검출하는 형광 현장 교배입니다.ImmunoCyt는 글리코실화 CEA 및 MUCIN 유사 항원(M344, LDQ10, 19A11)[60][61]을 검출하는 면역 형광 시험이다.BTA-STAT는 인간보완인자 H 관련 단백질 검출을 위한 딥스틱 면역측정법이다.BTA-TRAK는 인체보완인자 H 관련 단백질도 [60]검출하는 샌드위치 ELISA입니다.바이오마커 전반의 민감도는 0.57 - 0.82, 특이성은 0.74 - 0.88이었다.바이오마커는 단독으로 사용할 때보다 소변 세포학과 함께 사용할 때 성능이 더 뛰어납니다.그러나 낮은 등급의 암은 검출 정확도가 떨어지고 10%의 암이 여전히 [58]누락된다.현행 가이드라인에서는 검출 및 [63]감시를 위해 비뇨기 바이오마커를 사용하지 않는 것이 좋습니다.
분류
| 유형 | 상대적 발생률 | 서브타입 |
|---|---|---|
| 전이세포암 | 95%[64][65] | 유두(70%)[64] |
| 비양악(30%)[64] | ||
| 비전이세포암 | 5% [64][65] | 편평상피암, 선암, 육종, 소세포암, 그리고 신체의 [65]다른 곳에서 발생한 암의 2차 퇴적물. |
비양악암은 위치암(CIS), 미세침습성암 및 솔직히 [66]침습성암을 포함한다.위치암(CIS)은 반드시 세포학적으로 높은 등급의 [67]종양세포로 구성된다.
전이성 세포암은 [66][68][69]변종으로 분화(25%)될 수 있다.현미경으로 관찰할 때, 유두 전이 세포암은 전형적인 형태 또는 그 변형 중 하나로 나타날 수 있다(오징어, 선 분화 또는 미세 유두 변종).아래에는 다양한 종류의 비유두 전이 세포암이 나열되어 있습니다.
| 변종 | 조직학 | 비유두증례의 비율 | 시사점[70] |
|---|---|---|---|
| 편평 분화 | 세포간 브릿지의 존재 또는 각화 | 60% | 종래의 전이 세포암과 유사한 결과 |
| 선분화 | 진선 공간의 존재 | 10% | |
| 사코마토이드포치 | 상피 및 간엽 분화가 모두 존재하는지 여부 | 7% | 임상적으로[71] 공격적 |
| 미립자 변이체 | 난소의 유두장막암과 유사하거나 유방 또는[72] 폐의 미세유두장막암과 유사함 | 3.7% | 임상적으로 공격적인 조기 방광절제술 권장 |
| 소세관과 소낭포 형태를 가진 요관암 | 현미경에서 1~2mm 사이즈의 낭종 유무 | 드문 | |
| 림프상피종양암 | 비인두 림프상피종과 유사 | ||
| 림프종양 및 플라스마사이토이드 변이체 | 악성세포는 악성 림프종 또는 플라스마 세포종 세포와 유사합니다 | ||
| 중첩된 변형 | 조직학적으로 폰 브룬의 둥지와 비슷해 보인다. | 양성 폰 브룬의 둥지 또는 비침습성 저급 유두 요도암으로 오진될 수 있습니다 | |
| 거대 세포를 가진 요관암 | 상피종양의 거대세포가 존재하며 폐의 거대세포암과 유사하다 | ||
| 영양아세포분화 | HCG를 발현할 수 있는 합성영양세포 거대세포 또는 엽록암종 분화의 존재 | ||
| 클리어 셀 바리안트 | 글리코겐이 풍부한 세포질을 가진 투명한 세포 패턴 | ||
| 플라스마사이토이드 | 지질 함량이 풍부한 세포, 위/소엽 유방암의 시그넷 고리 세포 선암을 모방한 세포 | 임상적으로 공격적이고 복막확대 경향 | |
| 비정상적인 간질 반응 | 다음 존재 여부: 가성육종, 간질삼투 또는 연골화생, 골아세포형 거대세포, 림프관 침윤 |
스테이징
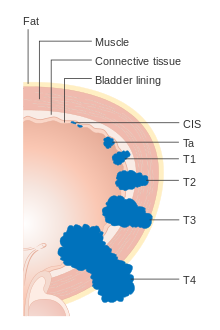
방광암은 치료를 결정하고 결과를 예측하기 위해 단계별(암의 확산 정도에 따라 분류)되고 등급별(현미경 하에서 세포가 얼마나 비정상적이고 공격적으로 보이는지)됩니다.스테이징은 보통 방광종양의 경요도 절제(TURBT)와 방사선 영상(CT 및 MRI)을 통해 수행됩니다.점막에 국한되거나 라미나 프로프리아에 침입하는 유두종양은 Ta 또는 T1로 분류된다.방광 점막의 기저막을 침범하지 않는 편평한 병변은 Tis(위치)라고 한다.세 가지 범주(Tis, Ta, T1) 모두 치료 목적으로 비근육 침습성 질환으로 분류되며, 대부분의 경우 전체 방광을 급진적으로 절제할 필요 없이 TURBT에 의한 방광경 절제술을 제공한다.나머지 범주(T2, T3, T4)의 종양은 근육침습성 질환으로 불리며 [54]예후가 좋지 않다.
방광암에 [73][74]대한 TNM 병기 시스템(2017년 9월 8일)에서:
T(원발성 종양)
- TX 기본 종양을 평가할 수 없습니다.
- T0 원발성 종양의 증거가 없습니다
- Ta 비침습성 유두암
- Tis Canceroma in situit('평평한 종양')
- T1 종양이 상피하 결합조직을 침범함
- T2a 종양은 표층 근육([75]탈루근의 절반 안쪽)을 침범합니다.
- T2b 종양은 깊은 근육(탈루근의 [75]절반 바깥쪽)을 침범한다.
- T3 종양은 상피 조직을 침범합니다.
- T3a 현미경으로 보기
- T3b 거시적 (초대 질량)
- T4a 종양은 전립선, 자궁 또는 질에 침입합니다.
- T4b 종양이 골반 벽 또는 복벽을 침범함
N(림프 노드)
- NX 국소 림프절을 평가할 수 없습니다
- N0 국소 림프절 전이 없음
- N1 진정한 골반의 단일 림프절 전이(최고위, 폐쇄제, 외부 장골 또는 전골절)
- N2 진정한 골반에서 여러 림프절 전이(최고위, 폐쇄제, 외부 장골 또는 전골절)
- N3 일반적인 장골 림프절 전이
M(원거리 전이)
- MX 원격 전이를 평가할 수 없습니다.
- M0 원거리 전이 없음
- M1 원거리 전이
- 암은 골반 밖의 림프절에만 전이되었습니다.
- 암이 신체의 다른 부위로 전이되었습니다.
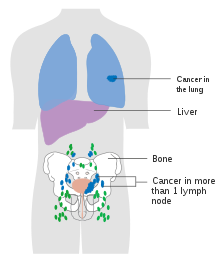
방광암이 전이되는 가장 흔한 부위는 림프절, 뼈, 폐, 간, 복막이다.[76]방광암을 배출하는 가장 흔한 센티넬 림프절은 폐쇄제와 내장 장골 림프절이다.림프 확산의 위치는 종양의 위치에 따라 달라집니다.상부 방광벽의 종양이 외부 장골 림프절까지 전이되었습니다.목, 전벽, 안저에 있는 종양은 일반적으로 장골 림프절 [77]내부로 퍼진다.국소 림프절(즉, 폐쇄제, 내부 및 외부 림프절)[78]에서 암은 일반적인 장골 림프절 및 부피질 림프절과 같은 먼 부위로 전이된다.생략된 [77]림프절 병변은 방광암에서 볼 수 없습니다.
숫자
위의 단계는 다음과 [79]같이 숫자 단계(로마 숫자 포함)로 통합할 수 있습니다.
| 단계. | 종양 | 노드 | 전이 | 미국에서의[80] 5년간의 생존 |
|---|---|---|---|---|
| 스테이지 0a | 타 | N0 | M0 | 98% |
| 스테이지 0is | 티스 | N0 | M0 | 95% |
| 스테이지 1 | T1 | N0 | M0 | 63% |
| 스테이지 II | T2a | N0 | M0 | |
| T2b | ||||
| 스테이지 IIIA | T3a | N0 | M0 | 35% |
| T3b | ||||
| T4a | ||||
| T1-4a | N1 | |||
| 스테이지 IIIB | T1-4a | N2 | M0 | |
| N3 | ||||
| 스테이지 IVA | T4b | 임의의 N | M0 | |
| 임의의 T | M1a | |||
| 스테이지 IVB | 임의의 T | 임의의 N | M1b | 5% |
채점
WHO 분류(1973년)에 따라 방광암은 조직학적으로 다음과 같이 [81]분류된다.
- G1 – 뛰어난 차별화,
- G2 – 중간 정도의 차별화
- G3 – 차별화 부족
- 유두병변
- 요관성 유두종
- 저악성 잠재성의 유두요도막신생물(PNLMP)
- 낮은 등급
- 하이 그레이드
- 평탄한 병변
- 불확실한 악성 잠재력의 요관 증식
- 반응성 비정형
- 의미를 알 수 없는 비정형
- 요관 이형성증
- 요관 CIS(항상 높은 등급)
- 기본적인
- 이차적인
- 동시
리스크 계층화
비근육침습방광암(NMIBC)을 가진 사람은 진행 및/[84]또는 재발 확률에 따라 적절하게 치료되도록 임상 및 병리학적 요인에 따라 위험 계층화된다.비근육침습성 종양이 있는 사람은 저위험성, 중간위험성, 고위험성으로 분류되거나 수치위험성 점수를 제공한다.위험 계층화 프레임워크는 미국 비뇨기학회/비뇨기 종양학회(AUA/SUO 계층화), 유럽 비뇨기학회(EAU) 지침, 유럽 암 연구 및 치료 기구(EORC) 위험 테이블 및 클럽 우롤파뇨시코에서 제공한다.
비근육 침습성 방광암의[85] AUA 위험 계층화| 리스크가 낮다 | 중간 리스크 | 리스크가 높다 |
|---|---|---|
| 저급 단독 Ta 종양, 3cm 미만 | 1년 이내 재발, 저급 Ta종양 | 하이 그레이드 T1 |
| 저악성 잠재성의 유두 요도 신생물 | 단독성 저급 Ta종양, 3cm 이상 | 재발성 종양이나 고농도 Ta |
| 저급 Ta, 다초점 종양 | 3cm 이상(또는 다초점)의 고등급 Ta | |
| 고급 Ta, 3cm 미만 | 암 발생 여부 | |
| 저급 T1 | 고악도 종양의 BCG 기능 상실 | |
| 모든 변종 조직학 | ||
| 림프관 침입 | ||
| 고급 전립선 요도 질환 |
EORC 및 CUTO 모델은 개별 예후 요인에서 얻은 누적 점수를 사용하며, 이는 진행 및 재발 위험으로 변환된다.EORC 모델에 포함된 6가지 예후 인자는 종양 수, 재발률, T 단계, 암 발생 상황 및 종양의 등급입니다.CUTO 모델에서 재발에 대한 점수는 연령, 성별, 등급, 종양 상태, 종양 수 및 티의 유무 등 6가지 변수를 포함한다.진행 스코어링의 경우 이전 6개의 변수와 T 스테이지가 사용됩니다.[88][89]
누적[90][91] 점수에 따른 EORTC/CUTO 재발 위험| 모델 | 반복 누적 점수 | 1년간의 재발(%) | 5년간의 재발(%) |
|---|---|---|---|
| EORTC | 0 | 15 | 31 |
| 1-4 | 24 | 46 | |
| 5-9 | 38 | 62 | |
| 10-17 | 61 | 78 | |
| 큐토 | 0-4 | 8.2 | 21 |
| 5-6 | 12 | 36 | |
| 7-9 | 25 | 48 | |
| 10-16 | 42 | 68 |
| 모델 | 진행누계점수 | 1년 경과(%) | 5년 경과(%) |
|---|---|---|---|
| EORTC | 0 | 0.2 | 0.8 |
| 2-6 | 1 | 6 | |
| 7-13 | 5 | 17 | |
| 12-23 | 17 | 45 | |
| 큐토 | 0-4 | 1.2 | 3.7 |
| 5-6 | 3 | 12 | |
| 7-9 | 5.5 | 21 | |
| 10-16 | 14 | 34 |
예방
2019년 현재, 채소와 과일을 먹는 것이 방광암의 [47]위험을 감소시킨다는 것을 암시하는 제한된 높은 수준의 증거가 있다.2008년의 한 연구는 "특정 과일과 채소가 방광암의 [92]위험을 감소시키는 역할을 할 수 있다"고 결론지었다.과일과 노란색 오렌지색 채소, 특히 당근과 셀레늄이 [93]함유된 야채는 방광암의 위험을 적당히 낮추는 것과 관련이 있을 것이다.감귤류 과일과 십자화과 채소도 보호 효과가 있는 것으로 확인되었다.그러나 건강 전문가 추적 연구에서 47,909명의 남성을 대상으로 한 분석에서는 십자화과 채소를 다량 섭취한 남성에 비해 전반적으로 암 감소와 과일 및 채소, 특히 노란색 또는 녹색 잎이 많은 채소의 높은 소비 사이에는 거의 관계가 없는 것으로 나타났다.플라보놀과 리그난(전곡류, 콩류, 과일 및 야채에서 발견되는 다이페놀 화합물)의 섭취와 공격적인 방광암 사이의 역관계도 [94]설명되었다.
차에 함유된 폴리페놀 화합물이 방광종양의 형성과 성장을 억제하는 효과가 있을 수 있지만, 차를 마시는 것이 방광암 [47]위험을 감소시킨다는 증거는 제한적이다.
거의 49,000명의 남성들을 대상으로 한 10년간의 연구에서, 연구원들은 하루에 적어도 1.44리터의 물을 마신 남성들이 덜 마신 남성들에 비해 방광암에 걸릴 위험이 낮다는 것을 발견했습니다.또한 "액체 240mL를 첨가할 때마다 방광암 위험이 7% 감소"하는 것으로 나타났다.[95]저자들은 방광암이 소변으로 배출되는 발암물질과 직접 접촉해 부분적으로 발생할 수 있다고 제안했다.[92]
스크리닝
2019년 현재 증상이 없는 사람의 방광암 검진이 효과적인지 [96]여부를 판단할 수 있는 충분한 증거가 없다.
치료
방광암의 치료는 종양이 방광 벽에 얼마나 깊이 침투하느냐에 달려 있다.
- 비근육침습성: 방광종양의 경요도 절제(TURBT)로, 방광내 화학요법 또는 면역요법을 포함하거나 포함하지 않음
- 근육 침습
- 전이성 질환 : 시스플라틴 기반 화학요법
- 전이성 질환이지만 시스플라틴 기반 화학요법에는 부적합: 카르보플라틴 기반 화학요법
- 화학요법 금지 전이성 질환: 프로그램된 사망배위자 1(PD L1) 양성일 경우 체크포인트 억제제
- 방광 편평상피암 또는 선암: 래디컬 방광 절제술
비근육침습성
경요도 절제술
비근육 침습성 방광암은 방광경에 부착된 전기 소작 장치를 사용하여 "제거"할 수 있는데, 이 경우 절제경이라고 불립니다.그 절차는 경요도 방광종양 절제라고 불리며 주로 병적 단계에 사용된다.비근육침습성 방광암의 경우 TURBT 자체가 치료법이지만 근육침습성 암의 경우 최종 [53]치료법으로는 불충분하다.또한 초기 TURBT에서 병변 검출(특히 현장 암)을 증가시키고 절제 품질을 개선하여 [99][100]재발을 줄이기 위해 광학 이미징제 헥사미노불린산염(HAL)을 사용한 청색광 방광경 검사가 권장된다.절제술의 품질을 평가하는 것이 중요합니다. 불완전한 절제술의 증거가 있거나 검체에 근육이 없는 경우(근육 침윤성을 판단할 수 없는 경우), 두 번째 TURBT를 강력히 권장합니다.또한, 고도 비침습성 질환을 가진 사람 중 절반 가까이가 1차 TURBT 후 잔류 종양을 가지고 있다. 이러한 경우, 2차 TURBT는 [101][102]저단계 상태를 피하기 위해 중요하다.이 시점에서 사람들을 위험 그룹으로 분류하는 것이 좋습니다.다른 위험 그룹에 대한 치료 및 감시는 아래 [citation needed]표에 나와 있습니다.
종양의 재발을 줄이는 또 다른 방법은 TURBT 수술 후 약물치료이다.이러한 목적으로 사용되는 가장 일반적인 두 가지 약은 Bacillus Calmette-Guérin(BCG)과 mitomycin이다.[103]이미 TURBT 시술을 받은 사람의 경우 BCG는 유사한 사망 위험을 초래할 수 있으며 종양 [103]재발 위험을 줄일 수 있습니다.하지만, 이 약은 심각한 원치 않는 [103]부작용의 위험을 증가시킬 수 있습니다.이러한 결과를 확인하기 위해서는 더 많은 연구가 필요하다.
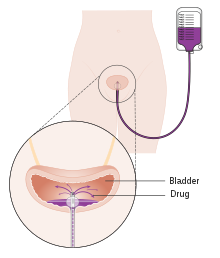
화학 요법
1차 TURBT 후 방광에 화학요법을 한 번 주입하면 비근육침습성 [104]질환에서 재발을 35% 감소시키는 효과가 있는 것으로 나타났다.이를 위해 사용할 수 있는 의약품은 미토마이신C(MMC), 에피루비신, 피라루비신 및 젬시타빈이다.수술 후 화학요법은 TURBT 후 처음 몇 시간 이내에 실시해야 합니다.시간이 경과함에 따라 잔류 종양 세포는 단단하게 달라붙어 [102]링거의 효과를 감소시키는 세포외 기질로 덮여 있는 것으로 알려져 있다.가장 흔한 부작용은 화학 방광염과 피부 [104]자극이다.TURBT 시 방광 천공 의심증이 있을 경우 약물 누출로 심각한 부작용이 발생하는 것으로 알려져 있으므로 방광에 화학요법을 주입해서는 안 된다.연구들은 화학요법의 효과가 장치 보조 화학요법의 [105]사용으로 증가한다는 것을 보여주었다.이러한 기술은 방광에 직접 주입된 화학요법 약물의 흡수와 작용을 촉진하기 위해 다른 메커니즘을 사용합니다.또 다른 기술인 전기 약물 투여(EMDA)는 [106][107]종양을 외과적으로 제거한 후 전류를 사용하여 약물 흡수를 강화합니다.또 다른 기술인 온열요법은 방광벽을 직접 가열하기 위해 고주파 에너지를 사용하는 것으로 화학요법(화학고온증)과 함께 서로 종양세포를 [108]죽이는 능력을 높여주는 상승효과를 보여준다.
면역 요법
NMIBC의 [109]치료 및 재발 방지를 위해 방광에 대한 BCG(Bacillus Calmette-Guérin) 전달에 의한 면역요법도 사용된다.BCG는 인체에서 독성을 상실한 약화된 살아있는 소결핵균인 마이코박테륨보비스에서 제조한 결핵 백신이다.BCG 면역요법은 이 단계에서 2/3까지 효과가 있으며 무작위 시험에서는 표준 화학요법보다 [110]우수한 것으로 나타났다.BCG가 재발을 방지하는 정확한 메커니즘은 알려져 있지 않습니다.그러나 이 박테리아는 암세포에 [111]흡수되는 것으로 나타났다.방광에 있는 이러한 세포의 감염은 암세포를 [112][113]제거하는 국소 면역 반응을 일으킬 수 있다.
BCG는 인덕션 및 유지보수 코스로 제공됩니다.유도 코스는 6주간의 방광 [114]내 및 경피 BCG 코스로 구성됩니다.그 후 유지 보수 코스가 계속됩니다.유지관리 일정에 대한 합의는 없지만, 가장 일반적으로 따르는 것은 Southwestern Oncology Group([115]SWOG) 일정입니다.SWOG 유지관리 스케줄은 3, 6, 12, 18, 24, 30, 36개월에 [114]주어지는 3주 동안 매주 방광 내 및 경피 내 BCG로 구성됩니다.6개월에 6주 유도 BCG를 받은 사람들의 69%에 비해, 유도를 통한 3주 유지 요법은 84%의 완전한 응답률을 보였다.많은 연구가 BCG의 대체 치료 일정과 방법을 탐색했지만 임상적 [114]의미는 없었다.BCG의 다른 변종(Connaught, TICE, Pastre, Tokio-172)의 효능은 다르지 않은 것으로 나타났으나 높은 수준의 [116]증거는 없다.
BCG 치료의 부작용으로는 방광염, 전립선염, 부고환막염, 난간염, 요관폐쇄, 방광수축, 마이코박테리아성 골수염, 반응성 관절염, 마이코박테리아성 폐렴, 육아종성 간염, 육아종성 신장염, 간질성 신장염, 감염성 혈관염, 파종성 [117][118]감염 등이 있다.
BCG로 인한 국소 감염(즉, 전립선염, 부고환관절염, 난간염)은 3중결절요법으로 치료해야 하며, 그 중 하나는 3-6개월 동안 플루오로퀴놀론이다.전신 감염자의 경우 BCG 치료를 중단하고 최소 6개월 동안 항결핵 다제 치료를 시작해야 한다.이 치료에 사용될 수 있는 약물은 INH, 리팜피신, 에탐부톨, 플루오로퀴놀론, 클라리트로마이신, 아미노글리코시드, 독시사이클린이다.BCG 균주는 피라진아미드에 민감하지 않으므로 항결핵 [119]치료의 일부가 되어서는 안 됩니다.
BCG 처리 실패
BCG 치료 실패는 BCG 재발, BCG 내성, BCG 내성 등 3가지 그룹으로 분류할 수 있다.BCG가 재발하는 경우, 무병 기간이 지나면 종양이 재발합니다.BCG-환원성 종양은 BCG의 유도 및 유지 용량에 반응하지 않거나 치료 중에 진행되는 종양이다.BCG 불내성에서는 BCG의 유도 과정을 견딜 수 없기 때문에 불완전한 치료로 인해 종양이 재발한다.약 50%의 사람들이 BCG 치료에 실패하여 추가 치료가 필요할 [114]것이다.
BCG로 치료한 후 종양이 재발하거나 치료에 반응하지 않는 사람은 치료가 [120]더 어렵다.그러한 사람들에게서 근위 방광 절제술이[121][122] 권장된다 BCG 치료에 반응을 보이지 않고 근위 방광 절제술을 받을 자격이 없거나 받을 의사가 없는 사람들에게서 근위 방광 절제술을 고려할 수 있다.인양요법에는 발루비신, 젬시타빈 또는 독세탁셀, 화학방사선 또는 화학저온증 [123]등의 약물에 의한 방광내 화학요법이 포함된다.
1차[53][84][98] TURBT 후 치료 및 사후관리| 위험. | 기타 고려사항 | 화학 요법 | 면역요법(BCG) | 방광경 검사(감시) | 이미징(서베이런스) |
|---|---|---|---|---|---|
| 낮다 | 3회차에 방광경 검사 후 12회차에 방광경 검사 후 5년간 1년에 한 번 | 베이스라인에서의 복부 및 골반의 CT/MR 요로그래피 및 CT/MRI | |||
| 중간의 | 화학요법 병력이 있는 원발성 종양 | 1년간 방광내 화학요법 또는 1년간 방광내 BCG 요법(권장) | 세포학이 있는 3회 투여 후 3~6개월에 1회 5년, 그 후 1년에 1회 투여한다. | 베이스라인에서의 복부 및 골반의 CT/MR 요로그래피 및 CT/MRI | |
| 이전 화학요법의 병력이 있는 재발 종양 | 1년간 방광 내 BCG | ||||
| 높은 | 3년간 방광 내 BCG(허용 범위 내) | 세포학에서 3회 투여 후 2년간 3회 투여에 1회 투여하고, 그 후 5년간 6회 투여 후 1년에 1회 투여한다. | 기준 복부 및 골반의 CT/MR 요도 및 CT/MRI, 10년간 연 1~2회 CT/MR 요도 검사 | ||
| T1G3/고급, 림프혈관침입, 변종조직학 존재 | 래디컬 방광 절제술을 고려하다 | ||||
근육 침습
멀티모달 치료(표준 치료)
치료되지 않은 비근육 침습성 종양은 방광의 근벽에 점차 침투하기 시작할 수 있습니다(근육 침습성 방광암).방광 벽에 침투하는 종양은 방광의 일부 또는 모든 부분(부분 방광 절제)이 제거되고(방광 절제) 요류가 격리된 장루프(회도관 또는 요로 절개)로 전환되는 보다 급진적인 수술이 필요하다.어떤 경우에, 숙련된 외과의사들은 장 조직의 일부에서 대체 방광(신장염)을 만들 수 있지만, 이것은 사람의 선호도, 사람의 나이, 신장 기능, 그리고 [citation needed]질병의 부위에 크게 좌우된다.
양쪽 골반 림프절제술은 급진적 방광절제술을 동반해야 한다.최소한 림프절제술의 표준 템플릿에 따라 외부 및 내부 장골 및 폐쇄성 [124]림프절을 제거해야 한다.림프절제술을 수행할 때 의사는 더 작은(표준) 영역 또는 더 큰(확장된) 영역에서 림프절을 제거할 수 있습니다.일반적인 림프절 절개술과 비교하여, 장기 절개술은 방광암으로 [125]사망하는 것을 포함하여 어떤 이유로든 사람의 사망 가능성을 낮출 수 있다.연장된 시술은 더 심각한 원치 않는 영향을 초래할 수 있으며 시간이 [125]지남에 따라 암이 재발할 가능성에 영향을 미칠 수도 있고 그렇지 않을 수도 있습니다.그렇게 심각하지 않은 부작용의 비율은 두 [125]수술 모두 비슷할 수 있다.
래디컬 방광절제술은 상당한 이환율을 가지고 있다.약 [126][127]50~65%의 사람들이 수술 후 90일 이내에 합병증을 경험한다.수술 후 90일 이내 사망률은 7%였다.고음량 센터는 저음량 [128]센터보다 더 나은 결과를 가져옵니다.일부 센터는 근치적 방광절제술 후 이환율을 낮추기 위해 수술 후 회복력 향상(ERAS) 사회 권고를 시행하고 있다.그러나 비뇨기과 수술의 구체적인 증거가 부족하기 때문에 ERAS 프로토콜은 비뇨기과 [129]의료에 널리 통합되지 않았다.
방광의 외과적 제거 후에도 근육침습성 질환(T2-T4) 환자 중 50%가 미소메타시스(micrometasis)[130]로 인해 2년 이내에 전이성 질환에 걸린다.이와 같이, 네오아주반트 화학요법(주요법, 즉 수술 전 화학요법)은 5년 동안 전체 생존율을 45%에서 50%로 증가시키고, 절대 생존율은 5%[131][132][133]이다.현재 네오아주반트 화학요법에 가장 많이 사용되는 두 가지 화학요법 요법은 백금 기반이다. 메토트렉세이트, 빈블라스틴, 독소루비신, 시스플라틴(MVAC) 및 시스플라틴(GC)[134]이 있는 젬시타빈이다.다른 요법으로는 용량 밀도 MVAC(DDMVC)와 시스플라틴, 메토트렉세이트 및 빈블라스틴(CMV)이 있다.최적의 요법은 아직 확립되지 않았지만, 네오어드주반트 치료를 위해 선호하는 요법은 MVAC이다.[134]
보조 화학요법(주요법 후 화학요법)의 역할은 종양(pT3/T4 및/또는 N+)이 높고 네오 보조요법으로 치료되지 않은 [124]사람으로 제한된다.방광암 [135]치료에는 보조 방사선 요법이 전혀 도움이 되지 않는다.
네오어드주반트 및 보조 화학요법을[136][137] 위한 화학요법 요법의 용량 및 일정| MVAC | DDMVAC | 젬시타빈 + 시스플라틴 |
|---|---|---|
| 메토트렉세이트(30mg/mIV2) - 1,15,22일째 Vinblastine (3mg/m2 IV) - 2일차, 15일차, 22일차 독소르비신(30mg/mIV2) - 2일차 시스플라틴(70mg/mIV2) - 2일째 4주마다 3사이클 반복 | 메토트렉세이트(30mg/mIV2) - 1일 Vinblastine (3mg/m2 IV) - 2일째 독소르비신(30mg/mIV2) - 2일차 시스플라틴(70mg/mIV2) - 2일째 과립구 콜로니 자극인자(G-CSF)(240μg/m2 SC) - 4~10일차 2주마다 3~4회 반복 | 젬시타빈(1,000mg/mIV2) - 1,8,15일째 시스플라틴(70mg/m2) - 2일째 4주마다 4사이클 반복 |
트리모달 요법(대체 치료)
경요도(내시경) 방광종양 절제술과 함께 방사선 및 화학요법(화학요법)을 조합하는 것이 일부 사람들에게 [138]대안으로 사용될 수 있습니다.이 소위 3중성 요법에 대한 이용 가능한 대규모 데이터 시리즈를 검토한 결과, 비뇨기 재구축과 함께 급진적 방광 절제술을 받는 사람들의 전반적인 삶의 질이 향상되면서 유사한 장기 암 특이 생존율이 나타났다.그러나 현재 삼각형 요법을 래디컬 방광 절제술과 비교한 무작위 대조군 시험은 없다.삼장치료를 받는 사람은 대개 고도로 선택되며 일반적으로 현장에서 [139]수문증 및/또는 암종이 없는 T2 질환을 가지고 있다.5년간 암 특이 생존율과 삼치 치료 후 전체 생존율은 50%에서 82%, 36%에서 74%[138] 사이입니다.
트리모달 치료에서는 최대 TURBT를 실시한 후 화학방사선 치료를 실시한다.시스플라틴 또는 5-플루로라실 및 미토마이신C로 이루어진 방사선감작화학요법요법을 사용한다.방사선 치료는 외부 콩 방사선 치료(EBRT)를 통해 이루어지며, 치료 선량은 64-66 [140]Gy이다.진행 또는 재발에 대한 감시는 CT 스캔, 방광 내시경 및 소변 [124]세포학의 도움을 받아 수행되어야 한다.화학요법의 부작용으로는 메스꺼움, 구토, 식욕부진, 탈모, 구강염, 설사, 변비, 감염 위험 증가, 출혈 및 [141]피로 등이 있다.
삼분지 요법에 실패한 사람들은 근육 침습이나 재발성 종양이 있는 경우 래디컬 방광 절제술을 고려한다.약 25-30%가 치료에 실패하여 근치성 [138]방광절제술을 받는다.비근육침습성 [124]질환에 대한 치료 실패 후 방광내 치료를 통한 TURBT가 나타난다.
부분 방광 절제술
깨끗한 수술 여백이 달성될 수 있는 부위에 동시에 암이 없는 단독 종양이 있는 경우 림프절제술을 포함한 부분 방광 절제술을 고려할 수 있다.부분 방광 절제술을 포함한 관리 계획은 네오어주반트 화학 [98]요법을 동반해야 한다.방광의 요람선암 환자는 요람인대 및 배꼽 절제술을 고려할 [11]수 있다.
전이성 질환
제일선 처리
시스플라틴 함유 복합화학요법은 전이성 방광 [142]케어의 표준이다.치료 전에 시스플라틴 기반 화학요법을 받는 적합성을 평가한다.다음 중 하나에 해당하는 자는 [143]부적격자로 판단된다.
- 동부종양학그룹 실적현황 2
- 크레아티닌 클리어런스 < 60 mL/min
- 2등급 이하의 난청
- 2급 신경 장애
- 뉴욕 심장 협회 Class III 심부전
적합하다고 판단되는 사람은 백금 기반의 요법, 즉 시스플라틴(MVAC)이 포함된 메토트렉세이트, 빈블라스틴, 독소루비신 또는 시스플라틴(GC)이 포함된 젬시탁셀과 시스플라틴(PCG, 삼중요법)과 시스플라틴(VLASTIN)이 있다.시스플라틴 기반 조합에 대한 응답률은 39 - 65%이며,[144] 전체 응답률은 12 - 35%의 사람들에게 나타난다.MVAC는 과립구 콜로니 자극 인자와 결합되어 용량 밀도가 높은 MVAC 레지멘(DDMVAC)으로 알려져 있는 경우 더 잘 견딜 수 있다.이 조합은 모든 사망원인을 감소시키는 것으로 나타났다.[145]MVAC 요법은 적극적이다.열성호중구감소증(백혈구의 감소로 인한 열감소)은 10~14%에서 발생하며 독성으로 인한 사망은 약 3~4%에서 발생한다.MVAC의 일반적인 부작용으로는 골수 억제, 백혈구 감소로 인한 발열, 패혈증, 점막염, 메스꺼움과 [144]구토 등이 있다.반면, GC 요법은 MVAC에 [146]비해 호중구 감소성 패혈증 및 등급 3/4 점막염의 발생률이 낮았다.시스플라틴 기반 식이요법을 카르보플라틴 기반 화학요법으로 대체함으로써 내성을 높이기 위한 노력이 이루어지고 있다.단, 시스플라틴계 치료는 카르보플라틴계 화학요법보다 전체적으로 완전한 [147]반응을 얻을 수 있다.그럼에도 불구하고, 전이성 질환을 가진 사람들의 거의 절반이 시스플라틴 기반 치료에 적합하지 않다.이 경우 카르보플라틴과 젬시타빈(GemCarbo)의 조합을 1차 화학요법으로 [148]사용할 수 있다.백금계 화학요법을 받을 자격이 없고 PD-L1 발현을 가진 사람에게는 아테졸리주맙과 펨브로리주맙을 [citation needed]사용할 수 있다.
뼈 전이가 있는 사람은 골격과 관련된 사건(예: 골절, 척수 압박, [149]뼈 통증)을 예방하기 위해 비스포네이트 또는 데노수맵을 받아야 한다.
시스플라틴 대상자의 전이성 방광암에 대한 일차 화학요법 요법의 용량 및 일정| DDMVAC | 젬시타빈 + 시스플라틴 |
|---|---|
| 메토트렉세이트(30mg/mIV2) - 1일 Vinblastine (3mg/m2 IV) - 2일째 독소르비신(30mg/mIV2) - 2일차 시스플라틴(70mg/mIV2) - 2일째 과립구 콜로니 자극인자(G-CSF)(240μg/m2 SC) - 4~10일차 2주마다 3~4회 반복 | 젬시타빈(1,000mg/mIV2) - 1,8,15일째 시스플라틴(70mg/m2) - 2일째 4주마다 4사이클 반복 |
| Atezolizumab (PD-L1+의 경우) | 젬시타빈+카르보플라틴 | 펨브로리주맙(PD-L1+의 경우) |
|---|---|---|
| 아테졸리주맙(아테졸리주맙 1200mg IV) 3주마다 | 젬시타빈(1,000mg/mIV2) - 1,8일째 카르보플라틴 (4.5 × [구체 여과율 + 25]) - 1일차 및 3주마다 | 펨브로리주맙 3주마다 200mg |
제2선 처리
백금계 화학요법 후 내화성이 있거나 진행이 보이는 방광암은 2차 화학요법이나 면역요법으로 치료할 수 있다.
가장 일반적으로 사용되는 2차 화학요법은 택산(Paclitaxel, nab-paclitaxel 및 Docetaxel)의 단일 에이전트 체계이다.다른 단일 작용제로는 3세대 빈카 알칼로이드(유럽에서 승인됨), 젬시타빈, 페메트렉세드, 옥살리플라틴 및 Ifosfamide가 있습니다.[150][151][152]빈플루닌의 부작용으로는 호중구 감소, 변비, 피로, 빈혈 등이 있으며 2차 약물로 사용이 제한돼 있다.2차 화학요법에 대한 반응은 5%-20%의 사람들에게서 일어난다.2차 화학요법의 중간 진행 자유 생존은 3-4개월이다.[153]
섬유아세포 성장인자 수용체(FGFR) 돌연변이를 가진 사람 및 실패 표준 백금 기반의 화학요법 에르다피티니브를 사용할 수 있다.Erdafitinib는 이 [154]환자들에게서 40%의 응답률을 보였다.
미국에서 5가지 면역치료제가 전이성 방광암에 사용하도록 승인되었다.이들은 프로그램된 세포사 단백질 1(PD-1) 또는 프로그램된 세포사 리간드 1(PD-L1)을 억제함으로써 작용한다.펨브로리주맙 및 니볼루맙은 프로그램된 세포사배위자1(PD-1)의 억제제이다.아벨루맙, 아테졸리주맙 및 두르발루맙은 PD-L1의 [155][156]억제제이다.
펨브로리주맙은 아마도 전반적인 생존을 약간 향상시키고 초기 치료 후 악화되었던 요관암 환자의 삶의 질을 지속적인 화학 [157]요법에 비해 약간 향상시킬 수 있다.그러나 펨브로리주맙은 치료로 인한 사망률이나 암이 [157]진행되는 속도에 최소한의 영향만 미칠 수 있다.펨브로리주맙은 [157]화학요법보다 덜 심각한 부작용을 일으킬 수 있다.
전이성 방광암에 대한 2차 면역치료 요법의 용량 및 일정(PD-L1+).[136]| 아테졸리주맙 | 니볼루마브 | 펨브로리주맙 | 두르바루마브 | 아베루마브 |
|---|---|---|---|---|
| 아테졸리주맙 1200mg IV 3주마다 | 니볼루맙 3mg/kg IV 2주마다 | 펨브로리주맙 200mg 3주마다 | 더발루맵 10mg/kg 12개월 동안 2주마다 | 아베루맙 10mg/kg IV 2주마다 |
감시 및 대응
조영 증강 CT는 폐, 간 및 림프절 전이를 모니터링하는 데 사용됩니다.뼈 스캔은 뼈 [158]전이를 감지하고 모니터링하는 데 사용됩니다.치료 반응은 고형 종양 반응 평가 기준(RECIST)을 사용하여 반응(완전 또는 부분), 안정적인 질병 및 진행성 [159]질환 중 하나로 측정됩니다.
예후
비근육 침습성 종양이 있는 사람은 양호한 결과를 보인다(5년 생존율은 근육 침습성 [160][161]방광암의 95% 대 69%).그러나 초기 치료 후 70%가 재발하고 30%는 근육침습성 [162]질환이 나타난다.재발과 더 높은 질병 단계로 진행되는 것은 덜 유리한 결과를 [163]낳는다.
래디컬 방광절제술과 골반 림프절 절개 후 생존 여부는 병리학적 단계에 따라 달라집니다.질병이 림프절로 전이되지 않고 방광(T1 또는 T2, N0)에만 국한된 경우 5년 생존율은 78%이다.림프절(T3, N0)이 포함되지 않은 방광 영역 주변에 국소적으로 퍼진 경우 5년 생존율은 47%로 떨어집니다.림프절 확산(N+, T 단계에 관계없이) 질환의 경우 5년 생존율은 31%이다.국소적으로 진행되고 전이되는 질병은 화학요법 없이 3~6개월의 중간 생존으로 생존을 급격히 감소시킨다.시스플라틴에 기초한 화학요법은 중위수 생존기간을 15개월로 늘렸다.하지만 5년 생존율은 여전히 15%[164]입니다.
래디컬 방광절제술 후 암 특이 생존을 결정하는 몇 가지 예후 요인이 있다.암 특이적 생존의 해로운 영향을 미치는 요인은 고령, 높은 종양 등급 및 병리학적 단계, 림프절 전이, 림프관 침입의 존재 및 양성 연조직 [165]가장자리이다.림프절 밀도(수술 시료에서 관찰된 양성 림프절/전체 림프절)는 림프절 양성 질환에서 생존의 예측 변수이다.밀도가 높을수록 [166]생존율이 낮아집니다.
삶의 질
근치적 방광절제술 후에도 비뇨기 및 성기능은 일반인보다 열악하다.네오블래더를 가진 사람들은 피부 교란(배 [167]위에 소변을 채취하기 위해 가방을 착용해야 하는 사람들)이 있는 사람들보다 더 나은 감정 기능과 신체 이미지를 가지고 있다.가족, 관계, 건강, 재정과 같은 사회적 요소들은 방광암 [168]진단을 받은 사람들의 삶의 질을 결정하는데 크게 기여한다.
방광암에 걸린 사람들의 높은 비율이 불안과 [169]우울증을 가지고 있다.젊고 미혼이며 임상 질환이 진행된 사람은 치료 후 정신 질환 진단을 받을 위험이 높다.정신 질환이 있는 사람들은 치료 후 암 특이성과 전반적인 [170][171]생존율이 더 나쁜 것으로 보인다.
역학
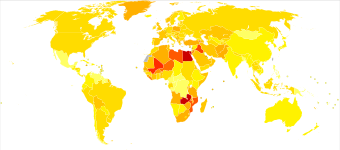
10만 명당 방광암 신규 환자 수 상위 국가(2018년)[172][173]| 순위 | 나라 | 전반적으로. | 남자들 | 여성들. |
|---|---|---|---|---|
| 1 | 레바논 | 25 | 40 | 9 |
| 2 | 그리스 | 21 | 40 | 4 |
| 3 | 덴마크 | 18 | 29 | 8 |
| 4 | 헝가리 | 17 | 27 | 9 |
| 5 | 알바니아 | 16 | 27 | 6 |
| 5 | 네덜란드 | 16 | 26 | 8 |
| 7 | 벨기에 | 16 | 27 | 6 |
| 8 | 이탈리아 | 15 | 27 | 6 |
| 9 | 독일. | 15 | 26 | 6 |
| 10 | 스페인 | 15 | 27 | 6 |
전 세계적으로 2017년 방광암으로 인한 사망자는 196,000명으로 [175]2007년보다 5.4%(연령 조정) 감소했다.2018년 방광암 신규환자의 연령조정률은 인구 10만명당 6명, 연령조정사망률은 인구 10만명당 2명이었다.레바논과 그리스가 새로운 사례 발생률이 가장 높다.레바논에서는 흡연자의 수가 많고 석유화학적인 대기 [176]오염이 높은 것으로 알려져 있습니다.
방광암 발병 위험은 남성이 [3]여성보다 4배 높다.흡연은 서반구 [177]남성들의 높은 비율을 부분적으로만 설명할 수 있다.또 다른 이유는 여성보다 남성에게 훨씬 더 활발한 안드로겐 수용체가 [178]암 발병의 한 원인이 될 수 있다는 것이다.이 가설은 또한 관련 없는 이유로 안드로겐 억제 치료를 받고 있는 남성이 [179]방광암에 걸릴 위험이 낮아 보인다는 사실에서도 뒷받침된다.아프리카에서는 남성들이 현장 작업을 더 많이 하고, 편평세포암에 감염되기 쉬운데, 이것은 방광암이 [177]유행하는 지역의 편평세포암 발생률의 차이를 어느 정도 설명해 줄 수 있다.그러나 여성은 남성보다 더 공격적인 질병을 가지고 있으며 결과가 더 나쁘다.이러한 결과의 차이는 발암물질 노출의 차이, 유전학, 사회성 및 [48]관리 품질과 같은 수많은 요인에 기인한다.방광암의 흔한 증상 중 하나는 혈뇨이며 여성의 요로 감염으로 오진되는 경우가 많아 [48]진단이 늦어지는 경우가 많다.게다가, 앞서 언급한 바와 같이, PSCA [citation needed]유전자는 여성의 공격적인 종양에 역할을 할 수 있다.
캐나다
방광암은 새로운 암 사례의 3.7%를 차지하는 여섯 번째로 흔한 암이다.2018년, 30,700명의 캐나다인들이 방광암으로 살고 있었고, 9160명의 새로운 환자가 진단되었고,[180] 2467명이 그로 인해 사망했다.2019년에는 11,800명의 새로운 환자가 진단되고 2500명이 [181]사망할 것으로 추산된다.11,800건의 신규 환자 중 9100건은 남성이, 2700건은 여성이 맡게 된다.이로 인해 사망한 2500명 중 1800명은 남성이며 700명은 여성이 [181]될 것이다.
중국
방광암은 14번째로 흔한 암이고 16번째로 흔한 암 사망 원인이다.2018년에는 82,300명의 신규 환자 발생과 38,200명의 [182]사망자를 기록했다.서양에 비해 신규 발생 건수가 상대적으로 적다.대부분의 사람들은 비근육침습성 질환(75%)으로 진단되고 나머지는 근육침습성 질환(25%)으로 진단된다.현장 암은 단지 2.4%의 [183]사례에서 나타났다.
유럽
2015년 유럽연합에서 131,000건의 뉴스 사례가 진단되었고 40,000명이 사망했다.그것은 암 사망의 5번째로 흔한 암이고 9번째로 흔한 원인이다.2000년과 2007년 사이에 진단된 방광암의 5년 상대 생존율은 69%이다.5년 생존율은 북유럽에서 [184]75%, 동유럽에서 65%로 지리적 차이가 나타난다.
영국
방광암은 영국에서 9번째로 흔한 암으로 모든 새로운 암 사례의 2.7%를 차지한다.2018년에는 12,200명의 새로운 환자가 발생했고 [185]6100명이 이로 인해 사망했다.
미국
2019년 미국에서는 80,470명의 환자와 17,670명의 사망자가 발생할 것으로 예상되며 이는 이 지역에서 [2]6번째로 흔한 암 유형이다.방광암은 남성에서 4번째로 흔한 암이고 [186]여성에서 12번째로 흔한 암이다.2019년에는 [187]약 62,000명의 남성과 19,000명의 여성이 방광암 진단을 받는다.2012년과 2016년 사이에 새로운 방광암 발병률이 [188]매년 1%씩 감소했다.
레퍼런스
- ^ a b c d e f g h i j k l m n "Bladder Cancer Treatment (PDQ®)–Patient Version - National Cancer Institute". www.cancer.gov. 11 May 2020. Retrieved 4 June 2020.
- ^ a b c d e f "Cancer of the Urinary Bladder - Cancer Stat Facts". SEER. Retrieved 30 October 2019.
- ^ a b c d e f "Bladder Cancer Factsheet" (PDF). Global Cancer Observatory. Retrieved 8 November 2019.
- ^ Heyes S.M., Previr K.N., Whitehead D., Bond M.J. 환자 및 파트너의 방광암 경험을 이해하려고 합니다.암 간호사..2020;43(5):E254-E263.doi:10.1097/NCC.00000000000718
- ^ "Bladder Cancer Treatment". National Cancer Institute. 5 June 2017. Archived from the original on 14 July 2017. Retrieved 18 July 2017.
- ^ "EAU Guidelines: Non-muscle-invasive Bladder Cancer". Uroweb.
- ^ "Bladder Cancer - Stages and Grades". Cancer.Net. 25 June 2012.
- ^ "Bladder cancer". World Cancer Research Fund. 24 April 2018.
- ^ "Survival statistics for bladder cancer - Canadian Cancer Society". www.cancer.ca.
- ^ Avellino GJ, Bose S, Wang DS (June 2016). "Diagnosis and Management of Hematuria". The Surgical Clinics of North America. 96 (3): 503–15. doi:10.1016/j.suc.2016.02.007. PMID 27261791.
- ^ a b Klaile Y, Schlack K, Boegemann M, Steinestel J, Schrader AJ, Krabbe LM (October 2016). "Variant histology in bladder cancer: how it should change the management in non-muscle invasive and muscle invasive disease?". Translational Andrology and Urology. 5 (5): 692–701. doi:10.21037/tau.2016.06.13. PMC 5071184. PMID 27785426.
- ^ Abeloff's clinical oncology. Niederhuber, John E.,, Armitage, James O., 1946-, Doroshow, James H.,, Kastan, M. B. (Michael B.),, Tepper, Joel E.,, Preceded by: Abeloff, Martin D. (6th ed.). Philadelphia, PA. 8 January 2019. p. 1388. ISBN 978-0-323-56815-9. OCLC 1089396489.
{{cite book}}: CS1 유지보수: 기타 (링크) - ^ Hodges, Stephanie C.; Holt, Harry R.; Degeorge, Katharine C. (15 October 2017). "Bladder Cancer: Diagnosis and Treatment". American Family Physician. 96 (8): 507–514. PMID 29094888.
- ^ Zeegers MP, Tan FE, Dorant E, van Den Brandt PA (August 2000). "The impact of characteristics of cigarette smoking on urinary tract cancer risk: a meta-analysis of epidemiologic studies". Cancer. 89 (3): 630–9. doi:10.1002/1097-0142(20000801)89:3<630::AID-CNCR19>3.0.CO;2-Q. PMID 10931463.
- ^ a b van Osch FH, Jochems SH, van Schooten FJ, Bryan RT, Zeegers MP (June 2016). "Quantified relations between exposure to tobacco smoking and bladder cancer risk: a meta-analysis of 89 observational studies". International Journal of Epidemiology. 45 (3): 857–70. doi:10.1093/ije/dyw044. PMID 27097748.
- ^ Letašiová S, Medve'ová A, Šovčíková A, Dušinská M, Volkovová K, Mosoiu C, Bartonová A (June 2012). "Bladder cancer, a review of the environmental risk factors". Environmental Health. 11 Suppl 1: S11. doi:10.1186/1476-069X-11-S1-S11. PMC 3388449. PMID 22759493.
- ^ Brennan P, Bogillot O, Cordier S, Greiser E, Schill W, Vineis P, et al. (April 2000). "Cigarette smoking and bladder cancer in men: a pooled analysis of 11 case-control studies". International Journal of Cancer. 86 (2): 289–94. doi:10.1002/(sici)1097-0215(20000415)86:2<289::aid-ijc21>3.0.co;2-m. PMID 10738259.
- ^ Yan H, Ying Y, Xie H, Li J, Wang X, He L, et al. (2018). "Secondhand smoking increases bladder cancer risk in nonsmoking population: a meta-analysis". Cancer Management and Research. 10: 3781–3791. doi:10.2147/CMAR.S175062. PMC 6159806. PMID 30288109.
- ^ "Health Risks of Secondhand Smoke". www.cancer.org. Retrieved 21 November 2019.
- ^ Afshari M, Janbabaei G, Bahrami MA, Moosazadeh M (2017). "Opium and bladder cancer: A systematic review and meta-analysis of the odds ratios for opium use and the risk of bladder cancer". PLOS ONE. 12 (6): e0178527. Bibcode:2017PLoSO..1278527A. doi:10.1371/journal.pone.0178527. PMC 5460843. PMID 28586371.
- ^ IARC Working Group on the Evaluation of Carcinogenic Risk to Humans (2012). 4-AMINOBIPHENYL. International Agency for Research on Cancer.
- ^ Saint-Jacques N, Parker L, Brown P, Dummer TJ (June 2014). "Arsenic in drinking water and urinary tract cancers: a systematic review of 30 years of epidemiological evidence". Environmental Health. 13: 44. doi:10.1186/1476-069X-13-44. PMC 4088919. PMID 24889821.
- ^ Clin B, Pairon JC (November 2014). "Medical follow-up for workers exposed to bladder carcinogens: the French evidence-based and pragmatic statement". BMC Public Health. 14: 1155. doi:10.1186/1471-2458-14-1155. PMC 4230399. PMID 25377503.
- ^ IARC Working Group on the Evaluation of Carcinogenic Risk to Humans (2012). CHLORNAPHAZINE. International Agency for Research on Cancer.
- ^ Humans, IARC Working Group on the Evaluation of Carcinogenic Risk to (2012). 2-NAPHTHYLAMINE. International Agency for Research on Cancer.
- ^ Reulen RC, Kellen E, Buntinx F, Brinkman M, Zeegers MP (September 2008). "A meta-analysis on the association between bladder cancer and occupation". Scandinavian Journal of Urology and Nephrology. Supplementum. 42 (218): 64–78. doi:10.1080/03008880802325192. PMID 18815919. S2CID 30510231.
- ^ Guha N, Steenland NK, Merletti F, Altieri A, Cogliano V, Straif K (August 2010). "Bladder cancer risk in painters: a meta-analysis". Occupational and Environmental Medicine. 67 (8): 568–73. doi:10.1136/oem.2009.051565. PMID 20647380.
- ^ Harling M, Schablon A, Schedlbauer G, Dulon M, Nienhaus A (May 2010). "Bladder cancer among hairdressers: a meta-analysis". Occupational and Environmental Medicine. 67 (5): 351–8. doi:10.1136/oem.2009.050195. PMC 2981018. PMID 20447989.
- ^ Mostafa MH, Sheweita SA, O'Connor PJ (January 1999). "Relationship between schistosomiasis and bladder cancer". Clinical Microbiology Reviews. 12 (1): 97–111. doi:10.1128/CMR.12.1.97. PMC 88908. PMID 9880476.
- ^ Zaghloul MS (December 2012). "Bladder cancer and schistosomiasis". Journal of the Egyptian National Cancer Institute. 24 (4): 151–9. doi:10.1016/j.jnci.2012.08.002. PMID 23159285.
- ^ Mostafa MH, Helmi S, Badawi AF, Tricker AR, Spiegelhalder B, Preussmann R (April 1994). "Nitrate, nitrite and volatile N-nitroso compounds in the urine of Schistosoma haematobium and Schistosoma mansoni infected patients". Carcinogenesis. 15 (4): 619–25. doi:10.1093/carcin/15.4.619. PMID 8149471.
- ^ Badawi AF (August 1996). "Molecular and genetic events in schistosomiasis-associated human bladder cancer: role of oncogenes and tumor suppressor genes". Cancer Letters. 105 (2): 123–38. doi:10.1016/0304-3835(96)04284-x. PMID 8697435.
- ^ Chaudhary KS, Lu QL, Abel PD, Khandan-Nia N, Shoma AM, el Baz M, et al. (January 1997). "Expression of bcl-2 and p53 oncoproteins in schistosomiasis-associated transitional and squamous cell carcinoma of urinary bladder". British Journal of Urology. 79 (1): 78–84. doi:10.1046/j.1464-410x.1997.30717.x. PMID 9043502.
- ^ Shokeir AA (January 2004). "Squamous cell carcinoma of the bladder: pathology, diagnosis and treatment". BJU International. 93 (2): 216–20. doi:10.1111/j.1464-410x.2004.04588.x. PMID 14690486. S2CID 10487371.
- ^ Monach PA, Arnold LM, Merkel PA (January 2010). "Incidence and prevention of bladder toxicity from cyclophosphamide in the treatment of rheumatic diseases: a data-driven review". Arthritis and Rheumatism. 62 (1): 9–21. doi:10.1002/art.25061. PMID 20039416.
- ^ Yang HY, Chen PC, Wang JD (2014). "Chinese herbs containing aristolochic acid associated with renal failure and urothelial carcinoma: a review from epidemiologic observations to causal inference". BioMed Research International. 2014: 569325. doi:10.1155/2014/569325. PMC 4241283. PMID 25431765.
- ^ Suriano F, Altobelli E, Sergi F, Buscarini M (2013). "Bladder cancer after radiotherapy for prostate cancer". Reviews in Urology. 15 (3): 108–12. PMC 3821989. PMID 24223022.
- ^ Sun JW, Zhao LG, Yang Y, Ma X, Wang YY, Xiang YB (24 March 2015). "Obesity and risk of bladder cancer: a dose-response meta-analysis of 15 cohort studies". PLOS ONE. 10 (3): e0119313. Bibcode:2015PLoSO..1019313S. doi:10.1371/journal.pone.0119313. PMC 4372289. PMID 25803438.
- ^ Al-Zalabani AH, Stewart KF, Wesselius A, Schols AM, Zeegers MP (September 2016). "Modifiable risk factors for the prevention of bladder cancer: a systematic review of meta-analyses". European Journal of Epidemiology. 31 (9): 811–51. doi:10.1007/s10654-016-0138-6. PMC 5010611. PMID 27000312.
- ^ "Cancer Genetics Browser". cancer.sanger.ac.uk. Retrieved 21 November 2019.
- ^ 온라인 Mendelian In Man (OMIM) : 109800
- ^ Zhang X, Zhang Y (September 2015). "Bladder Cancer and Genetic Mutations". Cell Biochemistry and Biophysics. 73 (1): 65–9. doi:10.1007/s12013-015-0574-z. PMID 27352265. S2CID 14316154.
- ^ "Bladder cancer". Genetics Home Reference.
- ^ Ahmad I, Sansom OJ, Leung HY (May 2012). "Exploring molecular genetics of bladder cancer: lessons learned from mouse models". Disease Models & Mechanisms. 5 (3): 323–32. doi:10.1242/dmm.008888. PMC 3339826. PMID 22422829.
- ^ Humphrey PA, Moch H, Cubilla AL, Ulbright TM, Reuter VE (July 2016). "The 2016 WHO Classification of Tumours of the Urinary System and Male Genital Organs-Part B: Prostate and Bladder Tumours" (PDF). European Urology. 70 (1): 106–119. doi:10.1016/j.eururo.2016.02.028. PMID 26996659.
- ^ Engel LS, Taioli E, Pfeiffer R, Garcia-Closas M, Marcus PM, Lan Q, et al. (July 2002). "Pooled analysis and meta-analysis of glutathione S-transferase M1 and bladder cancer: a HuGE review". American Journal of Epidemiology. 156 (2): 95–109. doi:10.1093/aje/kwf018. PMID 12117698.
- ^ a b c "Bladder Cancer Report" (PDF). World Cancer Research Fund : International. Retrieved 9 November 2019.
- ^ a b c Marks P, Soave A, Shariat SF, Fajkovic H, Fisch M, Rink M (October 2016). "Female with bladder cancer: what and why is there a difference?". Translational Andrology and Urology. 5 (5): 668–682. doi:10.21037/tau.2016.03.22. PMC 5071204. PMID 27785424.
- ^ Choi W, Ochoa A, McConkey DJ, Aine M, Höglund M, Kim WY, et al. (September 2017). "Genetic Alterations in the Molecular Subtypes of Bladder Cancer: Illustration in the Cancer Genome Atlas Dataset". European Urology. 72 (3): 354–365. doi:10.1016/j.eururo.2017.03.010. PMC 5764190. PMID 28365159.
- ^ Choi W, Czerniak B, Ochoa A, Su X, Siefker-Radtke A, Dinney C, McConkey DJ (July 2014). "Intrinsic basal and luminal subtypes of muscle-invasive bladder cancer". Nature Reviews. Urology. 11 (7): 400–10. doi:10.1038/nrurol.2014.129. PMID 24960601. S2CID 24723395.
- ^ "EAU Guidelines: Non-muscle-invasive Bladder Cancer Diagnosis". Uroweb. Retrieved 12 November 2019.
- ^ a b "EAU Guidelines: Muscle-invasive and Metastatic Bladder Cancer diagnosis". Uroweb. Retrieved 12 November 2019.
- ^ a b c "Uroweb - European Association of Urology (EAU)". Uroweb. Retrieved 7 November 2019.
- ^ a b Awiwi, MO; Vikram, R (18 June 2022). "Radiologic Diagnosis and Staging of Bladder Cancer: An Update". Journal of Computer Assisted Tomography. doi:10.1097/RCT.0000000000001322. PMID 35723651. S2CID 249869037. Retrieved 23 June 2022.
- ^ "Bladder Cancer Treatment". National Cancer Institute. 8 May 2020. Retrieved 4 June 2020.
- ^ Lotan Y, Roehrborn CG (January 2003). "Sensitivity and specificity of commonly available bladder tumor markers versus cytology: results of a comprehensive literature review and meta-analyses". Urology. 61 (1): 109–18, discussion 118. doi:10.1016/S0090-4295(02)02136-2. PMID 12559279.
- ^ Shariat SF, Karam JA, Lotan Y, Karakiewizc PI (2008). "Critical evaluation of urinary markers for bladder cancer detection and monitoring". Reviews in Urology. 10 (2): 120–35. PMC 2483317. PMID 18660854.
- ^ a b Chou R, Gore JL, Buckley D, Fu R, Gustafson K, Griffin JC, et al. (December 2015). "Urinary Biomarkers for Diagnosis of Bladder Cancer: A Systematic Review and Meta-analysis". Annals of Internal Medicine. 163 (12): 922–31. doi:10.7326/M15-0997. PMID 26501851.
- ^ Santoni G, Morelli MB, Amantini C, Battelli N (2018). "Urinary Markers in Bladder Cancer: An Update". Frontiers in Oncology. 8: 362. doi:10.3389/fonc.2018.00362. PMC 6137202. PMID 30245975.
- ^ a b c Miyake M, Owari T, Hori S, Nakai Y, Fujimoto K (2018). "Emerging biomarkers for the diagnosis and monitoring of urothelial carcinoma". Research and Reports in Urology. 10: 251–261. doi:10.2147/RRU.S173027. PMC 6299471. PMID 30588457.
- ^ a b Goodison S, Rosser CJ, Urquidi V (April 2013). "Bladder cancer detection and monitoring: assessment of urine- and blood-based marker tests". Molecular Diagnosis & Therapy. 17 (2): 71–84. doi:10.1007/s40291-013-0023-x. PMC 3627848. PMID 23479428.
- ^ Health, Center for Devices and Radiological (7 October 2019). "Nucleic Acid Based Tests". FDA.
- ^ Soria F, Droller MJ, Lotan Y, Gontero P, D'Andrea D, Gust KM, et al. (December 2018). "An up-to-date catalog of available urinary biomarkers for the surveillance of non-muscle invasive bladder cancer". World Journal of Urology. 36 (12): 1981–1995. doi:10.1007/s00345-018-2380-x. PMC 6280823. PMID 29931526.
- ^ a b c d Andreassen, B. K.; Aagnes, B.; Gislefoss, R.; Andreassen, M.; Wahlqvist, R. (2016). "Incidence and Survival of urothelial carcinoma of the urinary bladder in Norway 1981-2014". BMC Cancer. 16 (1): 799. doi:10.1186/s12885-016-2832-x. ISSN 1471-2407. PMC 5064906. PMID 27737647.
- ^ a b c "Types of Bladder Cancer: TCC & Other Variants". CancerCenter.com. Retrieved 10 August 2018.
- ^ a b Amin MB (June 2009). "Histological variants of urothelial carcinoma: diagnostic, therapeutic and prognostic implications". Modern Pathology. 22 Suppl 2 (S2): S96–S118. doi:10.1038/modpathol.2009.26. PMID 19494856.
- ^ Tang DH, Chang SS (December 2015). "Management of carcinoma in situ of the bladder: best practice and recent developments". Therapeutic Advances in Urology. 7 (6): 351–64. doi:10.1177/1756287215599694. PMC 4647140. PMID 26622320.
- ^ Chalasani V, Chin JL, Izawa JI (December 2009). "Histologic variants of urothelial bladder cancer and nonurothelial histology in bladder cancer". Canadian Urological Association Journal. 3 (6 Suppl 4): S193-8. doi:10.5489/cuaj.1195. PMC 2792446. PMID 20019984.
- ^ Moschini M, D'Andrea D, Korn S, Irmak Y, Soria F, Compérat E, Shariat SF (November 2017). "Characteristics and clinical significance of histological variants of bladder cancer". Nature Reviews. Urology. 14 (11): 651–668. doi:10.1038/nrurol.2017.125. PMID 28895563. S2CID 6351401.
- ^ Warrick JI (October 2017). "Clinical Significance of Histologic Variants of Bladder Cancer". Journal of the National Comprehensive Cancer Network. 15 (10): 1268–1274. doi:10.6004/jnccn.2017.7027. PMID 28982751.
- ^ Venyo AK, Titi S (2014). "Sarcomatoid variant of urothelial carcinoma (carcinosarcoma, spindle cell carcinoma): a review of the literature". ISRN Urology. 2014: 794563. doi:10.1155/2014/794563. PMC 3920806. PMID 24587922.
- ^ "Urothelial Carcinoma Variants - American Urological Association". www.auanet.org.
- ^ "EAU Guidelines - STAGING AND CLASSIFICATION SYSTEMS". Uroweb.
- ^ Magers MJ, Lopez-Beltran A, Montironi R, Williamson SR, Kaimakliotis HZ, Cheng L (January 2019). "Staging of bladder cancer". Histopathology. 74 (1): 112–134. doi:10.1111/his.13734. PMID 30565300.
- ^ a b "Bladder Cancer: Stages and Grades". Cancer.net. 25 June 2012. 암세포가 승인했습니다.Net Editing Board 2019년 5월 5일
- ^ Shinagare AB, Ramaiya NH, Jagannathan JP, Fennessy FM, Taplin ME, Van den Abbeele AD (January 2011). "Metastatic pattern of bladder cancer: correlation with the characteristics of the primary tumor". AJR. American Journal of Roentgenology. 196 (1): 117–22. doi:10.2214/AJR.10.5036. PMID 21178055.
- ^ a b Mao Y, Hedgire S, Prapruttam D, Harisinghani M (16 September 2014). "Imaging of Pelvic Lymph Nodes". Current Radiology Reports. 2 (11). doi:10.1007/s40134-014-0070-z.
- ^ Shankar PR, Barkmeier D, Hadjiiski L, Cohan RH (October 2018). "A pictorial review of bladder cancer nodal metastases". Translational Andrology and Urology. 7 (5): 804–813. doi:10.21037/tau.2018.08.25. PMC 6212631. PMID 30456183.
- ^ "How is bladder cancer staged?". American Cancer Society. Archived from the original on 4 October 2015. 최종 의료 리뷰: 2019년 11월 2일
- ^ "Survival rates for bladder cancer by stage". American Cancer Society. Archived from the original on 13 October 2015. 최종 의료 리뷰: 2014년 2월 26일
- ^ Seth P. Lerner. "Overview of Diagnosis and Management of Non-Muscle Invasive Bladder Cancer" (PDF). Food and Drug Administration. ODAC 2016년 9월 14일
- ^ Epstein JI, Amin MB, Reuter VR, Mostofi FK (December 1998). "The World Health Organization/International Society of Urological Pathology consensus classification of urothelial (transitional cell) neoplasms of the urinary bladder. Bladder Consensus Conference Committee". The American Journal of Surgical Pathology. 22 (12): 1435–48. doi:10.1097/00000478-199812000-00001. PMID 9850170.
- ^ Compérat EM, Burger M, Gontero P, Mostafid AH, Palou J, Rouprêt M, et al. (May 2019). "Grading of Urothelial Carcinoma and The New "World Health Organisation Classification of Tumours of the Urinary System and Male Genital Organs 2016"". European Urology Focus. 5 (3): 457–466. doi:10.1016/j.euf.2018.01.003. PMID 29366854.
- ^ a b Chang SS, Boorjian SA, Chou R, Clark PE, Daneshmand S, Konety BR, et al. (October 2016). "Diagnosis and Treatment of Non-Muscle Invasive Bladder Cancer: AUA/SUO Guideline". The Journal of Urology. 196 (4): 1021–9. doi:10.1016/j.juro.2016.06.049. PMID 27317986.
- ^ a b "Bladder Cancer: Non-Muscle Invasive Guideline - American Urological Association". www.auanet.org.
- ^ Soukup V, Čapoun O, Cohen D, Hernández V, Burger M, Compérat E, et al. (November 2018). "Risk Stratification Tools and Prognostic Models in Non-muscle-invasive Bladder Cancer: A Critical Assessment from the European Association of Urology Non-muscle-invasive Bladder Cancer Guidelines Panel". European Urology Focus. 6 (3): 479–489. doi:10.1016/j.euf.2018.11.005. PMID 30470647. S2CID 53722156.
- ^ Sylvester RJ, van der Meijden AP, Oosterlinck W, Witjes JA, Bouffioux C, Denis L, et al. (March 2006). "Predicting recurrence and progression in individual patients with stage Ta T1 bladder cancer using EORTC risk tables: a combined analysis of 2596 patients from seven EORTC trials". European Urology. 49 (3): 466–5, discussion 475–7. doi:10.1016/j.eururo.2005.12.031. PMID 16442208.
- ^ Sylvester RJ, van der Meijden AP, Oosterlinck W, Witjes JA, Bouffioux C, Denis L, et al. (March 2006). "Predicting recurrence and progression in individual patients with stage Ta T1 bladder cancer using EORTC risk tables: a combined analysis of 2596 patients from seven EORTC trials". European Urology. 49 (3): 466–5, discussion 475–7. doi:10.1016/j.eururo.2005.12.031. PMID 16442208.
- ^ Fernandez-Gomez J, Madero R, Solsona E, Unda M, Martinez-Piñeiro L, Gonzalez M, et al. (November 2009). "Predicting nonmuscle invasive bladder cancer recurrence and progression in patients treated with bacillus Calmette-Guerin: the CUETO scoring model". The Journal of Urology. 182 (5): 2195–203. doi:10.1016/j.juro.2009.07.016. PMID 19758621.
- ^ "EAU Guidelines: Non-muscle-invasive Bladder Cancer". Uroweb.
- ^ Choi SY, Ryu JH, Chang IH, Kim TH, Myung SC, Moon YT, et al. (October 2014). "Predicting recurrence and progression of non-muscle-invasive bladder cancer in Korean patients: a comparison of the EORTC and CUETO models". Korean Journal of Urology. 55 (10): 643–9. doi:10.4111/kju.2014.55.10.643. PMC 4198762. PMID 25324946.
- ^ a b Brinkman M, Zeegers MP (September 2008). "Nutrition, total fluid and bladder cancer". Scandinavian Journal of Urology and Nephrology. Supplementum. 42 (218): 25–36. doi:10.1080/03008880802285073. PMID 18815914. S2CID 21780999.
- ^ Brinkman M, Buntinx F, Muls E, Zeegers MP (September 2006). "Use of selenium in chemoprevention of bladder cancer". The Lancet. Oncology. 7 (9): 766–74. doi:10.1016/S1470-2045(06)70862-2. PMID 16945772.
- ^ Zamora-Ros R, Sacerdote C, Ricceri F, Weiderpass E, Roswall N, Buckland G, et al. (October 2014). "Flavonoid and lignan intake in relation to bladder cancer risk in the European Prospective Investigation into Cancer and Nutrition (EPIC) study". British Journal of Cancer. 111 (9): 1870–80. doi:10.1038/bjc.2014.459. PMC 4453722. PMID 25121955.
- ^ Valtin H (November 2002). ""Drink at least eight glasses of water a day." Really? Is there scientific evidence for "8 x 8"?". American Journal of Physiology. Regulatory, Integrative and Comparative Physiology. 283 (5): R993-1004. doi:10.1152/ajpregu.00365.2002. PMID 12376390. S2CID 2256436.
- ^ "Final Update Summary: Bladder Cancer in Adults: Screening - US Preventive Services Task Force". www.uspreventiveservicestaskforce.org. Retrieved 13 November 2019.
- ^ Kamat AM, Hahn NM, Efstathiou JA, Lerner SP, Malmström PU, Choi W, et al. (December 2016). "Bladder cancer". Lancet. 388 (10061): 2796–2810. doi:10.1016/S0140-6736(16)30512-8. PMID 27345655. S2CID 29104789.
- ^ a b c "NCCN Bladder cancer guidelines 2018" (PDF). Retrieved 25 November 2019.
- ^ Witjes JA, Babjuk M, Gontero P, Jacqmin D, Karl A, Kruck S, et al. (November 2014). "Clinical and cost effectiveness of hexaminolevulinate-guided blue-light cystoscopy: evidence review and updated expert recommendations" (PDF). European Urology. 66 (5): 863–71. doi:10.1016/j.eururo.2014.06.037. PMID 25001887.
- ^ Daneshmand S, Schuckman AK, Bochner BH, Cookson MS, Downs TM, Gomella LG, et al. (October 2014). "Hexaminolevulinate blue-light cystoscopy in non-muscle-invasive bladder cancer: review of the clinical evidence and consensus statement on appropriate use in the USA". Nature Reviews. Urology. 11 (10): 589–96. doi:10.1038/nrurol.2014.245. PMID 25245244.
- ^ Miladi M, Peyromaure M, Zerbib M, Saïghi D, Debré B (March 2003). "The value of a second transurethral resection in evaluating patients with bladder tumours". European Urology. 43 (3): 241–5. doi:10.1016/s0302-2838(03)00040-x. PMID 12600426.
- ^ a b "EAU Guidelines: Non-muscle-invasive Bladder Cancer". Uroweb.
- ^ a b c Schmidt, Stefanie; Kunath, Frank; Coles, Bernadette; Draeger, Desiree Louise; Krabbe, Laura-Maria; Dersch, Rick; Kilian, Samuel; Jensen, Katrin; Dahm, Philipp; Meerpohl, Joerg J (8 January 2020). Cochrane Urology Group (ed.). "Intravesical Bacillus Calmette-Guérin versus mitomycin C for Ta and T1 bladder cancer". Cochrane Database of Systematic Reviews. 1: CD011935. doi:10.1002/14651858.CD011935.pub2. PMC 6956215. PMID 31912907.
- ^ a b Zamboni S, Baumeister P, Mattei A, Mordasini L, Antonelli A, Simeone C, Moschini M (February 2019). "Single postoperative instillation for non-muscle invasive bladder cancer: are there still any indication?". Translational Andrology and Urology. 8 (1): 76–84. doi:10.21037/tau.2018.08.20. PMC 6414349. PMID 30976571.
- ^ Witjes JA, Hendricksen K (January 2008). "Intravesical pharmacotherapy for non-muscle-invasive bladder cancer: a critical analysis of currently available drugs, treatment schedules, and long-term results". European Urology. 53 (1): 45–52. doi:10.1016/j.eururo.2007.08.015. PMID 17719169.
- ^ Di Stasi SM, Riedl C (June 2009). "Updates in intravesical electromotive drug administration of mitomycin-C for non-muscle invasive bladder cancer" (PDF). World Journal of Urology. 27 (3): 325–30. doi:10.1007/s00345-009-0389-x. hdl:2108/6440. PMID 19234707. S2CID 24496739.
- ^ Kos B, Vásquez JL, Miklavčič D, Hermann GG, Gehl J (2016). "Investigation of the mechanisms of action behind Electromotive Drug Administration (EMDA)". PeerJ. 4 (e2309): e2309. doi:10.7717/peerj.2309. PMC 5012313. PMID 27635313.
- ^ Bahouth Z, Halachmi S, Moskovitz B, Nativ O (2016). "The role of hyperthermia as a treatment for non-muscle invasive bladder cancer". Expert Review of Anticancer Therapy. 16 (2): 189–98. doi:10.1586/14737140.2016.1126515. PMID 26618756. S2CID 681090.
- ^ Alexandroff AB, Jackson AM, O'Donnell MA, James K (May 1999). "BCG immunotherapy of bladder cancer: 20 years on". Lancet. 353 (9165): 1689–94. doi:10.1016/S0140-6736(98)07422-4. PMID 10335805. S2CID 19355109.
- ^ Lamm DL, Blumenstein BA, Crawford ED, Montie JE, Scardino P, Grossman HB, et al. (October 1991). "A randomized trial of intravesical doxorubicin and immunotherapy with bacille Calmette-Guérin for transitional-cell carcinoma of the bladder". The New England Journal of Medicine. 325 (17): 1205–9. doi:10.1056/NEJM199110243251703. PMID 1922207.
- ^ Kuroda K, Brown EJ, Telle WB, Russell DG, Ratliff TL (January 1993). "Characterization of the internalization of bacillus Calmette-Guerin by human bladder tumor cells". The Journal of Clinical Investigation. 91 (1): 69–76. doi:10.1172/JCI116202. PMC 329996. PMID 8423234.
- ^ Ratliff TL, Ritchey JK, Yuan JJ, Andriole GL, Catalona WJ (September 1993). "T-cell subsets required for intravesical BCG immunotherapy for bladder cancer". The Journal of Urology. 150 (3): 1018–23. doi:10.1016/s0022-5347(17)35678-1. PMID 8102183.
- ^ Fuge O, Vasdev N, Allchorne P, Green JS (2015). "Immunotherapy for bladder cancer". Research and Reports in Urology. 7: 65–79. doi:10.2147/RRU.S63447. PMC 4427258. PMID 26000263.
- ^ a b c d Kamat AM, Flaig TW, Grossman HB, Konety B, Lamm D, O'Donnell MA, et al. (April 2015). "Expert consensus document: Consensus statement on best practice management regarding the use of intravesical immunotherapy with BCG for bladder cancer". Nature Reviews. Urology. 12 (4): 225–35. doi:10.1038/nrurol.2015.58. PMID 25800393.
- ^ Alhunaidi O, Zlotta AR (2019). "The use of intravesical BCG in urothelial carcinoma of the bladder". ecancermedicalscience. 13: 905. doi:10.3332/ecancer.2019.905. PMC 6411413. PMID 30915163.
- ^ D'Andrea D, Gontero P, Shariat SF, Soria F (February 2019). "Intravesical bacillus Calmette-Guérin for bladder cancer: are all the strains equal?". Translational Andrology and Urology. 8 (1): 85–93. doi:10.21037/tau.2018.08.19. PMC 6414340. PMID 30976572.
- ^ Macleod LC, Ngo TC, Gonzalgo ML (July 2014). "Complications of intravesical bacillus calmette-guérin". Canadian Urological Association Journal. 8 (7–8): E540-4. doi:10.5489/cuaj.1411. PMC 4137021. PMID 25210559.
- ^ Shah S, Carter-Monroe N, Atta MG (October 2015). "Granulomatous interstitial nephritis". Clinical Kidney Journal. 8 (5): 516–23. doi:10.1093/ckj/sfv053. PMC 4581373. PMID 26413275.
- ^ Decaestecker K, Oosterlinck W (2015). "Managing the adverse events of intravesical bacillus Calmette-Guérin therapy". Research and Reports in Urology. 7: 157–63. doi:10.2147/RRU.S63448. PMC 4630183. PMID 26605208.
- ^ Witjes JA (May 2006). "Management of BCG failures in superficial bladder cancer: a review". European Urology. 49 (5): 790–7. doi:10.1016/j.eururo.2006.01.017. PMID 16464532. S2CID 5103506.
- ^ Babjuk W, Oosterlinck W, Sylvester R, et al. (2010). "Guidelines on TaT1 (Non-muscle invasive) Bladder Cancer". European Association of Urology. Archived from the original on 24 April 2010.
- ^ Bladder Cancer Clinical Guideline Update Panel (2007). Bladder Cancer: Guideline for the Management of Nonmuscle Invasive Bladder Cancer: (Stages Ta, T1, and Tis): 2007 Update. American Urological Association.[page needed]
- ^ Hassler MR, Shariat SF, Soria F (May 2019). "Salvage therapeutic strategies for bacillus Calmette-Guerin failure". Current Opinion in Urology. 29 (3): 239–246. doi:10.1097/MOU.0000000000000593. PMID 30762670. S2CID 73439134.
- ^ a b c d "Treatment of Non-Metastatic Muscle-Invasive Bladder Cancer: AUA/ASCO/ASTRO/SUO Guideline (2017) - American Urological Association". www.auanet.org. Retrieved 20 November 2019.
- ^ a b c Hwang, Eu Chang; Sathianathen, Niranjan J; Imamura, Mari; Kuntz, Gretchen M; Risk, Michael C; Dahm, Philipp (14 May 2019). Cochrane Urology Group (ed.). "Extended versus standard lymph node dissection for urothelial carcinoma of the bladder in patients undergoing radical cystectomy". Cochrane Database of Systematic Reviews. 2019 (5): CD013336. doi:10.1002/14651858.CD013336. PMC 6528183. PMID 31111956.
- ^ Johar RS, Hayn MH, Stegemann AP, Ahmed K, Agarwal P, Balbay MD, et al. (July 2013). "Complications after robot-assisted radical cystectomy: results from the International Robotic Cystectomy Consortium". European Urology. 64 (1): 52–7. doi:10.1016/j.eururo.2013.01.010. PMID 23380164. S2CID 7369962.
- ^ Shabsigh A, Korets R, Vora KC, Brooks CM, Cronin AM, Savage C, et al. (January 2009). "Defining early morbidity of radical cystectomy for patients with bladder cancer using a standardized reporting methodology". European Urology. 55 (1): 164–74. doi:10.1016/j.eururo.2008.07.031. PMID 18675501.
- ^ Moschini M, Simone G, Stenzl A, Gill IS, Catto J (April 2016). "Critical Review of Outcomes from Radical Cystectomy: Can Complications from Radical Cystectomy Be Reduced by Surgical Volume and Robotic Surgery?". European Urology Focus. 2 (1): 19–29. doi:10.1016/j.euf.2016.03.001. PMID 28723446.
- ^ Cerantola Y, Valerio M, Persson B, Jichlinski P, Ljungqvist O, Hubner M, et al. (December 2013). "Guidelines for perioperative care after radical cystectomy for bladder cancer: Enhanced Recovery After Surgery (ERAS(®)) society recommendations". Clinical Nutrition. 32 (6): 879–87. doi:10.1016/j.clnu.2013.09.014. PMID 24189391.
- ^ "UpToDate: Neoadjuvant chemotherapy". www.uptodate.com.
- ^ Vale, C. (June 2003). "Neoadjuvant chemotherapy in invasive bladder cancer: a systematic review and meta-analysis". Lancet. 361 (9373): 1927–34. doi:10.1016/s0140-6736(03)13580-5. PMID 12801735. S2CID 29233494.
- ^ Advanced Bladder Cancer (ABC) Meta-analysis Collaboration (August 2005). "Neoadjuvant chemotherapy in invasive bladder cancer: update of a systematic review and meta-analysis of individual patient data advanced bladder cancer (ABC) meta-analysis collaboration". European Urology. 48 (2): 202–5, discussion 205–6. doi:10.1016/j.eururo.2005.04.006. PMID 15939524.
- ^ Grossman HB, Natale RB, Tangen CM, Speights VO, Vogelzang NJ, Trump DL, et al. (August 2003). "Neoadjuvant chemotherapy plus cystectomy compared with cystectomy alone for locally advanced bladder cancer". The New England Journal of Medicine. 349 (9): 859–66. doi:10.1056/NEJMoa022148. PMID 12944571.
- ^ a b Yin M, Joshi M, Meijer RP, Glantz M, Holder S, Harvey HA, et al. (June 2016). "Neoadjuvant Chemotherapy for Muscle-Invasive Bladder Cancer: A Systematic Review and Two-Step Meta-Analysis". The Oncologist. 21 (6): 708–15. doi:10.1634/theoncologist.2015-0440. PMC 4912364. PMID 27053504.
- ^ Iwata T, Kimura S, Abufaraj M, Janisch F, Karakiewicz PI, Seebacher V, et al. (October 2019). "The role of adjuvant radiotherapy after surgery for upper and lower urinary tract urothelial carcinoma: A systematic review". Urologic Oncology. 37 (10): 659–671. doi:10.1016/j.urolonc.2019.05.021. PMID 31255542. S2CID 195760627.
- ^ a b c d "Bladder Cancer Treatment Regimens". Cancer Therapy Advisor. 1 January 2019. Retrieved 26 November 2019.
- ^ "UpToDate". www.uptodate.com. Retrieved 26 November 2019.
- ^ a b c Ploussard G, Daneshmand S, Efstathiou JA, Herr HW, James ND, Rödel CM, et al. (July 2014). "Critical analysis of bladder sparing with trimodal therapy in muscle-invasive bladder cancer: a systematic review". European Urology. 66 (1): 120–37. doi:10.1016/j.eururo.2014.02.038. PMID 24613684.
- ^ Smelser WW, Austenfeld MA, Holzbeierlein JM, Lee EK. Where are we with bladder preservation for muscle-invasive bladder cancer in 2017?. Indian J Urol 2017;33:111–7 http://www.indianjurol.com/text.asp?2017/33/2/111/203415 Archived 10 September 2017 at the Wayback Machine
- ^ Mirza A, Choudhury A (April 2016). "Bladder Preservation for Muscle Invasive Bladder Cancer". Bladder Cancer. 2 (2): 151–163. doi:10.3233/BLC-150025. PMC 4927909. PMID 27376137.
- ^ "Chemotherapy for Bladder Cancer". www.cancer.org. Retrieved 27 November 2019.
- ^ "EAU Guidelines: Muscle-invasive and Metastatic Bladder Cancer". Uroweb.
- ^ Galsky MD, Hahn NM, Rosenberg J, Sonpavde G, Hutson T, Oh WK, et al. (June 2011). "Treatment of patients with metastatic urothelial cancer "unfit" for Cisplatin-based chemotherapy". Journal of Clinical Oncology. 29 (17): 2432–8. doi:10.1200/JCO.2011.34.8433. PMID 21555688. S2CID 33263969.
- ^ a b Keam B (2018). "Section VI. Chemotherapy for Metastatic Bladder Cancer". Bladder Cancer. Academic Press. p. 527. ISBN 978-0-12-809939-1. Retrieved 27 November 2019.
- ^ Lyman GH, Dale DC, Culakova E, Poniewierski MS, Wolff DA, Kuderer NM, et al. (October 2013). "The impact of the granulocyte colony-stimulating factor on chemotherapy dose intensity and cancer survival: a systematic review and meta-analysis of randomized controlled trials". Annals of Oncology. 24 (10): 2475–84. doi:10.1093/annonc/mdt226. PMC 3841419. PMID 23788754.
- ^ Gilligan TD, Steele GS, Zietman AL, Kantoff PW (2003). Chemotherapy for Metastatic Disease.
- ^ Galsky MD, Chen GJ, Oh WK, Bellmunt J, Roth BJ, Petrioli R, et al. (February 2012). "Comparative effectiveness of cisplatin-based and carboplatin-based chemotherapy for treatment of advanced urothelial carcinoma". Annals of Oncology. 23 (2): 406–10. doi:10.1093/annonc/mdr156. PMID 21543626.
- ^ Shelley MD, Cleves A, Wilt TJ, Mason MD (July 2011). "Gemcitabine chemotherapy for the treatment of metastatic bladder carcinoma". BJU International. 108 (2): 168–79. doi:10.1111/j.1464-410X.2011.10341.x. PMID 21718430. S2CID 26003400.
- ^ Aapro M, Abrahamsson PA, Body JJ, Coleman RE, Colomer R, Costa L, et al. (March 2008). "Guidance on the use of bisphosphonates in solid tumours: recommendations of an international expert panel". Annals of Oncology. 19 (3): 420–32. doi:10.1093/annonc/mdm442. PMID 17906299.
- ^ Sridhar SS (May 2017). "Evolving Treatment of Advanced Urothelial Cancer". Journal of Oncology Practice. 13 (5): 309–315. doi:10.1200/JOP.2017.022137. PMID 28489981.
- ^ Gerullis H, Wawroschek F, Köhne CH, Ecke TH (January 2017). "Vinflunine in the treatment of advanced urothelial cancer: clinical evidence and experience". Therapeutic Advances in Urology. 9 (1): 28–35. doi:10.1177/1756287216677903. PMC 5167074. PMID 28042310.
- ^ Oing C, Rink M, Oechsle K, Seidel C, von Amsberg G, Bokemeyer C (February 2016). "Second Line Chemotherapy for Advanced and Metastatic Urothelial Carcinoma: Vinflunine and Beyond-A Comprehensive Review of the Current Literature". The Journal of Urology. 195 (2): 254–63. doi:10.1016/j.juro.2015.06.115. PMID 26410730.
- ^ Keam B (2018). "Section VI. Chemotherapy for Metastatic Bladder Cancer". Bladder Cancer. Academic Press. p. 530. ISBN 978-0-12-809939-1. Retrieved 27 November 2019.
- ^ "Erdafitinib Effective Against Advanced Bladder Cancer". National Cancer Institute. 9 August 2019.
- ^ Konala VM, Adapa S, Aronow WS (February 2019). "Immunotherapy in Bladder Cancer". American Journal of Therapeutics. 29 (3): e334–e337. doi:10.1097/MJT.0000000000000934. PMID 30839322. S2CID 73472390.
- ^ Katz H, Wassie E, Alsharedi M (September 2017). "Checkpoint inhibitors: the new treatment paradigm for urothelial bladder cancer". Medical Oncology. 34 (10): 170. doi:10.1007/s12032-017-1029-8. PMID 28864844. S2CID 22280860.
- ^ a b c Narayan, Vikram; Kahlmeyer, Andreas; Dahm, Philipp; Skoetz, Nicole; Risk, Michael C; Bongiorno, Connie; Patel, Neil; Hwang, Eu Chang; Jung, Jae Hung; Gartlehner, Gerald; Kunath, Frank (23 July 2018). Cochrane Urology Group (ed.). "Pembrolizumab monotherapy versus chemotherapy for treatment of advanced urothelial carcinoma with disease progression during or following platinum-containing chemotherapy. A Cochrane Rapid Review". Cochrane Database of Systematic Reviews. 7: CD012838. doi:10.1002/14651858.CD012838.pub2. PMC 6513246. PMID 30036453.
- ^ Heidenreich A, Albers P, Classen J, Graefen M, Gschwend J, Kotzerke J, et al. (2010). "Imaging studies in metastatic urogenital cancer patients undergoing systemic therapy: recommendations of a multidisciplinary consensus meeting of the Association of Urological Oncology of the German Cancer Society". Urologia Internationalis. 85 (1): 1–10. doi:10.1159/000318985. PMID 20693823.
- ^ Llewelyn R. "Response evaluation criteria in solid tumors Radiology Reference Article Radiopaedia.org". Radiopaedia.
- ^ Siddiqui MR, Grant C, Sanford T, Agarwal PK (August 2017). "Current clinical trials in non-muscle invasive bladder cancer". Urologic Oncology. 35 (8): 516–527. doi:10.1016/j.urolonc.2017.06.043. PMC 5556973. PMID 28778250.
- ^ "Bladder Cancer - Statistics". Cancer.Net. 25 June 2012.
- ^ Kaufman DS, Shipley WU, Feldman AS (July 2009). "Bladder cancer". Lancet. 374 (9685): 239–49. doi:10.1016/S0140-6736(09)60491-8. PMID 19520422. S2CID 40417997.
- ^ van der Heijden AG, Witjes JA (September 2009). "Recurrence, Progression, and Follow-Up in Non–Muscle-Invasive Bladder Cancer". European Urology Supplements. 8 (7): 556–562. doi:10.1016/j.eursup.2009.06.010.
- ^ Tyson MD, Chang SS, Keegan KA (2016). "Role of consolidative surgical therapy in patients with locally advanced or regionally metastatic bladder cancer". Bladder. 3 (2). doi:10.14440/bladder.2016.89 (inactive 28 February 2022). PMC 5336315. PMID 28261632.
{{cite journal}}: CS1 maint: DOI inactive as of February 2022 (link) - ^ Zhang L, Wu B, Zha Z, Qu W, Zhao H, Yuan J (July 2019). "Clinicopathological factors in bladder cancer for cancer-specific survival outcomes following radical cystectomy: a systematic review and meta-analysis". BMC Cancer. 19 (1): 716. doi:10.1186/s12885-019-5924-6. PMC 6642549. PMID 31324162.
- ^ Ku JH, Kang M, Kim HS, Jeong CW, Kwak C, Kim HH (June 2015). "Lymph node density as a prognostic variable in node-positive bladder cancer: a meta-analysis". BMC Cancer. 15: 447. doi:10.1186/s12885-015-1448-x. PMC 4450458. PMID 26027955.
- ^ Yang LS, Shan BL, Shan LL, Chin P, Murray S, Ahmadi N, Saxena A (September 2016). "A systematic review and meta-analysis of quality of life outcomes after radical cystectomy for bladder cancer". Surgical Oncology. 25 (3): 281–97. doi:10.1016/j.suronc.2016.05.027. PMID 27566035.
- ^ Somani BK, Gimlin D, Fayers P, N'dow J (November 2009). "Quality of life and body image for bladder cancer patients undergoing radical cystectomy and urinary diversion--a prospective cohort study with a systematic review of literature". Urology. 74 (5): 1138–43. doi:10.1016/j.urology.2009.05.087. PMID 19773042.
- ^ Vartolomei L, Ferro M, Mirone V, Shariat SF, Vartolomei MD (July 2018). "Systematic Review: Depression and Anxiety Prevalence in Bladder Cancer Patients". Bladder Cancer. 4 (3): 319–326. doi:10.3233/BLC-180181. PMC 6087432. PMID 30112443.
- ^ David E (February 2017). "Psychiatric disorders worsen bladder cancer survival". www.healio.com. Retrieved 27 November 2019.
- ^ Correa AF, Smaldone MC (August 2018). "Melancholia and cancer: The bladder cancer narrative". Cancer. 124 (15): 3080–3083. doi:10.1002/cncr.31402. PMID 29660788.
- ^ "Bladder cancer statistics". World Cancer Research Fund. 22 August 2018. Retrieved 9 November 2019.
- ^ "Greece Factsheet" (PDF). Global Cancer Observatory. Retrieved 9 November 2019.
- ^ "WHO Disease and injury country estimates". World Health Organization. 2009. Archived from the original on 11 November 2009. Retrieved 11 November 2009.
- ^ Roth, Gregory A.; Abate, Degu; Abate, Kalkidan Hassen; Abay, Solomon M.; Abbafati, Cristiana; Abbasi, Nooshin; Abbastabar, Hedayat; Abd-Allah, Foad; Abdela, Jemal; Abdelalim, Ahmed; Abdollahpour, Ibrahim; Abdulkader, Rizwan Suliankatchi; Abebe, Haftom Temesgen; Abebe, Molla; Abebe, Zegeye; Abejie, Ayenew Negesse; Abera, Semaw F.; Abil, Olifan Zewdie; Abraha, Haftom Niguse; Abrham, Aklilu Roba; Abu-Raddad, Laith Jamal; Accrombessi, Manfred Mario Kokou; Acharya, Dilaram; Adamu, Abdu A.; Adebayo, Oladimeji M.; Adedoyin, Rufus Adesoji; Adekanmbi, Victor; Adetokunboh, Olatunji O.; Adhena, Beyene Meressa; et al. (November 2018). "Global, regional, and national age-sex-specific mortality for 282 causes of death in 195 countries and territories, 1980-2017: a systematic analysis for the Global Burden of Disease Study 2017". Lancet. 392 (10159): 1736–1788. doi:10.1016/S0140-6736(18)32203-7. PMC 6227606. PMID 30496103.
- ^ Lakkis NA, Adib SM, Hamadeh GN, El-Jarrah RT, Osman MH (2018). "Bladder Cancer in Lebanon: Incidence and Comparison to Regional and Western Countries". Cancer Control. 25 (1): 1073274818789359. doi:10.1177/1073274818789359. PMC 6055109. PMID 30027755.
- ^ a b Hemelt M, Yamamoto H, Cheng KK, Zeegers MP (January 2009). "The effect of smoking on the male excess of bladder cancer: a meta-analysis and geographical analyses". International Journal of Cancer. 124 (2): 412–9. doi:10.1002/ijc.23856. PMID 18792102. S2CID 28518800.
- ^ "Scientists Find One Reason Why Bladder Cancer Hits More Men". University of Rochester Medical Center. 20 April 2007. Archived from the original on 11 January 2009. Retrieved 20 April 2007.
- ^ Kim A, Kim MS, Ahn JH, Choi WS, Park HK, Kim HG, Paick SH (November 2019). "Clinical significance of 5-α reductase inhibitor and androgen deprivation therapy in bladder cancer incidence, recurrence, and survival: a meta-analysis and systemic review". The Aging Male. 23 (5): 971–978. doi:10.1080/13685538.2019.1646238. PMID 31724468. S2CID 208017350.
- ^ "Canada Fact Sheet" (PDF). Global Cancer Observatory. Retrieved 9 November 2019.
- ^ a b "Bladder cancer statistics - Canadian Cancer Society". www.cancer.ca. Retrieved 2 December 2019.
- ^ "China Fact Sheet" (PDF). Global Cancer Observatory. Retrieved 9 November 2019.
- ^ Pang C, Guan Y, Li H, Chen W, Zhu G (June 2016). "Urologic cancer in China". Japanese Journal of Clinical Oncology. 46 (6): 497–501. doi:10.1093/jjco/hyw034. PMID 27049022.
- ^ team, FPFIS (8 March 2017). "Epidemiology of bladder cancer in Europe". EU Science Hub - European Commission. Retrieved 2 December 2019.
- ^ "UK fact sheet" (PDF). Global Cancer Observatory. Retrieved 9 November 2019.
- ^ Ward EM, Sherman RL, Henley SJ, Jemal A, Siegel DA, Feuer EJ, et al. (December 2019). "Annual Report to the Nation on the Status of Cancer, Featuring Cancer in Men and Women Age 20-49 Years". Journal of the National Cancer Institute. 111 (12): 1279–1297. doi:10.1093/jnci/djz106. PMC 6910179. PMID 31145458.
- ^ "Key Statistics for Bladder Cancer". www.cancer.org. Retrieved 28 November 2019.
- ^ "Common Cancer Sites - Cancer Stat Facts". SEER. Retrieved 28 November 2019.
External links
- Bladder cancer at Curlie
- Clinically reviewed bladder cancer information for patients, from Cancer Research UK
- Cancer.Net: Bladder Cancer
- EORTC calculator for non-muscle invasive bladder cancer risk stratification