CREB결합단백질
CREB-binding protein고리 아데노신 monophosphate 응답 요소 바인딩 단백질 바인딩 단백질(단백질 CREB-binding), 또한으로 알려진 CREBBP 또는 복수 승압 펌프 또는 KAT3A은 공활성화 인자하지 않은 암호화에 의해 CREBBP 유전자의 인간에 위치한 염색체 16p13.3.[5][6]복수 승압 펌프고 본질적인 아세틸 전달 효소 기능;그것 수 있는 추가 아세틸 그룹에 둘 다 전사 요인들도.안녕하세요로스톤 라이신(stone lysine)은 후자가 염색질 구조를 변화시켜 유전자가 전사하기 쉽도록 만드는 것으로 보여진다.[7][8][9][10]이와 같이 비교적 독특한 아세틸전달효소 활성은 또 다른 전사 효소인 EP300(p300)에서도 나타난다.함께, 그들은 p300-CBP 공동활성화 가족으로 알려져 있고 인간의 16,000개 이상의 유전자와 연관되어 있는 것으로 알려져 있다. 그러나, 이 단백질들이 많은 구조적 특징을 공유하는 동안, 이 두 공동활성화기가 다른 생물학적 기능을 가진 유전자의 전사를 촉진할 수 있다는 새로운 증거가 제시한다.[7][11][12]null
예를 들어, CBP만이 대장암과 머리와 목의 편평한 세포암을 포함한 다양한 병리학에 관련되어 있다.이러한 질병에서 β-catenin과 CBP의 연관성은 암세포의 증식과 질병의 공격성을 촉진하는 반면, p300/β-catenin은 세포 분화 및/또는 세포사멸을 유발하는 것으로 나타났다.[11][13]CBP는 또한 지방생식과 글루코네제지스를 담당하는 유전자와 전사 인자의 활동을 조절함으로써 세포 영양상태의 변화에 대응하여 에너지 홈스테이션을 통해 간기능을 조절하는 데 도움을 주는 것으로 나타났다.[6]또한 CBP는 혈액형 악성종양과 다른 고형종양, 당뇨병, 조현병, 알츠하이머병, 우울증, 그리고 많은 다른 신경학적 폐해를 포함한 몇 가지 다른 질병들의 식이론에도 관여하고 있다.[14][15][16][17][18]null
구조
기능 CBP는 약 7362 뉴클레오티드 길이로 2,441개의 아미노산을 암호화하고 있다.[8][18]CBP는 촉진 요소와 직접 상호작용하지 않는다. CBP는 다른 전사적 공동 활성자와 복잡한 구조 영역의 결과인 단백질-단백질 상호작용을 통해 현장에 전달된다.[8]null
전환 어댑터 아연 핑거 도메인
CBP는 각각 아연 이온에 의해 안정화된 4개의 알파 나선형으로 구성된 2개의 TAZ(Transition Adapter Asyn Finger) 도메인을 가지고 있다.TAZ1과 TAZ2 영역은 모두 암페타스 아미노산 시퀀스 내의 소수성 잔류물을 선호하며, 그 결합 친화력은 산성 잔류물과 양의 사이드 체인의 상호작용으로 강화된다.[19]TAZ2에 바인딩되는 요인도 아세틸트랜스퍼레이제 영역(KAT)에 근접하기 때문에 아세틸화를 통해 잠재적으로 규제된다.[19]null
시스틴히스티딘부유지역
CBP 내에서 세 개의 시스테인 히스티딘 리치 도메인이 확인되지만, 단지 도메인 1과 3(CH1, CH3)만이 구조적 기능을 해결했다.[8]CBP와 관련된 많은 요인들은 단백질의 반대쪽 끝에도 불구하고 CH1 또는 CH3 영역 중 하나 또는 둘 모두에 결합된다.현재까지 이 두 도메인 사이의 상호작용에 대해서는 거의 알려져 있지 않다.CH1과 CH3의 1차 구조는 아연 이온(Zn2+)을 킬레이트할 수 있는 컨센서스 시퀀스로 분해되는 것으로 나타났다.[8]또한 수행된 실험에서는 이러한 시퀀스의 잔류물이 CH1 또는 CH3에 의해 발생해야 하는 전사적 공동 활성화에 의무적인 것으로 나타났다.[8]단백질의 중간에 위치한 CH2 부위는 아세틸전달효소 영역에서 이러한 일치 순서를 포함하지 않으며, 아연 이온을 결합하는 것으로 결정적으로 나타나지 않았다.null
키나세-유도 도메인 상호 작용 도메인
Aka KIX 도메인, CREB 바인딩 도메인, MYB 상호 작용 도메인
KIX(Kinase-Induidable Domain)는 또한 CBP(또는 p300)와 다른 전사 인자 및 공동활성화자의 상호작용으로 이단계가 형성되는 CBP 및 p300의 단백질 영역이다.암페타 단백질 서열 친화력이 높은 알파 3개와 310개의 헬리코 2개로 구성된다.[19]흥미롭게도, 이 나선은 여러 다른 컨포머로 접힐 수 있는데, 이것은 이 영역이 규제 통제력을 발휘하면서 난잡한 수준을 유지할 수 있게 해준다.[19]KIX 영역은 전사 속도를 제어하며 조혈 분화에 중요한 것으로 나타났다.[8][19][20]이 영역에 결합하는 단백질들 중 일부는 경쟁적으로 결합하는 것으로 보여지는데, CREB와 Myb와 같은 다른 단백질들은 MLL과 Myb의 경우와 같이 알로스테릭한 협력을 통해 결합한다.[19]
브로모도마인
브롬도메인(BRD)은 아세틸화 리신 분자를 인식하는 기능을 하는 약 110개의 아미노산으로 구성된다.[8]그것들은 소수성 결합 주머니를 형성하는 루프에 의해 연결된 네 개의 왼손잡이 알파 나선형으로 구성되어 있다.[8][19]게놈의 영역에 결합하는 CBP의 브로모도메인은 아세틸화 리신 잔류물이 풍부한데, 이는 양성 전하를 상실하여 DNA에 대한 히스톤 친화력을 감소시켜 전사가 가능한 지역을 더욱 개방하고 접근할 수 있게 한다.아세틸화 p53과 STAT3는 CBP의 브로모도메인과 결합하는 것으로 나타났다.[18]null
리신 아세틸트랜스퍼레이제 도메인
380개의 단백질 잔류물 리신 아세틸트랜스퍼레이즈(KAT) 영역은 거의 틀림없이 CBP의 가장 중요하고 식별되는 구조적 구성요소 중 하나이다.그것의 활동은 CBP의 인산화 작용을 통해 조절된다.흥미로운 것은 그것이 히스톤뿐만 아니라 다른 단백질도 아세틸화 할 수 있다는 것이다.현재 CBP의 KAT 영역에는 p53, E2F-1-3, GATA-1, MyoD, CREB 등의 단백질을 포함하여 100개 이상의 기판이 알려져 있다.[18]CBP가 KAT 도메인을 통해 아세틸레이트 p53에 도달하는 능력은 CBP의 브로모도메인에 대한 p53의 친화력을 증가시켜 이 독특한 단백질이 유전자 전사를 자기 서비스적으로 조절할 수 있는 흥미로운 메커니즘을 보여준다.null
핵수용체 공동활성화기 결합 도메인
Aka Interferon 응답 계수 바인딩 도메인(IBiD)
결합되지 않은 상태에서 CBP의 c-terminus에 위치한 핵수용체 결합 도메인(NCBD)은 다중 순응 사이에서 변동한다.[19]표적 단백질을 NCBD에 결합하면 표적 단백질이 결합 파트너의 정렬되지 않은 영역과 관련하여 특별히 기능하는 3개의 나선형으로 접히게 된다.[19]이 부위에 결합하는 것으로 알려진 단백질 중에는 갑상선과 레티노이드 수용체를 위한 공동 활성제인 ACTR (p160), 그 호몰로로그 SRC-1, p53, SMAD 등이 있다.[20][19]
상호작용
CBP와 특별히 상호작용하는 것으로 보이는 단백질
함수
이 유전자는 보편적으로 표현되며 많은 다른 전사 인자의 전사적 공동 활성화에 관여한다.CBP는 유전자 발현을 조절할 수 있는 두 가지 중요한 메커니즘을 가지고 있다: 아세틸전달효소로서, 그리고 전사나 염색질 리모델링에 필요한 콤플렉스를 모집하고 건설하는 것을 돕는 단백질 비계로서.CBP의 인산화 작용은 아세틸전달효소 활동을 증가시키며, 이 과정은 세포 주기에 따라 조절되어야 한다는 가설을 세웠다.[18]최근의 결과는 새로운 CBP 매개 변환 후 N-glycosylation 활동이 CBP 상호작용 단백질의 준수를 변화시켜 유전자 발현, 세포 성장 및 분화의 규제로 이어진다는 것을 암시한다.[28]
p300과의 구별
종종 과학 논문(특히 덜 최근의 논문)에서 CBP와 p300은 CBP/p300으로 서로 교환하여 사용된다.이것은 이 두 단백질의 동질학, 구조적 유사성 및 결합 작용을 고려할 때 합성이 타당하다.그러나 현재 진행 중인 연구는 CBP와 p300이 뚜렷한 생물학적 기능을 유지하므로 혼동해서는 안 된다는 것을 보여준다.null
공통 히스톤 기판이 있음에도 불구하고 사용 가능한 히스톤이나 아세틸-CoA의 양이 적은 경우 CBP와 p300은 서로 다른 선호 아세틸전달효소 기판을 갖는 것으로 보고되었다.[18]카포시 육종 관련 헤르페스 바이러스와 관련된 실험에서, 병리학적 단백질(vIRF)은 CBP에 의해 조절되고 p300에 의해 억제되는 것으로 나타났다.p300 생쥐의 동란체 결핍 연구들은 배아 치사율이 높았으며, 부적절한 뉴런과 제한된 생존 기간 동안 심장 발육이 저조했다.[12]또한 이들 생쥐로부터 격리된 섬유블라스트는 제대로 증식을 할 수 없었고 레티노산 수용체가 부족했다.[7][18]CBP의 돌연변이를 위해 균일하게 유전자변형된 생쥐도 배아적으로 치명적이었지만, 그 대신 이 생쥐들은 혈관계 혈관신생과 비정상적인 조혈모세포 증식이 없고 조혈성 미세환경이 변형된 것으로 특징지어진다.[18]CBP와 p300 동란성 녹아웃이 모두 배아 치사였다는 사실은 이러한 요소들이 발생에 결정적인 역할을 한다는 것을 시사한다.이러한 배아의 차등 표현형태는 또한 CBP와 p300이 발생학적 발달의 다른 측면을 규제한다는 것을 나타낸다.null
세포주기 규제에서의 역할
1990년대 후반에 수행된 연구는 최고 CBP 아세틸전달효소 활동이 세포 주기 체크포인트의 G1/S 단계 사이의 전환에서 발생한다는 것을 입증했다.[29]셀 주기의 이 단계에서 셀에 존재하는 CDK2의 농도를 고려할 때, CDK2가 이러한 변환 후 수정의 주요 조절기일 수 있다는 가설을 세웠다.[7]사이클린 E/CDK2 억제제 투여는 사실상 CBP의 KAT 도메인의 효소 활동을 억제하는 것으로 나타났다.[29]인산화 CBP에 나타난 다른 단백질로는 MAP Kinase, PKA, CAMK4 등이 있다.[7][18] Ser-133은 CBP 전사 활동을 개시하기 위해 PKA에 의해 인산화되는 중요한 잔류물인 것으로 나타났다.[30][20]null
전사 인자의 E2F 계열은 셀 주기의 G1에서 S 단계로 셀을 취하는데 매우 중요하다.[31]그들은 DNA 복제에 관련된 유전자의 촉진자 영역에서 일련의 일치된 일치에 구속된다.CBP(및 p300)는 공동활성제로서 E2F 단백질과 상호작용하는 것으로 나타났으며, 아세틸전달효소로서 후자는 E2F DNA 결합 친화력을 증가시킨다.[5][12]CBP/p300에 대한 항체의 미세주사를 사용한 2000년에 발표된 KOUT 연구에서는 S 단계로 진행될 수 있는 세포의 수가 현저히 감소하여 G1/S 위상 전환에 필요한 인자의 전사에는 CBP가 필수적이라는 생각을 더욱 뒷받침했다.[12]null
또한 CBP는 복제의 기원을 중심으로 히스톤을 아세틸화함으로써 S단계에서 DNA 복제의 과정을 용이하게 하는 것으로 여겨진다.[12]히스톤의 아세틸레이션, 특히 히스톤의 리신 잔류물은 히스톤과 DNA 사이의 전하 상호작용을 약화시켜, 이 영역이 DNA 복제에 필요한 기계에 대해 더 개방적이고 접근하기 쉽게 되도록 한다.활성 영역과 연관된 히스톤 아세틸화 마커 2개에는 히스톤 3 리신 18 아세틸화(H3K18ac)와 히스톤 3 리신 27 아세틸화(H3K27ac)가 있다.[12]CBP는 오카자키 파편 처리에 관여하는 두 개의 내핵(FEN1, DNA2)을 아세틸화한다는 사실도 밝혀졌다.[12]null
CBP에 의해 규제되는 세포 주기의 또 다른 핵심 요소는 복합/사이클로섬(APC/C)을 촉진하는 아나파제다.이 단지는 '아크 램프'와 '플랫폼'이라는 두 개의 서브돔으로 묶인 수많은 서브유니트로 구성되며, 프로테아솜 열화를 위해 사이클린 B, 증권, PLK1 등 세포주기와 관련된 구성요소를 대상으로 하는 E3 유비쿼시틴 리가제 역할을 한다.[32][33]APC/C의 두 하위 유니트는 플랫폼 하위 도메인에 위치한 AP5와 아크 램프 하위 도메인에 위치한 AP7과 직접 상호작용하는 것으로 나타났다.[32][33]CBP와 p300을 완전히 억제하기 위해 RNAi를 사용하여 수행된 실험에서는 APC/C의 표적이 되는 사람들의 단백질 농도가 크게 증가했으며, 세포 주기의 유사상에서는 다수의 세포가 체포되는 원인이 되었다.[33]null
질병에서의 역할
루빈스타인-타이비 증후군
RTS(Rubinstein-Taybi Syndrome, RTS)는 희귀한 유전적 질환으로 CBP나 p300의 유전적 돌연변이의 결과물이다.500개 이상의 다른 변형이 기록된 CBP 돌연변이에 의해 발생하는 RTS 타입 1은 모든 사례의 약 55%를 차지하고, 120개에 가까운 다른 유형의 p300 돌연변이에 의해 발생하는 RTS 타입 2는 진단된 사례의 8%에 불과하다.[34]이러한 돌연변이의 대다수는 돌연변이를 삭제, 지적 또는 잘라냄으로써 유전자의 기능 상실을 초래하는 것으로 나타났다.[12]통계에 따르면 RTS 환자들은 암의 위험이 증가했으며, 그 중 약 5%가 신경마개에서 발생하는 소아 악성종양에 기인한다고 한다.[12]RTS를 가진 사람들은 종종 낮은 지능 수준, 주의력 결핍, 운동 조정 장애를 포함한 골격의 아불명성, 신경학적 결함, 정신적 장애를 가지고 있다.[22]null
CBP 돌연변이가 잦은 암| 암 유형 | N | 변이된 검체 비율(%) |
|---|---|---|
| 모낭 림프종 | 66 | 33.3 |
| 피부편평세포암 | 77 | 28.6 |
| 한계영역 B세포림프종 | 15 | 13.3 |
| 큰 B세포 림프종 확산 | 242 | 12.0 |
| 침샘암 | 63 | 9.5 |
| 방광암 | 438 | 8.9 |
| 자궁내막암 | 337 | 8.0 |
| 폐소세포암 | 52 | 7.7 |
| ER+ 유방암 | 80 | 7.5 |
암
CBP는 종양발달의 모든 단계에서 역할을 하는 것으로 나타났다.[8]세포 증식, 성장, 이주, 사멸의 규제에 중요한 역할을 하기 때문에, 종양 억제기 즉 종양 억제기로 간주된다.[5]대조적으로 지금까지 증가된 CBP 활동은 유방암, 폐암, 전립선암, 대장암, 급성백혈증, 머리와 목암, 그리고 많은 다른 악성종양과 관련이 있다.[8][11][18][12]COSMIC(Catalog of Cosmic in Cancer)에 따르면 CBP에서 가장 흔한 유전적 돌연변이는 오식 돌연변이다(전체 CBP 돌연변이의 약 71%를 차지한다).가장 빈번한 돌연변이는 KAT 도메인에서 발생하며, 그 결과 아세틸전달효소 활동이 감소하거나 억제된다.[12]null
혈액학적 악성종양
CBP(Cbp+/-)용 배아 생쥐 이형체에서는 '초대조혈증, 골수 세포성 저하[골수 대 지방 비율 낮음], 조혈 분화 이상'[18]이 나타났다.1세 때, 이 쥐들은 백혈병이나 혈액신종양증의 발병률이 증가했다.[25]흥미롭게도, 종양 염기서열 분석은 야생형 알레르기의 이형성 상실을 보여주었다.[18]이러한 실험 결과에 대해 제안된 한 가지 설명은 CBP가 조혈모세포 자가 재생에 역할을 한다는 것이다.[18]null
급성 골수성 백혈병(AML)과 골수분열증후군(Myelodynastic Syndrome) 진단을 받은 환자의 경우 CBP가 기능을 하는 것으로 나타났다.[12]이것은 단세포 백혈병 아연 핑거(MOZ)라고 불리는 CBP와 다른 아세틸전달효소 사이의 염색체 번역을 통해 발생하거나 MORF(Motz 관련 인자)와 MLL(혼합선 백혈병) 유전자 사이에서 발생한다.[12]두 경우 모두 CBP의 C-terminus가 손실되는 융합 단백질과 두 단백질에서 발생하는 아세틸전달효소 도메인이 남아 있어 상향조절 KAT 활성과 질병이 발생한다.[12]null
급성 림프성 백혈병(ALL) 재발환자의 경우 약 18%가 CBP KAT 도메인 돌연변이를 가지고 있는 것으로 보고되었다.[18]null
고체종양
폐암에서 CBP 돌연변이는 비교적 드물지만 확인되었다.[21]추가 분석 결과 호흡기 상피종양 초기에는 CBP 전사의 활동과 관련이 있는 것으로 알려진 AP-1과 사이클린 D1뿐만 아니라 CBP에서도 발현이 증가한다는 사실도 밝혀졌다.이러한 과잉 표현은 폐종양 발달을 선호하는 다운스트림 신호 사건으로 이어질 수 있다.[21]null
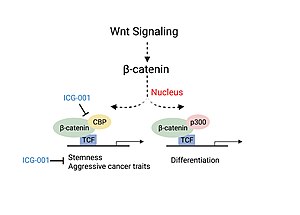
대장암과 두부암(HNSC) 질환 중증도는 표준 Wnt 신호 경로에 관여하는 중요 요인인 β-카테닌과 CBP의 연관성과 연계되어 있다.[11][13]β-카테닌과 CBP의 연관성은 암 줄기세포 인구의 존재, 면역세포 침투 감소, 전이 가능성 등 보다 공격적인 암 형질을 담당하는 유전자의 전사로 이어진다.[13]p300/β-catenin 연관성을 차단하지 않는 β-catenin/CBP 연관성(ICG-001)의 소분자 억제제 사용을 연구한 실험에서는 발암물질이 감소하고 세포 분화와 세포사멸이 증가했다.[11][13]null
안드로겐(AR) 수용체와 에스트로겐(ER) 수용체에 의해 매개되는 증가된 핵호르몬 신호는 각각 전립선암과 유방암 환자를 담당한다.[11]CBP는 공동활성화기와 아세틸트랜스퍼레이즈 컨텍스트 모두에서 AR 및 ER과 상호작용하는 것으로 알려져 있다.CBP KAT 활성의 억제는 수용체 발현을 다운 조절함으로써 AR과 ER 신호를 감소시키는 것으로 나타났다. 이는 다시 두 악성 종양의 종양성을 억제한다.[11]null
대사성동맥류
포도당과 지질의 균형에 의존하는 에너지 동점증은 유기체 생존에 필수적이다.[6]신진대사 활동이 저하되는 질환으로는 비만, 제2형 당뇨병(T2D), 비알코올성 지방간질환(NAFLD) 등이 있다.컨텍스트 평형에서 과잉 영양은 포도당과 인슐린 농도 증가에 대응하여 지질생성(지질합성)을 촉진하고, 단식은 β-산화(지질 분해)와 글루코네제지스(글루코네제지스)를 촉진한다.[6]다이어트 유도 비만 생쥐를 대상으로 한 실험에서는 탄수화물 반응성소자결합단백질(CHREBP)과 함께 작용하는 스테롤 규제요소결합단백질(SREBP1C)의 과다 발현에 의해 지방생식이 증가하는 것으로 나타났다.둘 다 지방생식에 중요한 전사 인자로, 둘 다 CBP에 의해 아세틸화되는데, 이는 그들의 전사 활동을 증가시키는 사후 번역 수정이다.[6]지질 합성의 증가의 균형을 맞추기 위해서, 신체는 세포와 저장고에서 고분자를 내보낼 수 있어야 한다.마이크로소말 트리글리세라이드전달단백질(MTP)은 지단백질 조립 및 분비를 담당하며, 이 단백질은 RNA 헬리코아제 DDX3와 연관되어 CBP와 상호작용하여 HNF4 아세틸화를 유발하며, 이는 다시 양성 피드백 루프에서 MTP의 전사율을 증가시킨다.[6]null
CBP는 또한 단식 조건에서의 포도당 동점선 조절에 대한 역할을 한다.연구 또한 글루카곤 호르몬 몸이 낮은 혈액 설탕이 발매된 cAMP 반응 요소 그 다음 복수 승압 펌프에 FOXO1의 전사에 대한 공활성화 인자로 묶어 주는 단백질(CREB결합), 바인딩을 활성화시키는 보여 주었다.포도당육 인산화 효소와 포스포에놀피 루브산 카르복시 키나아제(PECK1)포함이 될 수 있는 효소에[6]FOXO1은 전사 인자.e 글루코네제네시스에 필요하다.null
신경 장애
CREB는 신경보호성이 있는 것으로 밝혀졌다.[14]CBP와의 연관성 때문에, 신경학적 경로에서 CBP의 역할과 이상이 질병에 어떻게 영향을 미치는지 이해하는 것이 점점 더 흥미로워지고 있다.CBP 돌연변이가 있는 생쥐의 운동, 학습, 기억 기능의 변화를 평가하기 위해 수많은 동물 모델이 설계되었다.CBP에 대해 혈류성이 있거나 CBP 포인트 변이가 있는 조건부 KKO(conditional knockout) 마우스는 특히 장기 메모리와 관련된 메모리 결함을 보였다.[22]CBP KIX 영역에서 동란점 돌연변이를 가진 생쥐의 경우, 운동 기술 학습과 실행이 손상된 것을 입증했다.[22]RTS 환자들이 경험하는 신경학적 도전(지능의 낮은 수준, 주의력 결핍)과 연계하여 CBP는 많은 다른 종류의 질병의 특징인 다양한 신경학적 증상에 기인한다.null
태아알코올 스펙트럼 장애
태아 알코올 스펙트럼 장애(FASD)는 임신 중 알코올 노출로 인해 발생하는 질환의 분류다.[22]이러한 장애의 증상은 부실한 소뇌 의존적 학습, 운동 조정, 그리고 균형감각을 약화시키는 것을 포함한다.[22]FASD를 사용하는 랫드에서는 CBP 농도를 낮추고 H3와 H4 아세틸레이션 농도를 낮춘 것으로 나타났다.[22]null
헌팅턴병
헌팅턴병(HD)은 헌팅틴 유전자의 유전적 돌연변이가 돌연변이 헌팅틴(Htt) 단백질의 합성을 유발하는 치명적이고 진행 중인 신경퇴행성 질환이다.[22]이 질병과 가장 자주 연관되는 증상은 운동기능 저하, 행동변형, 인지장애 등 궁극적으로는 치매를 유발하는 운동장애다.[35]동물 모델에서는 HD 피험자가 CBP 활동을 감소시키고 뉴런 히스톤 아세틸화를 감소시켰다는 것이 관찰되었다.[22]연구 결과 mutHtt가 CBP와 직접 상호작용하는 것으로 나타났다 돌연변이 Htt가 CBP를 저하시킬 수 있거나 CBP의 아세틸전달효소 도메인을 직접 억제한다는 가설이 나왔다.[22][14]null
알츠하이머병
알츠하이머병(AD)은 뉴로이틱 아밀로이드 베타(Aβ) 격자 및 신경섬유질 타우(NeuroFibrillary tau) 엉킴이 유무를 기준으로 병리학 진단을 받는 진행성 신경퇴행성 질환이다.[22]질병의 정확한 원인이 명확하게 파악되지 않기 때문에, CBP가 AD의 진행에 역할을 하기 위해 가설되는 여러 가지 메커니즘이 있다.초기 온셋 가족성 AD(FAD)의 많은 경우, Aβ 격자 생성의 원인이 되는 효소를 구성하는 단백질의 돌연변이가 있다.CBP 활성도는 이러한 단백질이 없을 때 감소한다(Presenilin 1 또는 presenilin 2).[16][22]또한 AD의 마우스 모델에서는 CBP의 중요한 기능인 뉴런 히스톤 아세틸화가 감소하는 것으로 나타났다.[22]null
CBP 억제
대조군 CBP가 광범위한 생리학적 과정을 가지고 있기 때문에, CBP 활동에 대한 억제제 개발은 잠재적 치료법으로서 점점 더 중요해졌다.현재까지 밝혀진 것 중 극히 일부만이 임상실험으로 진전되었다.null
| 마약 | 개발 단계 | 질병/대상 지역 | 참조 |
|---|---|---|---|
| A-485 | 체외/체외 | 혈액학적 악성종양, 안드로겐 수용체 양성 전립선암 | [36] |
| C646 | 체외/체외 | 고형종양, 신경세포 히스톤 아세틸화 구조 | [8] |
| CBP30 | 체외 | 자가면역질환 | [8] |
| CCS1477 | 단계 1b/2a | 거세 저항성 전립선암, 혈액학적 악성종양 | [10][8] |
| CPI-637 | 체외/체외 | 거세저항성 전립선암 | [37] |
| dCBP-1 | 실리콘에 | 다발성 골수종(MM) | [38] |
| DC_CP20 | 실리콘에 | 백혈병 | [8] |
| E7386 | 1단계 | 고체종양, β-카테닌/CBP 단백질-단백질 방지 상호 작용 | [39] |
| 가르시놀 | 체외/체외 | 식도암 | [36] |
| GNE-049 | 체외/생비고 | 유방암 및 전립선암 | [38] |
| GNE-207 | 체외/체외 | 급성 골수성 백혈병(AML), 잠재적 기타 혈액학적 악성종양 | [8] |
| GNE-781 | 체외/체외 | 급성 골수성 백혈병(AML), 잠재적 기타 혈액학적 악성종양, 전립선암, 유방암 | [38][8][40] |
| HBS1 | 체외/체외 | 신장세포암 | [8][41] |
| I-CBP112 | 체외/체외 | CBP브로모도메인 | [8] |
| ICG-001 | 체외/체외 | 대장암, 머리와 목의 편평한 세포암 | [11][13] |
| KCN1 | 체외/체외 | 교모마 | [8][42] |
| 마이BMIM | 실리콘에 | 급성 골수성 백혈병(AML), CBP/Myb 예방 단백질과 단백질의 상호 작용 | [8] |
| NASTRp | 체외/체외 | 폐선상피종 | [8] |
| NEO2734 | 체외/체외 | 전립선암 | [8] |
| 니쿠르 | 실리콘에 | 위장 캐커너 | [8] |
| 옴1 | 체외/체외 | CBP/HIF-1α 단백질-단백질 상호작용 방지 | [8] |
| PRI-724 | 체외/체외 | 간섬유화 | [6] |
| PU139 | 체외/체외 | 신경블라스토마 | [36] |
| Y08197 | 체외 | 거세저항성 전립선암 | [37] |
참조
- ^ a b c GRCh38: 앙상블 릴리스 89: ENSG00000005339 - 앙상블, 2017년 5월
- ^ a b c GRCm38: 앙상블 릴리스 89: ENSMUSG000022521 - 앙상블, 2017년 5월
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ a b c d e f g Chan HM, La Thangue NB (July 2001). "p300/CBP proteins: HATs for transcriptional bridges and scaffolds". Journal of Cell Science. 114 (Pt 13): 2363–2373. doi:10.1242/jcs.114.13.2363. PMID 11559745.
- ^ a b c d e f g h i j k l m Yao W, Wang T, Huang F (2018). "p300/CBP as a Key Nutritional Sensor for Hepatic Energy Homeostasis and Liver Fibrosis". BioMed Research International. 2018: 8168791. doi:10.1155/2018/8168791. PMC 5976926. PMID 29862292.
- ^ a b c d e f g Vo N, Goodman RH (April 2001). "CREB-binding protein and p300 in transcriptional regulation". The Journal of Biological Chemistry. 276 (17): 13505–13508. doi:10.1074/jbc.R000025200. PMID 11279224.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z Akinsiku OE, Soremekun OS, Soliman ME (February 2021). "Update and Potential Opportunities in CBP [Cyclic Adenosine Monophosphate (cAMP) Response Element-Binding Protein (CREB)-Binding Protein] Research Using Computational Techniques". The Protein Journal. 40 (1): 19–27. doi:10.1007/s10930-020-09951-8. PMC 7868315. PMID 33394237.
- ^ Guo P, Chen W, Li H, Li M, Li L (October 2018). "The Histone Acetylation Modifications of Breast Cancer and their Therapeutic Implications". Pathology & Oncology Research. 24 (4): 807–813. doi:10.1007/s12253-018-0433-5. PMID 29948617. S2CID 47020435.
- ^ a b He ZX, Wei BF, Zhang X, Gong YP, Ma LY, Zhao W (January 2021). "Current development of CBP/p300 inhibitors in the last decade". European Journal of Medicinal Chemistry. 209: 112861. doi:10.1016/j.ejmech.2020.112861. ISSN 0223-5234. PMID 33045661. S2CID 222319204.
- ^ a b c d e f g h Bordonaro M, Lazarova DL (July 2015). "CREB-binding protein, p300, butyrate, and Wnt signaling in colorectal cancer". World Journal of Gastroenterology. 21 (27): 8238–8248. doi:10.3748/wjg.v21.i27.8238. PMC 4507093. PMID 26217075.
- ^ a b c d e f g h i j k l m n o Attar N, Kurdistani SK (March 2017). "Exploitation of EP300 and CREBBP Lysine Acetyltransferases by Cancer". Cold Spring Harbor Perspectives in Medicine. 7 (3): a026534. doi:10.1101/cshperspect.a026534. PMC 5334244. PMID 27881443.
- ^ a b c d e Kartha VK, Alamoud KA, Sadykov K, Nguyen BC, Laroche F, Feng H, et al. (July 2018). "Functional and genomic analyses reveal therapeutic potential of targeting β-catenin/CBP activity in head and neck cancer". Genome Medicine. 10 (1): 54. doi:10.1186/s13073-018-0569-7. PMC 6053793. PMID 30029671.
- ^ a b c d e Rouaux C, Loeffler JP, Boutillier AL (September 2004). "Targeting CREB-binding protein (CBP) loss of function as a therapeutic strategy in neurological disorders". Biochemical Pharmacology. 68 (6): 1157–1164. doi:10.1016/j.bcp.2004.05.035. PMID 15313413.
- ^ Wang H, Xu J, Lazarovici P, Quirion R, Zheng W (2018-08-30). "cAMP Response Element-Binding Protein (CREB): A Possible Signaling Molecule Link in the Pathophysiology of Schizophrenia". Frontiers in Molecular Neuroscience. 11: 255. doi:10.3389/fnmol.2018.00255. PMC 6125665. PMID 30214393.
- ^ a b Amidfar M, de Oliveira J, Kucharska E, Budni J, Kim YK (September 2020). "The role of CREB and BDNF in neurobiology and treatment of Alzheimer's disease". Life Sciences. 257: 118020. doi:10.1016/j.lfs.2020.118020. PMID 32603820. S2CID 220287306.
- ^ Steven A, Friedrich M, Jank P, Heimer N, Budczies J, Denkert C, Seliger B (October 2020). "What turns CREB on? And off? And why does it matter?". Cellular and Molecular Life Sciences. 77 (20): 4049–4067. doi:10.1007/s00018-020-03525-8. PMC 7532970. PMID 32347317.
- ^ a b c d e f g h i j k l m n o p q r s Dutta R, Tiu B, Sakamoto KM (September 2016). "CBP/p300 acetyltransferase activity in hematologic malignancies". Molecular Genetics and Metabolism. 119 (1–2): 37–43. doi:10.1016/j.ymgme.2016.06.013. PMID 27380996.
- ^ a b c d e f g h i j k l m n o p q r s t u v Dyson HJ, Wright PE (March 2016). "Role of Intrinsic Protein Disorder in the Function and Interactions of the Transcriptional Coactivators CREB-binding Protein (CBP) and p300". The Journal of Biological Chemistry. 291 (13): 6714–6722. doi:10.1074/jbc.R115.692020. PMC 4807259. PMID 26851278.
- ^ a b c Sapio L, Salzillo A, Ragone A, Illiano M, Spina A, Naviglio S (October 2020). "Targeting CREB in Cancer Therapy: A Key Candidate or One of Many? An Update". Cancers. 12 (11): 3166. doi:10.3390/cancers12113166. PMC 7693618. PMID 33126560.
- ^ a b c d e f g h i j k l m Karamouzis MV, Konstantinopoulos PA, Papavassiliou AG (April 2007). "Roles of CREB-binding protein (CBP)/p300 in respiratory epithelium tumorigenesis". Cell Research. 17 (4): 324–332. doi:10.1038/cr.2007.10. PMID 17372613. S2CID 36084602.
- ^ a b c d e f g h i j k l m n o p q r s Valor LM, Viosca J, Lopez-Atalaya JP, Barco A (2013-07-31). "Lysine acetyltransferases CBP and p300 as therapeutic targets in cognitive and neurodegenerative disorders". Current Pharmaceutical Design. 19 (28): 5051–5064. doi:10.2174/13816128113199990382. PMC 3722569. PMID 23448461.
- ^ a b c d e f g h i j k l Dutto I, Scalera C, Prosperi E (April 2018). "CREBBP and p300 lysine acetyl transferases in the DNA damage response". Cellular and Molecular Life Sciences. 75 (8): 1325–1338. doi:10.1007/s00018-017-2717-4. PMID 29170789. S2CID 3951961.
- ^ Mullan PB, Quinn JE, Harkin DP (September 2006). "The role of BRCA1 in transcriptional regulation and cell cycle control". Oncogene. 25 (43): 5854–5863. doi:10.1038/sj.onc.1209872. PMID 16998500. S2CID 41157893.
- ^ a b c d e f Blobel GA (2000-02-01). "CREB-binding protein and p300: molecular integrators of hematopoietic transcription". Blood. 95 (3): 745–755. doi:10.1182/blood.V95.3.745.003k05_745_755. ISSN 1528-0020. PMID 10648382.
- ^ a b c d e f g h i Newton AL, Sharpe BK, Kwan A, Mackay JP, Crossley M (May 2000). "The transactivation domain within cysteine/histidine-rich region 1 of CBP comprises two novel zinc-binding modules". The Journal of Biological Chemistry. 275 (20): 15128–15134. doi:10.1074/jbc.M910396199. PMID 10748221.
- ^ Cantor AB, Orkin SH (May 2002). "Transcriptional regulation of erythropoiesis: an affair involving multiple partners". Oncogene. 21 (21): 3368–3376. doi:10.1038/sj.onc.1205326. PMID 12032775. S2CID 33364155.
- ^ Siddique H, Rao VN, Reddy ES (August 2009). "CBP-mediated post-translational N-glycosylation of BRCA2". International Journal of Oncology. 35 (2): 387–391. doi:10.3892/ijo_00000351. PMID 19578754.
- ^ a b Ait-Si-Ali S, Ramirez S, Barre FX, Dkhissi F, Magnaghi-Jaulin L, Girault JA, et al. (November 1998). "Histone acetyltransferase activity of CBP is controlled by cycle-dependent kinases and oncoprotein E1A". Nature. 396 (6707): 184–186. Bibcode:1998Natur.396..184A. doi:10.1038/24190. PMID 9823900. S2CID 4340781.
- ^ Zhang H, Kong Q, Wang J, Jiang Y, Hua H (November 2020). "Complex roles of cAMP-PKA-CREB signaling in cancer". Experimental Hematology & Oncology. 9 (1): 32. doi:10.1186/s40164-020-00191-1. PMC 7684908. PMID 33292604.
- ^ Rubin SM, Sage J, Skotheim JM (October 2020). "Integrating Old and New Paradigms of G1/S Control". Molecular Cell. 80 (2): 183–192. doi:10.1016/j.molcel.2020.08.020. PMC 7582788. PMID 32946743.
- ^ a b Bodrug T, Welsh KA, Hinkle M, Emanuele MJ, Brown NG (2021-05-24). "Intricate Regulatory Mechanisms of the Anaphase-Promoting Complex/Cyclosome and Its Role in Chromatin Regulation". Frontiers in Cell and Developmental Biology. 9: 687515. doi:10.3389/fcell.2021.687515. PMC 8182066. PMID 34109183.
- ^ a b c Turnell AS, Stewart GS, Grand RJ, Rookes SM, Martin A, Yamano H, et al. (December 2005). "The APC/C and CBP/p300 cooperate to regulate transcription and cell-cycle progression". Nature. 438 (7068): 690–695. Bibcode:2005Natur.438..690T. doi:10.1038/nature04151. PMID 16319895. S2CID 4432156.
- ^ Van Gils J, Magdinier F, Fergelot P, Lacombe D (June 2021). "Rubinstein-Taybi Syndrome: A Model of Epigenetic Disorder". Genes. 12 (7): 968. doi:10.3390/genes12070968. PMC 8303114. PMID 34202860.
- ^ Kim C, Yousefian-Jazi A, Choi SH, Chang I, Lee J, Ryu H (November 2021). "Non-Cell Autonomous and Epigenetic Mechanisms of Huntington's Disease". International Journal of Molecular Sciences. 22 (22): 12499. doi:10.3390/ijms222212499. PMC 8617801. PMID 34830381.
- ^ a b c Wang Y, Xie Q, Tan H, Liao M, Zhu S, Zheng LL, et al. (November 2021). "Targeting cancer epigenetic pathways with small-molecule compounds: Therapeutic efficacy and combination therapies". Pharmacological Research. 173: 105702. doi:10.1016/j.phrs.2021.105702. PMID 34102228. S2CID 235378858.
- ^ a b Akinsiku OE, Soremekun OS, Olotu FA, Soliman ME (2020). "Exploring the Role of Asp1116 in Selective Drug Targeting of CREBcAMP- Responsive Element-binding Protein Implicated in Prostate Cancer". Combinatorial Chemistry & High Throughput Screening. 23 (3): 178–184. doi:10.2174/1386207323666200219122057. PMID 32072894. S2CID 211193693.
- ^ a b c Waddell AR, Huang H, Liao D (June 2021). "CBP/p300: Critical Co-Activators for Nuclear Steroid Hormone Receptors and Emerging Therapeutic Targets in Prostate and Breast Cancers". Cancers. 13 (12): 2872. doi:10.3390/cancers13122872. PMC 8229436. PMID 34201346.
- ^ "The CREB-binding protein (CBP)/β-catenin inhibitor E7386, co-created by Eisai and PRISM BioLab, achieved the clinical POC (Proof of Concept) News Release:2021 Eisai Co., Ltd". www.eisai.com. Retrieved 2021-12-04.
- ^ Romero FA, Murray J, Lai KW, Tsui V, Albrecht BK, An L, et al. (November 2017). "GNE-781, A Highly Advanced Potent and Selective Bromodomain Inhibitor of Cyclic Adenosine Monophosphate Response Element Binding Protein, Binding Protein (CBP)". Journal of Medicinal Chemistry. 60 (22): 9162–9183. doi:10.1021/acs.jmedchem.7b00796. PMID 28892380.
- ^ Farria A, Li W, Dent SY (September 2015). "KATs in cancer: functions and therapies". Oncogene. 34 (38): 4901–4913. doi:10.1038/onc.2014.453. PMC 4530097. PMID 25659580.
- ^ Yin S, Kaluz S, Devi NS, Jabbar AA, de Noronha RG, Mun J, et al. (December 2012). "Arylsulfonamide KCN1 inhibits in vivo glioma growth and interferes with HIF signaling by disrupting HIF-1α interaction with cofactors p300/CBP". Clinical Cancer Research. 18 (24): 6623–6633. doi:10.1158/1078-0432.CCR-12-0861. PMC 3518680. PMID 22923450.
추가 읽기
- Goldman PS, Tran VK, Goodman RH (1997). "The multifunctional role of the co-activator CBP in transcriptional regulation". Recent Progress in Hormone Research. 52: 103–19, discussion 119–20. PMID 9238849.
- Marcello A, Zoppé M, Giacca M (March 2001). "Multiple modes of transcriptional regulation by the HIV-1 Tat transactivator". IUBMB Life. 51 (3): 175–181. doi:10.1080/152165401753544241. PMID 11547919. S2CID 10931640.
- Matt T (2002). "Transcriptional control of the inflammatory response: a role for the CREB-binding protein (CBP)". Acta Medica Austriaca. 29 (3): 77–79. doi:10.1046/j.1563-2571.2002.02010.x. PMID 12168567.
- Combes R, Balls M, Bansil L, Barratt M, Bell D, Botham P, et al. (2002). "An assessment of progress in the use of alternatives in toxicity testing since the publication of the report of the second FRAME Toxicity Committee (1991)". Alternatives to Laboratory Animals. 30 (4): 365–406. doi:10.1177/026119290203000403. PMID 12234245. S2CID 26326825.
- Minghetti L, Visentin S, Patrizio M, Franchini L, Ajmone-Cat MA, Levi G (May 2004). "Multiple actions of the human immunodeficiency virus type-1 Tat protein on microglial cell functions". Neurochemical Research. 29 (5): 965–978. doi:10.1023/B:NERE.0000021241.90133.89. PMID 15139295. S2CID 25323034.
- Kino T, Pavlakis GN (April 2004). "Partner molecules of accessory protein Vpr of the human immunodeficiency virus type 1". DNA and Cell Biology. 23 (4): 193–205. doi:10.1089/104454904773819789. PMID 15142377.
- Greene WC, Chen LF (2004). "Regulation of NF-kappaB action by reversible acetylation". Novartis Foundation Symposium. Novartis Foundation Symposia. 259: 208–17, discussion 218–25. doi:10.1002/0470862637.ch15. ISBN 9780470862612. PMID 15171256.
- Liou LY, Herrmann CH, Rice AP (September 2004). "HIV-1 infection and regulation of Tat function in macrophages". The International Journal of Biochemistry & Cell Biology. 36 (9): 1767–1775. doi:10.1016/j.biocel.2004.02.018. PMID 15183343.
- Pugliese A, Vidotto V, Beltramo T, Petrini S, Torre D (2005). "A review of HIV-1 Tat protein biological effects". Cell Biochemistry and Function. 23 (4): 223–227. doi:10.1002/cbf.1147. PMID 15473004. S2CID 8408278.
- Bannwarth S, Gatignol A (January 2005). "HIV-1 TAR RNA: the target of molecular interactions between the virus and its host". Current HIV Research. 3 (1): 61–71. doi:10.2174/1570162052772924. PMID 15638724.
- Le Rouzic E, Benichou S (February 2005). "The Vpr protein from HIV-1: distinct roles along the viral life cycle". Retrovirology. 2: 11. doi:10.1186/1742-4690-2-11. PMC 554975. PMID 15725353.
- Gibellini D, Vitone F, Schiavone P, Re MC (April 2005). "HIV-1 tat protein and cell proliferation and survival: a brief review". The New Microbiologica. 28 (2): 95–109. PMID 16035254.
- Hetzer C, Dormeyer W, Schnölzer M, Ott M (October 2005). "Decoding Tat: the biology of HIV Tat posttranslational modifications". Microbes and Infection. 7 (13): 1364–1369. doi:10.1016/j.micinf.2005.06.003. PMID 16046164.
- Peruzzi F (January 2006). "The multiple functions of HIV-1 Tat: proliferation versus apoptosis". Frontiers in Bioscience. 11: 708–717. doi:10.2741/1829. PMID 16146763. S2CID 12438136.
외부 링크
- 루빈스타인-타이비 증후군에 대한 GeneReviews/NCBI/NIH/UW 입력
- CREBBP+단백질,+인간, 미국 국립 의학 도서관의 의학 과목 제목(MesH)
- 누르사 C39
- 드로필라 네지레 - 인터랙티브 플라이
- UCSC 게놈 브라우저의 인간 CREBBP 게놈 위치 및 CREBP 유전자 세부 정보 페이지.
이 기사는 공공영역에 있는 미국 국립 의학 도서관의 텍스트를 통합하고 있다.