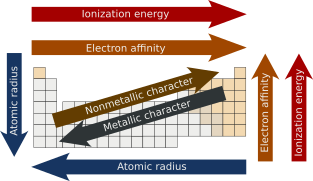
주기적인 경향
Periodic trends주기적 경향은 주기율표에 나타나는 특정 패턴으로 특정 원소의 다양한 측면을 나타냅니다.그것들은 1863년 러시아의 화학자 드미트리 멘델레예프에 의해 발견되었다.주요 주기적 경향은 원자 반지름, 이온화 에너지, 전자 친화력, 전기 음성도, 원자가 및 금속 특성을 포함한다.이러한 경향은 각각의 소그룹 또는 기간 내에 원소의 전자 구성이 유사하고 원소의 주기적인 특성 때문에 존재한다.이것들은 각 [1][2]요소의 특성에 대한 정성적 평가를 제공한다.
요약
| 정기 속성 | 기간 전반 | 다운더그룹 |
|---|---|---|
| 원자 반지름 | 감소하다 | 증가한다 |
| 이온화 에너지 | 증가한다 | 감소하다 |
| 전자 친화성 | 증가한다 | 감소하다 |
| 전기 음성도 | 증가한다 | 감소하다 |
| 발란시 | 처음에 증가했다가 감소하다 | 일정한 |
| 비금속 문자 | 증가한다 | 감소하다 |
| 금속 문자 | 감소하다 | 증가한다 |
원자 반지름
원자 반경은 원자핵에서 원자 내 가장 바깥쪽 전자 궤도까지의 거리이다.일반적으로 원자 반경은 일정 기간 동안 왼쪽에서 오른쪽으로 이동함에 따라 감소하며, 그룹을 내려가면 증가합니다.이것은 주기적으로, 원자가 전자는 같은 최외각 안에 있기 때문입니다.원자번호는 왼쪽에서 오른쪽으로 이동하면서 같은 기간 동안 증가하며, 이는 다시 유효 핵전하를 증가시킨다.인력의 증가는 원소의 원자 반경을 감소시킨다.그룹을 아래로 이동하면 새로운 [3][4]셸이 추가되어 원자 반경이 증가합니다.
이온화 에너지
이온화 에너지는 기체 원자 또는 이온에 있는 전자가 핵의 힘의 영향에서 벗어나기 위해 흡수해야 하는 최소한의 에너지 양입니다.이온화 전위라고도 합니다.첫 번째 이온화 에너지는 중성 원자로부터 첫 번째 전자를 제거하는 데 필요한 에너지의 양입니다.중성 원자로부터 두 번째 전자를 제거하기 위해 필요한 에너지는 두 번째 이온화 에너지라고 불립니다.[5]
추세에 따라 현대 주기율표의 기간에 걸쳐 왼쪽에서 오른쪽으로 이동하면 핵 전하 증가 및 원자 크기 감소에 따라 이온화 에너지가 증가한다.원자크기의 감소는 전자와 핵 사이의 더 강력한 흡인력을 낳는다.단, 한 그룹이 아래로 이동한다고 가정합니다.이 경우 원자가 셸을 첨가함으로써 원자 크기가 커짐에 따라 이온화 에너지가 감소하여 [6][7]전자에 대한 핵의 흡인력이 감소한다.
전자 친화력
중성 가스 원자에 음이온을 형성하기 위해 전자가 추가될 때 방출되는 에너지는 전자 [8]친화력으로 알려져 있습니다.추세에 따라 일정 기간에 걸쳐 왼쪽에서 오른쪽으로 진행됨에 따라 핵 전하 증가 및 원자 크기 감소에 따라 전자 친화력이 증가하여 핵과 추가된 전자의 흡인력이 더욱 강력해진다.단, 한 그룹이 아래로 이동한다고 가정합니다.이 경우 원자가 셸을 첨가함으로써 원자 크기가 커짐에 따라 전자 친화력이 감소하여 전자에 대한 핵의 흡인력이 감소한다.불소가 가장 큰 전자 친화력을 가져야 한다고 생각될 수 있지만, 불소의 작은 크기는 전자들 사이에서 충분한 반발을 일으켜 할로겐족 [9]중에서 가장 높은 전자 친화력을 가진 염소를 생성한다.
전기 음성도
분자 내 원자가 한 쌍의 전자를 자기 쪽으로 끌어당기는 경향은 전기음성도로 알려져 있다.그것은 단지 [10]경향이기 때문에 차원이 없는 재산이다.전기음성도를 측정하기 위해 가장 일반적으로 사용되는 척도는 라이너스 폴링에 의해 설계했다.그 저울은 그를 기리기 위해 폴링 저울이라고 명명되었다.이 척도에 따르면 불소는 가장 전기음성원소이고 세슘은 가장 전기음성원소이다.[11]
경향적으로 보면, 현대 주기율표의 기간에 걸쳐 왼쪽에서 오른쪽으로 이동함에 따라, 전기 음성도는 핵 전하 증가 및 원자 크기 감소에 따라 증가한다.그러나 집단으로 이동하면 원자가 껍데기의 추가에 의해 원자 크기가 커짐에 따라 전기음성도가 감소하여 [12]전자에 대한 원자의 흡인력이 감소한다.
그러나 그룹 XIII(보론 패밀리)에서 전기음성도는 먼저 붕소에서 알루미늄으로 감소한 후 그룹 아래로 증가합니다.원자크기는 군을 내려갈수록 증가하지만 동시에 내부 d전자와 f전자의 차폐 불량으로 인해 유효핵전하가 증가하기 때문이다.그 결과, 전자에 대한 핵의 흡인력이 증가하고, 따라서 전기음성도가 알루미늄에서 [13][14]탈륨으로 증가한다.
발란시
원소의 원자가는 안정적인 전자 구성을 얻기 위해 원자가 잃거나 얻어야 하는 전자의 수입니다.간단히 말해서, 화학 화합물을 형성하기 위한 원소의 결합 능력을 측정하는 것입니다.가장 바깥쪽 껍질에서 발견되는 전자는 일반적으로 원자가 전자로 알려져 있다. 원자가 전자의 수는 [15][16]원자의 원자를 결정한다.
추세에 따르면, 어떤 주기에 걸쳐 왼쪽에서 오른쪽으로 이동하는 동안, 원소의 원자가 전자 수는 증가하며 1~8개 사이에서 변화합니다.하지만 원소의 원자가가 처음에는 1에서 4로 증가하다가 우리가 희가스에 도달하면 0으로 감소합니다.하지만, 우리가 집단으로 이동함에 따라, 원자가 전자의 수는 변하지 않습니다.따라서 특정 그룹의 모든 요소는 동일한 원가를 가집니다.그러나 이러한 주기적 경향은 특히 F 블록과 전이 금속의 경우 무거운 원소에 대해 희박하게 나타난다.이들 원소는 두 번째 궤도로서 d-궤도를 가지며, 가장 바깥쪽 궤도로서 s-궤도를 가지므로 가변적인 원자가를 나타낸다.이러한 (n-1)d 및 ns 궤도의 에너지는 상대적으로 [17][18]가깝다.
금속 및 비금속 특성
금속 특성은 일반적으로 원자핵과 가장 바깥쪽 전자 사이의 흡인력이 감소하면 이러한 전자가 느슨하게 결합되어 열과 전기를 전도할 수 있기 때문에 그룹을 감소시킵니다.왼쪽에서 오른쪽으로, 각각의 기간에 걸쳐, 핵과 가장 바깥쪽 전자 사이의 증가하는 인력은 금속 특성을 감소시킵니다.반면 비금속 특성은 그룹을 줄이고 기간에 [19][20]따라 증가합니다.
「 」를 참조해 주세요.
레퍼런스
- ^ The Periodic Table I. doi:10.1007/978-3-030-40025-5.
- ^ Schrobilgen, Gary J. (2019), Mingos, D. Michael P. (ed.), "Chemistry at the Edge of the Periodic Table: The Importance of Periodic Trends on the Discovery of the Noble Gases and the Development of Noble-Gas Chemistry", The Periodic Table I: Historical Development and Essential Features, Cham: Springer International Publishing, pp. 157–196, doi:10.1007/430_2019_49, ISBN 978-3-030-40025-5, retrieved 2022-07-02
- ^ "atomic and ionic radius". www.chemguide.co.uk. Retrieved 2022-06-30.
- ^ Huggins, Maurice L. (1922-04-01). "Atomic Radii. I". Physical Review. 19 (4): 346–353. doi:10.1103/PhysRev.19.346.
- ^ "7.4: Ionization Energy". Chemistry LibreTexts. 2014-11-18. Retrieved 2022-07-02.
- ^ "Ionization Energy Trend Science Trends". sciencetrends.com. 2018-05-18. Retrieved 2022-07-02.
- ^ Zadeh, Dariush H. (2019-07-26). "Atomic shells according to ionization energies". Journal of Molecular Modeling. 25 (8): 251. doi:10.1007/s00894-019-4112-6. ISSN 0948-5023.
- ^ Gooch, Jan W., ed. (2007), "Electron affinity", Encyclopedic Dictionary of Polymers, New York, NY: Springer, pp. 350–350, doi:10.1007/978-0-387-30160-0_4245, ISBN 978-0-387-30160-0, retrieved 2022-07-02
- ^ "Electron Affinity Trend Science Trends". sciencetrends.com. 2018-05-14. Retrieved 2022-07-02.
- ^ Chemistry (IUPAC), The International Union of Pure and Applied. "IUPAC - electronegativity (E01990)". goldbook.iupac.org. doi:10.1351/goldbook.e01990. Retrieved 2022-06-30.
- ^ Bickmore, Barry R.; Wander, Matthew C. F. (2018), White, William M. (ed.), "Electronegativity", Encyclopedia of Geochemistry: A Comprehensive Reference Source on the Chemistry of the Earth, Cham: Springer International Publishing, pp. 442–444, doi:10.1007/978-3-319-39312-4_222, ISBN 978-3-319-39312-4, retrieved 2022-06-30
- ^ Mullay, John (1987), Sen, Kali Das; Jørgensen, C. K. (eds.), "Estimation of atomic and group electronegativities", Electronegativity, Berlin/Heidelberg: Springer-Verlag, vol. 66, pp. 1–25, doi:10.1007/bfb0029834, ISBN 978-3-540-17740-1, retrieved 2022-06-30
- ^ "21.1: The Elements of Group 13". Libretexts. 2013-11-26. Retrieved 2022-06-30.
- ^ Franz, Daniel; Inoue, Shigeyoshi (2016). "Advances in the development of complexes that contain a group 13 element chalcogen multiple bond". Dalton Transactions. 45 (23): 9385–9397. doi:10.1039/C6DT01413E. ISSN 1477-9226.
- ^ Manutchehr-Danai, Mohsen, ed. (2009), "valency", Dictionary of Gems and Gemology, Berlin, Heidelberg: Springer, pp. 899–899, doi:10.1007/978-3-540-72816-0_22746, ISBN 978-3-540-72816-0, retrieved 2022-07-02
- ^ Vohr, Hans-Werner, ed. (2016), "Valency", Encyclopedia of Immunotoxicology, Berlin, Heidelberg: Springer, pp. 947–947, doi:10.1007/978-3-642-54596-2_201542, ISBN 978-3-642-54596-2, retrieved 2022-07-02
- ^ Valency. doi:10.1007/978-1-4612-6262-6.
- ^ O’Dwyer, M. F.; Kent, J. E.; Brown, R. D. (1978), O’Dwyer, M. F.; Kent, J. E.; Brown, R. D. (eds.), "Many-electron Atoms", Valency, New York, NY: Springer, pp. 59–86, doi:10.1007/978-1-4612-6262-6_4, ISBN 978-1-4612-6262-6, retrieved 2022-07-02
- ^ Daw, Murray S.; Foiles, Stephen M.; Baskes, Michael I. (1993-03-01). "The embedded-atom method: a review of theory and applications". Materials Science Reports. 9 (7): 251–310. doi:10.1016/0920-2307(93)90001-U. ISSN 0920-2307.
- ^ "C9.1 – Periodic Trends". IGCSE AID. 2018-03-05. Retrieved 2022-07-02.