동위원소
Isotope| 핵물리학 |
|---|
 |
| 핵·핵자(p, n)·핵물질·핵력·핵구조·핵반응 |
동위원소는 원자번호(핵에 있는 양성자의 수)가 같고 주기율표에서 위치가 동일하며(따라서 동일한 화학 원소에 속함), 핵에 있는 중성자의 수가 다르기 때문에 핵자 번호(질량 번호)가 다른 두 가지 이상의 원자이다.주어진 원소의 모든 동위원소는 거의 동일한 화학적 성질을 가지고 있지만, 원자 질량과 물리적 [1]성질은 다르다.
The term isotope is formed from the Greek roots isos (ἴσος "equal") and topos (τόπος "place"), meaning "the same place"; thus, the meaning behind the name is that different isotopes of a single element occupy the same position on the periodic table.[2]그것은 1913년 스코틀랜드의 의사이자 작가인 마가렛 토드가 영국의 화학자 프레드릭 [3]소디에게 제안하여 만들었다.
원자의 핵 안에 있는 양성자의 수는 원자 번호라고 불리며 중성 원자에 있는 전자 수와 같습니다.각 원자 번호는 특정 원소를 식별하지만 동위원소는 식별하지 않는다. 특정 원소의 원자는 중성자 수가 광범위할 수 있다.핵에 있는 핵자의 수(양자와 중성자 모두)는 원자의 질량수이며, 주어진 원소의 각 동위원소는 다른 질량수를 가진다.
예를 들어 탄소-12, 탄소-13, 탄소-14는 질량수 12, 13, 14의 원소 탄소 동위원소이다.탄소의 원자 번호는 6이고, 이것은 모든 탄소 원자가 6개의 양성자를 가지고 있기 때문에 이 동위원소들의 중성자 번호는 각각 6, 7, 그리고 8입니다.
동위원소 대 핵종
핵종은 원자핵에 특정한 수의 양성자와 중성자를 가진 원자의 종이다. 예를 들어 6개의 양성자와 7개의 중성자를 가진 탄소-13이다.핵종 개념(개별 핵종을 지칭)은 화학적 특성보다 핵 특성을 강조하는 반면, 동위원소 개념(각 원소의 모든 원자를 그룹화)은 핵보다 화학을 강조한다.중성자 수는 핵 특성에 큰 영향을 미치지만 대부분의 원소에서는 화학적 특성에 미치는 영향은 무시할 수 있다.원자 번호에 대한 중성자 수의 비율이 동위원소 간에 가장 큰 차이를 보이는 가장 가벼운 원소라도, 어떤 상황에서는 문제가 되지만, 보통 작은 영향만을 갖는다(가장 가벼운 원소인 수소의 경우, 동위원소 효과는 생물학에 강하게 영향을 미칠 만큼 충분히 크다).동위원소(원래는 동위원소,[4] 때로는 동위원소 핵종[5])라는 용어는 비교(동의어 또는 이성질체)를 암시하기 위한 것이다.예를 들어 핵종
C, C
, C는
동위원소(원자번호는 같지만 질량번호는[6] 다른 핵종)이지만
Ar, K
, Ca는
이소바르(질량번호가[7] 같은 핵종)이다.그러나 동위원소는 오래된 용어이므로 핵종보다 더 잘 알려져 있으며, 핵종 기술이나 핵의학과 같이 핵종이 더 적합할 수 있는 맥락에서 여전히 사용된다.
표기법
동위원소 및/또는 핵종은 특정 원소의 이름(이는 원자번호를 나타냄)에 이어 하이픈과 질량 번호(예를 들어 헬륨-3, 헬륨-4, 탄소-12, 우라늄-235 및 우라늄-239)[8]로 지정된다.예를 들어 탄소에 "C"를 사용하는 경우, 표준 표기법(A는 질량 번호, Z는 원자 번호, E는 원소 번호이기 때문에 "AZE 표기법"으로 알려짐)은 화학 기호의 왼쪽 상단에 있는 질량 번호(핵자 수)를 나타내며, 하단에는 첨자가 있는 원자 번호를 나타낸다.t(예: He
, He
, C, C
, U
, U
)[9]원자번호는 원소기호에 의해 주어지기 때문에 위첨자에는 질량번호만 기재하고 원자번호 첨자(He, He
, C
, C
, U
, U
등
)는 생략하는 것이 일반적입니다.(최저 에너지 지상 상태와 대조적으로) 핵 이성질체 또는 에너지로 들뜬 핵 상태를 나타내기 위해 질량 번호 뒤에 문자 m이 추가되는 경우가 있다. 예를 들어
Ta(탄탈럼-180m)이다.
AZE 표기법의 일반적인 발음은 표기법과 다릅니다.4
2그는
보통 4-2헬륨 대신 헬륨-4로 발음되고
, U는 235-92-우라늄 대신 우라늄-2-35로 발음된다.
방사성, 원시, 안정 동위원소
일부 동위원소/핵종은 방사성 동위원소 또는 방사성핵종이라고 하며, 다른 동위원소/핵종은 방사성 붕괴가 관측된 적이 없으며 안정적인 동위원소 또는 안정적인 핵종이라고 한다.예를 들어, C는
탄소의 방사성 형태이고
, C와
C는 안정적인 동위원소이다.지구에는 [10]약 339개의 자연발생 핵종이 있으며, 그 중 286개가 원시 핵종이며, 이는 태양계가 형성된 이래로 존재해왔다는 것을 의미한다.
원시핵종에는 반감기가 매우 긴 34개의 핵종(1억 년 이상)과 붕괴가 관찰되지 않았기 때문에 공식적으로 "안정적인 핵종"[10]으로 간주되는 252개가 포함된다.대부분의 경우, 분명한 이유로, 원소가 안정적인 동위원소를 가지고 있다면, 그러한 동위원소는 지구와 태양계에서 발견되는 원소 풍부함에서 우세하다.단, 세 가지 원소(텔루르, 인듐, 레늄)의 경우 자연에서 가장 풍부한 동위원소는 하나 이상의 안정적인 동위원소를 가지고 있음에도 불구하고 실제로 원소의 매우 긴 수명 방사성 동위원소 1개(또는 2개이다.
이론은 많은 "안정적인" 동위원소/핵종이 매우 긴 반감기를 가진 방사능을 가지고 있다고 예측한다. (결국 모든 핵종을 불안정하게 만들 양성자 붕괴 가능성을 배제한다.)어떤 안정된 핵종들은 이론적으로 알파 붕괴나 이중 베타 붕괴와 같은 다른 알려진 형태의 붕괴에 에너지적으로 영향을 받기 쉽지만, 붕괴 생성물은 아직 관찰되지 않았기 때문에 이 동위원소들은 "관찰적으로 안정적인" 것으로 알려져 있다.이러한 핵종의 예측 반감기는 종종 우주의 추정 나이를 크게 초과하며, 실제로 우주의 나이보다 반감기가 긴 31개의 알려진 방사성핵종(원시 핵종 참조)도 있다.
인공적으로 생성된 방사성 핵종까지 더하면 현재 알려진 [11]핵종은 3339개다.여기에는 안정적이거나 반감기가 60분 이상인 905개의 핵종이 포함됩니다.자세한 내용은 핵종 목록을 참조하십시오.
역사
방사성 동위원소
동위원소의 존재는 1913년 방사화학자인 프레데릭 소디가 우라늄과 납 사이에 방사성 원소(방사성 원소)라고 불리는 약 40종의 방사성 붕괴 사슬에 대한 연구를 바탕으로 처음 제안했다. 그러나 주기율표는 납과 우라늄 함유물 사이의 11개 원소에만 허용된다.ve를 클릭합니다.[12][13][14]
이 새로운 방사성 원소를 화학적으로 분리하려는 몇 가지 시도는 실패했다.[15]예를 들어, 소디는 1910년에 메소토륨(나중에 Ra로 밝혀짐), 라듐(226Ra, 최장수 동위원소), 토륨 X(224Ra)가 [16]분리될 수 없다는 것을 보여주었다.주기율표에 방사성 원소를 배치하려는 시도는 1913년 소디와 카지미에즈 파얀스가 독립적으로 방사성 변위 법칙을 제안하도록 이끌었는데, 이는 알파 붕괴가 주기율표의 왼쪽에 두 자리 원소를 생성하는 반면, 베타 붕괴 방출은 오른쪽에 [17][18][19][20]한 자리 원소를 생성했다는 취지의 것이었다.소디는 알파 입자와 두 개의 베타 입자의 방출이 화학적으로 초기 원소와 동일하지만 질량이 4단위가 가볍고 다른 방사능 특성을 가진 원소의 형성을 초래한다는 것을 알아냈다.
소디는 (방사능 특성에서 확산되는) 여러 유형의 원자가 표에서 [14]같은 위치를 차지할 수 있다고 제안했다.예를 들어 우라늄-235의 알파 붕괴는 토륨-231을 형성하고 악티늄-230의 베타 붕괴는 토륨-230을 [15]형성한다.그리스어로 "같은 장소에서"[14]를 뜻하는 "이소토프"라는 용어는 스코틀랜드 의사이자 가족 친구인 마가렛 토드가 [16][21][22][23][24][25]소디에게 자신의 생각을 설명하는 대화 중에 제안되었다.그는 [26]동위원소에 대한 연구로 1921년 노벨 화학상을 받았다.
1914년 T. W. Richards는 다른 방사능 기원에 [15][26]의한 동위원소 조성의 변화에 기인하는 다양한 광물원으로부터의 납의 원자량 사이의 변화를 발견했다.
안정 동위원소
안정적(비방사성) 원소의 다중 동위원소에 대한 첫 번째 증거는 1912년 J. J. 톰슨에 의해 운하선(양성 이온)[27][28]의 구성에 대한 탐구의 일환으로 발견되었다.Thomson은 평행한 자기장과 전기장을 통해 네온 이온의 흐름을 채널링하고, 경로에 사진 플레이트를 배치하여 편향을 측정했으며, Thomson의 포물선 방법이라고 알려진 방법을 사용하여 질량 대 전하 비율을 계산했습니다.각각의 물줄기는 접시에 부딪힌 지점에서 빛나는 반점을 만들어 냈다.톰슨은 사진판(이미지 참조)에서 두 개의 분리된 포물선 모양의 빛을 관찰했는데, 이는 전하 대비 질량이 다른 두 종류의 핵을 제안했다.
F. W. 애스턴은 질량분석기를 사용하여 다수의 원소에 대해 안정적인 동위원소를 여러 개 발견했다.1919년 애스턴은 네온을 충분한 분해능으로 연구하여 두 동위원소 질량이 정수 20과 22에 매우 가깝고 둘 다 네온 가스의 알려진 몰 질량(20.2)과 같지 않다는 것을 보여주었다.이것은 동위원소 질량에 대한 애스턴의 정수 법칙의 한 예로서, 정수에 대한 원소 몰 질량의 큰 편차는 원소가 동위원소의 혼합이라는 사실에 주로 기인한다.Aston도 마찬가지로[when?] 염소 몰 질량(35.45)이 두 동위원소 Cl과 [29]Cl에 대한 거의 적분 질량의 가중 평균임을 보여주었다.
동위원소 간 특성 변화
화학적 및 분자적 특성
중성 원자는 양성자와 같은 수의 전자를 가지고 있다.따라서 주어진 원소의 다른 동위원소들은 모두 같은 수의 전자를 가지고 있고 비슷한 전자 구조를 공유한다.원자의 화학적 거동은 주로 원자의 전자 구조에 의해 결정되기 때문에, 다른 동위원소들은 거의 동일한 화학적 거동을 보인다.
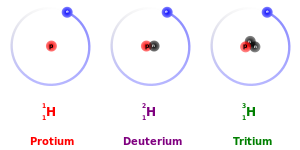
이것의 주된 예외는 운동 동위원소 효과이다: 더 무거운 동위원소는 같은 원소의 더 가벼운 동위원소보다 약간 더 느리게 반응하는 경향이 있다.이는 프로튬(H),1
[30] 중수소(2
H
), 삼중수소(3
H
)에서 가장 두드러진다. 중수소는 프로튬의 질량이 두 배이고 삼중수소는 프로튬의 질량이 세 배이기 때문이다.이러한 질량 차이는 원자 시스템의 무게 중심을 변화시킴으로써 각각의 화학 결합의 거동에 영향을 미칩니다.그러나 무거운 원소의 경우 동위원소 간의 상대적 질량 차이가 훨씬 작기 때문에 화학에 미치는 질량 차이는 보통 무시할 수 있다.(또한 무거운 원소는 가벼운 원소에 비해 상대적으로 더 많은 중성자를 가지고 있기 때문에 전체 전자 질량에 대한 핵 질량의 비율은 약간 더 크다.)평형 동위원소 효과도 있다.
마찬가지로, 원자의 동위원소만 다른 두 분자는 동일한 전자 구조를 가지고 있기 때문에 물리적, 화학적 특성을 거의 구별할 수 없다. (또한 중수소와 삼중수소가 주요 예외이다.)분자의 진동 모드는 그 모양과 구성 원자의 질량에 의해 결정됩니다. 그래서 다른 등방체는 서로 다른 진동 모드를 가집니다.진동 모드는 분자가 대응하는 에너지의 광자를 흡수할 수 있도록 하기 때문에, 등방체는 적외선 범위에서 다른 광학 특성을 가집니다.
핵의 특성과 안정성
원자핵은 양성자와 중성자가 남아 있는 강한 힘에 의해 결합되어 있다.양성자는 양전하를 띠기 때문에 서로 밀어낸다.전기적으로 중성인 중성자는 두 가지 방법으로 핵을 안정시킨다.그들의 공존은 양성자를 약간 밀어내고 양성자 사이의 정전적 반발을 줄여주며, 그들은 서로와 양성자에게 매력적인 핵력을 가합니다.이러한 이유로, 두 개 이상의 양성자가 핵에 결합하기 위해서는 하나 이상의 중성자가 필요하다.양성자의 수가 증가함에 따라 중성자 대 양성자의 비율도 안정적인 핵을 보장하기 위해 필요합니다(오른쪽 그래프 참조).예를 들어 He의
중성자:양성자비는 1:2이지만 U의
중성자:양성자비는 3:2보다 크다.다수의 가벼운 원소는 1:1(Z = N)의 비율로 안정적인 핵종을 가지고 있다.핵종
Ca(칼슘-40)는 관측상 중성자와 양성자의 수가 같은 가장 무거운 안정 핵종이다.칼슘-40보다 무거운 모든 안정된 핵종은 양성자보다 더 많은 중성자를 포함하고 있다.
원소당 동위원소 수
안정 동위원소를 가진 80개의 원소 중 어떤 원소에 대해 관측된 안정 동위원소 수가 10개(주석 원소)이다.어떤 원소도 9~8개의 안정 동위원소를 가지고 있지 않다.5요소, 86안정 동위 원소, 5시 5분 전 안정 동위 원소, 94안정 동위 원소, 53안정 동위 원소, 16두 안정 동위 원소가 있(안정적인 나라로 180m73Ta 계수)이 있고, 26요소 이(의 단일 안정 동위 원소, 19은 소위mononuclidic 요소를 단일 prim를 하는 7안정 동위 원소다.ordial 자연 원소의 원자량을 지배하고 고정하는 안정 동위원소. [31]3개의 방사성 단핵 원소도 발생한다.)붕괴가 관측되지 않은 핵종은 모두 252개입니다.안정 동위원소가 1개 이상 있는 80개 원소의 경우 안정 동위원소의 평균 수는 252/80 = 3.15개이다.
짝수 및 홀수 핵자 수
| p, n | EE | OO | EO | OE | 총 |
|---|---|---|---|---|---|
| 안정적인. | 146 | 5 | 53 | 48 | 252 |
| 장수 | 22 | 4 | 3 | 5 | 34 |
| 모두 원시 | 168 | 9 | 56 | 53 | 286 |
양성자: 중성자 비율은 핵 안정성에 영향을 미치는 유일한 요인이 아니다.또한 원자 번호 Z, 중성자 번호 N, 그리고 결과적으로 질량 번호 A의 짝수 또는 홀수에도 의존한다.Z와 N의 홀수성은 핵 결합 에너지를 감소시키는 경향이 있으며, 일반적으로 홀수 핵을 덜 안정적으로 만든다.인접한 핵들, 특히 홀수 A 이소바의 핵결합 에너지의 이 놀라운 차이는 중요한 결과를 가져온다. 베타 붕괴(양전자 방출 포함), 전자 포획 또는 자발적 핵분열 및 클러스터 de와 같은 기타 덜 일반적인 붕괴 모드에 의해 중성자 또는 양성자의 수가 최적이 아닌 불안정한 동위원소이다.케이
안정적인 핵종의 대부분은 짝수 양성자이며, 모든 숫자 Z, N 및 A가 짝수입니다.홀수 A 안정핵종은 홀수-짝수-중성자와 짝수-짝수-중성자 핵종으로 나뉩니다.안정적인 홀수-프로톤-홀수-중성자 핵이 가장 흔하지 않다.
짝수 원자 번호
146개의 짝수-양성자, 짝수-중성자(EE) 핵종은 안정적인 모든 핵종의 약 58%를 구성하며 쌍으로 인해 모두 스핀 0을 가집니다.또한 24개의 원시적인 긴 수명 짝수 핵종이 있다.그 결과, 2~82의 41개의 짝수 원소 각각은 적어도 1개의 안정 동위원소를 가지며, 이들 원소의 대부분은 여러 개의 원시 동위원소를 가진다.이 짝수 원소들의 절반은 6개 이상의 안정적인 동위원소를 가지고 있다.양성자 2개와 중성자 2개의 이중 쌍으로 인한 헬륨-4의 극한 안정성은 5
25개의
(He, Li
) 또는 8
48개의
(Be) 핵자를 포함하는 핵종이 항성의 핵융합을 통해 무거운 원소를 생성하기 위한 플랫폼 역할을 할 만큼 충분히 오랫동안 존재하는 것을 막는다(3중 알파 과정 참조).
| 붕괴 | 반감기 | |
|---|---|---|
| 113 48CD | 베타. | 7.7×1015 a |
| 147 62SM | 알파 | 1.06×1011 a |
| 235 92U | 알파 | 7.04×108 a |
53개의 안정적인 핵종은 짝수의 양성자와 홀수의 중성자를 가지고 있다.이들은 짝수 동위원소보다 약 3배 많은 짝수 동위원소에 비해 소수이다.안정적인 핵종을 가진 41개의 짝수 Z 원소 중 짝수 안정적인 핵종이 없는 원소는 2개(아르곤과 세륨)뿐이다.1개의 원소(주석)는 3개입니다.짝수 핵종이 1개 있는 원소는 24개이고 짝수 핵종이 2개 있는 원소는 13개입니다.35개의 원시 방사성핵종 중 핵분열
U를 포함한 4개의 짝수 핵종(오른쪽 표 참조)이 존재한다. 짝수 핵종은 홀수 중성자 수 때문에 중성자 쌍화 효과의 결과로 발생하는 에너지로 인해 큰 중성자 포획 단면을 갖는 경향이 있다.이러한 안정적인 짝수-양성자 홀수-중성자 핵종은 자연에서 풍부하게 존재하기 때문에 흔치 않은 경향이 있다. 왜냐하면, 일반적으로 원시 풍요를 형성하기 위해서는 중성자 포획을 피해야 하며, 중성자 포획의 s-과정과 r-과정 모두에서 중성자 포획의 안정적인 짝수 동위원소를 형성해야 하기 때문이다.이러한 이유로 Pt와 Be만이
원소
중 가장 자연적으로 풍부한 동위원소이다.
홀수 원자 번호
안정된 홀수-프로톤 짝수-중성자 핵종 48개가 짝수-중성자 핵종 48개로 홀수-프로톤-홀수-중성자 핵종은 홀수-프로톤-홀수-중성자 핵종의 안정적인 동위원소 대부분을 형성한다.Z = 1~81의 홀수 원소는 41개이며, 이 중 39개는 안정적인 동위원소를 가지고 있다(테크네튬(
43Tc
)과 프로메튬(
61Pm
)은 안정적인 동위원소가 없다).이들 39개의 홀수 Z원소 중 30개 원소(중성자 0개가 짝수인 수소-1 포함)는 1개의 안정적인 홀수 동위원소를 가지며,
17 염소
(Cl),
19 칼륨
(K),
29 구리
(Cu),
31갈륨
(Ga),
35브롬
(Br),
47 은
(Ag),
51 안티몬
(Sb),
77이리듐
(Ir),
81탈륨
(Tl) 등 9개 원소는 각각 2개의 안정적인 홀수 동위원소를 가진다.따라서 총 30 + 2(9) = 48개의 안정적인 홀수 짝수 동위원소가 된다.
또한 Rb
, In
, Re
, Eu
, Bi의
5가지 원시 장수명 방사성 홀수 동위원소가 있다.마지막 두 마리는 최근에야 부패한 것으로 밝혀졌으며 반감기는 10년 이상이다18.
5개의 안정적인 핵종만이 홀수 양성자와 홀수 중성자를 모두 포함하고 있다.처음 4개의 "홀수" 핵종은 저질량 핵종에서 발생하며, 양성자를 중성자로 바꾸거나 그 반대로 바꾸면 매우 편향된 양성자-중성자 비율(2
1H
, Li
, B
, N
; 스핀 1, 1, 3, 1)이 된다.유일하게 "안정적인" 홀수 핵종인
Ta(spin 9)는 252개의 안정 동위원소 중 가장 희귀한 것으로 생각되며, 실험 [32]시도에도 불구하고 붕괴되지 않은 유일한 원시 핵 이성질체이다.
상대적으로 반감기가 짧은 많은 홀수 방사성핵종(탄탈-180 등)이 알려져 있다.보통, 그들은 양성자와 중성자를 쌍으로 가진 짝수 이소바 근처까지 베타 붕괴합니다.9개의 원시 홀수 핵종(안정된 5개와 긴 반감기를 가진 방사성 4개) 중 N개만이
공통 원소의 가장 일반적인 동위원소이다.이는 CNO 사이클의 일부이기 때문입니다.핵종 Li와
B는 다른 가벼운 원소에 비해 희귀한 원소들의 소수 동위원소이지만, 나머지 6개의 동위원소들은 원소들의 자연적 풍부함의 극히 일부만을 차지한다.
홀수 중성자 수
| N | 심지어. | 이상한 |
|---|---|---|
| 안정적인. | 194 | 58 |
| 장수 | 27 | 7 |
| 모두 원시 | 221 | 65 |
중성자 번호가 홀수인 악티니드는 일반적으로 핵분열성(열 중성자 포함)이지만, 짝수 중성자 번호는 고속 중성자와 핵분열성이지만 일반적으로 핵분열성이 아니다.관측적으로 안정된 홀수 핵종은 모두 0이 아닌 정수 스핀을 가집니다.이는 단일 무쌍 중성자와 무쌍 양성자가 반정렬 대신 스핀이 정렬(최소 1단위 이상의 총 스핀을 생성)될 경우 서로에 대한 핵력 흡인력이 더 크기 때문이다.이 핵 거동의 가장 간단한 예는 중수소를 참조하십시오.
Pt, Be
, N만이
홀수 중성자 수를 가지며 원소 중 가장 자연적으로 풍부한 동위원소이다.
자연발생
원소는 하나의 핵종(단핵 원소) 또는 둘 이상의 자연 발생 동위원소로 구성됩니다.불안정한 (방사성) 동위원소는 원시 동위원소 또는 사후 원시 동위원소이다.원시 동위원소는 항성 핵합성 또는 우주선 파쇄와 같은 다른 형태의 핵합성의 산물이었으며, 붕괴 속도가 매우 느리기 때문에 현재까지 지속되고 있다(예: 우라늄-238과 칼륨-40).원시 후 동위원소는 우주선 충돌에 의해 우주 발생 핵종(예를 들어, 삼중수소, 탄소-14)으로 생성되거나 방사성 원시 동위원소가 방사성 방사성 핵종 딸(예: 우라늄 대 라듐)로 붕괴됨으로써 생성되었다.일부 동위원소는 자연 핵분열로 인한 중성자가 다른 원자에 의해 흡수되는 것과 같은 다른 자연 핵반응에 의해 자연적으로 핵생성 핵종으로 합성된다.
위에서 설명한 바와 같이 안정 동위원소는 80개뿐이며, 이중 26개 원소에는 안정 동위원소가 1개밖에 없다.따라서 안정 원소의 약 3분의 2는 지구상에서 여러 안정 동위원소에서 자연적으로 발생하며, 가장
많은 안정 동위원소는 주석(
50Sn)의 10개이다.지구에는 플루토늄-244와 같이 극히 미량의 원소만 검출되지만(플루토늄까지 포함) 지구에는 약 94개의 원소가 있다.과학자들은 지구에서 자연적으로 발생하는 원소(일부 방사성 동위원소만 해당)가 [33]총 339개의 동위원소(핵종)로 발생한다고 추정한다.이러한 자연발생 핵종 중 252개만이 현재까지 붕괴가 관찰되지 않았다는 점에서 안정적이다.추가로 34개의 원시 핵종(총 286개의 원시 핵종)은 알려진 반감기와 함께 방사성이지만, 1억 년 이상 긴 반감기를 가지고 있어 태양계 초기부터 존재할 수 있다.자세한 내용은 핵종 목록을 참조하십시오.
알려진 모든 안정된 핵종들은 지구상에서 자연적으로 발생하며, 다른 자연발생 핵종들은 방사능이지만 상대적으로 긴 반감기 때문에 지구상에서 발생한다.여기에는 앞서 언급한 우주원성핵종, 핵원성핵종 및 우라늄의 라돈 및 라듐과 같은 원시 방사성핵종의 지속적인 붕괴에 의해 형성된 방사성핵종이 포함된다.
자연에서 발견되지 않은 약 3000개의 방사성 핵종이 원자로와 입자 가속기에서 추가로 생성되었다.지구에서 자연적으로 발견되지 않는 많은 단수명 핵종들도 별이나 초신성에서 자연적으로 생성되는 분광 분석을 통해 관찰되었다.예를 들어 알루미늄-26은 지구에서는 자연적으로 발견되지 않지만 천문학적인 규모로 풍부하게 발견된다.
원소의 표로 된 원자 질량은 질량이 다른 여러 동위원소의 존재를 설명하는 평균이다.동위원소가 발견되기 전에, 경험적으로 결정된 원자 질량의 정수 값이 과학자들을 혼란스럽게 했다.예를 들어 염소 샘플은 75.8%의 염소-35와 24.2%의 염소-37을 함유하고 있으며, 평균 원자 질량은 35.5원자 질량 단위이다.
일반적으로 받아들여진 우주론에 따르면, 수소와 헬륨의 동위원소, 리튬과 베릴륨의 일부 동위원소, 그리고 아마도 붕소의 일부 동위원소만이 빅뱅에서 만들어졌고, 다른 모든 핵종들은 나중에 별과 초신성, 그리고 우주선과 같은 에너지 입자 사이의 상호작용에서 합성되었다.생성된 핵종.(동위원소 생성을 담당하는 것으로 생각되는 다양한 과정의 자세한 내용은 핵합성을 참조한다.)지구상에 존재하는 동위원소의 양은 이러한 과정을 통해 형성되는 양, 은하의 확산, 그리고 불안정한 동위원소의 붕괴 속도에서 비롯됩니다.태양계의 최초 결합 후, 동위원소는 질량에 따라 재분배되었고, 원소의 동위원소 구성은 행성마다 조금씩 다르다.이것은 때때로 운석의 출처를 추적하는 것을 가능하게 한다.
동위원소 원자 질량
동위원소(핵종)의 원자질량r(m)은 주로 질량수(즉 핵의 핵자수)에 의해 결정된다.작은 보정은 핵의 결합 에너지(질량 결함 참조), 양성자와 중성자 사이의 가벼운 질량 차이 및 원자와 관련된 전자의 질량에 기인하며, 후자는 전자:핵 비율이 동위원소 간에 다르기 때문이다.
질량 수는 무차원 수량입니다.반면 원자 질량은 탄소-12 원자의 질량에 기초한 원자 질량 단위를 사용하여 측정된다.이것은 "u"(통합 원자질량 단위의 경우) 또는 "Da"(달톤의 경우) 기호로 표시됩니다.
원소의 자연발생 동위원소의 원자 질량이 원소의 원자 질량을 결정한다.원소에 N개의 동위원소가 포함되어 있는 경우, 아래 식은 평균 ma { {a에 적용됩니다.
여기서1 m, m2, ..., m은N 각 개별 동위원소의 원자질량이고1 x, ..., x는N 이들 동위원소의 상대적 풍부함이다.
동위원소의 용도
동위원소 정제
특정 원소의 다양한 동위원소의 특성을 활용하는 몇 가지 응용 프로그램이 존재합니다.동위원소 분리는 특히 우라늄이나 플루토늄과 같은 무거운 원소의 경우 중요한 기술적 과제이다.리튬, 탄소, 질소, 산소와 같은 가벼운 원소는 일반적으로 CO와 NO와 같은 화합물의 가스 확산에 의해 분리된다.수소와 중수소의 분리는 예를 들어 황화 거들러 공정에서 물리적 특성이 아닌 화학적 특성에 기초하기 때문에 특이하다.우라늄 동위원소는 가스 확산, 가스 원심 분리, 레이저 이온화 분리, 그리고 (맨하탄 프로젝트에서) 생산 질량 분석의 일종으로 대량으로 분리되었다.
화학적 및 생물학적 특성 사용
- 동위원소 분석은 특정 표본에서 주어진 원소의 동위원소 상대적 풍부성인 동위원소 시그니처의 결정이다.동위원소 분석은 종종 동위원소 비율 질량 분석으로 이루어진다.특히 생체물질의 경우, C, N, O의 동위원소가 크게 변화할 수 있다.이러한 변이의 분석은 식품[34] 내에서의 불순물 검출이나 등시경을 이용한 제품의 지리적 원산지 등 폭넓은 응용 분야를 가지고 있다.특정 운석이 화성에서 발생했다는 확인은 부분적으로 [35]운석에 포함된 미량 가스의 동위원소적 특징에 기초한다.
- 동위원소 치환은 운동 동위원소 효과를 통한 화학 반응 메커니즘을 결정하기 위해 사용될 수 있다.
- 또 다른 일반적인 적용은 동위원소 라벨링으로 화학 [36]반응의 추적기 또는 표지자로서 특이한 동위원소를 사용한다.일반적으로, 주어진 원소의 원자는 서로 구별할 수 없다.그러나 질량이 다른 동위원소를 사용함으로써 서로 다른 비방사성 안정 동위원소라도 질량분석이나 적외선 분광법으로 구별할 수 있다.예를 들어 '세포 배양 내 아미노산에 의한 안정적인 동위원소 라벨링(SILAC)'에서는 단백질을 정량화하기 위해 안정적인 동위원소가 사용된다.방사성 동위원소를 사용하면 방사선에 의해 검출될 수 있다(방사성 동위원소 라벨링이라고 한다.
- 동위원소는 일반적으로 동위원소 희석법을 사용하여 다양한 원소 또는 물질의 농도를 결정하기 위해 사용된다. 따라서 동위원소는 알려진 양의 동위원소 치환 화합물을 샘플과 혼합하고 결과 혼합물의 동위원소 시그니처를 질량 분석으로 결정한다.
핵물질의 사용
- 방사성 동위원소 라벨링과 유사한 기술은 방사성 연대 측정법이다. 불안정한 원소의 알려진 반감기를 사용하여 알려진 동위원소 농도가 존재한 이후 경과한 시간을 계산할 수 있다.가장 널리 알려진 예는 탄소질 물질의 연대를 결정하는 데 사용되는 방사성 탄소 연대 측정법이다.
- 스펙트럼 분석의 여러 가지 형태는 방사성 및 안정성이라는 특정 동위원소의 고유한 핵 특성에 의존한다.예를 들어 핵자기공명(NMR) 분광법은 핵 스핀이 0이 아닌 동위원소에만 사용할 수 있다.NMR 분광법에 사용되는 가장 일반적인 핵종은 H, D, N, C, P이다.
- 또한 뫼스바우어 분광학은 Fe와 같은 특정 동위원소의 핵 전이에 의존한다.
- 방사성핵종은 중요한 용도도 있다.핵발전과 핵무기 개발에는 비교적 많은 양의 특정 동위원소가 필요하다.핵의학과 방사선 종양학에서는 각각 진단과 치료에 방사성 동위원소를 사용하고 있습니다.
「 」를 참조해 주세요.
레퍼런스
- ^ Herzog, Gregory F. (2 June 2020). "Isotope". Encyclopedia Britannica.
- ^ Soddy, Frederick (12 December 1922). "The origins of the conceptions of isotopes" (PDF). Nobelprize.org. p. 393. Retrieved 9 January 2019.
Thus the chemically identical elements - or isotopes, as I called them for the first time in this letter to Nature, because they occupy the same place in the Periodic Table ...
- ^ "isotope—Origin and meaning". www.etymonline.com. Retrieved 21 October 2021.
{{cite web}}: CS1 maint :url-status (링크) - ^ Soddy, Frederick (1913). "Intra-atomic charge". Nature. 92 (2301): 399–400. Bibcode:1913Natur..92..399S. doi:10.1038/092399c0. S2CID 3965303.
- ^ "IUPAP Red Book" (PDF). Archived from the original (PDF) on 2015-03-18. Retrieved 2018-01-06.
- ^ IUPAC 골드북
- ^ IUPAC 골드북
- ^ IUPAC (코넬리, 노스캐롤라이나주, 담후스, 하트손, R.M., 허튼, 허튼), 무기화학 명명법 – IUPAC 권고 2005, 2005; IUPAC, IUPAC, J.M.C. 권장사항 2000, The Royal Society of Chemistry, 2001; IUPAC(Leigh, G. J.), 무기화학 명명법(1990), Blackwell Science, 1990; IUPAC, 무기화학 명명법, 제2판, 1970; 아마도 1958년 초판일 것이다.
- ^ 이 표기법은 1930년대 후반에 도입된 것으로 보인다.그 이전에는 네온-22의 경우 Ne(2222), 네온-22의 경우 Ne(1935), 납-210의 경우 Pb210(1933) 등 다양한 표기가 사용되었다.
- ^ a b "Radioactives Missing From The Earth".
- ^ "NuDat 2 Description". Retrieved 2 January 2016.
- ^ 초핀, G., 릴젠진, J.O. 및 Rydberg, J. [1995] 방사화학 및 핵화학 (제2판)Butterworth-Heinemann, 페이지 3-5
- ^ 다른 이들은 다음과 같은 동위원소 가능성을 제시했다.
- Strömholm, Daniel and Svedberg, Theodor(1909) "Untersuchungen die Chemie der radiocactiven Grundstoffe II." (방사성 원소 화학에 대한 조사, 파트 2), Zeitschrift fürigft anischen Chemie, 63: 197-206; 특히 206 페이지 참조.
- Alexander Thomas Cameron, Radichemistry (런던, 영국: J. M. Dent & Sons, 1910), 페이지 141. (Cameron도 치환법을 예측했다.)
- ^ a b c Ley, Willy (October 1966). "The Delayed Discovery". For Your Information. Galaxy Science Fiction. pp. 116–127.
- ^ a b c Scerri, Eric R. (2007) The Periodic Table Oxford University Press, 176-179 ISBN 0-19-530573-6페이지
- ^ a b Nagel, Miriam C. (1982). "Frederick Soddy: From Alchemy to Isotopes". Journal of Chemical Education. 59 (9): 739–740. Bibcode:1982JChEd..59..739N. doi:10.1021/ed059p739.
- ^ Kasimir Fajans(1913) "Wiber eine Beziehung zwischen der Art einer radioaktiven Umwandlung und dem elektrochemischen Verhalten der betreffenden Radioelemente"(방사능 변환 유형과 관련 방사성 원소의 전기 화학적 거동 사이의 관계에 대하여), 물리치프트hitschits)
- ^ Soddy는 다음과 같이 자신의 "배치법"을 발표했습니다.
- ^ 소디는 소디, 프레데릭 (1913) "방사능", 화학 협회 연례 보고서, 10:262-288에서 그의 치환 법칙을 상세하게 설명했습니다.
- ^ 알렉산더 스미스 러셀 (1888–1972)은 또한 치환 법칙을 발표했다: 러셀, 알렉산더 S. (1913), 화학 뉴스와 산업 과학 저널 (107:49–52).
- ^ Soddy는 "아이소토프"라는 단어를 다음과 같이 처음 사용했다.
- ^ Fleck, Alexander (1957). "Frederick Soddy". Biographical Memoirs of Fellows of the Royal Society. 3: 203–216. doi:10.1098/rsbm.1957.0014.
p. 208: Up to 1913 we used the phrase 'radio elements chemically non-separable' and at that time the word isotope was suggested in a drawing-room discussion with Dr. Margaret Todd in the home of Soddy's father-in-law, Sir George Beilby.
- ^ Budzikiewicz H, Grigsby RD (2006). "Mass spectrometry and isotopes: a century of research and discussion". Mass Spectrometry Reviews. 25 (1): 146–57. Bibcode:2006MSRv...25..146B. doi:10.1002/mas.20061. PMID 16134128.
- ^ Scerri, Eric R. (2007) The Periodic Table, Oxford University Press, ISBN 0-19-530573-6, Ch. 6, 주 44 (p.312)는 Soddy의 전 학생으로 묘사된 Alexander Flex를 인용한다.
- ^ 1893년 그의 책, 윌리엄 T.에서.피터는 또한 요소들 사이의 유사성을 나타내기 위해 "아이소톱"이라는 단어를 사용했다.윌리엄 T의 9페이지부터요피더, Das genetische System der chemischen Elemente [화학 원소의 유전자 시스템] (베를린, 독일: R)Friedländer&손태영 1893년):"다이 ersteren nämlich Stuffe, einnehmen dieselbeich derKürze wegen 동위 원소 Elemente genannt,jedem der유닛 Stämmme 역동 Ort gleichenweil 크기를,시거든."왜냐하면 그들은 각각의 가족들을 일곱번의 같은 장소를 차지한(번잡을 피해, 나는, 경우는 아름다운 요정의 즉, 기둥들이 그 전"동위 원소"요소 이름을 붙였다.odic table], 즉 동일한 단계 [즉 주기율표의 행].
- ^ a b 노벨상 강연 프레데릭 소디 동위원소 개념의 기원
- ^ Thomson, J. J. (1912). "XIX. Further experiments on positive rays". Philosophical Magazine. Series 6. 24 (140): 209–253. doi:10.1080/14786440808637325.
- ^ Thomson, J. J. (1910). "LXXXIII. Rays of positive electricity". Philosophical Magazine. Series 6. 20 (118): 752–767. doi:10.1080/14786441008636962.
- ^ 질량 스펙트럼과 동위원소 프랜시스 W. 애스턴, 1922년 노벨상 강연
- ^ Laidler, Keith (1987). Chemical Kinetics (3rd ed.). India: Pearson Education. p. 427. ISBN 978-81-317-0972-6.
- ^ Sonzogni, Alejandro (2008). "Interactive Chart of Nuclides". National Nuclear Data Center: Brookhaven National Laboratory. Archived from the original on 2018-10-10. Retrieved 2013-05-03.
- ^ Hult, Mikael; Wieslander, J. S.; Marissens, Gerd; Gasparro, Joël; Wätjen, Uwe; Misiaszek, Marcin (2009). "Search for the radioactivity of 180mTa using an underground HPGe sandwich spectrometer". Applied Radiation and Isotopes. 67 (5): 918–21. doi:10.1016/j.apradiso.2009.01.057. PMID 19246206.
- ^ "Radioactives Missing From The Earth". Retrieved 2012-06-16.
- ^ Jamin, Eric; Guérin, Régis; Rétif, Mélinda; Lees, Michèle; Martin, Gérard J. (2003). "Improved Detection of Added Water in Orange Juice by Simultaneous Determination of the Oxygen-18/Oxygen-16 Isotope Ratios of Water and Ethanol Derived from Sugars". J. Agric. Food Chem. 51 (18): 5202–6. doi:10.1021/jf030167m. PMID 12926859.
- ^ Treiman, A. H.; Gleason, J. D.; Bogard, D. D. (2000). "The SNC meteorites are from Mars". Planet. Space Sci. 48 (12–14): 1213. Bibcode:2000P&SS...48.1213T. doi:10.1016/S0032-0633(00)00105-7.
- ^ Deegan, Frances M.; Troll, Valentin R.; Whitehouse, Martin J.; Jolis, Ester M.; Freda, Carmela (2016-08-04). "Boron isotope fractionation in magma via crustal carbonate dissolution". Scientific Reports. 6 (1): 30774. Bibcode:2016NatSR...630774D. doi:10.1038/srep30774. ISSN 2045-2322. PMC 4973271. PMID 27488228.
외부 링크
- 핵과학 웹 포털 뉴클레오니카
- 카를스루에 핵종 차트
- NNDC에서 제공하는 무료 데이터 및 분석 프로그램의 대규모 저장소로 가는 국립 원자력 데이터 센터 포털
- 국립 동위원소 개발 센터 동위원소 생산, 가용성 및 분포 조정 및 관리, 동위원소 군집 참조 정보
- 동위원소 생산 및 생산 연구 개발을 위한 미국 에너지부 프로그램(IDPRA)
- 국제원자력기구(IAEA)의 국제원자력기구(IAEA) 홈페이지
- NIST(National Institute of Standards and Technology)의 모든 원소에 대한 원자량 및 동위원소 조성표
- 아톰게이치테, 제르폴세네르기엔, 할베르츠자이텐 알러 동위원소
- LBNL에서의 동위원소 표 탐색
- 현재 동위원소 연구 및 정보 isotope.info
- CDC(질병통제예방센터)에 의한 비상대비 및 대응: 방사성 동위원소
- 2018-10-10년에 보관된 핵종 차트(Wayback Machine Interactive Chart of Nuclipse of Nuclipse) (국립원자력데이터센터)
- 핵종, 동위원소 및 주기표 상호작용도
- 핵종의 LiveChart – 동위원소 데이터가 있는 IAEA.
- 알소스 핵문제 디지털 라이브러리의 동위원소 주석 목록
- 안정성의 계곡(비디오) – CEA(프랑스)가 핵종 차트를 3D로 표현한 가상 "비행"