부타디엔
Butadiene
| | |||
| | |||
| 이름 | |||
|---|---|---|---|
| 선호 IUPAC 이름 부타-1,3-다이엔[1] | |||
기타 이름
| |||
| 식별자 | |||
| |||
3D 모델(JSmol) | |||
| 605258 | |||
| 체비 | |||
| 켐벨 | |||
| 켐스파이더 | |||
| ECHA InfoCard | 100.003.138 | ||
| EC 번호 |
| ||
| 25198 | |||
| 케그 | |||
펍켐 CID | |||
| RTECS 번호 |
| ||
| 유니 | |||
| UN 번호 | 1010 | ||
CompTox 대시보드 (EPA) | |||
| |||
| |||
| 속성[3] | |||
| C4H6 CH2=CH-CH=CH2 | |||
| 어금질량 | 54.0916g/192 | ||
| 외관 | 무색 가스 또는 냉장된 액체 | ||
| 냄새 | 순한 방향제 또는 가솔린 느낌 | ||
| 밀도 |
| ||
| 녹는점 | -108.91°C(-164.04°F; 164.24K) | ||
| 비등점 | -4.41°C(24.06°F, 268.74K) | ||
| 5℃에서 1.3 g/L, 20℃에서 735 mg/L | |||
| 용해성 | |||
| 증기압 | 2.4 atm(20°C)[2] | ||
굴절률(nD) | 1.4292 | ||
| 점도 | 0°C에서 0.25cP | ||
| 위험 | |||
| 산업안전보건(OHS/OSH): | |||
주요 위험 | 인화성, 자극성, 발암성 | ||
| GHS 라벨 표시:[6] | |||
   | |||
| 위험 | |||
| H220, H280, H340, H350 | |||
| P202, P210, P280, P308+P313, P377, P381, P403 | |||
| NFPA 704(화재 다이아몬드) | |||
| 플래시 포인트 | -85°C(-121°F, 188K) 액체 플래시 포인트[2] | ||
| 414°C(777°F, 687K)[5] | |||
| 폭발 한계 | 2–12% | ||
| 치사량 또는 농도(LD, LC): | |||
LD50(중간 선량) | 548mg/kg(랫드, 구강) | ||
LC50(중간농도) | |||
LCLo(최저공표) | 25만ppm (1950, 30분)[4] | ||
| NIOSH(미국 건강 노출 제한): | |||
PEL(허용) | TWA 1ppm ST 5ppm[2] | ||
REL(권장) | 잠재적 직업상 발암물질[2] | ||
IDLH(즉시 위험) | 2000ppm[2] | ||
| 안전 데이터 시트(SDS) | ECSC 0017 | ||
| 관련 화합물 | |||
| 이솝렌 클로로프렌 | |||
관련 화합물 | 부탄 | ||
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |||
| Infobox 참조 자료 | |||
1,3-부타디엔(/ˌbjuːtədadaɪi/n/)[7]은 공식(CH2=CH)이 있는 유기 화합물이다.2 액체에 쉽게 응축되는 무색의 기체다. 그것은 산업적으로 합성고무의 전조로서 중요하다. 이 분자는 두 개의 비닐 그룹의 결합으로 볼 수 있다. 그것은 가장 간단한 혼합 디엔이다.
부타디엔은 대기 중에 빠르게 분해되지만, 그럼에도 불구하고 자동차에서 지속적으로 배출된 결과 도시와 교외 지역의 대기에서 발견된다.[8]
부타디엔이라는 이름도 이소머, 1,2부타디엔을 지칭할 수 있는데, 이 이소머는 구조 HC2=CH=CH-CH가3 응축된 디엔이다. 이 알렌은 산업적인 의미가 없다.
역사
1863년 프랑스의 화학자 E. 카벤투는 아밀알코올의 열분해에서 부타디엔을 분리했다.[9] 이 탄화수소는 헨리 에드워드 암스트롱이 석유 열분해 제품에서 분리시킨 후 1886년에 부타디엔으로 확인되었다.[10] 1910년 러시아의 화학자 세르게이 레베데프는 부타디엔을 중합하여 고무와 같은 성질을 가진 물질을 얻었다. 그러나 이 중합체는 특히 자동차 타이어와 같은 많은 용도에서 천연고무를 대체하기에는 너무 부드러운 것으로 밝혀졌다.
부타디엔 산업은 제2차 세계대전이 일어난 해에 시작되었다. 많은 호전적인 국가들은 전쟁이 일어나면 대영제국이 통제하는 고무 농장과 단절될 수 있다는 것을 깨닫고 천연고무에 대한 의존도를 줄이려고 노력했다.[11] 1929년 독일의 IG 파르벤에서 일하던 에두아르 츠쿤커와 월터 보크는 자동차 타이어에 사용될 수 있는 스티렌과 부타디엔을 혼합하여 만들었다. 부타디엔은 소련과 미국의 곡물 알코올과 독일의 석탄 유래 아세틸렌에서 생산되는 등 전 세계적인 생산이 빠르게 이어졌다.
생산
C4 탄화수소에서 추출
미국, 서유럽, 일본에서 부타디엔은 에틸렌과 다른 알케인을 생산하는 데 사용되는 증기 균열 공정의 부산물로 생산된다. 증기와 혼합하여 매우 높은 온도(종종 900 °C 이상)로 잠시 가열하면, 알리페틱 탄화수소는 수소를 포기하여 부타디엔을 포함한 불포화 탄화수소의 복합 혼합물을 생산한다. 부타디엔의 생산량은 공급으로 사용되는 탄화수소에 따라 달라진다. 에탄과 같은 가벼운 사료는 균열이 생겼을 때 주로 에틸렌을 주지만, 무거운 사료는 무거운 올레핀, 부타디엔, 방향족 탄화수소의 형성을 선호한다.
부타디엔은 일반적으로 아세토나이트릴, N-메틸-2-피롤리돈, 푸르푸랄, 디메틸포름아미드 등의 극지방 아프로틱 용제를 사용하여 추출 증류에 의해 증기 균열로 생성된 다른 4-탄소 탄화수소와 격리되며, 이 탄화수소는 증류에 의해 벗겨진다.[12]
엔부탄의 탈수소화로부터
부타디엔은 일반 부탄(n-butane)의 촉매 탈수 작용에 의해서도 생성될 수 있다. 이런 전후 최초의 상업공장은 연간 6만5000t의 부타디엔을 생산해 1957년 텍사스주 휴스턴에서 가동을 시작했다.[13] 그 이전에, 1940년대에 미국 정부의 일부인 고무 예비 회사는 미국 합성 고무 프로그램의 일환으로, 전쟁 노력을 위한 합성 고무를 생산하기 위해 텍사스 보거, 오하이오 톨레도, 캘리포니아 엘 세군도에 여러 개의 공장을 건설했다.[14] 총 용량은 68KMTA(연간 킬로 미터 톤)이었다.
오늘날 엔부탄의 부타디엔은 제2차 세계대전 당시 개발된 후드리 카타디엔 공정을 이용해 상업적으로 생산되고 있다. 이것은 높은 온도에서 알루미나 색소보다 부탄을 치료하는 것을 수반한다.[15]
에탄올로부터
남미, 동유럽, 중국, 인도 등 세계 다른 지역에서도 부타디엔이 에탄올에서 생산된다. 부타디엔 대량 생산을 위한 증기 균열에는 경쟁력이 없지만, 자본비용 절감은 에탄올을 소용량 공장에 적용할 수 있는 옵션으로 만든다. 두 가지 공정이 사용되고 있었다.
세르게이 레베데프가 개발한 한 단계 공정에서 에탄올은 다양한 금속 산화 촉매를 통해 400~450°C에서 부타디엔, 수소 및 물로 변환된다.[16]
이 과정은 제2차 세계 대전 중과 후 구소련의 합성고무 산업의 기초가 되었고, 1970년대 말까지 러시아를 비롯한 동유럽의 다른 지역에서 제한적으로 사용되어 왔다. 동시에 이런 종류의 제조는 브라질에서 취소되었다. 2017년 현재 산업적으로 에탄올에서 부타디엔이 생산되지 않았다.
러시아 이민 화학자 이반 오스트로미슬렌스키에 의해 개발된 다른 2단계 과정에서는 에탄올이 아세트알데히드로 산화되는데, 아세트알데히드는 탄탈룸이 촉진하는 다공성 실리카 촉매 위에 325~350℃에서 에탄올과 반응하여 부타디엔을 생산한다.[16]
이 과정은 비록 대량의 부탄이나 부텐 루트에 비해 경제성은 떨어지지만, 2차 세계대전 중 "정부 고무"를 생산하기 위해 미국에서 사용된 세 가지 과정 중 하나였다. 그래도 루이빌 공장은 1943년 완공된 미국(인스트릿, 웨스트버지니아, 켄터키, 펜실베이니아 코부타)에 연 20만t 규모의 공장 3개가 건설돼 처음에는 관련 칼슘 카바이드 공장에서 생성된 아세틸렌에서 부타디엔을 만들어냈다. 이 과정은 오늘날 중국과 인도에서 사용되고 있다.
부테네스 출신
1,3-부타디엔은 정상부텐의 촉매 탈수에도 의해 생성될 수 있다. 이 방법은 제2차 세계대전 당시 미국의 합성고무프로그램(USRP)에서도 사용되었다. 이 과정은 알코올이나 n-부탄 경로보다 훨씬 경제적이었지만 이용 가능한 부틴 분자를 위해 항공 가솔린과 경쟁했다(촉매성 균열 덕분에 부텐이 풍부했다). USSRP는 루이지애나주 배턴루즈와 레이크 찰스, 텍사스주 휴스턴, 베이타운, 포트네체스, 캘리포니아주 토런스에 여러 공장을 건설했다.[14] 연간 총 생산량은 275KMTA였다.
1960년대 휴스턴의 페트로텍스라는 회사가 특허 촉매를 이용한 산화성 탈수증에 의해 일반 부텐에서 부타디엔을 생산하는 공정에 특허를 얻었다. 이 기술이 상업적으로 행해지는지는 불분명하다.[17]
제2차 세계 대전 이후, 부테네스의 생산은 구소련의 주요 생산 유형이 되었다.
실험실용
1,3-부타디엔은 기체여서 실험실 사용이 불편하다. 실험실 절차는 비물질 전구체로부터 그 생성에 최적화되었다. 사이클로헥센의 레트로-딜-알데르 반응에 의해 생산될 수 있다.[18] 설폴린은 실험실에서 1,3부타디엔을 보관할 수 있는 편리한 고체 저장원료다. 그것은 가열할 때 디엔과 아황산가스를 방출한다.
사용하다
대부분의 부타디엔은 타이어, 그로밋, 탄성 밴드의 제조를 위한 합성 고무를 만드는 데 사용된다.
부타디엔이 합성고무로 전환되는 것을 중합화라고 하는데, 이 과정에서 작은 분자(모노머)가 연결돼 큰 분자(폴리머)를 만드는 과정이다. 부타디엔의 중합만 해도 폴리부타디엔을 주는데, 이 물질은 매우 부드럽고 거의 액체 상태의 물질이다. 부타디엔과 다른 모노머의 중합은 복합체를 주는데, 이는 더욱 가치가 있다. 아크릴로니트릴 부타디엔 스티렌(ABS), 니트릴부타디엔(NBR), 스티렌부타디엔(SBR) 등 부타디엔과 스티렌 및/또는 아크릴로니트릴의 중합. 이러한 복합체는 준비 시 사용되는 단량체의 비율에 따라 견고하고/또는 탄성이 있다. SBR은 자동차 타이어 생산에 가장 일반적으로 사용되는 재료다. 여전히 다른 합성 고무의 전구체는 부타디엔으로부터 준비된다. 하나는 클로로프렌이다.[15]
부타디엔의 적은 양이 일부 나일론의 전구체인 아디포니트릴을 만드는데 사용된다. 부타디엔을 아디포니트릴로 전환하면 각각 부타디엔의 이중결합에 시안화수소를 첨가하게 된다. 그 과정을 수경화라고 한다.
부타디엔은 용제 설폴레인 제조에 사용된다.
부타디엔은 디엘-알데르 반응을 통해 2중, 3중의 탄소-탄소 결합과 반응하기 때문에 사이클로알카네스와 사이클로알케네스의 합성에도 유용하다. 가장 널리 사용되는 반응은 부타디엔의 하나 또는 두 개의 다른 분자와 부타디엔의 반응, 즉 각각 조광화와 트리머라이징을 포함한다. 디메리자티온 부타디엔을 통해 4비닐시클로헥센과 사이클로옥타디엔으로 전환된다. 실제로 비닐사이클로헥센은 부타디엔을 보관할 때 쌓이는 흔한 불순물이다. 부타디엔은 트리머화를 통해 사이클로데카트리엔으로 전환된다. 이 공정들 중 일부는 니켈이나 티타늄을 함유한 촉매를 사용한다.[19]
구조, 적합성 및 안정성
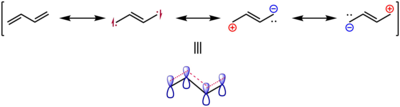
1,3-부타디엔의 가장 안정된 컨포머는 분자가 평면인 s-트랜스 컨포머로, 두 쌍의 이중 결합이 반대 방향을 향하고 있다. 이 순응은 이중 결합 사이의 궤도 중첩이 극대화되어 최대의 결합이 가능한 반면, 강직 효과는 최소화되기 때문에 가장 안정적이다. 통상적으로 s-transformation은 C-C23 diedral 각도가 180°인 것으로 간주된다. 이와는 대조적으로, 치조각이 0°인 s-cis 순응은 같은 방향을 향한 쌍의 이중 결합이 장력 방해로 인해 약 16.5 kJ/mol(3.9 kcal/mol)의 에너지가 더 높다. 이 기하학은 국부 에너지 최대치여서 s-trans 기하학과 대조적으로 컨포머가 아니다. s-cis 기하학의 이중 결합이 꼬여 약 38°의 이음각 각도를 주는 거슈 기하학은 s-트랜스 컨포머보다 에너지가 약 12.0 kJ/mol(2.9 kcal/mol) 높은 두 번째 컨포머다. 전체적으로 두 컨포머 사이에 이소머라이징을 위한 장벽은 24.8 kJ/mol(5.9 kcal/mol)이다.[20] 이처럼 회전 장벽이 높아지고 평면 근사형 기하학에 대한 전반적인 선호도가 강한 것은 공진 이론에 따라 소량의 C-C 단일 결합에서 소량의 부분적 이중 결합 성질과 탈색 π 시스템에 대한 증거다.
s-cis 순응의 높은 에너지에도 불구하고, 1,3-부타디엔은 이러한 순응(또는 매우 유사한 것 하나)을 가정해야 디엘-알데르 반응과 같은 일치된 사이클로 추가 반응에 4 전자 성분으로 참여할 수 있다.
마찬가지로, s-trans-butadiene의 이중 결합은 133.8 pm, 에틸렌의 경우 133.0 pm이라는 실험 및 계산 연구가 결합된 결과 밝혀졌다. 이는 아래에 나타낸 공진구조로 묘사된 바와 같이 탈색에 의해 ocal본드가 약화되고 길어진 증거로서 취해졌다.[21]
1,3부타디엔 분자 궤도에 대한 정성적 그림은 후켈 이론을 적용하여 쉽게 얻을 수 있다.(후켈 이론에 관한 기사는 부타디엔 궤도상에 대한 파생어를 제공한다.)
1,3-부타디엔도 열역학적으로 안정되어 있다. 단분해 이중 결합은 수소화 시 약 30.3 kcal/mol의 열을 방출하는 반면, 1,3 부타디엔은 이 에너지(60.6 kcal/mol)의 2배보다 약간 적게 방출된다. 그것은 3.5 kcal/mol의 안정화 에너지를 의미한다.[22] 마찬가지로 1,4-펜타디엔의 단자 이중결합 수소화는 30.1 kcal/mol의 열을 방출하는 반면, 결합(E)-1,3-펜타디엔의 단자 이중결합 수소화는 26.5 kcal/mol만 방출하는 것으로 안정화 에너지의 매우 유사한 값인 3.6 kcal/mol을 의미한다.[23] 이러한 수소 가열에서 최대 3.5 kcal/mol 차이는 결합 디엔의 공진 에너지로 간주할 수 있다.
반응
산업용 용도는 중합화하려는 부타디엔의 경향을 보여준다. 1,4개의 추가 반응에 대한 그것의 민감성은 그것의 수력 계통화에 의해 설명된다. 많은 디엔처럼, 그것은 동맹국을 통해 진행되는 pd-cataly reactions를 거친다.[24] Diels-Alder 반응의 파트너로, 예를 들어 수성 무수화물(maleic anhardide)을 사용하여 테트라히드롭탈산 무수화물(tetrahydrophthalic anhardide)을 투여한다.[25]
다른 디엔과 마찬가지로 부타디엔은 낮은 가치의 금속 콤플렉스를 위한 리간드로, 예를 들어 파생상품 Fe(부타디엔)(3CO)와 Mo(부타디엔)가 있다.3
환경보건안전
부타디엔은 급성 독성이 낮다. LC50은 랫드와 생쥐가 흡입하는 경우 12.5–11.5%이다.[15]
장기 노출은 심혈관 질환과 관련이 있다. 백혈병과 일관된 연관성이 있을 뿐만 아니라 다른 암과도 상당한 연관성이 있다.[27]
IARC는 1,3-부타디엔을 1그룹 발암물질('인체에 대한 카시네이션')[28]으로 지정했으며, 독성물질병등록부와 미국 EPA도 이 화학물질을 발암물질로 등재했다.[29][30] 미국 정부 산업 위생사 회의(ACGIH)는 이 화학물질을 발암 의심 물질로 분류하고 있다.[30] 천연자원방어위원회(NRDC)는 이 화학물질과 관련이 있는 것으로 의심되는 몇몇 질병 군집을 열거하고 있다.[31] 일부 연구자들은 이 발암물질이 담배 연기 중 가장 강력한 발암물질로 아크릴로니트릴보다[32] 두 배나 더 강력한 것으로 결론을 내렸다.
1,3-부타디엔 역시 인간 테라토겐으로 의심받고 있다.[33][34][35] 장기적이고 과도한 노출은 인체의 많은 부분에 영향을 줄 수 있다; 혈액, 뇌, 눈, 심장, 신장,[36] 폐, 코, 그리고 목구멍 모두 과도한 1,3-부타디엔의 존재에 반응하는 것으로 나타났다. 동물 데이터는 여성이 화학 물질에 노출되었을 때 남성보다 부타디엔의 발암성 영향에 더 높은 민감도를 가지고 있음을 시사한다. 이것은 에스트로겐 수용체 영향 때문일 수 있다. 이러한 데이터는 부타디엔에 대한 인간의 노출 위험에 대한 중요한 의미를 드러내지만, 결정적인 위험 평가를 이끌어내기 위해서는 더 많은 데이터가 필요하다. 쥐에서 나타나는 생식 및 발육에 대한 부타디엔의 영향에 대한 인간 데이터도 부족하지만, 동물 연구에서는 임신 중 호흡 부타디엔이 선천성 결함의 수를 증가시킬 수 있으며, 인간은 동물과 동일한 호르몬 체계를 가지고 있다는 것이 밝혀졌다.[37]
1,3-부타디엔은 오존을 쉽게 형성할 수 있는 잠재력 때문에 고반응 휘발성 유기화합물(HRVOC)로 인정받고 있으며, 따라서 이 화학물질의 방출은 휴스턴-브라조리아-갈베스턴 오존 비접촉 지역 일부에서 TCEQ에 의해 높은 규제를 받는다.[2]
데이터시트
| 특성. | |
|---|---|
| 위상행동 | |
| 트리플 포인트 | 164.2K(-109.0°C) 바? |
| 임계점 | 425K(152°C) 43.2 bar |
| 구조 | |
| 대칭군 | C2h |
| 가스 특성 | |
| ΔfH0 | 110.2 kJ/mol |
| Cp | 79.5 J/몰·K |
| 액체 특성 | |
| ΔfH0 | 90.5 kJ/mol |
| S0 | 199.0 J/몰·K |
| Cp | 123.6 J/몰·K |
| 액체 밀도 | 0.64 ×103 kg/m3 |
참고 항목
참조
- ^ "Front Matter". Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. p. 374. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ a b c d e NIOSH Pocket Guide to Chemical Hazards. "#0067". National Institute for Occupational Safety and Health (NIOSH).
- ^ NIST 웹북
- ^ a b "1,3-Butadiene". Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ [1]
- ^ 산업안전보건연구소의 게스티스 물질 데이터베이스에 기록
- ^ https://www.lexico.com/definition/butadiene
- ^ "1,3-Butadiene". US Environmental Protection Agency US EPA. Retrieved 2 September 2014.
- ^ Caventou, E. (1863). "Ueber eine mit dem zweifach-gebromten Brombutylen isomere Verbindung und über die bromhaltigen Derivate des Brombutylens". Justus Liebigs Annalen der Chemie. 127: 93–97. doi:10.1002/jlac.18631270112.
- ^ Armstrong, H. E.; Miller, A. K. (1886). "The decomposition and genesis of hydrocarbons at high temperatures. I. The products of the manufacture of gas from petroleum". J. Chem. Soc. 49: 74–93. doi:10.1039/CT8864900074.
- ^ 지구를 구할 수 없는 단순한 것들, J. 로버트 헌터
- ^ Sun, H.P. Wristers, J.P. (1992) 부타디엔 J.I. Kroschwitz (Ed.), 화학 기술 백과사전, 제4권, 제4권, 제663–690호. 뉴욕: John Wiley & Sons.
- ^ 1957년 6월, M.R.와 W.J.의 Beychok과 Brack, "제1차 전후 부타디엔 공장" Petraficial First France Butadiene Factory, 1957년 6월.
- ^ a b 허버트, 버논, "합성 고무: 성공해야 했던 프로젝트" 그린우드 프레스, 1985년 ISBN 0-313-24634-3
- ^ a b c J. Grub, E. Löser (2012). "Butadiene". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a04_431.pub2.CS1 maint: 작성자 매개변수 사용(링크)
- ^ a b 키르센바움, I. (1978년) 부타디엔 M. Grayson (Ed.)에서 화학 기술 백과사전, 3차 개정, 제4권, 페이지 313–337. 뉴욕: John Wiley & Sons.
- ^ "BUTADIENE VIA OXIDATIVE DEHYDROGENATION". ResearchGate. Retrieved 1 June 2019.
- ^ E. B. Hershberg, John R. Ruhoff (1937). "1,3-Butadiene". Org. Synth. 17: 25. doi:10.15227/orgsyn.017.0025.CS1 maint: 작성자 매개변수 사용(링크)
- ^ 4-Vinylcyclohexene (PDF). IARC. ISBN 9789283212607. Retrieved 19 April 2009.
- ^ Feller, David; Craig, Norman C. (26 February 2009). "High Level ab Initio Energies and Structures for the Rotamers of 1,3-Butadiene". The Journal of Physical Chemistry A. 113 (8): 1601–1607. Bibcode:2009JPCA..113.1601F. doi:10.1021/jp8095709. ISSN 1089-5639. PMID 19199679.
- ^ Craig, Norman C.; Groner, Peter; McKean, Donald C. (1 June 2006). "Equilibrium Structures for Butadiene and Ethylene: Compelling Evidence for Π-Electron Delocalization in Butadiene". The Journal of Physical Chemistry A. 110 (23): 7461–7469. Bibcode:2006JPCA..110.7461C. doi:10.1021/jp060695b. ISSN 1089-5639. PMID 16759136.
- ^ Vollhardt, K. Peter C. (2007). Organic chemistry : structure and function. Schore, Neil Eric, 1948- (5th ed.). New York: W.H. Freeman. ISBN 978-0716799498. OCLC 61448218.
- ^ Carey, Francis A. (2002). Organic chemistry (5th ed.). London: McGraw-Hill. ISBN 978-0071151498. OCLC 49907089.
- ^ J. E. Nyström, T. Rein, J. E. Bäckvall (1989). "1,4-Functionalization of 1,3-Dienes via Palladium-Catalyzed Chloroacetoxylation and Allylic Amination: 1-Acetoxy-4-diethylamino-2-butene and 1-Acetoxy-4-benzylamino-2-butene". Org. Synth. 67: 105. doi:10.15227/orgsyn.067.0105.CS1 maint: 작성자 매개변수 사용(링크)
- ^ Arthur C. Cope, Elbert C. Herrick (1950). "cis-Δ4-Tetrahydrophthalic Anhydride". Org. Synth. 50: 93. doi:10.15227/orgsyn.030.0093.CS1 maint: 작성자 매개변수 사용(링크)
- ^ Reiss, Guido J. (2010). "Redetermination of (η4-s-cis-1,3-butadiene)tricarbonyliron(0)". Acta Crystallographica Section E. 66 (11): m1369. doi:10.1107/S1600536810039218. PMC 3009352. PMID 21588810.
- ^ "NPI sheet". Archived from the original on 22 December 2003. Retrieved 10 January 2006.
- ^ Grosse, Yann; Baan, Robert; Straif, Kurt; Secretan, Béatrice; El Ghissassi, Fatiha; Bouvard, Véronique; Altieri, Andrea; Cogliano, Vincent (2008). "Carcinogenicity of 1,3-butadiene, ethylene oxide, vinyl chloride, vinyl fluoride, and vinyl bromide". The Lancet Oncology. 8 (8): 679–680. doi:10.1016/S1470-2045(07)70235-8. ISSN 1470-2045. PMID 17726789.
- ^ "ATSDR - Toxic Substances - 1,3-Butadiene".
- ^ a b Health Effects https://www.osha.gov/SLTC/butadiene/index.html
- ^ "Disease Clusters Spotlight the Need to Protect People from Toxic Chemicals".
- ^ Fowles, J; Dybing, E (4 September 2003). "Application of toxicological risk assessment principles to the chemical constituents of cigarette smoke". Institute of Environmental Science and Research. 12 (4): 424–430. doi:10.1136/tc.12.4.424. PMC 1747794. PMID 14660781.
- ^ Landrigan, PJ (1990). "Critical assessment of epidemiologic studies on the human carcinogenicity of 1,3-butadiene". Environmental Health Perspectives. 86: 143–147. doi:10.1289/ehp.9086143. PMC 1567758. PMID 2205484.
- ^ "1,3-Butadiene CAS No. 106-99-0" (PDF). Report on Carcinogens (11th ed.). Archived from the original (PDF) on 8 May 2009.
- ^ Melnick, Ronald L.; Kohn, Michael C. (1995). "Mechanistic data indicate that 1,3-butadiene is a human carcinogen". Carcinogenesis. 16 (2): 157–63. doi:10.1093/carcin/16.2.157. PMID 7859343.
- ^ "Archived copy". Archived from the original on 3 February 2011. Retrieved 20 August 2010.CS1 maint: 제목으로 보관된 복사본(링크)
- ^ EPA 웹사이트
외부 링크
- 1,3-부타디엔 – 유해 물질 및 질병 등록 기관
- 1,3-부타디엔 – CDC - 화학적 위험성에 대한 NIOSH 포켓 가이드
- 국가 오염 물질 재고 – 1,3-부타디엔