간상증후군
Hepatorenal syndrome| 간상증후군 | |
|---|---|
| 분류 및 외부 자원 | |
 | |
 | |
| ICD-10 | K76.7 |
| ICD-9 | 572.4 |
| 질병.DB | 5810 |
| 메드라인플러스 | [1] |
| e메디컬 | 약/1001년 기사/907429 |
| 메슈 | D006530 |
간상증후군(간상증후군, 흔히 HRS라고 한다)은 생명을 위협하는 질환으로 간경변이나 간 기능저하가 있는 개인에서 신장 기능이 급격히 저하되는 것으로 구성된다.투석 등 다양한 치료로 병세가 진전되는 것을 막을 수 있지만 간 이식을 하지 않으면 보통 치명적이다.
HRS는 간경변이나 심각한 알코올성 간염, 간기능저하 등의 개인에게 영향을 줄 수 있으며, 대개 감염이나 위장관 출혈, 이뇨제 과다 복용 등 갑작스런 모욕으로 간 기능이 급격히 악화될 때 발생한다.HRS는 비교적 흔한 간경변 합병증으로 진단 후 1년 이내에 18%, 진단 후 5년 이내에 39%가 발생한다.간기능이 나빠지면 장에 공급되는 순환에 변화가 생겨 신장의 혈류 및 혈관 톤이 변하는 것으로 생각된다.HRS의 신부전은 신장에 직접 손상을 입히기 보다는 이러한 혈류 변화의 결과물이다.간상증후군의 진단은 그 상태에 취약한 개인에 대한 실험실 검사에 근거한다.간성 증후군의 두 가지 형태가 정의되었다.제1형 HRS는 신장 기능이 급격하게 점진적으로 저하되는 것을 수반하는 반면, 제2형 HRS는 표준 이뇨제로는 개선되지 않는 아스카이트(복부 유체 축적)와 관련된다.
간상증후군의 사망 위험은 매우 높다; 역사적 사례 시리즈에 의해 결정된 바와 같이 1형 HRS를 가진 개인의 사망률은 단기적으로 50%가 넘는다.이 질환에 대한 유일한 장기 치료 방법은 간 이식이다.이식을 기다리는 동안 HRS를 가진 사람들은 종종 약물을 이용한 보조적 치료나 문맥의 혈압을 낮추기 위해 배치된 작은 션트인 경정맥 내 포트로 시스템 션트(TIPS)를 삽입하는 등 혈관 톤의 이상을 개선하는 다른 치료를 받는다.신장 기능을 지원하기 위해 혈액투석이 필요한 환자도 있고, 간 투석 회로와 알부민 결합막을 사용하여 간에서 보통 지워지는 독소를 결합하고 제거하는 간 투석이라는 새로운 기법이 이식이 이루어질 때까지 체외 간을 지탱하는 수단을 제공할 수도 있다.
분류
간경화증후군은 간경변증이나 완치성 간기능 장애를 가진 개인에게 영향을 미치는 특수하고 흔한 형태의 신장 기능 부전이다.[1]신드롬은 장에 공급되는 비장순환에서 신장의 혈관을 수축시키고 혈관을 팽창시키는 것을 포함한다.[2]간성 증후군의 분류는 신장 기능 부전의 두 가지 범주로 구분되는데, 이 두 범주는 모두 간경변이나 완충성 간 기능 부전을 가진 개인에게서 발생한다.두 범주에서 신장 기능의 저하는 혈액 내 크레아티닌 수치의 상승 또는 소변 내 크레아티닌의 간극 감소에 의해 정량화된다.[3]
1형 간증후군
타입 1 HRS는 급속도로 진행성 신장 기능 부전이 특징으로, 혈청 크레아티닌이 221μmol/L(2.5mg/dL) 이상 수준으로 2배 증가하거나 크레아티닌 간극을 20mL/min 이하로 절반으로 감소시킨다.1형 HRS를 가진 개인의 예후는 특히 암울하며 한 달 후 사망률이 50%를 넘는다.[4]제1형 HRS환자들은 보통 아프고, 혈압이 낮을 수 있으며, 심장 근육 수축(이노트로프)의 강도를 향상시키기 위한 약이나 혈압을 유지하기 위한 다른 약(바소프레스터)을 이용한 치료가 필요할 수 있다.[5]Ⅱ유형과 달리 Ⅰ유형 간상증후군은 치료와 함께 신장부전이 개선되고 안정된다.혈관확장기와 볼륨확장기가 치료의 주축이다.[6]
2형 간성증후군
이와는 대조적으로 타입 2 HRS는 시작과 진행 속도가 느리고 선동 이벤트와는 관련이 없다.혈청 크레아티닌 수치가 133μmol/L(1.5mg/dL)로 증가하거나 크레아티닌 간극이 40mL/min 미만, 소변 나트륨 < 10μmol/L)로 정의된다.[7]또한 감염자가 간 이식을 받지 않는 한 평균 생존기간이 약 6개월에 이를 정도로 전망이 좋지 않다.타입 2 HRS는 복부(아시스사이트)의 유체의 발달로 시작되는 관문맥 순환의 압력 증가와 관련된 질병의 스펙트럼에 속하는 것으로 생각된다.이 스펙트럼은 신장이 이뇨제 사용에도 액체를 맑게 할 수 있을 만큼 충분한 나트륨을 배설하지 못하는 이뇨 저항성 아스카이트로 계속된다.2형 HRS를 가진 대부분의 사람들은 신장 기능 저하를 일으키기 전에 이뇨 저항성 승천증을 가지고 있다.[8]
징후 및 증상
두 종류의 간염 증후군은 모두 간기능의 변화, 순환의 이상, 신장 기능 부전의 세 가지 주요 성분을 공유하고 있다.이러한 현상들이 반드시 진로에 늦은 시간까지 증상을 일으키는 것은 아닐 수 있기 때문에, 간성 증후군을 가진 개인은 전형적으로 변경된 실험실 시험에 기초하여 그 상태를 진단한다.HRS에 걸린 대부분의 사람들은 간경변증을 앓고 있으며, 같은 증상과 징후가 있을 수 있는데, 이는 황달, 정신 상태 변화, 영양 감소의 증거, 그리고 복승자의 존재를 포함할 수 있다.[2]구체적으로는 이뇨제 사용에 내성이 있는 아스카이트의 생산이 타입 2 HRS의 특징이다.소변량 감소인 과두증은 신장 기능 부전의 결과로 발생할 수 있지만, HRS를 가진 일부 개인은 계속해서 정상적인 양의 소변을 생산한다.[3]이러한 징후와 증상이 반드시 HRS에서 발생하는 것은 아닐 수 있기 때문에, 이러한 징후와 증상은 이 상태를 진단하기 위한 주요 및 사소한 기준에 포함되지 않는다. 대신에 HRS는 실험실 시험의 결과와 다른 원인의 배제에 기초하여 해당 조건에 대한 위험에 처한 개인에서 진단된다.[3]
원인들
간상증후군은 대개 간경변과 관문맥계의 압력이 상승하는 개인에게 영향을 미친다(구문맥 고혈압이라고 한다).HRS는 어떤 종류의 간경변에서도 발병할 수 있지만 알코올성 간경변증을 가진 개인에게 가장 흔하며, 특히 간 생체검사에서 알 수 있는 동반성 알코올성 간염이 있는 경우 더욱 그러하다.[9]HRS는 간경변이 없는 개인에게도 발생할 수 있지만, 간기능저하로 불리며 급성 간기능저하로 불린다.[3][9]
HRS의 특정 침전물은 간경변이나 심각한 간기능 장애를 가진 취약한 사람들에게서 확인되었다.박테리아 감염, 급성 알코올성 간염, 위장관 출혈 등이 이에 해당한다.아스카이트 액체의 감염인 자발적 세균성 복막염은 HRS의 가장 흔한 침전물이다.HRS는 간질환의 합병증 치료에 의해 유발될 수 있다: HRS의 이아트로겐 침전물은 정맥 대체에 의한 유체손실을 보상하지 않고 이뇨제제의 적극적인 사용이나 복강에서 근위축에 의한 대량의 수태액을 제거하는 것을 포함한다.[9]
진단
간경변이나 간기능 장애가 있는 사람에게는 신장 기능 부전의 많은 원인이 있을 수 있다.이에 따라 간질환이 진행된 상황에서 신장기능저하를 일으키는 다른 실체와 간질환을 구분하는 것이 과제다.그 결과 간증후군의 진단에 도움이 되는 장·단기적 기준들이 추가로 개발되었다.[3]
주요 기준은 포털고혈압에 의한 간질환, 신장부전, 쇼크, 감염, 신장기능에 영향을 미치는 약물(네프로톡신)에 의한 최근 치료, 유체손실, 정맥 정상염수 1.5리터 치료에도 불구하고 신장기능이 지속적으로 개선되지 않는 것, 복근 등이다.단백뇨의 발생(소변 내 출혈) 및 초음파에서 볼 수 있는 신장질환의 부재 또는 신장유출의 방해.[3]
경미한 기준은 낮은 소변량(하루 500mL(18imp floz, 17 US floz)), 낮은 소변 농도, 혈액 내 소변보다 큰 소변 삼염도, 소변 내 적혈구 부재, 혈청 나트륨 농도가 130mmol/L 미만이다.[3]
신장의 다른 많은 질병들은 간질환과 연관되어 있으며 간증후군을 진단하기 전에 제외되어야 한다.신부전 신장에 이상이 있는 사람은 신장에 손상이 없지만, HRS가 있는 사람과 마찬가지로 신장으로 가는 혈류량이 감소하여 신장에 장애가 있다.또한, HRS와 마찬가지로 신장전 기능부전은 나트륨 농도가 매우 낮은 소변 형성을 유발한다.그러나 HRS와는 대조적으로 신장전 장애는 대개 정맥주사로 치료에 반응하여 혈청 크레아티닌의 감소와 나트륨의 배설 증가를 초래한다.[3]급성관괴사(ATN)는 신장의 관절이 손상되는 것을 수반하며, 독성 약물에 노출되거나 혈압 저하로 인해 간경변이 있는 개인에게 합병증이 될 수 있다.관의 손상 때문에, ATN에 영향을 받은 신장은 보통 소변에서 나트륨을 최대한 재흡수할 수 없다.결과적으로 ATN을 가진 개인은 소변 나트륨 측정치가 HRS보다 훨씬 높기 때문에 실험실 테스트에 기초하여 ATN과 HRS를 구별할 수 있다. 그러나 권선학에서는 항상 그렇지는 않을 수 있다.[5]ATN을 가진 개인은 현미경 검사에서 소변에서 히알린 깁스나 흙갈색 깁스의 증거를 가질 수 있는 반면, HRS를 가진 개인의 소변에는 신장이 직접 상하지 않았기 때문에 일반적으로 세포 물질이 없다.[3]B형 간염과 C형 간염 등 간의 일부 바이러스 감염도 신장의 글루머룰루스에 염증을 일으킬 수 있다.[10][11]간질환이 있는 개인의 신장 기능 부전의 다른 원인으로는 약물 독성(불가독성, 항생제 젠타미닌)이나 조영신피증이 있는데, 이는 의료 영상검사에 사용되는 조영제의 정맥 투여에 의한 것이다.[3]
병리학


간상증후군의 신부전은 신장의 혈관 톤에 이상이 생겨 발생하는 것으로 생각된다.[2]우세한 이론(부족한 이론으로 말함)은 신장 순환에 있는 혈관이 간질환에 의해 방출되는 인자에 의해 매개되는 비장순환(장장에 공급되는 것)에서 확장되어 수축된다는 것이다.[4][12]질산화물, [13]프로스타글란딘,[2][14] 그리고 다른 혈관활성 물질들은[2] 간경변에서 비산정맥관절제술의 강력한 매개체로 가정되어 왔다.[2]이러한 현상의 결과는 헥타글로머 기구가 감지하는 "유효한" 혈액량이 감소하여 레닌 분비가 이루어지고 레닌-안지오텐신 계통이 활성화되어 혈관이 시스템적으로나 구체적으로 신장에 혈관수축이 일어나는 것이다.[2]그러나 이것의 효과는 비장순환의 혈관확장 중재자를 상쇄시키기에 불충분하여 신장순환의 지속적인 '과소화'와 신장혈관확장 악화로 이어져 신부전증을 초래한다.[12]
이 이론을 정량화하기 위한 연구는 간증후군에 전신 혈관 내성이 전반적으로 감소하지만, 심박출력의 측정된 대퇴골과 신장 분율이 각각 증가 및 감소한다는 것을 보여주었고, 이는 신장 결함에 비장 혈관 절제가 관련되어 있음을 시사한다.[15]많은 혈관 활성 화학물질들이 심방 내성인자,[16] 프로스타시클린, 트롬박산 A2,[17] 엔도톡신 등 전신 혈류역학적 변화를 중재하는 데 관여한다는 가설을 세워왔다.[4]이것 이외에, 약물의 정부 내장의 혈관 확장( 같은 ornipressin,[16]terlipressin,[18]과 octreotide)[19]사구체 거르기율(신장 기능의 양적 조치)에 간신 증후군 환자에서는 추후 eviden을 제공하는 improvement으로 이어진다 중화시키기 위해 관찰되었다.는 spl'ce'기계식 혈관확장술은 병원생식의 주요 특징이다.
저충전 이론은 레닌-안지오텐신-알도스테론 계통의 활성화를 수반하는데, 이는 알도스테론에 의해 매개된 신장관절(신장나트륨 아비디티)에서 나트륨의 흡수를 증가시켜 원위경련관 내의 미네랄로코르티코이드 수용체에 작용한다.[8][12]이것은 또한 권태기에 있는 금욕자들의 병원생성에 있어 중요한 단계라고 여겨진다.고환에서 간상증후군으로 발전하는 것은 비장 혈관확장술에서 (타입 2 HRS에서 흔히 볼 수 있는) 고환에서 이뇨제에 대한 저항성과 (위에서 설명한 바와 같이) 신장 혈관확장술의 시작 모두 간상증후군으로 이어지는 스펙트럼이라는 가설이 제기되어 왔다.[8]
예방
간상증후군의 사망위험은 매우 높으며, 따라서 HRS에 위험이 있는 환자의 식별과 HRS 개시를 위한 트리거의 예방에 상당한 강조점이 있다.감염(특이하게 자연발생적인 세균성 복막염)과 위장출혈은 모두 간경변증을 가진 개인의 합병증이며, HRS의 공통적인 유발요인이기 때문에 이러한 합병증을 가진 권열질환의 조기 확인과 치료에서 HRS를 예방하기 위해 구체적인 관리가 이루어진다.[5]HRS에 대한 트리거 중 일부는 아스피트의 처리에 의해 유도되며 예방이 가능하다.이뇨제의 공격적인 사용은 피해야 한다.또한 경혈성 합병증(일부 항생제 등)이나 기타 조건을 치료하기 위해 사용되는 많은 약물은 경혈성 콩팥 기능에 충분한 손상을 일으켜 HRS로 이어질 수 있다.[4][5]또한 불편함을 완화하기 위해 바늘이나 카테터를 사용하여 복부에서 액체를 제거하는 대량의 근위축은 혈류역학에서 HRS를 침전시킬 수 있는 충분한 변화를 일으킬 수 있으므로 위험에 처한 개인에게는 피해야 한다.알부민 주입은 대량의 부피중심점 이후 발생하는 순환장애를 피할 수 있으며 HRS를 예방할 수 있다.[20]반대로, 매우 긴장된 승천을 하는 개인에서는, 신정맥에 대한 압력을 줄이면, 복수를 제거하면 신장 기능이 향상될 수 있다는 가설이 제기되어 왔다.[21]
자연적으로 감염되는 인공호흡기를 가진 개인은 HRS의 발달에 특히 높은 위험에 처해 있다.[2]SBP를 가진 개인들의 경우, 한 무작위 통제 실험에서 입원 당일과 입원 사흘째에 정맥 알부민 투여로 신장 부족률과 사망률이 모두 감소했다는 것을 발견했다.[22]
치료
이식
간성 증후군에 대한 최종적인 치료법은 간 이식이며, 다른 모든 치료법은 이식을 위한 다리라고 가장 잘 묘사할 수 있다.[1][23]간 이식이 HRS에 가장 적합한 관리 옵션인 반면, HRS를 가진 개인의 사망률은 이식 후 첫 달 안에 25%에 이르는 것으로 나타났다.[24]HRS가 있고 간기능장애가 더 크다는 증거(MELD 점수는 36점 이상)가 있는 개인은 간 이식 후 조기 사망 위험이 가장 큰 것으로 밝혀졌다.[24]HRS를 가진 개인의 간 이식 후에도 신장 기능의 추가 저하가 여러 연구에서 입증되었다. 그러나 이는 일시적인 것이며 신장에 독성을 가진 약물의 사용, 특히 타크로리무스나 사이클로스포린과 같은 면역억제제의 도입에 기인한다고 생각되었다.신장 기능을 악화시키는 것으로 알려져 있다.[2]그러나 장기적으로는 간 이식을 받은 HRS를 가진 개인이 거의 보편적으로 신장기능을 회복하고 있으며, 연구결과 3년 생존율이 HRS 이외의 이유로 간 이식을 받은 사람과 비슷하다는 것이 밝혀졌다.[1][2]
간 이식(병원 내 상당한 지연과 관련이 있을 수 있음)을 기대하면서, 신장 기능 보존에 몇 가지 다른 전략이 도움이 되는 것으로 밝혀졌다.여기에는 정맥 내 알부민 주입, 약물(비판적 혈관수축을 유발하는 바소프레신의 유사성에 대한 가장 좋은 증거), 포털 정맥의 압력을 감소시키기 위한 방사선 션트, 투석, 분자 흡착제 재순환 시스템이라 불리는 특수 알부민 결합막 투석 시스템의 사용이 포함된다.(MARS) 또는 간 투석.[2]
의료 요법
간상증후군 환자의 신장 기능이 향상되었다는 많은 주요 연구들은 정맥주사를 투여한 알부민으로 혈장의 부피를 확장하는 것을 포함했다.[2][25][26]정맥주사를 투여하는 알부민의 양은 다양하다. 1일 1kg에 1g의 알부민이 정맥주사로 투여되고, 그 다음 날 20~40g의 알부민이 처방된다.[27]특히, 연구들은 알부민만으로 치료하는 것이 알부민과의 연계로 다른 약물과 함께 하는 치료보다 열등하다는 것을 보여주었다; HRS를 위한 이식 전 치료법을 평가하는 대부분의 연구는 알부민의 다른 의료적 또는 절차적 치료와 함께 사용하는 것을 포함한다.[2][28]
미도드린(Midodrine)은 알파곤(Alpha-agonist)이며 옥트레오티드는 위장관의 혈관 톤 조절에 관여하는 호르몬인 소마토스타틴(somatostatin)의 아날로그물이다.이 약은 각각 전신 혈관수축제와 비장 혈관수축 억제제로서 간성 증후군을 치료할 때 개별적으로 사용할 때 유용하지 않은 것으로 밝혀졌다.[1][2][29]다만, 간상증후군 환자 13명을 대상으로 한 한 연구에서는 두 사람을 함께 사용했을 때(구강으로 미도드린, 혈압에 따라 피하로티드가 투여된 옥트레오티드, 둘 다 투여된 경우) 신장 기능이 크게 향상되어 3명의 환자가 생존해 퇴원하는 것으로 나타났다.[30]피하 옥트레오티드와 구강 미도드로 처리된 HRS를 가진 사람들을 대상으로 한 또 다른 무작위적이고 관찰적인 연구는 30일 동안 생존이 증가했다는 것을 보여주었다.[1][31]
바소프레신 아날로그 오르니프레신은 간성증후군 환자의 신장 기능 향상에 유용한 연구결과가 다수 발견됐으나 주요 장기에 심각한 허혈증을 일으킬 수 있어 사용이 제한돼 왔다.[1][25][32][1][25]테리프레신은 한 대형 연구에서 허혈 발생이 적은 간성 증후군 환자의 신장 기능 향상에 유용한 것으로 밝혀졌지만 미국에서는 구할 수 없는 바소프레신 아날로그다.[1][26]플로렌스 웡이 이끄는 무작위 대조군 실험은 위약보다 테리프레신과 알부민으로 처리된 1형 HRS를 가진 개인들에게 신장 기능이 향상되었음을 보여주었다.[33]이러한 모든 치료법에 대한 주요 비판은 조사 대상의 이질성과 결과 측정으로 사망률 대신 신장 기능을 사용하는 것이었다.[34]
HRS 치료에 사용하기 위해 조사된 다른 약으로는 펜톡시필린,[35] 아세틸시스틴,[36] 오프로스톨 등이 있다.[1][37]이러한 모든 치료법에 대한 증거는 알코올성 간염으로 치료된 환자의 하위 집합에서 추론된, 또는 펜톡시피델린의 경우 어느 한 사례 시리즈에 근거한다.[1]
절차적 치료
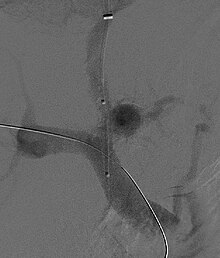
경정맥내 포트로시스템 션트(TIPS)는 포털과 간정맥 사이에 작은 스텐트를 놓음으로써 포털 순환의 고압의 감압을 포함한다.이것은 내부 경정맥이나 대퇴정맥을 통해 간정맥으로 전달되는 방사선학적으로 유도된 카테터를 통해 이루어진다.이론적으로, 포털 압력의 감소는 궁극적으로 간성 증후군의 발달을 이끄는 혈류역학 현상을 역전시키는 것으로 생각된다.TIPS는 간성 증후군 환자의 신장 기능을 향상시키는 것으로 나타났다.[8][38][39]HRS 치료를 위한 TIPS의 합병증으로는 간뇌병증 악화(포토시스템 분쇄를 강제적으로 생성하여 간에서 독소를 제거하는 능력을 효과적으로 우회하게 함), 포탈 압력의 적절한 감소를 달성할 수 없음, 출혈 등이 있다.[8][38]
간 투석은 통상 알부민 결합 막이 들어 있는 2차 투석 회로를 추가해 순환에서 독소를 제거하기 위해 체외 투석을 포함한다.분자 흡착제 재순환장치(MARS)는 간상증후군 환자에게 이식하는 가교로서 일부 효용을 보였지만 아직 초기 단계에 있다.[8][40]
간성 증후군을 가진 개인을 간 이식에 연결하기 위해 신장 대체 요법이 필요할 수 있지만 환자의 상태는 사용된 양식에 영향을 미칠 수 있다.[41]그러나 투석의 사용은 HRS 환자들의 신장기능 회복이나 보존으로 이어지지 않으며, 이식이 일어날 수 있을 때까지 신장기능의 합병증을 피하기 위해서만 기본적으로 사용된다.혈액투석을 받는 환자의 경우 아직 적절한 연구가 수행되지 않았지만 HRS 환자의 저혈압으로 인한 사망 위험이 증가할 수 있다.그 결과, HRS 환자에 대한 신장 대체 치료의 역할은 여전히 불명확하다.[2]
역학
간질환 증후군을 가진 사람의 대다수가 간경변을 앓고 있기 때문에 HRS에 대한 역학 자료의 상당 부분은 권태인구에서 나온 것이다.그 질환은 꽤 흔하다. 약 10%의 사람들이 금욕환자와 함께 병원에 입원해 있다.[9]테리프레스틴으로 치료된 권태기 환자의 소급 사례 시리즈에서는 권태기의 급성 신부전증의 20.0%가 타입 1 HRS에 기인하고, 6.6%가 타입 2 HRS에 기인한다고 밝혔다.[18]간경변과 복통이 있는 사람의 18%는 간경변으로 진단받은 후 1년 이내에 HRS가 발병하고, 이 중 39%는 진단 후 5년 이내에 HRS가 발병할 것으로 추정된다.[9]간 크기, 플라즈마 레닌 활동, 혈청 나트륨 농도 등 세 가지 독립적 위험 요인이 권선화학의 HRS in cirrhotics는 간 크기, 혈청 레닌 활동, 혈청 나트륨 농도.[9]
이러한 환자들의 예후는 치료되지 않은 환자들이 극도로 짧은 생존을 하고 있기 때문에 암울하다.[4][9][23]간질환의 심각성(MELD 점수에서 입증된 바와 같이)이 결과의 결정요인으로 나타났다.[24][42]간경변이 없는 일부 환자는 HRS가 발병하는데, 알코올성 간염 환자에 대한 한 연구에서 약 20%의 발병률을 보였다.[35]
역사
만성 간질환을 앓고 있는 개인에게서 신장 기능 부전에 대한 최초의 보고는 19세기 후반 프레리히스와 플린트에 의한 것이었다.[9]그러나 간성 증후군은 담도 수술의 설정에서 발생한 급성 신부전증으로 처음 정의되었다.[1][43]이 증후군은 곧 고도 간질환과 다시 연관되었고,[23] 1950년대에 셜록, 헤커, 파퍼, 베신 등에 의해 임상적으로 전신 혈류역학적 이상과 높은 사망률과 연관되어 있다고 정의되었다.[9][44]헤커와 셜록은 특히 HRS를 가진 사람들이 소변에서 소변 출력이 낮고, 소변에서 나트륨이 매우 낮으며, 소변에서 단백질이 없다는 것을 확인했다.[1]머레이 엡스타인은 신드롬 환자들의 혈류역학에서 중요한 변화로 비장 혈관수축과 신장 혈관수축이 특징인 최초의 환자였다.[45]HRS에서 신장 장애의 기능성은 간성 증후군 환자로부터 이식된 신장이 새로운 숙주에서 기능을 회복했다는 연구결과에 의해 결정되었고,[46] 간성 증후군은 신장 질환이 아닌 전신 상태라는 가설을 낳았다.간증후군을 정의하기 위한 첫 번째 체계적인 시도는 1994년 간 전문의들의 모임인 국제 아스카이트 클럽에 의해 이루어졌다.HRS의 최근 역사는 이 질환의 비장 및 신장 혈류 이상을 유발하는 다양한 혈관 활성 매개체에 대한 설명과 관련이 있다.[9]
참조
- ^ a b c d e f g h i j k l Ng CK, Chan MH, Tai MH, Lam CW (February 2007). "Hepatorenal syndrome". Clin Biochem Rev. 28 (1): 11–7. PMC 1904420. PMID 17603637.
- ^ a b c d e f g h i j k l m n o Ginès P, Arroyo V (1999). "Hepatorenal syndrome". J. Am. Soc. Nephrol. 10 (8): 1833–9. doi:10.1681/ASN.V1081833. PMID 10446954. Retrieved 17 July 2009.
- ^ a b c d e f g h i j Arroyo V, Ginès P, Gerbes AL, et al. (1996). "Definition and diagnostic criteria of refractory ascites and hepatorenal syndrome in cirrhosis. International Ascites Club". Hepatology. 23 (1): 164–76. doi:10.1002/hep.510230122. PMID 8550036.
- ^ a b c d e Arroyo V, Guevara M, Ginès P (2002). "Hepatorenal syndrome in cirrhosis: pathogenesis and treatment". Gastroenterology. 122 (6): 1658–76. doi:10.1053/gast.2002.33575. PMID 12016430.
- ^ a b c d 무케르지, S.간성 증후군.emedicine.com.2009년 8월 2일 검색됨
- ^ Lenz K; et al. (March 2015). "Treatment and management of ascites and hepatorenal syndrome: an update". Therapeutic Advances in Gastroenterology. 8 (2): 83–100. doi:10.1177/1756283x14564673. PMC 4314304. PMID 25729433.
- ^ Ginés P, Arroyo V, Quintero E, et al. (1987). "Comparison of paracentesis and diuretics in the treatment of cirrhotics with tense ascites. Results of a randomized study". Gastroenterology. 93 (2): 234–41. doi:10.1016/0016-5085(87)91007-9. PMID 3297907.
- ^ a b c d e f Blendis L, Wong F (2003). "The natural history and management of hepatorenal disorders: from pre-ascites to hepatorenal syndrome" (PDF). Clin Med. 3 (2): 154–9. doi:10.7861/clinmedicine.3-2-154. PMC 4952737. PMID 12737373.
- ^ a b c d e f g h i j Ginès A, Escorsell A, Ginès P, et al. (1993). "Incidence, predictive factors, and prognosis of the hepatorenal syndrome in cirrhosis with ascites". Gastroenterology. 105 (1): 229–36. doi:10.1016/0016-5085(93)90031-7. PMID 8514039.
- ^ Han SH (2004). "Extrahepatic manifestations of chronic hepatitis B". Clin Liver Dis. 8 (2): 403–18. doi:10.1016/j.cld.2004.02.003. PMID 15481347.
- ^ Philipneri M, Bastani B (February 2001). "Kidney disease in patients with chronic hepatitis C". Curr Gastroenterol Rep. 3 (1): 79–83. doi:10.1007/s11894-001-0045-0. PMID 11177699. S2CID 21358956.
- ^ a b c Schrier RW, Arroyo V, Bernardi M, Epstein M, Henriksen JH, Rodés J (1988). "Peripheral arterial vasodilation hypothesis: a proposal for the initiation of renal sodium and water retention in cirrhosis". Hepatology. 8 (5): 1151–7. doi:10.1002/hep.1840080532. PMID 2971015. S2CID 40231648.
- ^ Martin PY, Ginès P, Schrier RW (August 1998). "Nitric oxide as a mediator of hemodynamic abnormalities and sodium and water retention in cirrhosis". N. Engl. J. Med. 339 (8): 533–41. doi:10.1056/NEJM199808203390807. PMID 9709047.
- ^ Epstein M (April 1994). "Hepatorenal syndrome: emerging perspectives of pathophysiology and therapy". J. Am. Soc. Nephrol. 4 (10): 1735–53. doi:10.1681/ASN.V4101735. PMID 8068872.
- ^ Fernandez-Seara J, Prieto J, Quiroga J, et al. (1989). "Systemic and regional hemodynamics in patients with liver cirrhosis and ascites with and without functional renal failure". Gastroenterology. 97 (5): 1304–12. doi:10.1016/0016-5085(89)91704-6. PMID 2676683.
- ^ a b Lenz K, Hörtnagl H, Druml W, et al. (1991). "Ornipressin in the treatment of functional renal failure in decompensated liver cirrhosis. Effects on renal hemodynamics and atrial natriuretic factor". Gastroenterology. 101 (4): 1060–7. doi:10.1016/0016-5085(91)90734-3. PMID 1832407.
- ^ Moore K, Ward PS, Taylor GW, Williams R (1991). "Systemic and renal production of thromboxane A2 and prostacyclin in decompensated liver disease and hepatorenal syndrome". Gastroenterology. 100 (4): 1069–77. doi:10.1016/0016-5085(91)90284-r. PMID 2001805.
- ^ a b Moreau R, Durand F, Poynard T, Duhamel C, Cervoni JP, Ichaï P, Abergel A, Halimi C, Pauwels M, Bronowicki JP, Giostra E, Fleurot C, Gurnot D, Nouel O, Renard P, Rivoal M, Blanc P, Coumaros D, Ducloux S, Levy S, Pariente A, Perarnau JM, Roche J, Scribe-Outtas M, Valla D, Bernard B, Samuel D, Butel J, Hadengue A, Platek A, Lebrec D, Cadranel JF (April 2002). "Terlipressin in patients with cirrhosis and type 1 hepatorenal syndrome: a retrospective multicenter study". Gastroenterology. 122 (4): 923–30. doi:10.1053/gast.2002.32364. PMID 11910344.
- ^ Kaffy F, Borderie C, Chagneau C, et al. (January 1999). "Octreotide in the treatment of the hepatorenal syndrome in cirrhotic patients". J. Hepatol. 30 (1): 174. doi:10.1016/S0168-8278(99)80025-7. PMID 9927168.
- ^ Velamati PG, Herlong HF (2006). "Treatment of refractory ascites". Curr Treat Options Gastroenterol. 9 (6): 530–7. doi:10.1007/s11938-006-0009-4. PMID 17081486. S2CID 21860692.
- ^ Sherlock S, Dooley J (2002). "Chapter 9". Diseases of the liver and biliary system. edition 11. Wiley-Blackwell. ISBN 978-0-632-05582-1.
- ^ Sort P, Navasa M, Arroyo V, et al. (1999). "Effect of intravenous albumin on renal impairment and mortality in patients with cirrhosis and spontaneous bacterial peritonitis". N. Engl. J. Med. 341 (6): 403–9. doi:10.1056/NEJM199908053410603. PMID 10432325.
- ^ a b c Wong F, Blendis L (2001). "New challenge of hepatorenal syndrome: prevention and treatment". Hepatology. 34 (6): 1242–51. doi:10.1053/jhep.2001.29200. PMID 11732014. S2CID 22984489.
- ^ a b c Xu X, Ling Q, Zhang M, et al. (May 2009). "Outcome of patients with hepatorenal syndrome type 1 after liver transplantation: Hangzhou experience". Transplantation. 87 (10): 1514–9. doi:10.1097/TP.0b013e3181a4430b. PMID 19461488. S2CID 25409550.
- ^ a b c Guevara M, Ginès P, Fernández-Esparrach G, et al. (1998). "Reversibility of hepatorenal syndrome by prolonged administration of ornipressin and plasma volume expansion". Hepatology. 27 (1): 35–41. doi:10.1002/hep.510270107. PMID 9425914.
- ^ a b Ortega R, Ginès P, Uriz J, et al. (2002). "Terlipressin therapy with and without albumin for patients with hepatorenal syndrome: results of a prospective, nonrandomized study". Hepatology. 36 (4 Pt 1): 941–8. doi:10.1053/jhep.2002.35819. PMID 12297842.
- ^ Ginès P, Cárdenas A, Arroyo V, Rodés J (2004). "Management of cirrhosis and ascites". N. Engl. J. Med. 350 (16): 1646–54. doi:10.1056/NEJMra035021. PMID 15084697.
- ^ Martín-Llahí M, Pépin MN, Guevara M, et al. (May 2008). "Terlipressin and albumin vs albumin in patients with cirrhosis and hepatorenal syndrome: a randomized study". Gastroenterology. 134 (5): 1352–9. doi:10.1053/j.gastro.2008.02.024. PMID 18471512.
- ^ Pomier-Layrargues G, Paquin SC, Hassoun Z, Lafortune M, Tran A (2003). "Octreotide in hepatorenal syndrome: a randomized, double-blind, placebo-controlled, crossover study". Hepatology. 38 (1): 238–43. doi:10.1053/jhep.2003.50276. PMID 12830007.
- ^ Angeli P, Volpin R, Gerunda G, et al. (1999). "Reversal of type 1 hepatorenal syndrome with the administration of midodrine and octreotide". Hepatology. 29 (6): 1690–7. doi:10.1002/hep.510290629. PMID 10347109. S2CID 21213418.
- ^ Esrailian E, Pantangco ER, Kyulo NL, Hu KQ, Runyon BA (2007). "Octreotide/Midodrine therapy significantly improves renal function and 30-day survival in patients with type 1 hepatorenal syndrome". Dig. Dis. Sci. 52 (3): 742–8. doi:10.1007/s10620-006-9312-0. PMID 17235705. S2CID 34909700.
- ^ Gülberg V, Bilzer M, Gerbes AL (1999). "Long-term therapy and retreatment of hepatorenal syndrome type 1 with ornipressin and dopamine". Hepatology. 30 (4): 870–5. doi:10.1002/hep.510300430. PMID 10498636.
- ^ Wong F, Pappas SC, Curry MP, Reddy KR, Rubin RA, Porayko MK, Gonzalez SA, Mumtaz K, Lim N, Simonetto DA, Sharma P, Sanyal AJ, Mayo MJ, Frederick RT, Escalante S, Jamil K (March 2021). "Terlipressin plus Albumin for the Treatment of Type 1 Hepatorenal Syndrome". N Engl J Med. 384 (9): 818–828. doi:10.1056/NEJMoa2008290. PMID 33657294. S2CID 232113995.
- ^ Tandon P, Bain VG, Tsuyuki RT, Klarenbach S (May 2007). "Systematic review: renal and other clinically relevant outcomes in hepatorenal syndrome trials". Aliment. Pharmacol. Ther. 25 (9): 1017–28. doi:10.1111/j.1365-2036.2007.03303.x. PMID 17439502.
- ^ a b Akriviadis E, Botla R, Briggs W, Han S, Reynolds T, Shakil O (2000). "Pentoxifylline improves short-term survival in severe acute alcoholic hepatitis: a double-blind, placebo-controlled trial". Gastroenterology. 119 (6): 1637–48. doi:10.1053/gast.2000.20189. PMID 11113085.
- ^ Holt S, Goodier D, Marley R, et al. (1999). "Improvement in renal function in hepatorenal syndrome with N-acetylcysteine". Lancet. 353 (9149): 294–5. doi:10.1016/S0140-6736(05)74933-3. PMID 9929029. S2CID 31985301.
- ^ Clewell JD, Walker-Renard P (1994). "Prostaglandins for the treatment of hepatorenal syndrome". Ann Pharmacother. 28 (1): 54–5. doi:10.1177/106002809402800112. PMID 8123962. S2CID 208875962.
- ^ a b Wong F, Pantea L, Sniderman K (2004). "Midodrine, octreotide, albumin, and TIPS in selected patients with cirrhosis and type 1 hepatorenal syndrome". Hepatology. 40 (1): 55–64. doi:10.1002/hep.20262. PMID 15239086. S2CID 43508937.
- ^ Guevara M, Rodés J (2005). "Hepatorenal syndrome". Int. J. Biochem. Cell Biol. 37 (1): 22–6. doi:10.1016/j.biocel.2004.06.007. PMID 15381144.
- ^ Mitzner SR, Stange J, Klammt S, et al. (2000). "Improvement of hepatorenal syndrome with extracorporeal albumin dialysis MARS: results of a prospective, randomized, controlled clinical trial". Liver Transpl. 6 (3): 277–86. doi:10.1053/lv.2000.6355. PMID 10827226.
- ^ Witzke O, Baumann M, Patschan D, et al. (2004). "Which patients benefit from hemodialysis therapy in hepatorenal syndrome?". J. Gastroenterol. Hepatol. 19 (12): 1369–73. doi:10.1111/j.1440-1746.2004.03471.x. PMID 15610310. S2CID 28850099.
- ^ Alessandria C, Ozdogan O, Guevara M, et al. (2005). "MELD score and clinical type predict prognosis in hepatorenal syndrome: relevance to liver transplantation". Hepatology. 41 (6): 1282–9. doi:10.1002/hep.20687. PMID 15834937. S2CID 205863757.
- ^ Helwig FC, Schutz CB (1932). "A liver kidney syndrome. Clinical pathological and experimental studies". Surg Gynecol Obstet. 55: 570–80.
- ^ Hecker R, Sherlock S (December 1956). "Electrolyte and circulatory changes in terminal liver failure". Lancet. 271 (6953): 1121–5. doi:10.1016/s0140-6736(56)90149-0. PMID 13377688.
- ^ Wadei HM, Mai ML, Ahsan N, Gonwa TA (September 2006). "Hepatorenal syndrome: pathophysiology and management". Clin J Am Soc Nephrol. 1 (5): 1066–79. doi:10.2215/CJN.01340406. PMID 17699328.
- ^ Koppel MH, Coburn JW, Mims MM, Goldstein H, Boyle JD, Rubini ME (1969). "Transplantation of cadaveric kidneys from patients with hepatorenal syndrome. Evidence for the functional nature of renal failure in advanced liver disease". N. Engl. J. Med. 280 (25): 1367–71. doi:10.1056/NEJM196906192802501. PMID 4890476.




