에타너셉트
Etanercept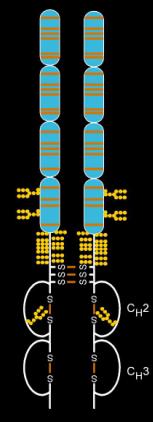 | |
| 임상자료 | |
|---|---|
| 상명 | 엔브렐, 베네팔리, 에렐지 등 |
| 기타 이름 | 에타너셉츠, 에타너셉트예크로 |
| AHFS/Drugs.com | 모노그래프 |
| 메드라인플러스 | a602013년 |
| 라이센스 데이터 | |
| 임신 범주 | |
| 경로: 행정 | 피하 주사 |
| ATC 코드 | |
| 법적현황 | |
| 법적현황 | |
| 약동학 데이터 | |
| 생체이용가능성 | 58~76%(SC) |
| 신진대사 | 레티쿨루엔델리알 시스템(과용) |
| 제거 반감기 | 70시간대 |
| 식별자 | |
| CAS 번호 | |
| 펍켐 SID | |
| 드러그뱅크 | |
| 켐스파이더 |
|
| 유니 | |
| 케그 | |
| 켐벨 | |
| CompTox 대시보드 (EPA) | |
| ECHA InfoCard | 100.224.383 |
| 화학 및 물리적 데이터 | |
| 공식 | C2224H3475N621O698S36 |
| 어금질량 | 51235.07 g·192−1 |
그중에서도 엔브렐이라는 브랜드명으로 판매되는 에타너셉트는 TNF 억제제 역할을 하여 수용성 염증성 사이토카인 종양괴사인자(TNF)를 간섭하여 자가면역질환 치료에 사용되는 생물학적 의료제품이다. 미국 식품의약국(FDA)이 류마티스 관절염, 청소년 특발성 관절염 및 건선 관절염, 명판 건선, 항균성 척추염 치료에 대한 승인을 받았다. 종양 괴사 인자 알파(TNFα)는 많은 장기 시스템에서 염증(면역) 반응의 "주 조절기"이다. 자가면역질환은 면역반응이 지나치게 활발해 발생한다. Etanercept는 TNF-알파를 억제하여 이러한 질병을 치료할 수 있는 잠재력을 가지고 있다.[10]
Etanercept는 재조합 DNA에 의해 생성된 융합 단백질이다. TNF 수용체를 IgG1 항체의 일정한 끝에 융합한다. 먼저 개발자들은 종양 괴사 인자-알파(Alpha)에 결합하는 수용체인 수용성 TNF 수용체 2에 대해 인간 유전자를 암호화하는 DNA 염기서열을 분리했다. 둘째, 그들은 면역글로불린 G1(IgG1)의 Fc end를 위해 인간 유전자를 암호화하는 DNA 염기서열을 분리했다. 셋째, TNF 수용체 2의 DNA를 IgG1 Fc의 DNA에 연결하였고, 마지막으로 TNF 수용체 2의 단백질과 IgG1 Fc의 단백질을 연결하는 단백질을 생산하기 위해 연결된 DNA를 표현하였다.
시제품 핵융합 단백질은 브루스 A가 최초로 합성해 1990년대 초 생체내 TNF 봉쇄를 위한 모달리티로서 활동성이 높고 비정상적으로 안정된 것으로 나타났다. 당시 댈러스에 있는 텍사스 주립대 남서부의료센터의 학계 연구원이었던 베어러와 그의 동료들.[11][12]
이 조사관들은 또한 이 단백질의 모든 사용권을 2002년 암젠이 인수한 생명공학 회사인 이먼텍스에 [13]팔면서 특허를 얻었다.[14]
150kDa의 분자량을 가지는 TNFα고 ankylosing spondylitis,[15]소아 류머티스 관절염, 건선, 건선성 관절염, 류머티스성 관절염, 그리고 잠재적으로 같은 면역 질환 등 질환이 인간과 다른 동물들의 과도한 염증과 관련된에서는 va.에 그것의 역할을 감소시켜 원래 그것은 큰 분자,riet초과 TNFα에 의해 매개되는 다른 장애의 y. 그것은 세계보건기구의 필수 의약품 목록에 올라 있다.[16]
의학적 용법
미국에서는 에탄셉트가 다음에 대해 표시된다.
- 중간에서 중증 류마티스 관절염 (RA) (1998년 11월)[8][17]
- 중경중성 류마티스성 관절염 (1999년 5월)[8][18]
- 시뇨관절염(2002년 1월)[8][19]
- Ankylosing Spondylitis (AS) (2003년 7월)[8][20][21]
- 중경화판 건선(2004년 4월)[8][22]
유럽 연합에서 이타너셉트는 다음을 다루기 위해 표시된다.
- 중간에서 심각한 류마티스성 관절염[9]
- 중증, 활동성 및 진행성 류마티스성 관절염[9]
- 청소년 특발성 관절염[9]
- 다관절염(다관절염-양성 또는 음성) 및 소아 및 청소년기의[9] 확장 올리고관절염
- 활발하고 진행성인 건식성 관절염[9]
- 장염 관련 관절염
- 축성 척추관절염[9]
- 심한 활동성 안키로싱 척추염[9]
- 심한 비강간성 축성 척추관절염[9]
- 보통에서 중증의 명판 건선[9].
- 만성 중증 치석 건선 소아 치석 건선[9]
안전
2008년 5월 2일 미국 식품의약국(FDA)은 이 약과 관련된 다수의 심각한 감염으로 인해 블랙박스 경고문을 에탄셉트에 부착했다.[23] 사망자를 포함한 심각한 감염과 패혈증은 잠복결핵과 B형 간염의 재활성화를 포함한 에탄세르셉트를 사용한 것으로 보고되었다.[8][24]
작용기전
Etanercept는 자연적으로 존재하는 TNF의 영향을 감소시키므로 TNF 억제제로 TNF에 결합하는 데코이 수용체 역할을 한다.[25]
종양 괴사 인자-알파(TNFα)는 백혈구의 두 종류인 림프구와 대식세포에서 생성되는 사이토카인이다. 염증 부위에 백혈구를 추가로 끌어들이고 염증을 유발하고 증폭시키는 추가 분자 메커니즘을 통해 면역 반응을 매개한다. 이타너셉트에 의한 그 작용의 억제는 염증 반응을 감소시키며, 이것은 특히 자가면역질환 치료에 유용하다.
TNF 수용체에는 다른 사이토카인을 방출하여 TNF에 반응하는 백혈구에 내재된 것으로 발견된 수용성 TNF 수용체와 TNF를 비활성화하고 면역 반응을 무디게 하는 데 사용되는 수용성 TNF 수용체 두 종류가 있다. 또한 TNF 수용체는 사실상 모든 핵세포의 표면에서 발견된다(핵이 아닌 적혈구는 그 표면에 TNF 수용체를 포함하지 않는다). 이타너셉션은 자연적으로 발생하는 수용성 TNF 수용체의 억제 효과를 모방하는데, 그 차이점은 단순한 TNF 수용체가 아닌 융합 단백질이기 때문에 혈류에서 반감기가 크게 연장되어 자연적으로 발생하는 수용성 TNF rec보다 심오하고 오래 지속되는 생물학적 효과를 가지고 있기 때문이다.에프터[26]
구조
Etanercept는 IgG1의 Fc 부분에 연결된 두 개의 자연적으로 발생하는 수용성 인간 75 킬로달톤 TNF 수용체의 조합으로 만들어진다.[27] 그 효과는 인공적으로 조작된 조광융단백질이다.[27] Etanercept는 6 N-glycans, 최대 14 O-glycans, 29개의 이황화 교량 구조물을 포함하는 복잡한 분자다.[28][29][30]
역사
이 융합 단백질은 브루스 A에 의해 개발되었다. 당시 댈러스의 텍사스 주립대 서남부병원의 학계 연구원인 베어러와 동료들이 특허를 내고 이머넥스에 판 권리다.[citation needed] 첫 번째 이탄셉트 관련 특허는 1989년 9월 5일에 이먼텍스에 의해 출원되었다.[31]
Etanercept는 1998년 11월 미국에서 사용 승인을 받았다.[8][32]
Etanercept는 2000년 2월 유럽연합에서 사용 승인을 받았다.[9]
사회와 문화
마케팅
북아메리카에서는 암겐이 엔브렐이라는 상표명으로 판매하고 있는데, 하나는 분말 형태로, 다른 하나는 사전 혼합액으로 두 개의 별도 제형으로 판매하고 있다. 와이에스(화이자 일부분)는 다케다제약이 시판하는 일본을 제외한 북미 이외 지역에서 유일하게 에탄셉트를 판매하는 마케터였다.
경제학
미국의 이타너셉트 소매가격은 시간이 지나면서 상승했다. 2008년 에탄셉트 비용은 월 1,500달러 또는 연간 18,000달러였다.[33] 2011년까지 그 비용은 연간 2만 달러를 넘어섰다.[34][35] 2013년 국제보건계획연맹(IFHP)의 조사 결과 미국의 평균 에타네르셉트 비용은 월 2225달러, 즉 연간 2만6700달러인 것으로 나타났다.[36] IFHP 보고서는 또한 25번째 백분위에서는 월 1,946달러, 95번째 백분위에서는 월 4,006달러 사이의 미국의 다양한 건강플랜에 부과되는 가격에서 큰 차이를 발견했다.[36]
Etanercept는 다른 나라들보다 미국에서 더 비싸다.[36] 2013년 현재 조사 대상 국가의 월평균 비용은 스위스 1017달러에서 캐나다 1646달러로 미국의 월평균 비용은 2225달러였다.[36]
암젠은 미국과 캐나다 내에서 이타너셉트를 판매하고, 화이저사는 미국과 캐나다 이외의 지역에서 이 약을 판매한다.[34] 2010년 미국과 캐나다 내 매출은 35억 달러였다.[34] 2010년 미국과 캐나다 외 지역에서의 이타너셉트 매출은 33억 달러였다.[37]
특허
이탄셉트에 대한 특허는 2012년 10월 23일에 만료될 예정이었으나,[38] 미국에서는 16년 더 독점권을 부여하는 두 번째 특허가 허가되었다.[39]
연장되기 전에는 일반인이 이용가능하지 않을 것 같았다. 생물학적 개념으로서, 이타너셉트는 화학적 제형에 적용되는 법칙과는 다른 법칙의 적용을 받는다. 현재 많은 나라들이 일반 생물학의 제조를 허용하지 않고 있다. 그러나 유럽연합과 미국(2009년 생물학 가격 경쟁 및 혁신법)은 현재 "의무적인 임상시험과 정기적인 검토가 필요한" 일반 생물학(바이오시밀러)을 승인하는 시스템을 갖추고 있다.[40]
2013년 4월 인도 제약사 메이저 시플라(Cipla)는 류머티즘 질환 치료를 위해 '이타셉트'라는 브랜드명으로 인도에 첫 바이오시밀러를 출시했다고 발표했다. 이 회사의 2013년 4월 17일 보도 자료는 바이오시밀러가 혁신자에 비해 30% 저렴할 것이라고 주장했다.[41]
삼성과 바이오젠의 합작사인 '삼성바이오에피스'는 2015년 1월 바이오시밀러 의약품인 베네팔리를 유럽의약품청(EMA)에 성공적으로 제출하고 다른 지역에서도 규제 승인을 추진하겠다고 밝혔다. 같은 해 말, 유럽의약품청도 산도즈의 에탄노즈 바이오시밀러 에렐지 리뷰 신청을 받아들였는데, 이는 노바티스가 시판할 것이다.[42]
미국에서 산도즈는 2016년 7월 제안된 이타너셉트 제품 'GP2015'에 대한 바이오로지스 라이선스 신청서(BLA)를 제출했다. 미국 FDA는 1차 신청 절차를 수용한 뒤 유럽 임상시험 자료와 생체분석 조사 자료를 검토, 미국 허가 엔브렐에 대한 GP2015의 생물학적 유사성을 입증했다. 산도즈는 2009년 호프만-라 로슈/임무넥스가 보유한 특허를 무효화하고 암젠에 독점 허가했지만 연방법원에서 패소했다. 그리고 나서 산도즈는 건선 및/또는 건선 관절염 치료 방법과 관련된 특허 침해로 암겐에 의해 반대되었다. Immunex Corp. 외 연구진 vs. 사례 산도즈 외, 16-cv-01118-CCC-JBC(D.N.J.)가 계류 중이다.[43]
미국 의사 에드워드 토비닉은 뇌졸중과 뇌손상 후 만성 신경장애를 치료하기 위해 이탄셉트 사용법을 발명해 미국 특허 89만583건을 포함한 미국과 외국 특허를 냈다.[44][45]
바이오시밀러
2016년 1월 베네팔리는 유럽연합(EU)에서 사용 승인을 받았다.[46]
라이프미어는 2017년 2월 유럽연합(EU)에서 사용 승인을 받았다.[47] 2020년 2월 시장에서 철수했다.[48]
2017년 6월 에렐지는 유럽연합(EU)에서 사용 승인을 받았다.[49]
2019년 3월 일본에서 YLB113(YL바이오로직스 Etanercept biosimilar by YL Biologics)이 승인되었다.[50]
2020년 5월 네페스토는 유럽연합(EU)[51]에서 사용 승인을 받았다.
렘티와 에테라는 2020년 10월 호주에서 의료용 허가를 받았다.[1][52][3][4]
유사 에이전트
참조
- ^ Jump up to: a b https://www.tga.gov.au/sites/default/files/auspar-etanercept-210224.pdf
- ^ "Etanercept Use During Pregnancy". Drugs.com. 24 January 2020. Retrieved 13 August 2020.
- ^ Jump up to: a b "Rymti ARTG". Therapeutic Goods Administration (TGA). Retrieved 12 June 2021.
- ^ Jump up to: a b "Etera ARTG". Therapeutic Goods Administration (TGA). Retrieved 12 June 2021.
- ^ "Benepali 25 mg solution for injection in pre-filled syringe - Summary of Product Characteristics (SmPC)". (emc). 25 January 2021. Retrieved 12 June 2021.
- ^ "Enbrel 25mg solution for injection in pre-filled pen - Summary of Product Characteristics (SmPC)". (emc). 8 June 2021. Retrieved 12 June 2021.
- ^ "Erelzi 50 mg solution for injection in pre filled pen - Summary of Product Characteristics (SmPC)". (emc). 25 May 2021. Retrieved 12 June 2021.
- ^ Jump up to: a b c d e f g h "Enbrel- etanercept solution Enbrel- etanercept kit". DailyMed. Retrieved 17 April 2021.
- ^ Jump up to: a b c d e f g h i j k l "Enbrel EPAR". European Medicines Agency (EMA). Retrieved 2 April 2020. 본문은 유럽 의약청인 이 출처로부터 복사되었다. 출처가 인정되면 재생산은 허가된다.
- ^ Feldmann M, Maini RN (October 2003). "TNF defined as a therapeutic target for rheumatoid arthritis and other autoimmune diseases". Nature Medicine. 9 (10): 1245–50. doi:10.1038/nm939. PMID 14520364. S2CID 52860838.
- ^ Peppel K, Crawford D, Beutler B (December 1991). "A tumor necrosis factor (TNF) receptor-IgG heavy chain chimeric protein as a bivalent antagonist of TNF activity". The Journal of Experimental Medicine. 174 (6): 1483–89. doi:10.1084/jem.174.6.1483. PMC 2119031. PMID 1660525.
- ^ Peppel K, Poltorak A, Melhado I, Jirik F, Beutler B (November 1993). "Expression of a TNF inhibitor in transgenic mice". Journal of Immunology. 151 (10): 5699–703. PMID 7693816.
- ^ 미국 특허 번호: 544만 7,851건
- ^ "Arthritis Drug Effective for Depression in Psoriasis Sufferers". Archived from the original on 2007-10-20. Retrieved 2008-01-10.
- ^ Braun J, McHugh N, Singh A, Wajdula JS, Sato R (June 2007). "Improvement in patient-reported outcomes for patients with ankylosing spondylitis treated with etanercept 50 mg once-weekly and 25 mg twice-weekly". Rheumatology. 46 (6): 999–1004. doi:10.1093/rheumatology/kem069. PMID 17389658.
- ^ World Health Organization (2019). World Health Organization model list of essential medicines: 21st list 2019. Geneva: World Health Organization. hdl:10665/325771. WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
- ^ Siegel JP (November 2, 1998). "Approval of Etanercept for treatment of rheumatoid arthritis" (PDF). Letter to Sally Gould. U.S. Food and Drug Administration (FDA). Retrieved April 14, 2015.
- ^ Weiss, Karen D. (May 27, 1999). "Approval of Etanercept for treatment of polyarticular course juvenile rheumatoid arthritis (JRA)" (PDF). Letter to Sally Gould. U.S. Food and Drug Administration (FDA). Retrieved April 14, 2015.
- ^ Weiss KD (January 15, 2002). "Approval of Etanercept for treatment of psoriatic arthritis". Letter to Sally Gould. U.S. Food and Drug Administration (FDA). Retrieved April 14, 2015.
- ^ Keegan P (July 24, 2003). "Approval of Etanercept for treatment of ankylosing spondylitis" (PDF). Letter to Douglas Hunt. U.S. Food and Drug Administration (FDA). Retrieved April 14, 2015.
- ^ Maxwell LJ, Zochling J, Boonen A, Singh JA, Veras MM, Tanjong Ghogomu E, Benkhalti Jandu M, Tugwell P, Wells GA (April 2015). "TNF-alpha inhibitors for ankylosing spondylitis". The Cochrane Database of Systematic Reviews. 4 (4): CD005468. doi:10.1002/14651858.CD005468.pub2. PMID 25887212.
- ^ Walton M (April 30, 2004). "Approval of Etanercept for treatment of moderate to severe plaque psoriasis" (PDF). Letter to Douglas Hunt. U.S. Food and Drug Administration (FDA). Retrieved April 14, 2015.
- ^ "Wyeth and Amgen heighten warning of life-threatening infections on skin drug Enbrel". Archived from the original on 2008-05-05. Retrieved 2008-05-02.
- ^ Safety Update on TNF- α Antagonists: Infliximab and Etanercept (PDF). U.S. Food and Drug Administration (FDA). pp. 13–14. Retrieved 20 December 2013.[데드링크]
- ^ Zalevsky J, Secher T, Ezhevsky SA, Janot L, Steed PM, O'Brien C, Eivazi A, Kung J, Nguyen DH, Doberstein SK, Erard F, Ryffel B, Szymkowski DE (August 2007). "Dominant-negative inhibitors of soluble TNF attenuate experimental arthritis without suppressing innate immunity to infection". Journal of Immunology. 179 (3): 1872–83. doi:10.4049/jimmunol.179.3.1872. PMID 17641054.
- ^ Madhusudan S, Muthuramalingam SR, Braybrooke JP, Wilner S, Kaur K, Han C, Hoare S, Balkwill F, Ganesan TS (September 2005). "Study of etanercept, a tumor necrosis factor-alpha inhibitor, in recurrent ovarian cancer". Journal of Clinical Oncology. 23 (25): 5950–59. doi:10.1200/JCO.2005.04.127. PMID 16135466.
- ^ Jump up to: a b Smola MG, Soyer HP, Scharnagl E (October 1991). "Surgical treatment of dermatofibrosarcoma protuberans. A retrospective study of 20 cases with review of literature". European Journal of Surgical Oncology. 17 (5): 447–53. PMID 1936291.
- ^ Houel S, Hilliard M, Yu YQ, McLoughlin N, Martin SM, Rudd PM, Williams JP, Chen W (January 2014). "N- and O-glycosylation analysis of etanercept using liquid chromatography and quadrupole time-of-flight mass spectrometry equipped with electron-transfer dissociation functionality". Analytical Chemistry. 86 (1): 576–84. doi:10.1021/ac402726h. PMID 24308717.
- ^ Mukai Y, Nakamura T, Yoshikawa M, Yoshioka Y, Tsunoda S, Nakagawa S, Yamagata Y, Tsutsumi Y (November 2010). "Solution of the structure of the TNF-TNFR2 complex". Science Signaling. 3 (148): ra83. doi:10.1126/scisignal.2000954. PMID 21081755. S2CID 24226117.
- ^ Lamanna WC, Mayer RE, Rupprechter A, Fuchs M, Higel F, Fritsch C, Vogelsang C, Seidl A, Toll H, Schiestl M, Holzmann J (June 2017). "The structure-function relationship of disulfide bonds in etanercept". Scientific Reports. 7 (1): 3951. Bibcode:2017NatSR...7.3951L. doi:10.1038/s41598-017-04320-5. PMC 5479810. PMID 28638112.
- ^ Norman P (January 2017). "Enbrel and etanercept biosimilars: a tale of two patent systems". Pharmaceutical Patent Analyst. 6 (1): 5–7. doi:10.4155/ppa-2016-0043. PMID 28201948.
- ^ "Etanercept Product Approval Information - Licensing Action 12/2/98". U.S. Food and Drug Administration (FDA). 1 April 2016. Archived from the original on 18 January 2017. Retrieved 4 June 2020.
- ^ "신세대 마약에 대한 엄청난 가격표 이면에 있는 것은 무엇인가? 암젠의 대표적인 류마티스 관절염 치료제인 엔브렐의 생산 배후에 있는 이야기는 생체공학으로 만들어진 약이 왜 그렇게 비싼가에 대한 통찰력을 제공한다." 캐롤 M. 2008년 8월 18일 시애틀 타임스 오스트롬
- ^ Jump up to: a b c 2011년 11월 23일 뉴욕타임스 앤드루 폴록, "암겐 약물 메이 언더컷 건강관리 계획"
- ^ 2011년 11월 3일 보스턴 헤럴드의 메러디 이간, "코페이 상승은 고통스러운 현실이다; 미라클 약 한 달 가격이 42달러에서 600달러로 급등한다."
- ^ Jump up to: a b c d "2013 Comparative Price Report" (PDF). International Federation of Health Plans. Retrieved 24 November 2017.
- ^ "Portions of the 2010 Financial Report". Sec.gov. Retrieved 2019-06-05.
- ^ "Patent Terms Extended Under 35 USC §156".
- ^ "New Amgen Enbrel patent could block biosimilars until 2028". 2011-11-25. Retrieved 2019-07-14.
- ^ Kaldre I (2008). "The Future of Generic Biologics: Should the United States "Follow-On" the European Pathway?". www.law.duke.edu. Retrieved 2019-06-05.
- ^ "Cipla - Home" (PDF). Cipla.com. Retrieved 2019-06-05.
- ^ 바이오시밀러 에타너셉트는 EU GaBI Online – Generics and Biosimilars Initiative(2015년 1월)에 승인을 요청했다. 2016년 7월 13일 회수됨.
- ^ 2016년 7월 13일 FDA 브리핑 문서 관절염 자문 위원회 회의 FDA AAC 개요. BLA 761042, GP2015, Enbrel과 바이오시밀러 제안. 2016년 7월 13일 회수됨.
- ^ "New hope for survivors of stroke and traumatic brain injury". Springer Select. October 31, 2012. Retrieved November 17, 2018.
- ^ [1], "바이오로직스를 활용한 뇌손상 치료방법", 2011-10-31 발행
- ^ "Benepali EPAR". European Medicines Agency (EMA). Retrieved 2 April 2020.
- ^ "Lifmior EPAR". European Medicines Agency (EMA). Retrieved 2 April 2020.
- ^ "Public statement on Lifmior: Withdrawal of the marketing authorisation in the European Union" (PDF). Retrieved 2 April 2020.
- ^ "Erelzi EPAR". European Medicines Agency (EMA). Retrieved 2 April 2020.
- ^ "Japanese approval for Lupin's etanercept biosimilar".
- ^ "Nepexto EPAR". European Medicines Agency (EMA). 24 March 2020. Retrieved 4 June 2020.
- ^ "AusPAR: Etanercept". Therapeutic Goods Administration (TGA). 25 February 2021. Retrieved 12 June 2021.
외부 링크
| 위키미디어 커먼즈에는 에타너셉트와 관련된 미디어가 있다. |
- "Etanercept". Drug Information Portal. U.S. National Library of Medicine.


