육불화황
Sulfur hexafluoride
| | |||
 | |||
| 이름 | |||
|---|---|---|---|
| IUPAC 이름 육불화황 | |||
| 시스템 IUPAC 이름 헥사플루오로γ술판6[1] | |||
| 기타 이름 엘라가스 에사플론 | |||
| 식별자 | |||
3D 모델(JSmol) | |||
| 체비 | |||
| 켐스파이더 | |||
| ECHA 정보 카드 | 100.018.050 | ||
| EC 번호 |
| ||
| 2752 | |||
| 케그 | |||
| 메쉬 | 황+헥사플루오르화물 | ||
PubChem CID | |||
| RTECS 번호 |
| ||
| 유니 | |||
| UN 번호 | 1080 | ||
CompTox 대시보드 (EPA ) | |||
| |||
| |||
| 특성. | |||
| SF6 | |||
| 몰 질량 | 146.06 g/g | ||
| 외모 | 무색 가스 | ||
| 냄새 | 무취의[2] | ||
| 밀도 | 6.17g/L | ||
| 녹는점 | -64 °C, -83 °F, 209 K | ||
| 비등점 | -50.8°C(-59.4°F, 222.3K) | ||
| 임계점(T, P) | 45.51±0.1°C, 3.749±0.01MPa[3] | ||
| 0.003%(25°[2]C) | |||
| 용해성 | 물에 약간 녹는, 에탄올, 헥산, 벤젠에 매우 녹는 | ||
| 증기압 | 2.9 MPa (21.1 °C에서) | ||
자화율(δ) | -44.0×10cm−63/세로 | ||
| 열전도율 |
| ||
| 점성 | 15.23μPa/s[5] | ||
| 구조. | |||
| 정형외과, oP28 | |||
| 오h | |||
| 직교 육각형 | |||
| 팔면체 | |||
| 0 D | |||
| 열화학 | |||
열용량 (C) | 0.097 kJ/(mol·K)(정압) | ||
표준 어금니 엔트로피 (S | 292 J·mol−1·K−1[6] | ||
표준 엔탈피/ 형성 (δHf⦵298) | - 1209 kJ/mol−1[6] | ||
| 약리학 | |||
| V08DA05 (WHO) | |||
| 라이선스 데이터 | |||
| 위험 요소 | |||
| GHS [7]라벨링: | |||
 | |||
| 경고 | |||
| H280 | |||
| P403 | |||
| NFPA 704(파이어 다이아몬드) | |||
| NIOSH(미국 건강 노출 제한): | |||
PEL(허용) | TWA 1000ppm(6000mg/m3)[2] | ||
REL(권장) | TWA 1000ppm(6000mg/m3)[2] | ||
IDLH(즉시 위험) | N.D.[2] | ||
| 안전 데이터 시트(SDS) | 외부 MSDS | ||
| 관련 화합물 | |||
관련 불화황 | 디술프 데카플루오르화물 | ||
관련 화합물 | 육불화 셀레늄 | ||
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |||
육불화황(SF)6 또는 육불화황(영국식 철자)은 전기 절연체 및 아크 억제제로 [8][9]주로 사용되는 매우 강력하고 지속적인 온실가스입니다.무기질, 무색, 무취, 불연성, 무독성입니다.SF는
6 중심 유황 원자에 부착된 6개의 불소 원자로 구성된 8면체 형상을 가지고 있습니다.그것은 고가의 분자입니다.
비극성
6 가스의 경우 SF는 물에 잘 녹지 않지만 비극성 유기 용제에는 상당히 용해됩니다.해수면 조건에서의 밀도는 6.12 g/L로 공기 밀도(1.225 g/L)보다 상당히 높다.그것은 일반적으로 액화 압축 기체로 운반된다.
2021년 지구 대류권의 SF
6 농도는 10.63ppt/[10]년에 0.36ppt로 증가했다.지난 40년 동안의 증가는 중압 및 고전압 개폐 장치에 포함된 SF 가스
6 뱅크에서 방출되는 방출을 포함한 전력 부문의 확대에 의해 크게 추진되었습니다.마그네슘, 알루미늄 및 전자 제품 제조에 사용되는 것도 대기 [11]성장을 가속화했습니다.
합성 및 반응
지구상에 존재하는 육불화황은 주로 인공 산업용 가스로 존재하지만 자연적으로 [12]발생하는 것으로 밝혀졌다.
SF는
6 S에서
2 F까지의 노출을
8 통해 요소로부터 준비할 수 있다.이것은 1901년에 발견한 앙리 모상과 폴 르보가 사용했던 방법이기도 하다.일부 다른 불소화황은 코제너레이션되지만 혼합물을 가열하여 SF(독성이 매우 높음)를
2
10 불균형하게 한 다음 제품을 NaOH로 문질러 SF를
4 파괴함으로써 제거된다.
또는 브롬을 이용하여 다음과 [13]같이 낮은 온도(예: 100 °C)에서 SF 및 CoF로부터43 육불화황을 합성할 수 있다.
SF에 대한
6 반응 화학은 사실상 없다.SF의6 불활성성에 대한 주요 기여는 황 원자의 입체 장애이며, SeF와6 같은 무거운 16족 원자의 반응성은 SF보다 낮다6(가수분해 [14]예 참조).끓는점 [15]이하의 녹은 나트륨과 반응하지 않고 리튬과 발열 반응합니다.
적용들
전력 산업은 2000년에 생산된 육불화황의 약 80%를 가스 유전 [16]매체로 사용했습니다.2015년 현재 다른 주요 용도로는 반도체 제조를 위한 실리콘 식각제와 마그네슘 [17]주조를 위한 불활성 가스가 있습니다.
유전 매체
SF는
6 고전압 6불화황 회로 차단기, 스위치 기어 및 기타 전기 기기의 기체 유전 매체로 전기 산업에서 사용되며 유해한 폴리염화 비페닐(PCB)을 포함할 수 있는 오일 충전 회로 차단기(OCB)를 대체하는 경우가 많습니다.SF
6 가스는 공기나 건조 질소보다 유전 강도가 훨씬 높기 때문에 가스 절연 스위치 기어(GIS)에서 절연체로 사용됩니다.높은 유전 강도는 가스의 높은 전기음성도와 밀도의 결과입니다.이러한 특성을 통해 전기 기어의 크기를 크게 줄일 수 있습니다.따라서 GIS는 공기 절연 전기 기구에 비해 실내 배치와 같은 특정 목적에 더 적합합니다. 공기 절연 전기 기구는 공간을 상당히 많은 공간을 차지합니다.
가스 절연 전기 기구는 또한 오염과 기후의 영향에 대한 내성이 더 강할 뿐만 아니라 제어된 작동 환경 때문에 장기 작동 시 신뢰성이 더 높습니다.아크에 노출되면 화학적으로 SF가 분해되지만
6 대부분의 분해 생성물은 SF를 빠르게 재형성하는
6 경향이 있습니다.이 과정은 "셀프 힐링"[18]이라고 불립니다.아크나 코로나는 포스겐과 유사한 독성을 가진 독성이 강한 디황 데카플루오르화물(SF)
2
10을 발생시킬 수 있다.SF는
2
10 열상이나 피부 염증을 일으키지 않아 노출에 대한 경고가 거의 없기 때문에 제2차 세계대전 당시 잠재적 화학전 매개체로 여겨졌다.
SF는
6 또한 Van de Graff 발생기 및 펠레트론과 같은 입자 가속기의 고전압 공급 및 고전압 투과 전자 현미경에서 고전압 유전체로 흔히 볼 수 있습니다.
유전체 가스로서의 SF의
6 대안에는 몇 가지 플루오로케톤이 [19][20]포함된다.진공 스위칭과 청정 공기 단열재를 결합한 소형 GIS 기술이 최대 420kV의 [21]일부 애플리케이션에 도입되었습니다.
의료용
SF는
6 망막 박리 복구 작업에서[22] 기포 형태로 망막 구멍의 탐포나드 또는 플러그를 제공하기 위해 사용됩니다.유리실에서[23] 불활성이고 처음에는 36시간 만에 부피가 두 배로 증가하다가 10-14일 [24]만에 혈액에 흡수된다.
초음파
6 영상촬영용 조영제로 SF를 사용한다.말초정맥에 주입하여 육불화황 마이크로버블을 용액에 투여한다.이 미세 기포들은 혈관의 초음파를 보는 시야를 높여준다.이 애플리케이션은 [25]종양의 혈관성을 검사하는 데 사용되어 왔다.그것은 혈액에서 3분에서 8분 동안 보이고,[26] 폐에 의해 내쉬어진다.
트레이서 화합물
육불화황은 첫 번째 도로 공기 분산 모델 보정에 사용된 추적 가스입니다. 이 연구 프로그램은 미국 환경 보호청의 후원으로 미국 101번 고속도로 [27]서니베일에서 실시되었습니다.SF가스는
6 건물 및 실내외기에서의 단기 환기효율 실험 및 침투율 결정에 트레이서 가스로 사용된다.그 사용을 권장하는 두 가지 주요 요소: 그것의 농도는 매우 낮은 농도에서도 만족스러운 정확도로 측정될 수 있고, 지구 대기의 SF 농도는
6 무시해도 될 정도로 낮다.
6불화황은 2007년 3월 25일 영국 런던의 세인트 존스 우드 튜브 스테이션에서의 실험에서 무독성 시험 가스로 사용되었다.[28]가스는 역 전체에 방출되어 표류하는 것을 감시하고 있었다.더글러스 알렉산더 교통부 장관이 3월 초 발표한 이 실험의 목적은 테러 공격 중 독성 가스가 런던 지하철역과 건물 전체에 어떻게 퍼질지 조사하는 것이었다.
6불화황은 실험실 후드 격납 테스트에서 추적 가스로도 정기적으로 사용됩니다.가스는 ASHRAE 110 흄 후드 자격의 최종 단계에서 사용됩니다.흄 후드 내부에 가스 플룸을 생성하고, 흄 후드의 격납 특성을 확인하기 위해 흄 후드 외부에 배치된6 가스 분석기가 SF를 시료화하면서 일련의 시험을 실시한다.
그것은 해양학에서 디아피칼 혼합과 공기-바다 가스 [29]교환을 연구하는 트레이서로 성공적으로 사용되어 왔다.
기타 용도
- 마그네슘 업계는 주조 [30]중 산화를 방지하기 위해 SF를 불활성 "커버 가스"로 사용합니다
6.한때 가장 많은 사용자가 사용하던 소비는 회수 및 [11]재활용과 함께 크게 감소했습니다. - 단열 유리창은 열 및 [31][32]방음 성능을 개선하기 위한 필러로 사용되었습니다.
- SF
6 플라즈마는 반도체 산업에서 딥 리액티브 이온 식각과 같은 공정에서 식각제로 사용됩니다.SF의
6 소량은 플라즈마 내에서 황과 불소로 분해되며 불소 이온은 [33]실리콘과 화학 반응을 일으킨다. - 타이어가 채워진 타이어는 분자 [31]크기가 크기 때문에 고무에 의한 확산으로부터 공기를 빼는 데 시간이 오래 걸립니다.
- 나이키도 [34]1992년부터 2006년까지 에어라는 브랜드 신발에 쿠션백을 채워 넣기 위해 사용했고 1997년에는 [31]277t이 최고조에 달했다.
- 미 해군의 마크 50 어뢰 폐쇄형 랭킨 사이클 추진 시스템은 고체 [35]리튬과의 발열 반응으로 육불화황에 의해 작동된다.
- 고출력 마이크로파 시스템의 도파로는 그것과 함께 가압됩니다.가스는 도파로를 전기적으로 절연하여 내부 아크를 방지합니다.
- 정전 확성기는 높은 유전 강도와 높은 분자량 때문에 [36]그것을 사용해 왔다.
- 화학무기 디황 데카플루오르화물은 그것을 원료로 하여 제조된다.
- 엔터테인먼트를 위해 SF는
6 숨을 쉴 때 음성을 크게 높입니다.이 비디오에서 볼 수 있듯이 SF의 밀도는 공기보다 훨씬 높기 때문입니다.이것은 저밀도 헬륨 호흡의 더 잘 알려진 효과와 관련이 있는데, 이것은 누군가의 목소리를 훨씬 더 높게 만든다.이 두 가지 효과는 모두 폐가 공기 중에서 추출하려는 산소를 이 가스가 대체하기 때문에 주의해서만 시도해야 합니다.육불화황도 가벼운 [37]마취제입니다. - 가벼운 호일 보트는 탱크에 띄울 수 있고, 공기로 채워진 풍선도 띄울 수 있기 때문에 "보이지 않는 물"로서의 과학 시연/마법.
- DEA(Associative and Deariative Electron Attachment) 실험에서[38][39] 벤치마크 및 교정 측정에 사용됩니다.
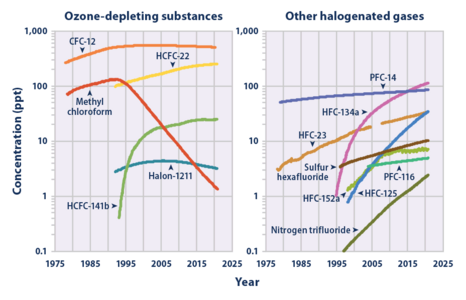
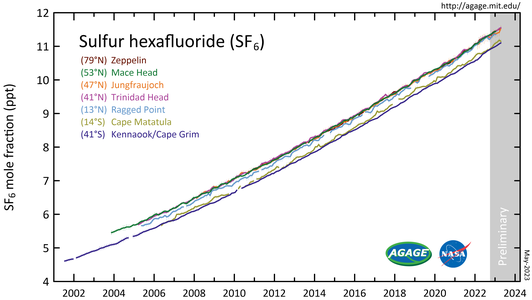
온실 가스
지구 대류권 SF의
6 풍부성과 증가율(1978-2018).[11]
기후변화에 관한 정부간 패널(Intergovernment Panel on Climate Change)에 따르면, SF는
6 지금까지 평가된 가장 강력한 온실가스이며, 지구 온난화 잠재력은 100년 동안 [40]CO의 23
2,900배이다.육불화황은 대류권과 성층권에서는 불활성이며 대기 수명이 800-3200년으로 [41]매우 길다.
SF의6 세계 평균 혼합비율은 산업화 전 약 54ppt에서[12] 2020년 4월 현재 10ppt 이상으로 매년 0.35ppt(3.5%)[10][42]씩 증가하고 있다.1980년대와 1990년대에 전 세계6 평균 SF 농도는 마그네슘 생산과 전기 설비 및 전자 제품 제조업체에 의한 사용으로 인해 매년 약 7%씩 증가했습니다.이산화탄소에 비해 적은 양의 SF가6 방출되는 것을 감안하면, 지구 온난화에 대한 전반적인 개인의 기여는 0.2% [43]미만으로 추정되지만, 2020년 [44]현재 SF와 유사한 인공 할로겐화 가스의 집단 기여는 약 10%에 달했다.대안은 [45][46]테스트 중입니다.
유럽에서는 SF가
6 [8]F-Gas 지침에 따라 여러 응용 프로그램에 대한 사용을 금지하거나 제어합니다.2006년 1월 1일부터 SF는
6 트레이서 가스로서 고압 [47]개폐 장치를 제외한 모든 애플리케이션에서 사용이 금지되었습니다.2013년 미국 에너지부가 고압 절연체로 사용되는 프린스턴 플라즈마 물리학 연구소와 같은 미국 내 연구소에서 누출을 확인하고 수리하기 위한 3년간의 노력이 생산적이었으며 연간 누출량을 1,030kg(2,280파운드) 줄였다고 보고되었다.이는 구입과 재고품을 비교하여 차액이 누출되었다고 가정하고 [48]누출을 찾아 수리하는 방식으로 수행되었습니다.
생리학적 영향 및 주의사항
육불화황은 무독성 가스이지만, 폐에 있는 산소를 대체함으로써 너무 많이 [49]흡입하면 질식할 위험이 있다.공기보다 밀도가 높기 때문에 방출될 때 상당량의 가스가 저지대에 정착하고 해당 지역에 진입할 경우 질식 위험이 크다.작업자가 [50]SF가 포함된
6 장비 아래의 트렌치 또는 구덩이에 있을 수 있으므로 이는 전기 장비의 절연체로 사용하는 것과 특히 관련이 있다.
모든 가스와 마찬가지로 SF의
6 밀도는 성관의 공명 주파수에 영향을 미쳐 이를 들이마시는 사람의 음색 또는 음색을 크게 변화시킵니다.성대 주름의 진동에는 영향을 주지 않습니다.6불화황의 밀도는 가스의 큰 몰 질량 때문에 상온과 압력에서 상대적으로 높습니다.약 4g/mol의 몰 질량을 가지고 음성을 높이는 헬륨과 달리 SF는
6 약 146g/mol의 몰 질량을 가지고 있으며, 가스를 통과하는 음속은 상온에서 약 134m/s로 음성을 낮춘다.비교를 위해 질소 80%와 산소 20%인 공기의 몰 질량은 약 30g/mol로 음속 343m/[51]s로 이어진다.
육불화황은 [52]아산화질소보다 마취능력이 약간 낮으며 가벼운 마취제로 [53]분류된다.
「 」를 참조해 주세요.
레퍼런스
- ^ "Sulfur Hexafluoride - PubChem Public Chemical Database". PubChem. National Center for Biotechnology Information. Archived from the original on 3 November 2012. Retrieved 22 February 2013.
- ^ a b c d e NIOSH Pocket Guide to Chemical Hazards. "#0576". National Institute for Occupational Safety and Health (NIOSH).
- ^ Horstmann, Sven; Fischer, Kai; Gmehling, Jürgen (2002). "Measurement and calculation of critical points for binary and ternary mixtures". AIChE Journal. 48 (10): 2350–2356. doi:10.1002/aic.690481024. ISSN 0001-1541.
- ^ Assael, M. J.; Koini, I. A.; Antoniadis, K. D.; Huber, M. L.; Abdulagatov, I. M.; Perkins, R. A. (2012). "Reference Correlation of the Thermal Conductivity of Sulfur Hexafluoride from the Triple Point to 1000 K and up to 150 MPa". Journal of Physical and Chemical Reference Data. 41 (2): 023104–023104–9. Bibcode:2012JPCRD..41b3104A. doi:10.1063/1.4708620. ISSN 0047-2689.
- ^ Assael, M. J.; Kalyva, A. E.; Monogenidou, S. A.; Huber, M. L.; Perkins, R. A.; Friend, D. G.; May, E. F. (2018). "Reference Values and Reference Correlations for the Thermal Conductivity and Viscosity of Fluids". Journal of Physical and Chemical Reference Data. 47 (2): 021501. Bibcode:2018JPCRD..47b1501A. doi:10.1063/1.5036625. ISSN 0047-2689. PMC 6463310. PMID 30996494.
- ^ a b Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A23. ISBN 978-0-618-94690-7.
- ^ GHS: 2021-12-13에 접속된 산업안전보건연구소의 GESTIS 물질 데이터베이스 내의 Schwefelhexafluorid 기록.
- ^ a b David Nikel (2020-01-15). "Sulfur hexafluoride: The truths and myths of this greenhouse gas". phys.org. Retrieved 2020-10-18.
- ^ Marie-Charlotte Guetlein and Carine Sebi (2020-10-14). "Toward the end of SF6, the most powerful greenhouse gas?". The Conversation.
- ^ a b "Trends in Atmospheric Sulpher Hexaflouride". US National Oceanic and Atmospheric Administration. Retrieved 26 April 2022.
- ^ a b c Simmonds, P. G., Rigby, M., Manning, A. J., Park, S., Stanley, K. M., McCulloch, A., Henne, S., Graziosi, F., Maione, M. 및 기타 19(2020) 대기 중 부담 증가"아트모, 화학. 물리, 20:7271-7290.doi:10.5194/acp-20-7271-2020.
 자료는 Creative Commons Attribution 4.0 International License에 따라 제공되는 이 소스로부터 복사되었습니다.
자료는 Creative Commons Attribution 4.0 International License에 따라 제공되는 이 소스로부터 복사되었습니다. - ^ a b Busenberg, E. and Plummer, N. (2000). "Dating young groundwater with sulfur hexafluoride: Natural and anthropogenic sources of sulfur hexafluoride". Water Resources Research. American Geophysical Union. 36 (10): 3011–3030. Bibcode:2000WRR....36.3011B. doi:10.1029/2000WR900151.
{{cite journal}}: CS1 maint: 여러 이름: 작성자 목록(링크) - ^ Winter, R. W.; Pugh, J. R.; Cook, P. W. (January 9–14, 2011). SF5Cl, SF4 and SF6: Their Bromine−facilitated Production & a New Preparation Method for SF5Br. 20th Winter Fluorine Conference.
- ^ Duward Shriver; Peter Atkins (2010). Inorganic Chemistry. W. H. Freeman. p. 409. ISBN 978-1429252553.
- ^ Raj, Gurdeep (2010). Advanced Inorganic Chemistry: Volume II (12th ed.). GOEL Publishing House. p. 160. 160페이지 발췌
- ^ Constantine T. Dervos; Panayota Vassilou (2000). "Sulfur Hexafluoride: Global Environmental Effects and Toxic Byproduct Formation". Journal of the Air & Waste Management Association. Taylor and Francis. 50 (1): 137–141. doi:10.1080/10473289.2000.10463996. PMID 10680375. S2CID 8533705.
- ^ Deborah Ottinger; Mollie Averyt; Deborah Harris (2015). "US consumption and supplies of sulphur hexafluoride reported under the greenhouse gas reporting program". Journal of Integrative Environmental Sciences. Taylor and Francis. 12 (sup1): 5–16. doi:10.1080/1943815X.2015.1092452.
- ^ Jakob, Fredi; Perjanik, Nicholas. "Sulfur Hexafluoride, A Unique Dielectric" (PDF). Analytical ChemTech International, Inc. Archived (PDF) from the original on 2016-03-04.
{{cite journal}}:Cite 저널 요구 사항journal=(도움말) - ^ "Archived copy" (PDF). Archived (PDF) from the original on 2017-10-12. Retrieved 2017-10-12.
{{cite web}}: CS1 maint: 제목으로 아카이브된 복사(링크) - ^ Kieffel, Yannick; Biquez, Francois (1 June 2015). "SF<inf>6</inf> alternative development for high voltage switchgears". SF6 alternative development for high voltage switchgears. pp. 379–383. doi:10.1109/ICACACT.2014.7223577. ISBN 978-1-4799-7352-1. S2CID 15911515 – via IEEE Xplore.
- ^ "Sustainable switchgear technology for a CO2 neutral future". Siemens Energy. 2020-08-31. Retrieved 2021-04-27.
- ^ Daniel A. Brinton; C. P. Wilkinson (2009). Retinal detachment: principles and practice. Oxford University Press. p. 183. ISBN 978-0199716210.
- ^ Gholam A. Peyman, M.D., Stephen A. Meffert, M.D., Mandi D. Conway (2007). Vitreoretinal Surgical Techniques. Informa Healthcare. p. 157. ISBN 978-1841846262.
{{cite book}}: CS1 maint: 여러 이름: 작성자 목록(링크) - ^ Hilton, G. F.; Das, T.; Majji, A. B.; Jalali, S. (1996). "Pneumatic retinopexy: Principles and practice". Indian Journal of Ophthalmology. 44 (3): 131–143. PMID 9018990.
- ^ Lassau N, Chami L, Benatsou B, Peronneau P, Roche A (December 2007). "Dynamic contrast-enhanced ultrasonography (DCE-US) with quantification of tumor perfusion: a new diagnostic tool to evaluate the early effects of antiangiogenic treatment". Eur Radiol. 17 (Suppl. 6): F89–F98. doi:10.1007/s10406-007-0233-6. PMID 18376462. S2CID 42111848.
- ^ "SonoVue, INN-sulphur hexafluoride - Annex I - Summary of Product Characteristics" (PDF). European Medicines Agency. Retrieved 2019-02-24.
- ^ C Michael Hogan (September 10, 2011). "Air pollution line source". Encyclopedia of Earth. Archived from the original on 29 May 2013. Retrieved 22 February 2013.
- ^ "'Poison gas' test on Underground". BBC News. 25 March 2007. Archived from the original on 15 February 2008. Retrieved 22 February 2013.
- ^ Fine, Rana A. (2010-12-15). "Observations of CFCs and SF6 as Ocean Tracers". Annual Review of Marine Science. 3 (1): 173–195. doi:10.1146/annurev.marine.010908.163933. ISSN 1941-1405. PMID 21329203.
- ^ Scott C. Bartos (February 2002). "Update on EPA's manesium industry partnership for climate protection" (PDF). US Environmental Protection Agency. Archived from the original (PDF) on October 10, 2012. Retrieved December 14, 2013.
- ^ a b c J. Harnisch and W. Schwarz (2003-02-04). "Final report on the costs and the impact on emissions of potential regulatory framework for reducing emissions of hydrofluorocarbons, perfluorocarbons and sulphur hexafluoride" (PDF). Ecofys GmbH.
- ^ Hopkins, Carl (2007). Sound insulation - Google Books. pp. 504–506. ISBN 9780750665261.
- ^ Y. Tzeng & T.H. Lin (September 1987). "Dry Etching of Silicon Materials in SF
6 Based Plasmas" (PDF). Journal of the Electrochemical Society. Archived from the original (PDF) on 6 April 2012. Retrieved 22 February 2013. - ^ Stanley Holmes (September 24, 2006). "Nike Goes For The Green". Bloomberg Business Week Magazine. Archived from the original on June 3, 2013. Retrieved December 14, 2013.
- ^ Hughes, T.G.; Smith, R.B. & Kiely, D.H. (1983). "Stored Chemical Energy Propulsion System for Underwater Applications". Journal of Energy. 7 (2): 128–133. Bibcode:1983JEner...7..128H. doi:10.2514/3.62644.
- ^ Dick Olsher (October 26, 2009). "Advances in loudspeaker technology - A 50 year prospective". The Absolute Sound. Archived from the original on December 14, 2013. Retrieved December 14, 2013.
- ^ Edmond I Eger MD; et al. (September 10, 1968). "Anesthetic Potencies of Sulfur Hexafluoride, Carbon Tetrafluoride, Chloroform and Ethrane in Dogs: Correlation with the Hydrate and Lipid Theories of Anesthetic Action". Anesthesiology: The Journal of the American Society of Anesthesiologists. Anesthesiology - The Journal of the American Society of Anesthesiologists, Inc. 30 (2): 127–134.
- ^ Braun, M; Marienfeld, S; Ruf, M-W; Hotop, H (2009-05-26). "High-resolution electron attachment to the molecules CCl4and SF6over extended energy ranges with the (EX)LPA method". Journal of Physics B: Atomic, Molecular and Optical Physics. 42 (12): 125202. Bibcode:2009JPhB...42l5202B. doi:10.1088/0953-4075/42/12/125202. ISSN 0953-4075. S2CID 122242919.
- ^ Fenzlaff, Marita; Gerhard, Rolf; Illenberger, Eugen (1988-01-01). "Associative and dissociative electron attachment by SF6 and SF5Cl". The Journal of Chemical Physics. 88 (1): 149–155. Bibcode:1988JChPh..88..149F. doi:10.1063/1.454646. ISSN 0021-9606.
- ^ "2.10.2 Direct Global Warming Potentials". Intergovernmental Panel on Climate Change. 2007. Archived from the original on 2 March 2013. Retrieved 22 February 2013.
- ^ A. R. Ravishankara, S. Solomon, A. A. Turnipseed, R. F. Warren; Solomon; Turnipseed; Warren (8 January 1993). "Atmospheric Lifetimes of Long-Lived Halogenated Species". Science. 259 (5092): 194–199. Bibcode:1993Sci...259..194R. doi:10.1126/science.259.5092.194. PMID 17790983. S2CID 574937. Archived from the original on 24 September 2015. Retrieved 22 February 2013.
{{cite journal}}: CS1 maint: 여러 이름: 작성자 목록(링크) - ^ "Sulfur hexafluoride (SF6) data from hourly in situ samples analyzed on a gas chromatograph located at Cape Matatulu (SMO)". July 7, 2020. Retrieved August 8, 2020.
- ^ "SF6 Sulfur Hexafluoride". PowerPlantCCS Blog. 19 March 2011. Archived from the original on 30 December 2012. Retrieved 22 February 2013.
- ^ Butler J. and Montzka S. (2020). "The NOAA Annual Greenhouse Gas Index (AGGI)". NOAA Global Monitoring Laboratory/Earth System Research Laboratories.
- ^ "g3, the SF6-free solution in practice Think Grid". think-grid.org. 18 February 2019.
- ^ Mohamed Rabie; Christian M. Franck (2018). "Assessment of Eco-friendly Gases for Electrical Insulation to Replace the Most Potent Industrial Greenhouse Gas SF6". Environmental Science & Technology. American Chemical Society. 52 (2): 369–380. Bibcode:2018EnST...52..369R. doi:10.1021/acs.est.7b03465. hdl:20.500.11850/238519. PMID 29236468.
- ^ "Climate: MEPs give F-gas bill a 'green boost'". www.euractiv.com. EurActiv.com. 13 October 2005. Archived from the original on 3 June 2013. Retrieved 22 February 2013.
- ^ Michael Wines (June 13, 2013). "Department of Energy's Crusade Against Leaks of a Potent Greenhouse Gas Yields Results". The New York Times. Archived from the original on June 14, 2013. Retrieved June 14, 2013.
- ^ "Sulfur Hexafluoride". Hazardous Substances Data Bank. U.S. National Library of Medicine. Archived from the original on 9 May 2018. Retrieved 26 March 2013.
- ^ "Guide to the safe use of SF6 in gas". UNIPEDE/EURELECTRIC. Archived from the original on 2013-10-04. Retrieved 2013-09-30.
- ^ "Physics in Speech". University of New South Wales. Archived from the original on 21 February 2013. Retrieved 22 February 2013.
- ^ Adriani, John (1962). The Chemistry and Physics of Anesthesia (2nd ed.). Illinois: Thomas Books. p. 319. ISBN 9780398000110.
- ^ Weaver, Raymond H.; Virtue, Robert W. (1 November 1952). "The mild anesthetic properties of sulfur hexafluoride". Anesthesiology. 13 (6): 605–607. doi:10.1097/00000542-195211000-00006. PMID 12986223. S2CID 32403288.
추가 정보
- "Sulfur hexafluoride". Air Liquide Gas Encyclopedia. Archived from the original on 31 March 2012. Retrieved 22 February 2013.
- Christophorou, Loucas G.; Isidor Sauers, eds. (1991). Gaseous Dielectrics VI. Plenum Press. ISBN 978-0-306-43894-3.
- Holleman, A. F.; Wiberg, E. (2001). Inorganic Chemistry. San Diego: Academic Press. ISBN 0-12-352651-5.
- Khalifa, Mohammad (1990). High-Voltage Engineering: Theory and Practice. New York: Marcel Dekker. ISBN 978-0-8247-8128-6. OCLC 20595838.
- Maller, V. N.; Naidu, M. S. (1981). Advantages in High Voltage Insulation and Arc Interruption in SF6 and Vacuum. Oxford; New York: Pergamon Press. ISBN 978-0-08-024726-7. OCLC 7866855.
- 전력6 시스템용 SF 절감 파트너십
- Matt McGrath (September 13, 2019). "Climate change: Electrical industry's 'dirty secret' boosts warming". BBC News. Retrieved September 14, 2019.



![Abundance and growth rate of SF 6 in Earth's troposphere (1978-2018).[11]](http://upload.wikimedia.org/wikipedia/commons/thumb/7/7b/AGAGE_sulfur_hexafluroride_growth.png/404px-AGAGE_sulfur_hexafluroride_growth.png)