오불화 브롬
Bromine pentafluoride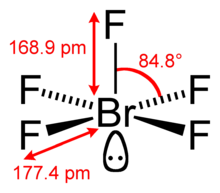 | |||
| | |||
| 이름 | |||
|---|---|---|---|
| IUPAC 이름 오불화 브롬 | |||
| 식별자 | |||
3D 모델(JSmol) | |||
| 켐스파이더 | |||
| ECHA 정보 카드 | 100.029.234 | ||
| EC 번호 |
| ||
PubChem CID | |||
| RTECS 번호 |
| ||
| 유니 | |||
| UN 번호 | 1745 | ||
CompTox 대시보드 (EPA ) | |||
| |||
| |||
| 특성. | |||
| BrF5 | |||
| 몰 질량 | 174.894 g.140−1 | ||
| 외모 | 옅은 노란색 액체 | ||
| 밀도 | 2.466g/cm3 | ||
| 녹는점 | -61.30°C(-78.34°F, 211.85K) | ||
| 비등점 | 40.25°C(104.45°F, 313.40K) | ||
| 물과 반응하다 | |||
| 구조. | |||
| 정사각형 피라미드 | |||
| 위험 요소 | |||
| 산업안전보건(OHS/OSH): | |||
주요 위험 요소 | 강력한 산화제, 부식성, 독성이 강하며 물과 격렬하게 반응하여 HF를[1] 방출합니다. | ||
| GHS 라벨링: | |||
    | |||
| 위험. | |||
| H271, H300+H310+H330, H314, H372 | |||
| P210, , , , , , , , , , , , , , , , , , , , , , , , , , , , ,, | |||
| NFPA 704(파이어 다이아몬드) | |||
| 플래시 포인트 | 불연성 | ||
| NIOSH(미국 건강 노출 제한): | |||
PEL(허용) | 없음[1] | ||
REL(권장) | TWA 0.1ppm(0.7mg/m3)[1] | ||
IDLH(즉시 위험) | N.D.[1] | ||
| 안전 데이터 시트(SDS) | 외부 MSDS[데드링크] | ||
| 관련 화합물 | |||
기타 음이온 | 일염화 브롬 | ||
기타 캐티온 | 오불화염소 오불화 요오드 | ||
관련 화합물 | 브롬 모노플루오르화물 삼불화 브롬 | ||
| 보충 데이터 페이지 | |||
| 오불화 브롬(데이터 페이지) | |||
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |||
브롬펜타플루오르화물(BrF5)은 브롬의 할로겐간 화합물 및 불소화물이다.강한 불소화제입니다.
BrF는5 산소 동위원소 분석에서 사용된다.BrF가5 있는 상태에서 고체 규산염의 레이저 절제는 후속 [2]분석을 위해 O를 방출합니다2.액체 로켓 추진제의 산화제로서도 시험되어 우라늄 가공에 불소화제로 사용되고 있다.
준비
BrF는5 1931년 브롬과 [3]불소의 직접 반응에 의해 처음 제조되었다.이 반응은 다량의 준비에 적합하며 150°C(302°F) 이상의 온도에서 불소가 과다한 상태에서 수행됩니다.
- Br2 + 52 F → 2 BrF5
- KBr + 32 F → KF + BrF5
이5 경로에서는 BrF에 삼불화물 및 기타 [3]불순물이 거의 없습니다.
반응
BrF는5 물과 반응하여 브롬산 및 불산을 [4]형성합니다.
- BrF5 + 32 HO → HBrO3 + 5 HF
실온에서도 대부분의 금속을 가장 높은 불소로 변환할 수 있는 매우 효과적인 불소화제입니다.우라늄과 우라늄 화합물에서는 육불화우라늄을 생성하는 데 사용할 수 있습니다.
- 5 U + 6 BrF5 → 56 UF + 3 Br2
위험 요소
BRF는5 물과 격렬하게 반응하며 심하게 부식되고 독성이 있습니다.이것의 증기는 또한 특히 피부, 눈 그리고 다른 점막 등 인체의 모든 부분에 극도로 자극적이다.다른 많은 할로겐 간 화합물처럼, 공기 중의 물과 반응하여 발생하는 습한 공기에 노출되면 산성 증기를 포함한 "연기"를 방출합니다.1분 이상 100ppm 이상의 노출은 대부분의 실험 동물에게 치명적이다.만성적인 노출은 신장 손상과 간부전을 일으킬 [5]수 있다.
또한5 BrF는 강력한 산화제이며 유기물이나 금속 [5]분진 등의 인화성 물질과 접촉하면 자연 발화 또는 폭발할 수 있습니다.
레퍼런스
- ^ a b c d NIOSH Pocket Guide to Chemical Hazards. "#0065". National Institute for Occupational Safety and Health (NIOSH).
- ^ Clayton, R.; Mayeda, T. K. (1963). "The use of bromine pentafluoride in the extraction of oxygen from oxides and silicates for isotopic analysis". Geochimica et Cosmochimica Acta. 27 (1): 43–48. Bibcode:1963GeCoA..27...43C. doi:10.1016/0016-7037(63)90071-1.
- ^ a b c Hyde, G. A.; Boudakian, M. M. (1968). "Synthesis routes to chlorine and bromine pentafluorides". Inorganic Chemistry. 7 (12): 2648–2649. doi:10.1021/ic50070a039.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. p. 834. ISBN 978-0-08-037941-8.
- ^ a b Patnaik, Pradyot (2007). A comprehensive guide to the hazardous properties of chemical substances (3rd ed.). Wiley-Interscience. p. 480. ISBN 978-0-471-71458-3.
외부 링크
- BrF용5 WebBook 페이지
- 국제화학안전카드 0974
- NIOSH Pocket Guide to Chemical Hazards. "#0065". National Institute for Occupational Safety and Health (NIOSH).
- 국가 오염 물질 목록 - 불소 및 화합물 팩트 시트