플루오르화 은(I)
Silver(I) fluoride | |
 | |
| 이름 | |
|---|---|
| IUPAC 이름 플루오르화 은(I) | |
| 기타 이름 아르헨티나불소화합물 은모노플루오라이드 | |
| 식별자 | |
3D 모델(JSmol) | |
| ECHA InfoCard | 100.028.996 |
펍켐 CID | |
| RTECS 번호 |
|
| 유니 | |
CompTox 대시보드 (EPA) | |
| |
| 특성. | |
| AGF | |
| 어금질량 | 126.8666 g·190−1 |
| 외관 | 황갈색의 고체 |
| 밀도 | 5.852 g/cm3(15°C) |
| 녹는점 | 435°C(815°F, 708K) |
| 비등점 | 1,159°C(2,118°F, 1,432K) |
| 85.78 g/100 mL(0°C) 119.8 g/100 mL(10 °C) 179.1 g/100 mL(25 °C) 213.4 g/100 mL(50 °C)[1] | |
| 용해성 | 플루오르화 수소에서 83g/100g(11.9°C) 메탄올(25°C)[2] 내 1.5g/100mL |
자기 감수성(magnetic susibility) | -36.5·10cm−63/190cm |
| 구조 | |
| 입방체의 | |
| 열화학 | |
열 용량 (C) | 48.1 J/몰·K[1] |
성 어금니 엔트로피 (S | 83.7 J/몰·K[1] |
의 성 엔탈피 대형화 (ΔfH⦵298) | -206 kJ/mol[1] |
기브스 자유 에너지 (ΔfG˚) | -187.9 kJ/mol[1] |
| 위험 | |
| 산업안전보건(OHS/OSH): | |
주요 위험 | 부식성 |
| GHS 라벨 표시:[4] | |
 | |
| 위험 | |
| H314 | |
| P260, P280, P303+P361+P353, P304+P340, P305+P351+P338, P310[3] | |
| NFPA 704(화재 다이아몬드) | |
| 안전 데이터 시트(SDS) | 외부 SDS |
| 관련 화합물 | |
기타 음이온 | 산화은 염화 은(I) |
기타 양이온 | 구리(I)불소화 금(I)불소화 |
관련 화합물 | 과불화 은 불소화 은(II) |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
Silver(I) 불소는 AGF라는 공식을 가진 무기 화합물이다. 은의 세 가지 주요 불소 중 하나이며, 다른 것은 은화 아불화 은화(Silver subfluoride)과 은화(Silver)이다.II) 플루오르화. AGF는 비교적 적은 수의 틈새 용도를 가지고 있다; 유기 합성에서는 불소화 시약과 탈일화 시약으로, 치과에서는 국소 카리에스 치료법으로 수용액에 채용되어 왔다.
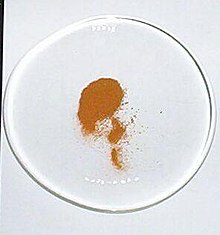
순수한 무수 샘플은 노란색인 반면, AGF의 하이드레이트는 무색이다.[5]: 150
준비
고순도 실버(I) 플루오르화는 수소 플루오르화 환경에서 310°C(590°F)까지 백금관에서 가열하여 만들 수 있다.[6]: 9
- AgCO23 + 2HF → 2AgF + HO2 + CO2
화합물로 가는 실험실 경로는 일반적으로 기체 수소 불소의 사용을 피한다. 한 가지 방법은 은색 사화불화분열 분해법이다.
- AgBF4 → AgF + BF3
대체 경로에서 산화은은은 농축된 수성 불화수소산에 용해되고, 산화은은 아세톤에 의해 그 결과 용액에서 침전된다.[6]: 10
- AGO2 + 2HF → 2AGF + HO2
특성.
구조
AGF의 구조는 X선 회절에 의해 결정되었다.[7][8]: 3735 주변 온도와 압력에서 은(I) 플루오르화물은 폴리모프 아그프-I로서 존재하며, 헤르만-마우구인 표기법에서 우주군 Fm3m로 입방 결정계를 채택한다. 암염 구조는 다른 은색 모노할라이드에 의해 채택된다. 격자 매개변수는 4.936(1) å로 AgCl 및 AgBr보다 현저히 낮다.[9]: 562 중성자 및 X선 회절 연구는 2.70(2) GPA에서 염화 세슘 구조와 격자 매개변수 2.945 å의 두 번째 폴리모르프(AgF-II)로 구조적 전환이 발생한다는 것을 추가로 밝혀냈다.[10]: 7945 [11]: 770 관련 부피의 감소는 대략 10%이다.[10]: 7946 세 번째 폴리모프인 AgF-III는 압력을 2.59(2) GPA로 줄이는 것을 형성하고, 역 니켈 비소 구조를 가지고 있다. 격자 매개변수는 a = 3.244(2) å 및 c = 6.24(1) å이며, 암석염 구조는 압력을 0.9(1) GPA로 감소시킬 때만 회복된다. 극한 압력 하에서 세 개의 다형 모두 비스토키오미터 행동을 나타낸다.[12]: 939 [10]: 7947
분광학
불소는 특이한 광학적 특성을 보인다. 단순 전자 밴드 이론은 AgF의 기본 익시톤 흡수율이 AgCl(5.10 eV)보다 높으며 다른 은 할로겐화물과 마찬가지로 음이온 발란스 밴드로부터의 전환에 해당한다고 예측한다. 실험적으로, AGF의 기본 흥분제는 4.63 eV이다.[13]: 2604 이러한 불일치는 주로 은색 4d-오르바이탈 문자를 가진 발랑스 밴드로부터의 전환을 상쇄함으로써 설명될 수 있다.[9]: 563 고주파 굴절률은 1.73(2)이다.[8]: 3737
광감성
다른 은 할로겐화물과 대조적으로 무수은화물은 비록 디하이드레이트는 눈에 띄게 감광성이 강하지 않다.[14]: 286 [5]: 150 이것과 물 속 물질의 용해성을 고려했을 때, 사진에서 거의 응용을 발견하지 못했다는 것은 놀라운 일이 아니지만, 비록 1970년에 실험적인 AgF 기반 방법의 미국 특허가 허가되었지만, Levi Hill이 그의 "헬리오크롬"[15]에서 사용한 소금 중 하나였을 수도 있다.[16]
용해성
다른 은 할로겐과 달리, AGF는 물(1800 g/L)에 용해성이 높고 아세토나이트릴에도 용해성이 있다. 또한 은(I) 화합물 중에서 특이하며, 수용액에서 강수에 대한 하이드레이트 AgF·(HO2)2와 AgF·(HO2)4를 형성한다는 점에서 은이 할로겐화된다.[17]: 1185 [18] 알칼리 금속 불소화물과 마찬가지로 불소화수소에 용해되어 전도용액을 준다.[19]
적용들
유기합성
Silver(I) fluoride는 여러 결합에 걸쳐 불소를 첨가하기 위해 orgorofluorine 화학에서 응용을 찾는다. 예를 들어, AGF는 아세토나이트릴의 과불화탄소(perfluoroalkenes)에 첨가하여 과불화탄실버(I)파생상품을 제공한다.[20]: 7367 그것은 또한 티우레아에서 파생된 기판에 탈황-불화 시약으로도 사용될 수 있다.[18]: 562 물과 유기용제 내 용해도가 높아 불소 이온의 편리한 공급원으로, 가벼운 조건에서 알킬 할로겐을 불소화하는데 사용할 수 있다.[2] 예는 다음과 같은 반응에 의해 제시된다.[21]
은(I) 플루오르를 사용한 또 다른 유기 합성 방법은 실릴 에놀 에테르들의 비나프-아그프 복합 촉매 항저항 양성이다.[22]: 1546
무기합성
은색 아세틸라이드가 은색(I) 플루오르 농축 용액과 반응하면 내피드랄 아세틸렌디아이드와 함께 샹들리에와 같은10 [Ag]2+ 성단이 형성된다.[23]
Tetralkylammonium 플루오르화물은 수용성 AgF 용액과 함께 Tetralkylammonium Bromide의 반응으로 실험실에서 편리하게 준비할 수 있다.[24]: 430
기타
실리콘 표면에 균일한 은색 마이크로레이어(0.1~1μm 두께)를 코팅할 수 있는 것은 60~800°C에서 AgF 증기를 통과시켜 가능하다.[25] 관련 반응은 다음과 같다.
- 4AGF + Si → 4AG + SiF4
여러 연구에서 비록 이 메커니즘이 현재 연구 대상이지만, 은(I) 플루오르화물이 효과적인 항캐리제임을 밝혀냈다.[26] 치료는 일반적으로 질량 수용성 은(I) 플루오르 용액에 의해 40%를 가한 후, 유리 아이노머 시멘트로 덴틴을 밀봉하는 "외상적" 방법에 의해 이루어진다.[27] 일반적으로 치료법이 안전한 것으로 인식되지만, 불소 독성은 특히 일부 상업적 준비물이 상당한 은을 가졌기 때문에 소아용 응용에서 중요한 임상적 관심사였다().II)[27][28][29] 과거 불소 오염 농축된 AGF 용액의 불안정성으로 인해 현재 은색 직경 불소(Ag(NH3)2F)가 더 많이 사용되고 있다.[29]: 26 준비는 수성 은 불소 용액에 암모니아를 첨가하거나 수성 암모니아에서 은 불소가 용해되는 것이다.[30]
참조
- ^ a b c d e 케미스터 화학 데이터베이스, Kiper Ruslan Anatollievich, 2002-15. URL: http://chemister.ru/Database/properties-en.php?dbid=1&id=1067
- ^ a b Busse, Juliette K.; Stoner, Eric J. (2001). "Silver (I) fluoride". E-EROS Encyclopedia of Reagents for Organic Synthesis. doi:10.1002/047084289X.rs016. ISBN 0471936235.
- ^ "Silver Fluoride". American Elements. Retrieved 2018-09-07.
- ^ 시그마알드리히 주식회사, 실버(I) 불소화. 2014-05-08년에 검색됨.
- ^ a b Palmer, William George (1954). Experimental Inorganic Chemistry. CUP Archive. ISBN 9780521059022.
- ^ a b Roesky, Herbert W. (2012). Efficient Preparation of Fluorine Compounds. Somerset, New Jersey: Wiley. ISBN 9781118409428.
- ^ Ott, H. (1926). "XI. Die Strukturen von MnO, MnS, AgF, NiS, SnJ4, SrCl2, BaF2; Präzisionsmessungen einiger Alkalihalogenide". Z. Kristallogr. 63 (1–6): 222–230. doi:10.1524/zkri.1926.63.1.222. S2CID 102244646.
- ^ a b Bottger, G.L.; Geddes, A.L. (1972). "Lattice Vibrations, Crystal Structure, Dielectric Properties, and Elastic Constants of AgF". J. Chem. Phys. 56 (8): 3735–3739. Bibcode:1972JChPh..56.3735B. doi:10.1063/1.1677770.
- ^ a b Birtcher, R.C.; Deutsch, P.W.; Wendelken, J.F.; Kunz, A.B. (1972). "Valence band structure in silver fluoride". J. Phys. C: Solid State Phys. 5 (5): 562–6. Bibcode:1972JPhC....5..562B. doi:10.1088/0022-3719/5/5/008.
- ^ a b c Hull, S.; Berastegui, P (1998). "High-pressure structural behaviour of silver(I) fluoride". J. Phys.: Condens. Matter. 10 (36): 7945–7955. Bibcode:1998JPCM...10.7945H. doi:10.1088/0953-8984/10/36/005.
- ^ Halleck, P.M.; Jamieson, J.C. (1972). "B1 and B2 phase change of AgF at high pressure". J. Phys. Chem. Solids. 33 (4): 769–773. Bibcode:1972JPCS...33..769H. doi:10.1016/s0022-3697(72)80093-3.
- ^ Jamieson, J.C.; Halleck, P.M.; Roof, R.B.; Pistorius, C.W.F.T. (1975). "Additional polymorphism and non-stoichiometry in AgF". Journal of Physics and Chemistry of Solids. 36 (9): 939–944. Bibcode:1975JPCS...36..939J. doi:10.1016/0022-3697(75)90172-9.
- ^ Marchetti, A.P.; Bottger, G.L. (1971). "Optical Absorption Spectrum of AgF". Physical Review B. 3 (8): 2604–7. Bibcode:1971PhRvB...3.2604M. doi:10.1103/physrevb.3.2604.
- ^ Slayter, Elizabeth (1992). Light and Electron Microscopy. Cambridge University Press. ISBN 9780521339483.
- ^ Hill, Levi L. (1856). A treatise on heliochromy : or, The production of pictures, by means of light, in natural colors. Embracing a full, plain, and unreserved description of the process known as the hillotype, including the author's newly discovered collodio-chrome, or natural colors on collodionized glass ... Getty Research Institute. New York : Robinson & Caswell. p. 143.
- ^ 미국 특허 3537855, "광감성 은 불소원소" 1971-11-3 발행
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ a b Tyrra, Wieland (2002). "Silver(I) fluoride and related compounds in chemical synthesis". Heteroatom Chemistry. 13 (6): 561–566. doi:10.1002/hc.10102.
- ^ Schwartz, Mel (2002). Encyclopedia of Materials, Parts and Finishes (2nd ed.). CRC press. p. 305. ISBN 1420017160.
- ^ Miller, W. T.; Burnard, R. J. (1968). "Perfluoroalkylsilver compounds" "Title". J. Am. Chem. Soc. 90: 7367–7368. doi:10.1021/ja01028a047.
- ^ Muller, Paul; Etienne, Robert; Pfyfer, Jean; Pinenda, Nelson; Schipoff, Michel (1978). "Allylic Reactions of Benzocyclopropenes. Discrimination of Halogen Substituents in 1,l-Dihalogenobenzocyclopropenes". Helvetica Chimica Acta. 61 (7): 2482–8. doi:10.1002/hlca.19780610719.
- ^ Yanagisawa, Akira; Touge, Taichiro; Takayoshi, Arai (2005). "Enantioselective Protonation of Silyl Enolates Catalyzed by a Binap⋅AgF Complex". Angewandte Chemie International Edition. 44 (10): 1546–8. doi:10.1002/anie.200462325. PMID 15645475.
- ^ Guo, Guo-Cong; Zhou, Gong-Du; Wang, Qi-Guang; Mak, Thomas C.W. (1998). "A Fully Encapsulated Acetylenediide in Ag2C2.8AgF". Angewandte Chemie International Edition. 37 (5): 630–2. doi:10.1002/(sici)1521-3773(19980316)37:5<630::aid-anie630>3.0.co;2-k.
- ^ Clark, James H. (1980). "Fluoride ion as a base in organic synthesis". Chemical Reviews. 80 (5): 429–452. doi:10.1021/cr60327a004.
- ^ Voorhoeve, R. J. H.; Merewether, J. W. (1972). "Selective Deposition of Silver on Silicon by Reaction with Silver Fluoride Vapor". J. Electrochem. Soc. 119 (3): 364–368. Bibcode:1972JElS..119..364V. doi:10.1149/1.2404203.
- ^ Peng, J. J-Y.; Botelho, M.G.; Matinlinna, J.P. (2012). "Silver compounds used in dentistry for caries management: A review". Journal of Dentistry. 40 (7): 531–541. doi:10.1016/j.jdent.2012.03.009. PMID 22484380.
- ^ a b Gotjamanos, Theo; Afonso, Fernando (1997). "Unacceptably high levels of fluoride in commercial preparations of silver fluoride". Australian Dental Journal. 42 (1): 52–3. doi:10.1111/j.1834-7819.1997.tb00097.x. PMID 9078648.
- ^ Gotjamanos, Theo; Orton, Vergil (1998). "Abnormally high fluoride levels in commercial preparations of 40 per cent silver fluoride solution: Contraindications for use in children". Australian Dental Journal. 43 (6): 422–7. doi:10.1111/j.1834-7819.1998.tb00203.x. PMID 9973713.
- ^ a b Shah, Shalin; Bhaskar, Visjay; Venkatraghavan, Karthik; Choudhary, Prashant; Trivedi, Krishna; M., Ganesh (2014). "Silver Diamine Fluoride: A Review and Current Applications". Journal of Advanced Oral Research. 5 (1): 25–35. doi:10.1177/2229411220140106. S2CID 56987580.
- ^ 미국 특허 3567823, 요코미조 이치로 & 야마가 레이이치, "은 암모니아 불소 용액과 그 사용 방법" 1971-2-12를 발간했다.