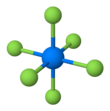
육불화 플루토늄
Plutonium hexafluoride본 기사는 해당 기사에서 독일어로 번역된 텍스트로 확장될 수 있다. (2012년 11월) 중요한 번역 지침을 보려면 [표시]를 클릭하십시오.
|
 | |||
| | |||
| 이름 | |||
|---|---|---|---|
| IUPAC 이름 플루토늄(VI) 불소화 | |||
| 식별자 | |||
3D 모델(JSmol) | |||
| 켐스파이더 | |||
펍켐 CID | |||
CompTox 대시보드 (EPA) | |||
| |||
| |||
| 특성. | |||
| PUF 6 | |||
| 외관 | 검붉은 불투명한 결정체 | ||
| 밀도 | 5.08 g·cm−3 | ||
| 녹는점 | 52°C(126°F, 325K) | ||
| 비등점 | 62°C(144°F, 335K) | ||
| 구조 | |||
| 정형외과, oP28 | |||
| 팽마로62번길 | |||
| 팔면체(Oh) | |||
| 0 D | |||
| 관련 화합물 | |||
관련 플루오르소플루토늄 | 삼불화 플루토늄 | ||
| 위험 | |||
| GHS 라벨 표시: | |||
    | |||
| 위험 | |||
| NFPA 704(화재 다이아몬드) | |||
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |||
| Infobox 참조 자료 | |||
플루토늄 헥사플루오라이드는 플루토늄의 가장 높은 불소로, 특히 조사 우라늄에서 순수 플루토늄-239를 생산하기 위해 플루토늄의 레이저 농축에 관심이 있다. 이 순수한 플루토늄은 플루토늄-240의 자발적 핵분열에 의해 생성된 중성자에 의한 저질량 핵무기 설계의 조기 발화를 피하기 위해 필요하다.
준비
플루토늄 테트라플루오르화(PuF4)를 불소화하여 원소 불소 등 강력한 불소화제를 사용하여 제조한다.[2][3][4][5]
- PuF
4 + F
2 → PuF
6
이 반응은 내열적이다. 제품은 750 °C의 온도에서 비교적 빨리 형성되며, 제품을 빠르게 응축하여 평형상태에서 제거함으로써 높은 수율을 얻을 수 있다.[5]
플루토늄(III) 불소화 또는 플루토늄()을 불소화하여 얻을 수도 있다.IV) 산화물.[4]
- 2 PuF
3 + 3 F
2 → 2 PuF
6
- PuO
2 + 3 F
2 → PuF
6 + O
2
1984년, 이산화디플루오라이드의 사용을 통해 전례 없는 저온에서 플루토늄 헥사플루오라이드의 합성이 달성되었다. 이전의 기법에서는 생산되는 플루토늄 6불화물이 빠르게 분해될 정도로 높은 온도가 필요했다.[6] 불소화수소는 강력한 불소화제임에도 불구하고[7] 충분하지 않다. 실온 합성도 크립톤 디플루오라이드나[8] 자외선으로 조사하면 가능하다.[9]
특성.
물리적 성질
플루토늄 헥사플루오라이드는 적갈색의 휘발성 결정고체로 승화의 열은 12.1kcal/mol이고[2] 기화열은 7.4kcal/mol이다.[1] 그것은 정형외과적 결정 체계에서 결정된다. 기체로서 분자는 팔면대칭(점군 Oh)을 가지고 있다.
화학적 특성
6불화 플루토늄은 비교적 다루기 어려워 부식성이 매우 강하고 자동방사성분해를 일으키기 쉽다.[10][11]
다른 화합물과의 반응
PuF는6 건조한 공기에서는 안정적이지만 대기 수분을 포함한 물과 격렬하게 반응하여 플루토늄(VI) 옥시플루오라이드와 불화수소산을 형성한다.[3][12]
- PuF
6 + 2 H
2O → PuO
2F
2 + 4 HF
석영이나 피렉스 앰플에 장기간 보관할 수 있는데, 습기의 흔적이 없고 유리가 완전히 빠져나갔으며, 화합물에서 불소화수소의 흔적이 조금이라도 제거되었으면 한다.[13]
PuF의6 중요한 반응은 이산화 플루토늄에 대한 감소다. 산소-메탄 불꽃에서 발생하는 일산화탄소는 육불화합물에서 직접 활성 산화물 생산을 위한 좋은 환원제의 예다.
분해반응
6불화 플루토늄은 플루토늄 테트라플루오라이드와 플루오린 가스로 분해된다.
- 실온에서는 발생하지 않지만 280 °C에서는 매우 빠르게 진행되는 열분해를 겪을 수 있다.[5]
- 또 다른 가능성은 자체 방사능으로 인해 분해되고 있는 자동방사선분해다. 수정 격자를 통해 방출된 알파 입자가 움직이면 결합이 깨져 분해되어 불소와 불소가스가 낮아진다. 알파 방사선을 통한 분해율은 고체상에서는 하루 평균 1.5%이지만 가스상에서는 현저히 적다.[5] 그것은 또한 감마선에서 분해된다.[14]
- 520nm 미만의 파장에서 레이저 조사를 받으면 플루토늄 펜타플루오라이드와 플루오린으로 분해되며,[15] 더 많은 조사를 한 후에는 플루토늄 테트라플루오라이드로 분해된다.[16]
사용하다
플루토늄 헥사플루오라이드는 플루토늄의 농축에 역할을 하며, 특히 핵분열 동위원소 Pu를 조사 우라늄에서 격리시키는 역할을 한다. 핵무기에 사용하기 위해서는 다음의 두 가지 이유로 Pu를 제거해야 한다.
- 자발적 핵분열에 의해 통제할 수 없는 반응을 일으키기에 충분한 중성자를 생성한다.
- 그것은 암 형성을 위해 베타 붕괴를 겪으며, 장기간 보관에 걸쳐 아메리슘이 축적되어 제거되어야 한다.
플루토늄과 아메리슘의 분리는 다이옥시겐 이플루오리드와의 반응을 통한 수익을 포함했다. 장기간 보관된 PuF는4 가스 PuF에6 실온에서 불소화되는데, 이는 분리되어 PuF로4 환원되는 반면, 존재하는 AmF는4 동일한 변환을 거치지 않는다. 따라서 이 제품에는 미처리 고체에 집중되는 아메리슘이 거의 들어 있지 않다.[17]
우라늄과 플루토늄의 육불화 분리는 핵폐기물 재처리에 중요하다.[18][19] 두 원소를 모두 함유한 용융 소금 혼합물에서 우라늄은 소량의 플루토늄만 PuF로6 빠져나가는 상황에서 높은 온도에서 안정적인 UF에6 불소를 공급하면 대부분 제거할 수 있다.[20]
참조
- ^ a b Lide, David R. (2009). Handbook of Chemistry and Physics (90 ed.). Boca Raton, Florida: CRC Press. pp. 4–81. ISBN 978-1-4200-9084-0. (webelements.com)
- ^ a b Florin, Alan E.; Tannenbaum, Irving R.; Lemons, Joe F. (1956). "Preparation and properties of plutonium hexafluoride and identification of plutonium(VI) oxyfluoride". Journal of Inorganic and Nuclear Chemistry. 2 (5–6): 368–379. doi:10.1016/0022-1902(56)80091-2.
- ^ a b A. E. Florin (9 November 1950). "Plutonium Hexafluoride: Second Report On The Preparation and Properties (LA-1168)" (PDF). Los Alamos Scientific Laboratory.
- ^ a b Mandleberg, C.J.; Rae, H.K.; Hurst, R.; Long, G.; Davies, D.; Francis, K.E. (1956). "Plutonium hexafluoride". Journal of Inorganic and Nuclear Chemistry. 2 (5–6): 358–367. doi:10.1016/0022-1902(56)80090-0.
- ^ a b c d Weinstock, Bernard; Malm, John G. (July 1956). "The properties of plutonium hexafluoride". Journal of Inorganic and Nuclear Chemistry. 2 (5–6): 380–394. doi:10.1016/0022-1902(56)80092-4.
- ^ Malm, J. G.; Eller, P. G.; Asprey, L. B. (1984). "Low temperature synthesis of plutonium hexafluoride using dioxygen difluoride". Journal of the American Chemical Society. 106 (9): 2726–2727. doi:10.1021/ja00321a056.
- ^ Evaluation of the U.S. Department of Energy's Alternatives for the Removal and Disposition of Molten Salt Reactor Experiment Fluoride Salts. 1997. p. 42. doi:10.17226/5538. ISBN 978-0-309-05684-7.
- ^ Asprey, L. B.; Eller, P. G.; Kinkead, Scott A. (1986). "Formation of actinide hexafluorides at ambient temperatures with krypton difluoride". Inorganic Chemistry. 25 (5): 670–672. doi:10.1021/ic00225a016. ISSN 0020-1669.
- ^ Trevorrow, L.E.; Gerding, T.J.; Steindler, M.J. (1969). "Ultraviolet-activated synthesis of plutonium hexafluoride at room temperature". Inorganic and Nuclear Chemistry Letters. 5 (10): 837–839. doi:10.1016/0020-1650(69)80068-1.
- ^ Bibler, Ned E. (23 August 1979). "α and β Radiolysis of Plutonium Hexafluoride Vapor". J. Phys. Chem. 83 (17): 2179–2186. doi:10.1021/j100480a001.
- ^ Steindler, M.J.; Steidl, D.V.; Fischer, J. (November 1964). "The decomposition of plutonium hexafluoride by gamma radiation". Journal of Inorganic and Nuclear Chemistry. 26 (11): 1869–1878. doi:10.1016/0022-1902(64)80011-7.
- ^ Kessie, R. W. (1967). "Plutonium and Uranium Hexafluoride Hydrolysis Kinetics". Industrial & Engineering Chemistry Process Design and Development. 6 (1): 105–111. doi:10.1021/i260021a018. ISSN 0196-4305.
- ^ Malm, John G.; Weinstock, Bernard; Weaver, E. Eugene (1958). "The Preparation and Properties of NpF 5 ; a Comparison with PuF 5". The Journal of Physical Chemistry. 62 (12): 1506–1508. doi:10.1021/j150570a009. ISSN 0022-3654.
- ^ Steindler, M.J.; Steidl, D.V.; Fischer, J. (1964). "The decomposition of plutonium hexafluoride by gamma radiation". Journal of Inorganic and Nuclear Chemistry. 26 (11): 1869–1878. doi:10.1016/0022-1902(64)80011-7.
- ^ 미국 4670239, 셔먼 W. 라비다우 & 조지 캠벨, 1987년 6월 2일 발간된 "플루토늄 펜타플루오라이드의 광화학 준비"는 미국에 배정되었다.
- ^ Lobikov, E. A.; Prusakov, V. N.; Serik, V. F. (August–September 1992). "Plutonium Hexafluoride Decomposition under the Action of Laser Radiation". Journal of Fluorine Chemistry. 58 (2–3): 277. doi:10.1016/S0022-1139(00)80734-4.
- ^ Mills, T.R.; Reese, L.W. (1994). "Separation of plutonium and americium by low-temperature fluorination". Journal of Alloys and Compounds. 213–214: 360–362. doi:10.1016/0925-8388(94)90931-8.
- ^ Moser, W.Scott; Navratil, James D. (1984). "Review of major plutonium pyrochemical technology". Journal of the Less Common Metals. 100: 171–187. doi:10.1016/0022-5088(84)90062-6.
- ^ Drobyshevskii, Yu. V.; Ezhov, V. K.; Lobikov, E. A.; Prusakov, V. N.; Serik, V. F.; Sokolov, V. B. (2002). "Application of Physical Methods for Reducing Plutonium Hexafluoride". Atomic Energy. 93 (1): 578–588. doi:10.1023/A:1020840716387. S2CID 100100314.
- ^ Read "Evaluation of the U.S. Department of Energy's Alternatives for the Removal and Disposition of Molten Salt Reactor Experiment Fluoride Salts" at NAP.edu. 1997. doi:10.17226/5538. ISBN 978-0-309-05684-7.