유기화학
Organic chemistry이 기사는 검증을 위해 추가적인 인용이 필요합니다. : – · · · (2023년 9월)(이 를 및 |
| 시리즈의 일부(on) |
| 화학 |
|---|
 |
유기화학은 유기화합물과 유기물질의 구조, 성질, 반응, 즉 탄소 원자를 포함하는 다양한 형태의 물질에 대한 과학적 연구와 관련된 화학의 하위 학문입니다.[1]구조에 대한 연구는 구조 공식을 결정합니다.특성에 대한 연구는 물리적 및 화학적 특성과 그들의 행동을 이해하기 위한 화학적 반응성 평가를 포함합니다.유기 반응에 대한 연구는 천연물, 약물 및 고분자의 화학적 합성, 실험실 및 이론적 연구를 통한 개별 유기 분자의 연구를 포함합니다.
유기 화학에서 연구되는 화학 물질의 범위는 탄소를 기반으로 하는 화합물뿐만 아니라 탄화수소(탄소와 수소만을 포함하는 화합물)를 포함하지만 다른 원소,[1][2][3] 특히 산소, 질소, 황, 인(많은 생화학 물질에 포함됨) 및 할로겐을 포함합니다.유기금속 화학은 탄소-금속 결합을 포함하는 화합물을 연구하는 학문입니다.
또한, 현대의 연구는 란탄을 포함한 다른 유기 금속 물질과 특히 전이 금속 아연, 구리, 팔라듐, 니켈, 코발트, 티타늄 및 크롬을 포함하는 유기 화학에 초점을 맞추고 있습니다.
유기 화합물은 지구상의 모든 생명체의 기초를 형성하며 알려진 화학 물질의 대부분을 구성합니다.탄소의 결합 패턴은 4개의 원자가(공식 단일 결합, 이중 결합, 삼중 결합)와 비국재화된 전자를 갖는 구조)를 가지며, 유기 화합물의 배열은 구조적으로 다양하고 그 응용 범위가 매우 넓습니다.이들은 의약품, 석유화학제품, 농약, 윤활유, 용제, 플라스틱, 연료 및 폭발물을 포함한 많은 상업 제품의 기초를 형성하거나 이들로부터 제조된 제품의 구성 성분입니다.유기화학의 연구는 유기금속화학과 생화학뿐만 아니라 약용화학, 고분자화학, 재료과학과도 중첩됩니다.[1]
역사

18세기 이전에 화학자들은 일반적으로 살아있는 유기체로부터 얻은 화합물이 무기 화합물과 구별되는 중요한 힘을 가지고 있다고 믿었습니다.생명력의 개념(생명력 이론)에 따르면, 유기물은 "생명력"을 부여 받았습니다.[4]19세기 전반 동안 유기 화합물에 대한 최초의 체계적인 연구들이 보고되었습니다.1816년경 Michel Chevreul은 다양한 지방과 알칼리로 만들어진 비누에 대한 연구를 시작했습니다.그는 알칼리와 결합하여 비누를 생산하는 산을 분리했습니다.이것들이 모두 개별적인 화합물이었기 때문에, 그는 "활력" 없이도 새로운 화합물을 생산하면서 다양한 지방(전통적으로 유기원에서 유래하는)에서 화학적 변화를 만드는 것이 가능하다는 것을 증명했습니다.1828년 프리드리히 뵐러는 무기 출발 물질(시안산칼륨과 황산암모늄)로부터 소변의 구성 성분인 유기 화학 요소(카바미드)를 만들어 냈습니다.비록 뵐러 자신이 생명력을 부정했다고 주장하는 것에 대해 조심스러웠지만, 이것은 생물학적 (유기) 출발 물질이 없이 실험실에서 유기로 생각되는 물질이 합성된 첫 번째였습니다.그 사건은 이제 일반적으로 생명력론의 교리를 실제로 반증하는 것으로 받아들여지고 있습니다.[5]
1856년, 윌리엄 헨리 퍼킨은 퀴닌을 제조하려고 하다가 우연히 현재 퍼킨의 연보라색으로 알려진 유기 염료를 생산했습니다.재정적인 성공으로 널리 알려진 그의 발견은 유기 화학에 대한 관심을 크게 높였습니다.[6]
유기화학의 중요한 돌파구는 1858년에 프리드리히 오귀스트 케쿨레와 아치볼드 스콧 쿠퍼에 의해 독립적으로 개발된 화학구조의 개념이었습니다.[7]두 연구자는 4가 탄소 원자가 서로 연결되어 탄소 격자를 형성할 수 있으며, 원자 결합의 세부적인 패턴은 적절한 화학 반응의 능숙한 해석에 의해 식별될 수 있다고 제안했습니다.[8]
제약 산업의 시대는 독일 회사인 바이엘이 아스피린으로 더 잘 알려진 아세틸살리실산을 처음으로 제조한 19세기의 마지막 10년에서 시작되었습니다.[9]1910년까지 Paul Ehlich와 그의 실험실 그룹은 매독의 첫 번째 효과적인 의학적 치료로 비소를 기반으로 하는 아르스페나민(Salvarsan)을 개발하기 시작했고, 그에 따라 화학 요법의 의학적 실천을 시작했습니다.에를리히는 "마법의 총알" 약물과 체계적으로 약물 치료를 개선하는 개념을 대중화했습니다.[10][11]그의 실험실은 디프테리아를 위한 항혈청을 개발하고 치료 혈청을 표준화하는데 결정적인 기여를 했습니다.[12]

유기 반응과 응용의 초기 예는 운과 예상치 못한 관찰에 대한 준비가 결합되어 종종 발견되었습니다.그러나 19세기 후반에는 유기 화합물에 대한 체계적인 연구가 이루어졌습니다.합성 인디고의 발전은 예시적인 것입니다.아돌프 폰 바이어가 개발한 합성법 덕분에 식물원에서 나오는 인디고 생산량은 1897년 19,000톤에서 1914년까지 1,000톤으로 떨어졌습니다.2002년에 17,000톤의 인조 인디고가 석유화학물질로부터 생산되었습니다.[14]
20세기 초반에 고분자와 효소는 큰 유기 분자로 나타났고, 석유는 생물학적 기원으로 밝혀졌습니다.
복잡한 유기 화합물의 다단계 합성을 총합성이라고 합니다.복합 천연 화합물의 총 합성은 글루코스 및 테르피네올에 대한 복잡도가 증가했습니다.예를 들어, 콜레스테롤 관련 화합물은 복잡한 인간 호르몬과 그 변형된 유도체를 합성하는 방법을 열었습니다.20세기가 시작된 이래로, 총 합성의 복잡성은 라이저그산과 비타민12 B와 같은 높은 복잡성을 가진 분자들을 포함하도록 증가되어 왔습니다.[15]

석유의 발견과 석유화학산업의 발전은 유기화학의 발전을 촉진시켰습니다.개별 석유 화합물을 다양한 화학적 공정에 의해 화합물의 종류로 변환시키는 것은 유기 반응으로 이어졌으며, 플라스틱, 합성 고무, 유기 접착제 및 다양한 특성을 변형시키는 석유 첨가제 및 촉매 등을 포함한 광범위한 산업 및 상업 제품을 가능하게 했습니다.
생물학적 유기체에서 발생하는 대부분의 화학적 화합물은 탄소 화합물이므로 유기 화학과 생화학의 연관성은 매우 밀접하여 생화학은 본질적으로 유기 화학의 한 분야로 여겨질 수 있습니다.비록 생화학의 역사가 약 4세기에 걸쳐 있다고 할지라도, 그 분야에 대한 기본적인 이해는 19세기 말에 발전하기 시작했고 실제 생화학이라는 용어는 20세기 초쯤에 만들어졌습니다.이 분야의 연구는 1920년대에 단일 연간권으로 시작된 BIOSIS Previews 및 Biological Abstracts와 같은 추상화 및 색인화 서비스의 점검을 통해 확인할 수 있듯이 증가 속도가 둔화되는 징후 없이 20세기 전반에 걸쳐 증가하였고,하지만 너무 급격하게 성장하여 20세기 말에는 온라인 전자 데이터베이스로만 일상적인 사용자들이 이용할 수 있게 되었습니다.[16]
특징화
유기 화합물은 혼합물로서 종종 존재하기 때문에, 순도를 평가하기 위한 다양한 기술들도 개발되어 왔습니다; 크로마토그래피 기술들은 이 응용에 특히 중요하고, HPLC 및 가스 크로마토그래피를 포함합니다.전통적인 분리 방법으로는 증류, 결정화, 증발, 자기 분리 및 용매 추출이 있습니다.
유기 화합물은 전통적으로 "습식 방법"이라고 불리는 다양한 화학적 테스트로 특징지어졌지만, 그러한 테스트는 분광학적 또는 다른 컴퓨터 집약적 분석 방법으로 대체되었습니다.[17]유용성의 대략적인 순서에 따라 나열되며, 주요 분석 방법은 다음과 같습니다.
- 핵자기공명(NMR) 분광법은 가장 일반적으로 사용되는 기술로, 종종 상관 분광법을 사용하여 원자 연결과 심지어 입체화학의 완전한 할당을 허용합니다.유기화학의 주요 구성 원자인 수소와 탄소는 각각 H와 C의 NMR 반응 동위원소와 함께 자연적으로 존재합니다.
- 원소 분석:분자의 원소 조성을 결정하기 위해 사용되는 파괴적인 방법.아래의 질량분석도 참조하십시오.
- 질량 분석법은 화합물의 분자량과 파편화 패턴으로부터 그 구조를 나타냅니다.고해상도 질량 분석법은 일반적으로 화합물의 정확한 공식을 식별할 수 있으며 원소 분석을 대신하여 사용됩니다.이전에는 질량 분석법이 약간의 휘발성을 보이는 중성 분자로 제한되었지만, 진보된 이온화 기술은 사실상 모든 유기 화합물의 "질량 스펙"을 얻을 수 있게 합니다.
- 결정학은 물질의 단결정을 사용할 수 있을 때 분자 형상을 결정하는 데 유용할 수 있습니다.매우 효율적인 하드웨어 및 소프트웨어를 통해 적합한 결정을 얻은 후 몇 시간 내에 구조를 결정할 수 있습니다.
적외선 분광법, 광회전, UV/VIS 분광법과 같은 전통적인 분광법은 상대적으로 비특이적인 구조 정보를 제공하지만 특정 응용 분야에는 여전히 사용되고 있습니다.굴절률과 밀도 또한 물질을 식별하는 데 중요할 수 있습니다.
특성.
일반적으로 관심있는 유기 화합물의 물리적 특성은 양적 특성과 질적 특성을 모두 포함합니다.정량적 정보에는 녹는점, 끓는점, 용해도, 굴절률 등이 포함됩니다.질적 특성에는 냄새, 일관성, 색상이 포함됩니다.
용융 및 비등특성
유기 화합물은 일반적으로 녹아서 많은 양이 끓습니다.이와 대조적으로, 무기 재료는 일반적으로 용융될 수 있지만, 많은 것들이 끓지 않고, 오히려 저하되는 경향이 있습니다.초기에는 녹는점(m.p.)과 끓는점(b.p.)이 유기화합물의 순도와 동일성에 대한 중요한 정보를 제공했습니다.녹는점과 끓는점은 분자의 극성과 분자의 무게와 상관관계가 있습니다.어떤 유기 화합물들, 특히 대칭적인 것들은 숭고합니다.승화 가능한 유기 화합물의 잘 알려진 예는 현대 나방볼의 요오드 성분인 파라-디클로로벤젠입니다.유기 화합물은 일부 예외가 존재하지만, 보통 300 °C 이상의 온도에서는 매우 안정적이지 않습니다.
용해도
중성 유기 화합물은 소수성을 띠는 경향이 있습니다. 즉, 무기 용매보다 물에 덜 용해됩니다.예외적으로, 이온화 가능한 그룹을 포함하는 유기 화합물 및 수소 결합이 발생하는 저분자량 알코올, 아민 및 카르복실산을 포함합니다.그렇지 않으면 유기 화합물은 유기 용매에 용해되는 경향이 있습니다.용해도는 유기 용질과 유기 용매에 따라 매우 다양합니다.
솔리드 스테이트 속성
공액 시스템을 갖는 분자 결정 및 유기 폴리머의 다양한 특화된 특성은 응용, 예를 들어 압전, 전기 전도성(전도성 폴리머 및 유기 반도체 참조) 및 전기 광학(예를 들어 비선형 광학) 특성과 같은 열-기계 및 전기-기계적 특성에 따라 관심의 대상이 됩니다.역사적인 이유로, 그러한 속성들은 주로 고분자 과학과 재료 과학의 영역의 주제입니다.
명명법

유기 화합물의 이름은 일련의 규칙에서 논리적으로 따온 체계적이거나 다양한 전통에 따라 비체계적입니다.체계적인 명명법은 IUPAC의 규격에 의해 규정되어 있습니다.체계적 명명법은 관심 분자 내의 부모 구조에 대한 이름으로 시작합니다.그런 다음 접두사, 접미사 및 숫자로 이 부모 이름을 수정하여 구조를 명확하게 전달합니다.수백만 개의 유기 화합물이 알려져 있는 것을 감안하면, 체계적인 이름을 엄격하게 사용하는 것은 번거로울 수 있습니다.따라서 IUPAC 권장사항은 복잡한 분자가 아닌 단순한 화합물에 대해 더 밀접하게 따릅니다.체계적인 이름을 사용하려면 부모 구조의 구조와 이름을 알아야 합니다.모체 구조는 비치환된 탄화수소, 헤테로사이클 및 이의 단일 기능화된 유도체를 포함합니다.
적어도 유기 화학자들에게는 비체계적 명명법이 더 간단하고 명확합니다.비체계적인 이름은 화합물의 구조를 나타내지 않습니다.그들은 대부분의 천연물을 포함하는 복잡한 분자에 흔합니다.따라서, 비공식적으로 명명된 라이세르그산 디에틸아미드는 체계적으로 (6aR,9R)-N,N-디에틸-7-메틸-4,6,6a,7,8,9-헥사하이드로인돌로-[4,3-fg]퀴놀린-9-카르복스아미드로 명명됩니다.
컴퓨팅의 사용이 증가함에 따라, 기계에 의해 해석되는 다른 명명법들이 진화해왔습니다.SMILES와 InChI 두 가지 인기 포맷이 있습니다.
구조도면
유기 분자는 도면 또는 구조 공식, 도면 및 화학 기호의 조합으로 더 일반적으로 설명됩니다.선각 공식은 단순하고 모호하지 않습니다.이 시스템에서 각 선의 끝점과 교차점은 하나의 탄소를 나타내며, 수소 원자는 명시적으로 표시되거나 4가 탄소로 암시된 것으로 가정될 수 있습니다.

역사
1880년까지 발견된 화학적 화합물의 수는 새로운 합성 및 분석 기술의 도움을 받아 폭발적으로 증가했습니다.Grignard는 동일한 화합물에 대해 여러 개의 이름을 갖는 것이 가능했던 관습의 결여로 인해 "혼돈과 완전한 혼돈"(complete carse)이라고 설명했습니다.이것은 1892년 제네바 규칙의 창설로 이어졌습니다.[18]
유기화합물의 분류
함수군
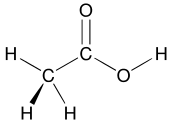
작용기의 개념은 유기화학에서 구조를 분류하고 특성을 예측하기 위한 수단으로서 중심적입니다.작용기는 분자 모듈이며, 그 작용기의 반응성은 한계 내에서 다양한 분자에서 동일하다고 가정됩니다.작용기는 유기 화합물의 화학적, 물리적 특성에 결정적인 영향을 미칠 수 있습니다.분자는 작용기에 따라 분류됩니다.예를 들어, 알코올은 모두 C-O-H라는 소단위를 가지고 있습니다. 모든 알코올은 약간 친수성인 경향이 있고, 보통 에스테르를 형성하며, 보통은 상응하는 할로겐화물로 전환될 수 있습니다.대부분의 작용 그룹은 헤테로 원자(C 및 H 이외의 원자)를 특징으로 합니다.유기 화합물은 작용기, 알코올, 카르복실산, 아민 등에 따라 분류됩니다.[19]작용기는 분자의 주변 부분에 대한 전자적인 영향으로 분자를 더 산성화하거나 염기성으로 만듭니다.
분자 부가/작용기의 pKa(일명 염기성)가 증가함에 따라 측정 시 강도가 증가하는 상응하는 쌍극자가 있습니다.작용기(pK가a 더 높기 때문에 그룹의 기본 특성)를 향하는 쌍극자는 그것을 가리키고 거리가 증가함에 따라 강도가 감소합니다.쌍극자 거리(앙스트롬으로 측정)와 작용기에 대한 입체 장애는 주변 환경과 pH 수준에 분자 간 및 분자 내 영향을 미칩니다.
상이한 작용기는 상이한 pK 값a 및 결합 강도(단일, 이중, 삼중)를 가지므로 낮은 pK로a 친유성이 증가하고 높은 pK로a 친유성 강도가 증가합니다.더 기본적인/핵 친화적인 작용기들은 더 낮은 pK를a 갖는 친전자성 작용기를 다른 분자(분자간) 또는 동일한 분자(분자내)에 공격하기를 원합니다.아실기나 카보닐기와 같이 범위 내에 있는 순산성 pK를a 갖는 그룹은 공정한 게임입니다.pK가 증가함에 따라 공격 가능성이 감소하므로 측정된 pK 값이 가장 낮은 염화 아실 성분이 공격 가능성이 가장 높고, 그 다음으로 카르복실산(pK = 4), 티올(13), 말론산(13), 알코올(17), 알데하이드(20), 질산염(25), 에스테르(25), 아민(35) 순입니다.아민은 아주 기본적이고 훌륭한 친핵자/공격자입니다.
지방족 화합물
지방족 탄화수소는 포화 상태에 따라 상동계열의 세 그룹으로 세분됩니다.
- 알케인(파라핀): 이중 또는 삼중 결합이 없는 지방족 탄화수소, 즉 C-C, C-H 단일 결합만 있음
- 알켄(olefins): 하나 이상의 이중 결합을 포함하는 지방족 탄화수소, 즉 디-올레핀(dienes) 또는 폴리-올레핀(poly-olefins.
- 알킨(acetylene): 하나 이상의 삼중 결합을 갖는 지방족 탄화수소.
나머지 그룹은 존재하는 기능 그룹에 따라 분류됩니다.이러한 화합물은 "직선 사슬", 분지 사슬 또는 순환 고리일 수 있습니다.분지 정도는 석유화학의 옥탄가나 세탄가와 같은 특성에 영향을 미칩니다.
포화(지환식) 화합물과 불포화 화합물은 모두 고리형 유도체로 존재합니다.가장 안정적인 고리는 대여섯 개의 탄소 원자를 포함하고 있지만 큰 고리(매크로사이클)와 작은 고리가 일반적입니다.가장 작은 사이클로알칸 계열은 3원 사이클로프로판(CH2)3입니다.포화 고리 화합물은 단일 결합만 포함하고 방향족 고리는 교대(또는 공액) 이중 결합을 가지고 있습니다.사이클로알케인은 다수의 결합을 포함하지 않지만 사이클로알케인과 사이클로알케인은 다수의 결합을 포함합니다.
방향족 화합물
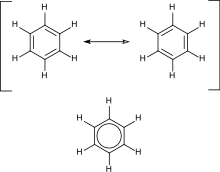
방향족 탄화수소는 공액 이중 결합을 포함합니다.이것은 고리의 모든 탄소 원자가 sp2 혼성화되어 안정성을 더한다는 것을 의미합니다.가장 중요한 예는 벤젠으로, 그 구조는 Kekulé가 처음으로 그 구조를 설명하기 위해 비국소화 또는 공진 원리를 제안하여 공식화되었습니다."통상적인" 고리형 화합물의 경우, 방향족성은 4n + 2개의 비국재화된 파이 전자의 존재에 의해 부여되며, 여기서 n은 정수입니다.특별한 불안정성(반방향성)은 4n 공액 파이 전자의 존재에 의해 부여됩니다.
복소환 화합물
헤테로 원자가 존재할 경우, 고리 자체의 구성원으로서 또는 고리 외부에 부착된 치환기로서 존재할 수 있는 헤테로 원자가 존재할 경우, 고리 탄화수소의 특성은 다시 변경됩니다.후자의 경우, 고리는 헤테로사이클이라고 불립니다.피리딘과 퓨란은 방향족 복소환의 예이고, 피페리딘과 테트라하이드로퓨란은 상응하는 지환족 복소환입니다.헤테로고리 분자의 헤테로 원자는 일반적으로 산소, 황 또는 질소이며, 후자는 생화학 시스템에서 특히 일반적입니다.
헤테로사이클은 아닐린 염료와 의약품을 포함한 다양한 제품에서 흔히 발견됩니다.또한, 이들은 알칼로이드, 비타민, 스테로이드 및 핵산(예를 들어, DNA, RNA)과 같은 다양한 생화학적 화합물에 널리 사용됩니다.
고리는 가장자리의 다른 고리와 융합하여 다환 화합물을 생성할 수 있습니다.퓨린 뉴클레오사이드 염기는 주목할 만한 다환 방향족 헤테로사이클입니다.고리는 또한 하나의 원자(거의 항상 탄소)가 하나의 고리와 두 개의 고리로 가는 두 개의 결합을 가지는 "모서리"에 융합될 수 있습니다.그러한 화합물은 스피로라고 불리며 몇몇 천연물에서 중요합니다.
폴리머

탄소의 중요한 특성 중 하나는 탄소-탄소(탄소 대 탄소) 결합으로 연결된 사슬 또는 네트워크를 쉽게 형성한다는 것입니다.연결 과정은 중합이라고 불리는 반면, 사슬 또는 네트워크는 폴리머라고 불립니다.그 공급원 화합물을 단량체라고 합니다.
고분자의 주요한 두 그룹은 합성 고분자와 생체 고분자가 존재합니다.합성 고분자는 인공적으로 제조된 것으로 흔히 공업용 고분자라고 합니다.[21]생체고분자는 자연 환경에서 또는 인간의 개입 없이 발생합니다.
생체분자
생물 분자 화학은 생화학자들에 의해 자주 연구되는 유기 화학 내의 주요 범주입니다.많은 복합 다기능 그룹 분자들은 생물체에서 중요합니다.어떤 것들은 긴 사슬 생체 고분자이며, 이것들은 동물의 녹말과 식물의 셀룰로스와 같은 펩티드, DNA, RNA 및 다당류를 포함합니다.다른 주요 부류는 아미노산(펩타이드와 단백질의 단분자 구성 요소), 탄수화물(다당류를 포함), 핵산(DNA와 RNA를 포함하는 고분자), 지질입니다.게다가, 동물 생화학은 크렙스 사이클을 통해 에너지 생산을 돕는 많은 작은 분자 중간체를 포함하고 있고, 동물들에게 가장 흔한 탄화수소인 이소프렌을 생산합니다.동물의 이소프렌은 중요한 스테로이드 구조와 스테로이드 호르몬 화합물을 형성합니다; 그리고 식물에서는 고무를 만드는 기초가 되는 다양한 식물 종의 라텍스에 존재하는 테르펜, 테르페노이드, 일부 알칼로이드, 그리고 바이오폴리머 폴리이소프렌노이드라고 불리는 탄화수소 종류를 형성합니다.
참고: 펩타이드 합성, 올리고뉴클레오티드 합성, 탄수화물 합성.
소분자

약리학에서 유기 화합물의 중요한 그룹은 '작은 유기 화합물'이라고도 불리는 작은 분자입니다.이러한 맥락에서, 작은 분자는 생물학적으로 활성이지만 폴리머가 아닌 작은 유기 화합물입니다.실제로, 작은 분자는 대략 1000 g/mol 미만의 몰 질량을 갖습니다.
풀러렌
구형과 관형 구조를 가진 탄소 화합물인 플러렌과 탄소 나노튜브는 물질 과학의 관련 분야에 대한 많은 연구를 자극했습니다.최초의 플러렌은 1985년 영국의 해롤드 W. 크로토 경과 리처드 E. 스몰리와 로버트 F에 의해 발견되었습니다.미국의 컬 주니어.이 화학자들과 그들의 조수들은 헬륨 가스의 대기에서 흑연봉을 기화시키기 위해 레이저를 사용하여 단일 결합과 이중 결합으로 결합된 60개의 탄소 원자 (C60)로 구성된 새장 같은 분자를 얻어 12개의 오각형 면과 20개의 육각형 면으로 이루어진 축구공 또는 축구공과 비슷한 디자인의 중공 구를 형성했습니다.1996년에 그 3인조는 그들의 선구적인 노력으로 노벨상을 수상했습니다.C60 분자는 미국인 건축가 R의 이름을 따서 벅민스터플러렌(혹은 간단히 버키볼)이라고 명명되었습니다.벅민스터 풀러, 측지 돔은 같은 구조적 원리 위에 지어졌습니다.
다른이들
탄소와 질소, 산소 및 할로겐의 결합을 포함하는 유기 화합물은 일반적으로 별도로 그룹화되지 않습니다.다른 것들은 때때로 유기 화학 내에서 주요 그룹으로 분류되며 유기황 화학, 유기금속 화학, 유기인 화학, 유기규소 화학과 같은 제목으로 논의됩니다.
유기반응
유기 반응은 유기 화합물을 포함하는 화학 반응입니다.이러한 반응의 대부분은 작용기와 관련이 있습니다.이러한 반응의 일반적인 이론은 주요 원자의 전자 친화성, 결합 강도 및 입체 장애와 같은 특성에 대한 세심한 분석을 포함합니다.이러한 요인은 수명이 짧은 반응 중간체의 상대적 안정성을 결정할 수 있으며, 이는 일반적으로 반응의 경로를 직접적으로 결정합니다.
기본 반응 유형은 첨가 반응, 제거 반응, 치환 반응, 주기적 반응, 재배열 반응 및 산화 환원 반응입니다.일반적인 반응의 예로는 다음과 같은 치환 반응이 있습니다.
가능한 유기 반응의 수는 무한합니다.그러나 일반적이거나 유용한 반응을 설명하는 데 사용할 수 있는 특정 일반적인 패턴이 관찰됩니다.각 반응은 순차적으로 일어나는 과정을 설명하는 단계적 반응 메커니즘을 가지고 있지만, 단계에 대한 자세한 설명은 반응물 목록만으로는 항상 명확하지는 않습니다.
임의의 주어진 반응 메커니즘의 단계적 과정은 시작 물질이 중간체를 거쳐 최종 생성물로 전이될 때 전자의 이동을 추적하기 위해 곡선 화살표가 사용되는 화살표 밀기 기술을 사용하여 나타낼 수 있습니다.
유기합성

합성 유기 화학은 공학, "실용적인 목적을 위한 작품의 설계, 분석 및/또는 구성"과 경계를 이루는 응용 과학입니다.새로운 화합물의 유기 합성은 문제 해결 과제로, 최적의 출발 물질에서 최적의 반응을 선택하여 대상 분자에 대해 합성을 설계합니다.복합 화합물은 원하는 분자를 순차적으로 생성하는 수십 개의 반응 단계를 가질 수 있습니다.분자 내 작용기의 반응성을 이용하여 합성이 진행됩니다.예를 들어, 카보닐 화합물은 엔올레이트로 변환하여 친핵체로 사용될 수도 있고, 전기적으로 사용될 수도 있습니다; 이 둘의 조합을 알돌 반응이라고 합니다.실질적으로 유용한 합성을 설계하려면 항상 실험실에서 실제 합성을 수행해야 합니다.복잡한 분자들을 위한 새로운 합성 경로를 만드는 과학적인 방법은 전체 합성이라고 불립니다.
합성을 설계하는 전략에는 표적 분자에서 시작하여 알려진 반응에 따라 조각으로 쪼개는 E.J. 코리에 의해 대중화된 레트로 합성이 포함됩니다.조각들, 또는 제안된 전구체들은 이용 가능하고 이상적으로 저렴한 출발 물질에 도달할 때까지 동일한 처리를 받습니다.그리고 나서, 역합성은 합성을 주기 위해 반대 방향으로 쓰여집니다.각각의 화합물과 각각의 전구체가 여러 개의 합성물을 가지고 있기 때문에 "합성 트리"를 만들 수 있습니다.
참고 항목
참고문헌
- ^ a b c 클레이든, J.; 그리브스, N. and Warren, S. (2012) 유기화학.옥스퍼드 대학교 출판부. 1-15쪽. ISBN0-19-927029-5.
- ^ Elschenbroich, C. (2006) Organometalics 3판, Wiley-VCH
- ^ 모리슨, 로버트 T.;Boyd, Robert N. and Boyd, Robert K. (1992) Organic Chemistry, 6판, Benjamin Cummings.ISBN 978-0136436690.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ Henry Marshall Leicester; Herbert S. Klickstein (1951). A Source Book in Chemistry, 1400-1900. Harvard University Press. p. 309.
- ^ Kiefer, D. M. (1993). "Organic Chemicals' Mauve Beginning". Chem. Eng. News. 71 (32): 22–23. doi:10.1021/cen-v071n032.p022.
- ^ "August Kekulé and Archibald Scott Couper". Science History Institute. June 2016. Retrieved 20 March 2018.
- ^ Streitwieser, Andrew; Heathcock, Clayton H.; Kosower, Edward M. (2017). Introduction to Organic Chemistry. New Delhi: Medtech (Scientific International, reprint of revised 4th edition, Macmillan, 1998). pp. 3–4. ISBN 978-93-85998-89-8.
- ^ 로버츠, 로라 (2010년 12월 7일) 아스피린의 역사.텔레그래프
- ^ Bosch F; Rosich L (2008). "The contributions of Paul Ehrlich to pharmacology: A tribute on the occasion of the centenary of his Nobel Prize". Pharmacology. 82 (3): 171–9. doi:10.1159/000149583. PMC 2790789. PMID 18679046.
- ^ "Paul Ehrlich, the Rockefeller Institute, and the first targeted chemotherapy". Rockefeller University. Retrieved 3 Aug 2012.
- ^ "Paul Ehrlich". Science History Institute. June 2016. Retrieved 20 March 2018.
- ^ Torker, Sebastian; Müller, Andre; Sigrist, Raphael; Chen, Peter (2010). "Tuning the Steric Properties of a Metathesis Catalyst for Copolymerization of Norbornene and Cyclooctene toward Complete Alternation". Organometallics. 29 (12): 2735–2751. doi:10.1021/om100185g.
- ^ Steingruber, Elmar (2004) "인디고와 인디고 착색제" 울만의 산업화학 백과사전, Wiley-VCH, Weinheim.doi:10.1002/14356007.a14_149.pub2
- ^ Nicolaou, K.C.; Sorensen, E.J. (1996). Classics in Total Synthesis: Targets, Strategies, Methods. Wiley. ISBN 978-3-527-29231-8.
- ^ 앨런, 바바라.라이브시, 브라이언 (1994)생물학적 추상화, 화학적 추상화 및 지수 화학적 추상화의 사용법가워.ISBN 978-0-566-07556-8
- ^ Shriner, R.L.; Hermann, C.K.F.; Morrill, T.C.; Curtin, D.Y. and Fusson, R.C. (1997) 유기화합물의 체계적 식별.John Wiley & Sons, ISBN 0-471-59748-1
- ^ Evieux, E. A. (1954-06-01). "The Geneva Congress on Organic Nomenclature, 1892". Journal of Chemical Education. 31 (6): 326. Bibcode:1954JChEd..31..326E. doi:10.1021/ed031p326. ISSN 0021-9584.
- ^ Smith, Michael B.; March, Jerry (2007), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th ed.), New York: Wiley-Interscience, ISBN 978-0-471-72091-1
- ^ "The pKa Table Is Your Friend". Master Organic Chemistry. 2010-06-18. Retrieved 2021-03-16.
- ^ "산업용 폴리머, 화학"æ디아 브리태니커 백과사전. 2006
외부 링크
- MIT.edu , 오픈코스웨어: 유기화학Ⅰ
- HaverFord.edu , 유기화학 강의, 동영상 및 텍스트
- Organic-Chemistry.org , 유기화학 포털 – 최근 초록 및 (이름)반응
- Orgsyn.org , 유기화학 합성저널
- Clutchprep.com , 유기화학 동영상 강의 및 실습문제
- Khanacademy.org , 칸아카데미 - 유기화학