화학식
Chemical formula| 황산 알루미늄은 화학적 공식인 Al2(SO4)을 가지고 있다.3황산알루미늄 육각카하이드레이트의 형태는 Al2(SO4)·316이다.H2O. |
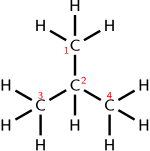
| 부탄의 구조 공식.부탄에 대한 다른 화학적 공식의 예로는 경험적 공식 CH25, 분자 공식 CH410 및 응축된(또는 반구조적) 공식 CHCHCH가3223 있다. |
화학식은 화학원소 기호, 숫자, 그리고 괄호, 대시, 괄호, 쉼표 및 더하기(+)와 마이너스(-) 부호와 같은 다른 기호를 사용하여 특정 화학성분이나 분자를 구성하는 원자의 화학적 비율에 대한 정보를 표시하는 방법이다.이것들은 첨자와 위첨자를 포함할 수 있는 기호의 단일 타이포그래픽 선으로 제한된다.화학식은 화학적 이름이 아니며, 어떤 단어도 포함하지 않는다.비록 화학식이 특정한 단순한 화학 구조를 의미할 수 있지만, 그것은 완전한 화학 구조 공식과 같지 않다.화학적 공식은 분자와 화학 물질 중 가장 단순한 구조만을 완전히 명시할 수 있으며, 일반적으로 화학적 명칭이나 구조 공식보다 힘이 더 제한된다.
가장 단순한 형태의 화학적 공식은 경험적 공식이라고 불리며, 이는 각 유형의 원자의 숫자 비율을 나타내는 문자와 숫자를 사용한다.분자 공식은 구조에 대한 정보가 없는 분자 내 각 원자의 단순한 수를 나타낸다.예를 들어 포도당에 대한 경험적 공식은2 CHO(탄소와 산소의 두 배)이고, 분자 공식은 CHO6126(수소 원자 12개, 탄소 및 산소 원자 6개)이다.
때로는 화학식이 응축식(또는 응축된 분자식, 때로는 "세미구조식"이라고도 함)으로 쓰여 복잡하기도 하는데, 이 공식은 공밸런트 결합, 이온 결합 또는 여러 조합의 원자가 화학적으로 결합되는 특정한 방법에 대한 추가 정보를 전달한다.sy type이는 관련 결합을 한 차원에서도 쉽게 보여줄 수 있는 경우 가능하다.그 예가 에탄올의 응축된 분자/화학 공식인데, 에탄올은 CH-CH-OH32 또는 CHCHO이다32. 다만, 응축된 화학 공식이라도 원자, 특히 4개 이상의 다른 대체 물질과 결합한 원자 사이의 복잡한 결합 관계를 보여주는 능력이 반드시 제한되어 있다.
화학 공식은 화학 원소 기호의 단일 선으로 표현되어야 하기 때문에, 화학 화합물에서 원자들 사이의 공간 관계를 그래픽으로 표현한 진정한 구조 공식만큼 유익할 수 없는 경우가 많다(예: 부탄 구조 공식과 화학 공식의 오른쪽 그림 참조).구조 복잡성의 이유로, 단일 응축 화학 공식(또는 반구조 공식)은 이소머라고 알려진 다른 분자에 해당할 수 있다.예를 들어 포도당은 과당, 갈락토스, 마노스를 포함한 많은 다른 당들과 분자식 CHO를6126 공유한다.선형 등가 화학적 명칭은 모든 복잡한 구조 공식(화학 명칭 참조)을 고유하게 지정할 수 있고 명시할 수 있는 것이 존재하지만, 그러한 명칭은 화학 공식을 정의하는 단순한 요소 기호, 숫자 및 단순한 활자 기호보다는 많은 용어(단어)를 사용해야 한다.
화학 공식은 화학 반응과 이온 화합물이 용액으로 용해되는 것과 같은 다른 화학적 변형을 설명하기 위해 화학 방정식에 사용될 수 있다.전술한 바와 같이 화학적 공식은 원자 사이의 화학적 관계를 보여줄 수 있는 구조적 공식의 전력은 없지만, 화학 반응에서 원자의 수와 전하의 수를 추적하기에 충분하며, 따라서 화학 방정식의 균형을 유지하여 이러한 방정식을 합의자와 관련된 화학적 문제에 사용할 수 있다.원자의 결합과 전하의 보존.
개요
화학식은 화학적 기호로 각 구성 원소를 식별하고 각 원소의 비례 원자의 수를 나타낸다.경험적 공식에서 이러한 비율은 주요 원소로 시작한 다음 화합물에 있는 다른 원소의 원자 수를 주요 원소에 비율별로 할당한다.분자 화합물의 경우 이러한 비율 수치는 모두 정수로 표현할 수 있다.예를 들어 에탄올의 분자는 모두 2개의 탄소 원자와 6개의 수소 원자와 1개의 산소 원자를 포함하고 있기 때문에 에탄올의 경험적 공식은 CHO라고26 쓰여질 수 있다.그러나 일부 유형의 이온 화합물은 완전히 정수 경험적 공식으로 쓰여질 수 없다.예를 들어 붕소 카바이드(boron carbide)가 있는데, CB의n 공식은 n이 4에서 6.5보다 많은 가변 비 와일 수 비율이다.
공식의 화학적 화합물이 단순한 분자로 구성되었을 때, 화학적 공식은 종종 분자의 구조를 제안하는 방법을 사용한다.이러한 종류의 공식은 분자공식, 응축공식 등으로 다양하게 알려져 있다.분자식은 분자 안에 있는 원자의 수를 반영하기 위해 원자의 수를 열거하므로 포도당의 분자식은 포도당 경험식인 CHO가2 아니라 CHO가6126 된다.그러나 매우 단순한 물질을 제외하고는 분자 화학적 공식은 필요한 구조적 정보가 부족하고 모호하다.
단순한 분자의 경우 응축식(또는 반구조식)은 올바른 구조식을 완전히 암시할 수 있는 화학식의 한 유형이다.예를 들어, 에탄올은 응축된 화학 공식 CHCHOH로32, 디메틸 에테르는 응축된 화학 공식 CHOCH로33 나타낼 수 있다.이 두 분자는 동일한 경험적 공식과 분자 공식(CHO26)을 가지고 있지만, 이 간단한 유기 화합물의 전체 구조를 나타내기에 충분한 표시된 응축된 공식에 의해 구별될 수 있다.
응축된 화학적 공식은 이산 분자로 존재하지 않는 이온 화합물을 나타내기 위해 사용될 수 있지만 그럼에도 불구하고 그 안에 공칭으로 결합된 성단을 포함하고 있다.이 다원자 이온은 황산염[SO
4]2−
이온과 같이 공동 결합되어 전체 이온 전하를 갖는 원자의 그룹이다.화합물의 각 다원자 이온은 별도의 그룹화를 설명하기 위해 개별적으로 작성된다.예를 들어, 디클로로인 육산화합물은 경험적 공식인
3 ClO와 분자 공식인 ClO를
2
6 가지고 있지만, 액체나 고체 형태에서는 이 화합물이 이온과 [ClO
2
4]+
−
이온으로 구성되어 있음을 보여주는 이온 농축식[ClO
2][+
ClO
4]]−
로 보다 정확하게 표시된다.이런 경우 응축식은 각 이오닉 종 중 적어도 한 종을 보여줄 수 있을 정도로 복잡하기만 하면 된다.
여기서 설명한 화학적 공식은 화학적 명칭의 다양한 시스템에 사용되는 훨씬 복잡한 화학 체계적 명칭과는 구별된다.예를 들어 포도당의 한 체계적 이름은 (2R,3S,4R,5R)-2,3,4,5,6-펜타하이드록시헥사날이다.뒤의 규칙에 의해 해석되는 이 이름은 포도당의 구조식을 완전히 명시하고 있지만, 그 명칭은 보통 이해되는 화학식이 아니며, 화학적 공식에서는 사용되지 않는 용어와 단어를 사용한다.이러한 명칭은, 기본적인 공식과는 달리, 그래프 없이 완전한 구조 공식을 나타낼 수 있을 것이다.
경험식
화학에서 화학의 경험적 공식은 각 원자의 유형별 상대적 수나 화합물 내 원소의 비율을 단순하게 표현한 것이다.경험적 공식은 CaCl과
2 같은 이온 화합물과 SiO와
2 같은 고분자의 표준이다.경험적 공식은 이성질체, 구조 또는 원자의 절대 수를 언급하지 않는다.경험적 용어는 원소별 순수 화학 물질의 상대적 비율 구성을 결정하는 데 사용되는 분석 화학의 기술인 원소 분석 과정을 말한다.
예를 들어, 헥산은 CH
6
14, 즉 구조적으로 CHCHCHCH의
3
2
2
2
2
3 분자식을 가지고 있어, 6개의 탄소 원자와 14개의 수소 원자의 연쇄 구조를 가지고 있음을 암시한다.그러나 헥산에 대한 경험적 공식은 CH이다
3
7.마찬가지로 과산화수소에 대한 경험식인 HO는
2
2 단순히 성분 원소의 1:1 비율을 나타내는 HO이다.포름알데히드와 아세트산은 같은 경험적 공식인 CHO를
2 가지고 있다.이것이 포름알데히드의 실제 화학식이지만 아세트산은 원자의 수가 두 배나 된다.
분자식
분자 공식은 분자 물질의 분자에 포함된 각 원자의 단순한 수를 나타낸다.그것들은 특정 유형의 원자 하나만 가지고 있는 분자에 대한 경험적 공식과 동일하지만, 그렇지 않으면 숫자가 더 클 수도 있다.그 차이의 예로는 포도당의 경험적 공식인 CHO2(비율 1:2:1)가 있고, 분자 공식은 CHO6126(원자 수 6:12:6)가 있다.물의 경우, 두 공식은 모두 HO이다2.분자 공식은 경험적인 공식보다 분자에 대한 정보를 더 많이 제공하지만, 확립하기가 더 어렵다.
분자 공식은 분자 내 원소의 수를 보여주고, 그것이 이항 화합물인지, 3차 화합물인지, 2차 화합물인지, 또는 훨씬 더 많은 원소를 가지고 있는지를 결정한다.
응축식
분자의 연결은 종종 물리적, 화학적 특성 및 행동에 강한 영향을 미친다.동일한 유형의 원자(즉, 한 쌍의 이소머)의 동일한 숫자로 구성된 두 개의 분자는 원자가 서로 다르거나 서로 다른 위치에 연결되어 있는 경우 화학적 및/또는 물리적 특성이 완전히 다를 수 있다.이러한 경우 어떤 원자가 다른 원자와 결합되는지를 보여주는 구조 공식은 유용하다.연결성을 통해 분자의 대략적인 모양을 추론할 수 있는 경우가 많다.
응축된 화학식은 등가물이나 복잡한 구조를 반드시 명시하지는 않지만, 단순한 화학 물질에서 결합의 유형과 공간 배열을 나타낼 수 있다.예를 들어, 에탄은 서로 단결합한 두 개의 탄소 원자로 구성되어 있으며, 각각의 탄소 원자는 그것에 결합된 세 개의 수소 원자를 가지고 있다.그것의 화학식은 CHCH로33 만들어질 수 있다.에틸렌에서는 탄소 원자 사이에 이중 결합이 있다(따라서 각 탄소는 두 개의 수산화물만 가지고 있다), 따라서 화학적 공식은 CHCH라고22 쓰여질 수 있으며, 탄소가 4의 용맹성을 가지기 때문에 탄화수소 사이에 이중 결합이 있다는 사실은 암묵적이다.그러나 좀 더 명시적인 방법은 HC2=CH2 또는 그 이하 일반적으로 HC2::CH2. 두 선(또는 두 쌍의 점)은 이중 결합이 원자의 양쪽에 있는 원자를 연결한다는 것을 나타낸다.
삼중 결합은 세 개의 선(HC≡CH) 또는 세 쌍의 점(HC:::CH) 및 모호성이 있을 경우 단일 결합을 나타내기 위해 단일 선 또는 점 쌍을 사용할 수 있다.
동일한 여러 기능군을 가진 분자는 반복된 그룹을 둥근 괄호로 묶어서 표현할 수 있다.예를 들어 이소부탄은 (CH3)3CH로 표기할 수 있다.이 응축된 구조 공식은 동일한 비율의 동일한 원자를 사용하여 형성될 수 있는 다른 분자(등분자)와의 다른 연결을 의미한다.공식(CH3)3CH는 수소 원자 1개와 CH3 그룹 3개에 연결된 중심 탄소 원자를 의미한다.각 원소의 동일한 수의 원자(수력 10개, 탄화 4개, 또는410 CH)를 사용하여 직선 체인 분자인 n-부탄: CHCHCH를3223 만들 수 있다.
구성의 법칙
주어진 화학 화합물에서 원소들은 항상 서로 같은 비율로 결합한다.이것이 끊임없는 구성의 법칙이다.
상수구성 법칙에 따르면 특정 화학성분에서 해당 화합물의 모든 표본은 동일한 비율이나 비율로 동일한 원소로 구성된다.예를 들어, 어떤 물 분자는 항상 2:1의 비율로 두 개의 수소 원자와 한 개의 산소 원자로 이루어져 있다.물 분자 내 산소와 수소의 상대적 질량을 살펴보면 물 분자 질량의 94%가 산소에 의해 설명되고 나머지 6%는 수소의 질량임을 알 수 있다.이 질량 비율은 모든 물 분자에 대해 동일할 것이다.[1]
화학적 공식의 제한에 따른 화학적 이름
but-2-ene이라고 불리는 알켄은 화학 공식 CHCH3=CHCH가3 식별하지 못하는 두 개의 이소머를 가지고 있다.두 메틸 그룹의 상대적 위치는 메틸 그룹이 이중 결합(cis 또는 Z)의 같은 쪽에 있는지 또는 서로 반대쪽에 있는지(trans 또는 E)를 나타내는 추가 표기법으로 표시해야 한다.[2]
위에서 언급한 바와 같이, 많은 복잡한 유기화합물과 무기화합물의 완전한 구조적 공식들을 나타내기 위해서는, 화학적 명명법이 위에서 단순 응축된 공식에서 사용되는 가용 자원을 훨씬 뛰어넘는 것이 필요할 수 있다.예는 유기화학 IUPAC 명명법 및 무기화학 2005 IUPAC 명명법을 참조한다.또, 국제 화학 식별자(InChI)와 같은 선형 명명 시스템을 통해 컴퓨터가 구조 공식을 구성할 수 있고, 분자 입력 라인 입력 시스템(SMiles)을 단순화하면 사람이 더 잘 읽을 수 있는 ASCII 입력이 가능하다.그러나 이 모든 명명 체계는 화학적 공식의 표준을 넘어서며, 기술적으로는 공식 체계가 아닌 화학적 명명 체계가 된다.[citation needed]
응축공식을 가진 중합체
응축된 화학적 공식에 있는 중합체의 경우, 반복 단위 주위에 괄호를 배치한다.예를 들어 CH3(CH2)50CH로3 묘사되는 탄화수소 분자는 50개의 반복단위를 가진 분자다.반복 단위의 수를 알 수 없거나 가변적인 경우, n자를 사용하여 이 공식: CH3(CH2)nCH를3 나타낼 수 있다.
응축식 이온
이온의 경우 특정 원자의 전하를 오른쪽 위첨자로 나타낼 수 있다.예를 들어, Na+ 또는 Cu2+.충전된 분자 또는 다원자 이온의 총 전하량도 이와 같이 보일 수 있다.예: HO3+ 또는 SO42−.+와 -는 각각 +1과 -1 대신 사용된다.
더 복잡한 이온의 경우, Cs2[BH1212]와 같은 화합물에서 볼 수 있는 [BH1212]2−와 같이 대괄호 [ ]를 이온식을 둘러싸는 데 사용하는 경우가 많다.괄호( )는 [Co(NH3)]63+Cl과3− 같이 반복 단위를 나타내기 위해 괄호 안에 내포할 수 있다.여기서 (NH3)6는 이온이 코발트에 결합된 6개의 NH3 그룹을 포함하고 있음을 나타내며, [ ]은 이온의 전체 공식에 전하 +3을 감싼다.[further explanation needed]
이는 엄격히 선택사항이며, 화학식은 이온화 정보를 포함하거나 포함하지 않고 유효하며, 헥삼민코발트(III) 염화물은 [Co(NH3)]63+Cl3− 또는 [Co(NH3)]6Cl3. 괄호처럼 수학에서와 같이 화학에서 작용하며, 항을 함께 그룹화한다 – 이온화 상태에만 특별히 채택된 것은 아니다.여기서 후자의 경우 괄호는 크기가 1인 다른 그룹(코발트 원자)에 접합된 6개의 그룹을 나타내며, 그 다음 전체 묶음이 3개의 염소 원자에 결합된다.전자의 경우, 클로로닌을 연결하는 결합이 공동효율이 아닌 이온성이 더 명확하다.
동위 원소
동위원소는 기존 화학에 비해 핵화학이나 안정적 동위원소 화학에 더 관련이 있지만, 화학식에서는 서로 다른 동위원소가 접두사 위첨자로 표시될 수 있다.예를 들어 방사성 인인-32를 함유한 인산염 이온은 [32PO4]3−이다.또한 안정적인 동위원소 비율을 포함하는 연구에는 OO라는16 분자가 포함될 수 있다.
왼쪽 첨자는 원자 번호를 나타내기 위해 중복적으로 사용되기도 한다.예를 들어, dioxygen의 경우 O2, dioxygen의 가장 풍부한 동위원소 종의 경우 O
2.이는 핵반응에 대한 방정식을 작성할 때 전하의 균형을 보다 명확하게 보여주기 위해 편리하다.
갇힌 원자
@ 기호(at 기호)는 우리 안에 갇혀 있지만 화학적으로 결합되지 않은 원자나 분자를 나타낸다.예를 들어 원자(M)를 가진 버크민스터풀레렌(C60)은 화학적 결합이 없는 풀레렌 안에 M이 있었든 아니면 탄소 원자 중 하나에 묶여 있었든 상관없이 간단히 MC로60 표현될 것이다.@ 기호를 사용하여 M이 탄소망 내부에 있다면 이것은 M@C로60 표시된다.비풀레렌의 예는 한 개의 As 원자가 다른 32개의 3−원자에 의해 형성된 우리에 갇힌 이온인 [As@NiAs1220]이다.
이 표기법은 1991년[3] La60@C나 La82@C와 같은 원자를 형성하도록 함정에 빠뜨릴 수 있는 풀러렌 케이지(내측면 풀러렌)가 발견되면서 제안되었다.기호의 선택은 간결하고, 쉽게 인쇄되고, 전자적으로 전송되는 것으로 저자들에 의해 설명되어 왔다(at 기호는 대부분의 현대적인 문자 인코딩 체계가 기초하고 있는 ASCII에 포함됨), 그리고 내피드랄 풀렌의 구조를 암시하는 시각적인 측면.
비스토리히화학공식
화학적 공식은 각 원소에 대해 정수를 가장 많이 사용한다.그러나 작은 정수로 나타낼 수 없는 비스토이치계 화합물이라 불리는 화합물의 종류가 있다.그러한 공식은 FeO에서와0.95 같이 십진수 분수를 사용하여 작성되거나 FeO에서와1–x 같이 문자로 표현되는 변수 부분을 포함할 수 있다. 여기서 x는 일반적으로 1보다 훨씬 작다.
유기화합물의 일반 형태
일정한 단위로 서로 다른 일련의 화합물에 사용되는 화학식을 일반식이라고 한다.그것은 일련의 화학적 공식들을 생성한다.예를 들어, 알코올은 메탄올, 에탄올, 프로판올을 n=1–3에 제공하는 CHOHn(2n + 1)(n ≥ 1) 공식으로 나타낼 수 있다.
힐 시스템
힐 시스템(또는 힐 표기법)은 분자 내 탄소 원자의 수, 그 다음 수소 원자의 수, 그 다음 다른 모든 화학 원소의 수를 알파벳 순으로 표시하는 경험적 화학 공식, 분자 화학 공식 및 응축 공식의 성분들을 작성하는 시스템이다.그는 화학 기호들을 가지고 있다.공식이 탄소를 포함하지 않으면 수소를 포함한 모든 원소가 알파벳 순으로 나열된다.
이러한 규칙에 따라 공식에 존재하는 각 원소의 원자의 수에 따라 공식을 분류함으로써, 텍스트 문자열을 사전순으로 분류하는 것과 같이, 이전의 요소나 숫자의 차이가 후기 원소나 숫자의 차이보다 더 유의한 것으로 취급됨으로써 화학 공식을 조합할 수 있다.힐 시스템 오더로 알려진 것.
Hill 시스템은 Edwin A에 의해 처음 출판되었다. 1900년 미국 특허청의 [4]힐이것은 화학 데이터베이스와 인쇄된 색인에서 화합물 목록을 정렬하기 위해 가장 일반적으로 사용되는 시스템이다.[5]
힐 시스템 순서의 공식 목록은 위와 같이 알파벳순으로 배열되어 있는데, 기호가 같은 문자로 시작할 때 단문자 원소가 두 글자 기호 앞에 온다(따라서 "B"는 "Be" 앞에 오며 "Be"는 "Br" 앞에 온다.[5]
힐 시스템을 사용하여 다음과 같은 공식을 작성하고 힐 순서에 열거한다.
- 브라이
- BrClH2Si
- CCL4
- CI3
- C2H5Br
- 호스24
참고 항목
참조
| Wikidata는 다음과 같은 속성을 가지고 있다. |
- ^ "Law of Constant Composition". Everything Math and Science. SIYAVULA. Retrieved 31 March 2016.
 이 자료는 Creative Commons Attribution-Share Elikes 3.0 라이센스로 이용할 수 있다.
이 자료는 Creative Commons Attribution-Share Elikes 3.0 라이센스로 이용할 수 있다. - ^ Burrows, Andrew. (2013-03-21). Chemistry³ : introducing inorganic, organic and physical chemistry (Second ed.). Oxford. ISBN 978-0-19-969185-2. OCLC 818450212.
- ^ Chai, Yan; Guo, Ting; Jin, Changming; Haufler, Robert E.; Chibante, L. P. Felipe; Fure, Jan; Wang, Lihong; Alford, J. Michael; Smalley, Richard E. (1991). "Fullerenes wlth Metals Inside". Journal of Physical Chemistry. 95 (20): 7564–7568. doi:10.1021/j100173a002.
- ^ Edwin A. Hill (1900). "On a system of indexing chemical literature; Adopted by the Classification Division of the U.S. Patent Office". J. Am. Chem. Soc. 22 (8): 478–494. doi:10.1021/ja02046a005. hdl:2027/uiug.30112063986233.
- ^ a b 위긴스, 게리(1991)화학 정보 출처.뉴욕: 맥그로우 힐 120페이지.
- Petrucci, Ralph H.; Harwood, William S.; Herring, F. Geoffrey (2002). "3". General chemistry: principles and modern applications (8th ed.). Upper Saddle River, N.J: Prentice Hall. ISBN 978-0-13-014329-7. LCCN 2001032331. OCLC 46872308.
외부 링크
- 힐 시스템 순서 정렬 방법을 포함한 매사추세츠 대학교 로웰 라이브러리의 힐 표기법 예
- Hill 표기법을 사용한 분자 공식 계산.힐 표기법을 계산하는 도서관은 npm에서 이용할 수 있다.