인터페론-알파/베타 수용체
Interferon-alpha/beta receptor| 인터페론(상호, 베타 수용체, 오메가) 수용체 1 | |||||||
|---|---|---|---|---|---|---|---|
| 식별자 | |||||||
| 기호 | IFNAR1 | ||||||
| Alt. 기호 | 이프나르 | ||||||
| 엔씨비유전자 | 3454 | ||||||
| HGNC | 5432 | ||||||
| 오밈 | 107450 | ||||||
| RefSeq | NM_000629 | ||||||
| 유니프로트 | P17181 | ||||||
| 기타자료 | |||||||
| 로커스 | 21번 씨 Q22.1 | ||||||
| |||||||
| 인터페론 수용체 2 | |||||||
|---|---|---|---|---|---|---|---|
 | |||||||
| 식별자 | |||||||
| 기호 | IFNAR2 | ||||||
| Alt. 기호 | IFNABR | ||||||
| 엔씨비유전자 | 3455 | ||||||
| HGNC | 5433 | ||||||
| 오밈 | 602376 | ||||||
| RefSeq | NM_207585 | ||||||
| 유니프로트 | P48551 | ||||||
| 기타자료 | |||||||
| 로커스 | 21번 씨 Q22.1 | ||||||
| |||||||
인터페론-α/β 수용체(IFNAR)는 내생성 I형 인터페론(IFN) 사이토카인을 결합하는 사실상 유비쿼터스 멤브레인 수용체다.내인성 인간형 IFN은 인터페론-α, -β, -ε,[2] -ε, -κ, -Ω, -ζ과 같은 많은 하위 유형을 포함한다.
함수
다양한 선천적 면역 신호 경로(TLR3, TLR4, TLR7, TLR8, TLR9, cGAS, LIG-I, MDA-5)의 활성화는 IFN의 (대부분) 무변성 유전자 구조로 인해 빠르게 유도된다.[3][4]IIFN 유전자의 업스트림 규제 요소가 달라 자극에 반응하여 IIFN의 차등 전사가 가능하다.[5]특히 IFNβ에는 κB 규제 사이트가 포함되어 있는 반면, IFNα 하위 유형은 그렇지 않다.특정 유형의 IFN 생산은 대개 소수의 IFN 유형의 IFN 하위 유형으로 제한된다.[5]분비된 IFNs는 파라시린과 자동분비 방식으로 IFNAR을 통해 신호를 입력한다.[6]
IFNAR은 저친화도 하위단위 IFNAR1과 고친화도 하위단위 IFNAR2로 불리는 2개의 하위유닛으로 구성된 이질세포 표면 수용체다.[7][8]I형 인터페론 바인딩 시 IFNAR은 MAPK, PI3K 및 Akt 신호 경로와 함께 JAK-STAT 신호 전달 경로를 활성화한다.[2]IFNAR의 작용은 2000개 이상의 다른 유전자의 전사를 증가시키거나 억제할 수 있는 잠재력을 가지고 전사의 변화를 초래한다.[9]예를 들어, IFNs 타입은 ISG(Interferon-Stimulated Gene) 발현을 유도하며, 고전적으로 강력한 항바이러스 면역 반응을 일으킨다.또한 IFN은 세포 건강 및 생존 능력에 주로 영향을 미치며, 세포 사멸, 자가 포식, 세포 분화 및 증식에 영향을 미친다.[10]I형 IFN의 다양한 영향은 세포와 환경 상황에 따라 달라질 수 있다.[8]
IFN의 하위 유형에 대한 항바이러스 대 항정신병 반응과 같은 다른 반응이 연구되었고 STAT 인산화 같은 근위부 신호는 결과와 상관관계가 없는 것으로 보인다.더욱이, 차등 효과는 만성 자극 후 며칠 후에 나타나지만, 수용체 구조, 방향 또는 정지계측법의 변화는 다른 유형의 IFN 하위 유형을 통한 차등 신호의 원인을 설명하지 못했다.[8][11]차등신호에 대한 현재 가설에는 3차 복합체의 안정성 또는 수명에 대한 리간드 고유의 차이,[12] 수용체의[8] 내적화와 인신매매에 대한 리간드 유도 변화, 현재 리간드 수용체 구조물에 대한 인식되지 않은 차이 등이 포함된다.[12]
구조
I형 IFN 수용체는 2개의 서브유닛 IFNAR1과 IFNAR2와 I형 IFN 리간드로 구성된 테너리 콤플렉스를 형성한다.수용체 조광 및 활성화를 위해 어느 한 서브유닛에 대한 리간드 결합이 필요하며 선행한다.IFNAR의 각 하위 유닛은 N-단자 리간드 결합 도메인(IFNAR2와 IFNAR1의 경우 각각 2개 또는 4개의 섬유소절제 타입 II와 같은 하위 도메인을 포함), 트랜스메브레인(TM) 도메인 및 세포질 도메인을 포함한다.[7]각 타입 IFN 리간드에는 수용체에 결합하는 데 관여하는 "핫스팟" 또는 보존된 아미노산의 시퀀스, 특히 수용체에 대한 각 리간드의 친화력을 결정하는 고 친화 수용체 IFNAR2가 포함되어 있다.[11]
IFN 리간드 아형식이 다른 IFN 수용체의 구조해석 결과 서로 다른 작용제에도 유사한 결합 부위가 나타났다.[8]IFN, IFNAR1 및 IFNAR2 유형의 돌연변이 유발 연구는 IFNAR2에 바인딩하는 능력에 영향을 미친 IFN 하위 유형에 중요한 결합 잔류물, 즉 "핫스팟"을 입증했다.IFNAR1에 대한 I형 IFN 바인딩은 단일 아미노산을 알라닌으로 변이시킴으로써 덜 강한 영향을 받았다.[9]중요한 것은, 리간드 친화력의 차이에도 불구하고, 구조 연구는 IFNAR과 다양한 유형의 IFN 하위 유형과의 3차 복합 구조의 차이를 밝혀내지 못했다.[8]친화력이 다른 동일한 현장에서 동일한 IFNAR 수용체를 결합하는 I형 IFN 하위 유형의 진화적 보존은 I형 IFN이 비중복적이고 잠재적으로 다른 세포 반응을 조절한다는 것을 시사한다.[2][11]보다 강력한 IFNα2를 설계하기 위한 노력은 IFNβ와 유사한 세포 반응을 이끌어 냈으며, IFNAR에 대한 I형 IFN의 친화력이 다운스트림 응답을 규제하는 데 중요한 역할을 한다는 것을 시사했다.[9]
수부닛
인간 IFNAR1과 IFNAR2 유전자는 21q22.1 염색체에 위치한다.[13][14]
IFNAR1
IFNAR1은 원래 1990년에 복제된 저친화성 서브 유닛으로 SD1-4라고 불리는 4개의 피브로넥틴 타입 II 유사(FNII 유사) 하위 도메인으로 구성되어 있다.[7][15]I형 IFN은 일반 바인딩 친화력이 0.5~5μM인 상태에서 SD1-3을 바인딩하며, IFNα1과 IFNβ는 바인딩 친화력이 각각 220nM과 100nM인 예외다.[7]I형 IFN은 IFNAR1에 대한 I형 IFN 하위 유형 선호도를 결정하는 가변 분리 속도의 바인딩 연결 속도가5 5x10M/s이다.[2]
IFNAR1의 막 발현에는 IFNAR1의 막 발현에 Tyk2 및 Tyk2와 연결된 IFNAR1 세포질 도메인이 필요하다.[2]Tyk2가 없는 경우 세포질 IFNAR1 모티브가 인광 처리되어 수용체 내부를 유도한다.[9]IFNAR1은 그 후 핵융합 내막 구획으로 국소화되며 분해된다.[8]Tyk2 null 셀은 IFNβ에 어느 정도 반응성을 유지한다.그러나 IFNα에 대한 대응성은 축소된 IFNAR1 막 표현 때문일 가능성이 높다.[8]IFNα 하위 유형과 같은 낮은 친화도 리간드에 대한 IFNAR1 바인딩은 3차 복합체 형성의 속도 제한 단계로 제안되었다.[8]따라서 IFNAR1의 멤브레인 레벨이 너무 낮으면 이진 IFNα-IFNAR2 콤플렉스는 이를 모집하여 신호를 유도할 수 없게 된다.이 가설은 IFNAR1 식이 낮은 셀 라인이 IFNα가 아니라 IFNβ에 반응한다는 관측에 의해 뒷받침된다.[8]
IFNAR2
IFNAR2는 D1과 D2라는 두 개의 FNII와 유사한 하위 도메인으로 구성된 1994년에 원래 복제된 고친화도 하위 유닛이다.[7][15]I형 IFNs는 0.4~5nM 사이의 일반적인 바인딩 친화력으로 D1과 D2를 바인딩하고 IFNβ는 약간 낮은 선호도(0.1nM)로 바인딩한다.[7]I형 IFN은 IFNAR2에 대한 I형 IFN 하위 유형 선호도를 결정하는 가변 분리 속도의 바인딩−6 연결 비율이−7 10–10M/s이다.[7]
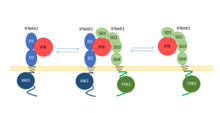
IFNAR2는 대체 스플라이싱, 엑손 스킵, 다중 폴리아데닐화 사이트로 인해 3개의 이소 형태로 표현된다. IFNAR2a(TM 영역이 부족한 수용성 형태), IFNAR2b( 세포질 영역이 부족한 수용성 형태), IFNAR2c(막 결합, 신호 경쟁 형태)이다.[2]IFNAR2c의 세포질 영역은 JAK1과 연관된다.[2]
신호
I형 IFN은 IFNAR1 또는 IFNAR2에 바인딩되어 이진 콤플렉스를 형성한다.[9]바이너리 콤플렉스는 나머지 IFNAR 서브 유닛을 추가로 모집하여 3차 콤플렉스를 완료하고 다운스트림 JAC/STAT 신호를 활성화한다.[9]IFNAR에 대한 IFN 레깅은 수용체 관련 키나아제인 JAK1과 Tyk2를 근접하게 가져와 IFNAR1과 IFNAR2에 대한 키나아제 트랜스인산화 및 이후 티로인의 인산화 결과를 초래한다.[5][7]IFNAR1과 IFNAR2의 인산염 잔류물은 SH2 도메인을 통해 STAT 단백질[7](일반적으로 STAT4, STAT5, STAT6이 특정 세포 유형에[16] 역할을 할 수 있지만 STAT1, STAT2 또는 STAT3)을 모집한다.일단 모집되면, STAT 단백질은 그들의 호모나 이질화를 유도하는 인산화된다.[17]이러한 조광기는 핵으로 번역되어, 간섭 자극 반응 요소(ISRE)와 감마 활성화 시퀀스(GAS)를 결합하여 유전자 전사를 촉진한다.[7][17]
규정
정상 조건에서 IFN 레벨은 바이러스 감염으로부터 보호되는 편익과 IFN 신호와 관련된 다른 세포 효과(예: 세포 주기 구속, 면역 변조)의 균형을 맞추기 위해 가정적으로 조절된다.[9]I형 IFN 신호의 엄격한 규제는 타이밍과 위치의 중요성을 시사한다.[5]I형 IFN 신호는 신호 성분의 차등 표현,[18] IFNAR 결합에 따른 차등 신호,[9] 수용체의 내포 및 다운조절, 음성 피드백 메커니즘을[9] 통해 제어된다.[2][9][15]
미분식
IFN 형식에 대한 대응성에는 IFNAR 및 STAT을 포함하여 주어진 대상 셀 내의 신호 구성요소의 표현이 필요하다.IFNAR 및 STATs에 대한 표현 수준과 변환 후 수정은 셀 응답성을 수정할 수 있다.[18]중요한 것은, 신호는 다른 STAT 단백질 표현 수준과 STAT 이단자 및 STAT 호모디머의 활성화에 의해 영향을 받는다; STAT 표현 수준을 줄이면 항바이러스, 항정신병제 및 염증 반응이 타입 IFN으로 바뀐다.[18]반대로 STAT1과 IRF9의 표현 증가는 진행 중인 사이토카인 수용체 신호가 없어도 ISG 표현을 유지하여 IFNAR 신호를 증폭시킨다.[18]IFN 신호는 단백질 번역에 관여하는 단백질을 변조하기 때문에 유도 유전자와 경로 신호에 관여하는 단백질의 단백질 수준을 간접적으로 변화시킬 수도 있다.[18]
30~70%의 호몰로지 범위인 I형 IFN 하위 유형은 모두 동일한 수용체를 결합한다.[9]한 수용체가 여러 개의 인지된 리간드에 어떻게 다르게 반응하는지를 더 잘 이해하기 위해 편향된 작용이 연구되어 이질적인 결과로 정점을 찍었다.
내분포증 및 다운조절
IFNAR1과 IFNAR2는 Clathrin 의존적이고 Clathrin 독립적인 메커니즘을 통해 작용에 반응하여 내분균을 통해 내분될 수 있다.[2]IFNAR 하위 유니트는 IFN 자극에 따라 차등 하향 조정될 수 있다.예를 들어 멤브레인 IFNAR1은 IFNα에 대응하여 감소하지만, IFNAR1과 IFNAR2는 IFNβ 바인딩에 대응하여 표면 수준이 하향 조정된다.[8]이러한 관측과 일치하여 IFNAR 내실화는 종종 각 작용제의 반작용 효과 유도 능력과 관련된다.[7]
IFNAR 소단위 내실화도 IFNAR2보다 IFNAR1의 기저 회전율이 더 큰 기저 조건에서 관찰된다.[2]IFNAR1은 내부화와 열화를 가능하게 하는 편재화를 위한 디그론 또는 모티브를 포함하고 있다.[2]Tyk2는 이 변을 차단하여 내장을 막을 수 있다.[8]
클라트린 의존성 내포증
수용체 작용에 이어 IFNAR의 C-terminus가 인광화되며, 그 다음으로는 유비쿼터스화 및 내연화가 이루어진다.[8][15]IFNAR 표면 표현은 Clathrin의 siRNA 녹다운 또는 GTPase 다이너믹의 작은 분자 억제제를 사용하여 Clathrin 의존성 내분증 경로를 억제할 때 자극의 존재로 유지된다.[15]내분화하면 수용체가 분해되어 막 발현이 감소하거나,[15] 멤브레인 수용체 수치에 대한 장기적인 영향 없이 수용체를 재활용하는 결과를 초래할 수 있다.[2]그러나 쇄도 매개 내피증은 IFNAR 수용체와 신호 구성요소를 집중시켜 신호를 증폭시키는 역할을 할 수도 있다.[15]전자 현미경 검사 실험에 따르면 IFNAR 수용체는 클라트린 코팅 구덩이에 집중되어 있으며, 클라트린 매개 내피세포증 억제 결과 JAK1, Tyk2, STATs의 인산화 감소와 STAT 핵 변환 감소로 나타났다.[9][15]
음성 피드백 메커니즘
사이토카인 신호 1 억제기(SOCS1)와 유비퀴틴 특이 펩티다아제 18(USP18)과 같은 IFN 신호의 음성 조절기가 4시간 후에 유도된다.[9]SOCS1은 JAK를 억제하고 인산화 Tyk2를 결합함으로써 IFN 신호를 억제한다.[9]USP18은 IFNAR2의 C 종단부에 바인딩된다.[9]USP18은 펩티다아제 기능이 아닌 3차 복합체 형성을 방해하여 IFN 신호를 규제할 수 있다.[7]USP18의 상실은 염증성 중간 매개 CNS 질환을 유발한다.[3]
임상적 시사점
I형 IFN은 다양한 질병에서 유익하거나 유해한 효과를 둘 다 제공할 수 있다.I형 IFN은 다발성 자가면역질환의 동인으로 생각되며 만성 감염에 대한 역할을 할 수 있다.[18]반대로 I형 IFN은 다른 질병 적응증에서도 치료제로 규정된다.[18]
특히 제1형 IFN은 전신 루푸스 에리테마토스(SLE), 스조그렌 증후군, 전신 경화증, 류마티스 관절염(RA), 근염 등의 자가면역질환의 병원생식에 관여한다.[18]척추내 IFNα의 증가된 수준은 또한 Aicardi-Goutiers 증후군, HIV 관련 치매, CNS 루푸스에도 해로운 역할을 한다고 여겨진다.[12]I형 IFN은 효과 항바이러스 반응에 필요한 고전적인 사이토카인 중 하나이지만, I형 IFN 수치가 높을수록 결핵이나 백혈병 같은 세균감염병의 질병 악화와 관련이 있다.[18]I형 IFN은 또한 신경퇴행 발생의 잠재적인 역할에 대해 조사되고 있다; 근위축성 측경화증(ALS)[12]의 어두운 모델에서 IFNAR 표현 장기 생존의 상실.
IFNα는 만성 골수성 백혈병(CML), 다발성 골수종, 털이 많은 세포 백혈병 등 IFN 반응 혈액학적 악성종양 치료에도 사용되어 왔다.[16]중요한 것은 IFN 내성 암의 IFNAR 발현이 낮거나 없는 것으로 나타났다.[16]또한 IFNα는 B형 간염과 C형 간염과 같이 잠재적으로 만성적인 바이러스 감염의 치료를 위한 치료법도 제공되었다.역설적으로 IFNβ는 MS에서 IFNβ에 대한 작용 메커니즘이 명확하게 입증되지는 않았지만, IFNβ는 중심 자가면역질환인 다발성 경화증(MS)에 대한 1차 치료였다.[12][16][19]
참조
- ^ PDB: 1n6u;Chill JH, Quadt SR, Levy R, Schreiber G, Anglister J (July 2003). "The human type I interferon receptor: NMR structure reveals the molecular basis of ligand binding". Structure. 11 (7): 791–802. doi:10.1016/S0969-2126(03)00120-5. PMID 12842042.
- ^ a b c d e f g h i j k l de Weerd NA, Nguyen T (May 2012). "The interferons and their receptors—distribution and regulation". Immunology and Cell Biology. 90 (5): 483–91. doi:10.1038/icb.2012.9. PMC 7165917. PMID 22410872.
- ^ a b McGlasson S, Jury A, Jackson A, Hunt D (September 2015). "Type I interferon dysregulation and neurological disease". Nature Reviews. Neurology. 11 (9): 515–23. doi:10.1038/nrneurol.2015.143. PMID 26303851. S2CID 9640903.
- ^ Nallar SC, Kalvakolanu DV (August 2014). "Interferons, signal transduction pathways, and the central nervous system". Journal of Interferon & Cytokine Research. 34 (8): 559–76. doi:10.1089/jir.2014.0021. PMC 4118707. PMID 25084173.
- ^ a b c d Hertzog PJ, Williams BR (June 2013). "Fine tuning type I interferon responses". Cytokine & Growth Factor Reviews. 24 (3): 217–25. doi:10.1016/j.cytogfr.2013.04.002. PMID 23711406.
- ^ Coccia EM, Battistini A (March 2015). "Early IFN type I response: Learning from microbial evasion strategies". Seminars in Immunology. 27 (2): 85–101. doi:10.1016/j.smim.2015.03.005. PMC 7129383. PMID 25869307.
- ^ a b c d e f g h i j k l m n Piehler J, Thomas C, Garcia KC, Schreiber G (November 2012). "Structural and dynamic determinants of type I interferon receptor assembly and their functional interpretation". Immunological Reviews. 250 (1): 317–34. doi:10.1111/imr.12001. PMC 3986811. PMID 23046138.
- ^ a b c d e f g h i j k l m Uzé G, Schreiber G, Piehler J, Pellegrini S (2007). "The receptor of the type I interferon family". Current Topics in Microbiology and Immunology. 316: 71–95. doi:10.1007/978-3-540-71329-6_5. ISBN 978-3-540-71328-9. PMID 17969444.
{{cite journal}}:Cite 저널은 필요로 한다.journal=(도움말) - ^ a b c d e f g h i j k l m n o p q r Schreiber G, Piehler J (March 2015). "The molecular basis for functional plasticity in type I interferon signaling". Trends in Immunology. 36 (3): 139–49. doi:10.1016/j.it.2015.01.002. PMID 25687684.
- ^ Trinchieri G (September 2010). "Type I interferon: friend or foe?". The Journal of Experimental Medicine. 207 (10): 2053–63. doi:10.1084/jem.20101664. PMC 2947062. PMID 20837696.
- ^ a b c Ng CT, Mendoza JL, Garcia KC, Oldstone MB (January 2016). "Alpha and Beta Type 1 Interferon Signaling: Passage for Diverse Biologic Outcomes". Cell. 164 (3): 349–52. doi:10.1016/j.cell.2015.12.027. PMC 4733246. PMID 26824652.
- ^ a b c d e Owens T, Khorooshi R, Wlodarczyk A, Asgari N (March 2014). "Interferons in the central nervous system: a few instruments play many tunes". Glia. 62 (3): 339–55. doi:10.1002/glia.22608. PMID 24588027. S2CID 5826145.
- ^ Lutfalla G, Roeckel N, Mogensen KE, Mattei MG, Uzé G (October 1990). "Assignment of the human interferon-α receptor gene to chromosome 21q22.1 by in situ hybridization". Journal of Interferon Research. 10 (5): 515–7. doi:10.1089/jir.1990.10.515. PMID 2148760.
- ^ Lutfalla G, Holland SJ, Cinato E, Monneron D, Reboul J, Rogers NC, Smith JM, Stark GR, Gardiner K, Mogensen KE (October 1995). "Mutant U5A cells are complemented by an interferon-αβ receptor subunit generated by alternative processing of a new member of a cytokine receptor gene cluster". The EMBO Journal. 14 (20): 5100–8. doi:10.1002/j.1460-2075.1995.tb00192.x. PMC 394613. PMID 7588638.
- ^ a b c d e f g h Claudinon J, Monier MN, Lamaze C (2007). "Interfering with interferon receptor sorting and trafficking: impact on signaling". Biochimie. 89 (6–7): 735–43. doi:10.1016/j.biochi.2007.03.014. PMID 17493737.
- ^ a b c d Deonarain R, Chan DC, Platanias LC, Fish EN (2002). "Interferon-α / β-receptor interactions: A complex story unfolding". Current Pharmaceutical Design. 8 (24): 2131–7. doi:10.2174/1381612023393288. PMID 12369858.
- ^ a b Hebenstreit D, Horejs-Hoeck J, Duschl A (May 2005). "JAK/STAT-dependent gene regulation by cytokines". Drug News & Perspectives. 18 (4): 243–9. doi:10.1358/dnp.2005.18.4.908658. PMID 16034480.
- ^ a b c d e f g h i Ivashkiv LB, Donlin LT (January 2014). "Regulation of type I interferon responses". Nature Reviews. Immunology. 14 (1): 36–49. doi:10.1038/nri3581. PMC 4084561. PMID 24362405.
- ^ Kieseier BC (June 2011). "The mechanism of action of interferon-β in relapsing multiple sclerosis". CNS Drugs. 25 (6): 491–502. doi:10.2165/11591110-000000000-00000. PMID 21649449. S2CID 25516515.
외부 링크
- 수용체,+Interferon+Alpha-beta 미국 국립 의학 라이브러리 제목(MesH)


