뎅기 바이러스
Dengue virus| 뎅기 바이러스 | |
|---|---|
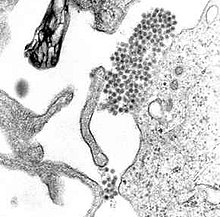 | |
| 뎅기 바이러스 처녀성을 보여주는 TEM 마이크로그래프(중앙 부근의 어두운 점들의 군집) | |
| 바이러스 분류 | |
| (랭킹되지 않음): | 바이러스 |
| 영역: | 리보비리아 |
| 킹덤: | 오르토나비라과 |
| 망울: | 키트리노비리코타 |
| 클래스: | 플라수비리케테스속 |
| 순서: | 아마릴로비루스목 |
| 패밀리: | 플라비비리스과 |
| 속: | 플라비바이러스 |
| 종: | 뎅기 바이러스 |
뎅기열의 원인은 뎅기 바이러스(DENV)이다.이것은 플라비바이러스와속인 플라비바이러스의 모기에 의한 단일 양성변형 RNA 바이러스다.[1][2]4개의 세로타입이 발견되었고, 보고된 5번째 바이러스는 아직 확인되지 않았으며,[3][4][5] 이 모든 것이 전체 범위의 질병을 유발할 수 있다.[1]그럼에도 불구하고, 뎅기 바이러스에 대한 과학자들의 이해는 뚜렷한 항원 집단보다는 연속체가 존재하는 것처럼 보일 수도 있다.[6]이 연구는 47종의 뎅기 바이러스를 확인했다.[7]게다가, 지카 바이러스와 치쿤구냐에 대한 신속한 검사 부족과 코인감염은 실제 감염의 문제를 복잡하게 만든다.[8]
뎅기 바이러스는 지난 20년 동안 급격히 증가해 열대 국가들이 처리해야 할 최악의 모기 매개 인간 병원균 중 하나가 되었다.현재 추정에 따르면 매년 3억 9천만 건에 달하는 감염이 발생하고 있으며, 많은 뎅기감염은 무증상 또는 비임상적 감염으로 점점 더 이해되고 있다.[9]
진화
봉투단백질 분석에 근거해 최소 3개의 유전자형(1~3개)이 알려져 있다.2013년에는 네 번째 세로타입이 보고되었다.[3]2015년[10] 다섯 번째 톱니형 DEN-5의 단일 보고서는 복제되지 않았거나 더 이상 보고되지 않았다.[5]이 바이러스의 뉴클레오티드 대체율은 다른 RNA 바이러스와 유사한 비율로 연간 뉴클레오티드당 6.5×10으로−4 추정되었다.미국 아프리카의 유전자형은 1907년에서 1949년 사이에 진화한 것으로 추정된다.이 시기에는 개체군의 상당한 이동과 환경 교란과 관련이 있었던 제1차 세계 대전과 제2차 세계 대전이 포함되는데, 이는 새로운 벡터 기반 바이러스 종의 진화를 촉진하는 것으로 알려진 요인이다.
4개의 세로타입 모두에 대한 베이시안 분석 결과 가장 최근의 공통 조상은 약 340 AD(95% 신뢰 구간: 280 BC-850 AD)가 존재한다고 추정했다.[11]
라이프사이클
몇백년 전까지만 해도 아프리카, 동남아, 남아시아에서 에이드속 모기들과 비인간 영장류의 모기 사이에 뎅기 바이러스가 실바틱 주기(sylvatic cycle)로 전염되어 인류에 드물게 출현하였다.[12][13]그러나 뎅기 바이러스의 전 세계적인 확산은 실바틱 사이클에서 그 출현을 따랐고 현재 1차 라이프사이클은 인간과 에데스 모기 사이의 전염을 독점적으로 포함하고 있다.[14]모기에서 모기로의 수직적 전달도 일부 벡터종에서 관찰되었다.[15]개들은 바이러스에 감염된 것으로 밝혀졌지만, 개나 다른 동물들이 저수지 역할을 할 수 있는지 아니면 단지 부수적인 숙주인지 더 많은 연구가 필요하다.[16]
최근 연구결과에 따르면 바이러스가 인간 세포를 감염시키면서 감염된 세포 유형에 따라 사멸은 물론 자가포화, ER 스트레스 반응 등 숙주동맥류 과정이 촉발된다.[17]감염 시 자가포장 및 ER 스트레스의 활성화는 바이러스 재생을 강화한다.[18][19] 세포 수준에서 뎅기열의 라이프 사이클의 상세한 요약을 제공하려는 시도는 여러 연구 그룹의 리뷰 기사에 게재되어 있다.[20][21]
게놈
DENV 게놈은 3개의 구조 단백질(캡시드 단백질 C, 막 단백질 M, 봉투 단백질 E)과 7개의 비구조적 단백질(NS1, NS2a, NS2b, NS3, NS4a, NS4b, NS5)을 코딩하는 양성감, 단일 좌초 RNA(ssRNA) 약 11000 베이스다.[4]그것은 또한 5와 3의 양쪽 끝에 있는 짧은 비코딩 영역을 포함한다.[1][22]
구조 및 효소 단백질
E단백질
성숙한 바이러스 입자의 표면에서 조광기로 발견된 DENV E(envelope) 단백질은 이 입자를 숙주 세포에 처음 부착하는 데 중요하다.각 E단백질 모노머는 ED1에서 ED3까지 3개의 엑토도메인과 트랜스메인 세그먼트로 구성된다.ED2는 조광화 인터페이스, 두 개의 글리코실화 부위, 세포막과의 융합 펩타이드 등을 포함한다.ED3는 연속적인 폴리펩타이드 세그먼트로, 접히는 부분이 콤팩트하고 면역글로불린과 유사하다.[23][24]뎅기 바이러스는 모기속 에이드의 종에 의해 전염된다.바이러스성 E 단백질(ICAM3-그래빙 비인분자,[25] CD209,[26][27] Rab 5, GRP 78,[28] 마노오스[29] 수용체)과 상호작용하는 여러 분자가 부착과 바이러스 입력을 매개하는 중요한 요소인 것으로 나타났다.[24]리보솜 단백질 SA의 막 형태도 부착에 관여할 수 있다.[30]E단백질에는 물리화학적으로 보존된 B세포와 T세포 특이상피가 들어 있어 백신을 설계하는데 활용할 수 있는 것으로 알려져 있다.[31]E단백질의 재조합 영역은 뎅기 바이러스에 대한 항체의 혈청학적 검출에 잘 정의된 항원으로, 백신 후보자들의 면역체로 사용된다.[32][33][34]
prM/M단백질
바이러스 입자의 형성과 성숙에 중요한 DENV prM(메브레인) 단백질은 이황화합물 3개로 안정화된 7개의 항타렐 β-스트란드로 구성된다.[24]
성숙한 DENV 처녀성의 당단백질 껍질은 E와 M 단백질의 각각 180매로 구성되어 있다.미성숙한 처녀성은 E와 prM 단백질이 바이러스 입자에 뾰족한 외관을 주는 90개의 이질체를 형성하면서 시작된다.이 미성숙한 바이러스 입자는 소포체 망막 속으로 싹을 틔우고 결국 골기 기구로 가는 비밀 통로를 통해 이동한다.처녀자리(Virion)가 트랜스골지 네트워크를 통과하면서 낮은 pH에 노출된다.이러한 산성 환경은 E단백질에 순응적인 변화를 일으켜 prM단백질과의 연결을 해제하고 바이러스 표면에 반듯이 누운 E 호모디머를 형성하게 하여 숙성한 처녀성을 매끄럽게 보이게 한다.이 성숙 기간 동안 pr 펩타이드 는 호스트 프로테아제인 푸린에 의해 M 펩타이드로부터 분리된다.그리고 나서 M 단백질은 성숙한 처녀성의 E-단백질 껍질 아래에서 투과단백질 역할을 한다.pr 펩타이드는 바이러스 입자가 세포외 환경으로 방출될 때까지 E 단백질과 연관되어 있다.이 pr 펩타이드는 바이러스 입자가 세포 밖으로 나올 때까지 E 단백질의 소수성 핵융합 루프를 덮으면서 캡처럼 작용한다.[24]
NS3단백질
DENV NS3는 세린 프로테아제일 뿐만 아니라 RNA 헬리코아제와 RTPase/NTPase이다.프로테아제 영역은 단백질의 잔류물 1–180에 의해 형성된 2개의 β-바렐로 배열된 6개의 β-가로 구성된다.촉매 트라이어드(His-51, Asp-75 및 Ser-135)는 이 두 개의 β-바렐 사이에서 발견되며, 활성도는 NS2B 공actor의 43 아미노산 세그먼트의 존재에 따라 달라진다.이 공동 요소는 NS3 protease 도메인을 감싸고 활성 사이트의 일부가 된다.공동 인자 영역 전후의 나머지 NS2B 잔류물은 막 결합에 관련된 나선 영역을 포함한다.나머지 NS3 잔류물(180–618)은 DENV 헬리코아제의 세 하위 도메인을 형성한다.4개의 α-헬리크로 둘러싸인 6줄 평행 β-시트(sheet)는 서브돔 I과 II를 구성하고, 서브도메인 III는 3개의 짧은 α-헬리스크와 2개의 반타렐 β-스트란드로 둘러싸인 4개의 α-헬리크로 구성된다.[24]
NS4A단백질
DENV NS4A는 세포막 곡률[35] 변화 및 자가포자기의 유도에 관여하는 비구조적 단백질이다.[19]NS4A는 멤브레인 변경 특성 외에도 바이러스 복제 복합체의 비계로서 과점화를 거친다.[36]NS4B와의 상호작용에 영향을 미치는 NS4A의 돌연변이는 NS4A의 중요성과 뎅기 번식에서 NS4B와의 상호작용을 나타내는 NS4A의 폐지 또는 심각하게 감소된 바이러스 복제에 영향을 미친다.[37]또한 뎅기 5종 중 4종의 NS4A는 모두 자가포장을 유발하고 감염된 세포를 ATM 경로를 통해 독소로부터 보호함으로써 뎅기 바이러스 중 단백질을 보존하는 기능을 시사한다.[38]
NS5단백질
DENV NS5 단백질은 메틸전달효소 도메인을 N-터미널 끝(Resides 1–296)에 갖는 900-레시듀 펩타이드, RNA 의존성 RNA 중합효소(RdRp)의 C-터미널 끝(Resides 320–900)이다.메틸트랜스퍼레이즈 영역은 N-와 C-단자 하위 도메인으로 측면에 있는 α/β/β 샌드위치로 구성된다.DENV RdRp는 손바닥, 손가락, 엄지손가락 하위 도메인과 뉴클레오티드를 통합하기 위한 GDD 모티브를 포함하는 다른 RdRps와 유사하다.[24]
E단백질과 중화항체 사이의 복합체
항체와 바이러스 E 단백질의 엑토도마인(sE) 또는 그 영역 3(ED3) 사이의 복합체의 결정 구조는 바이러스 인식과 중화라는 분자적 기초를 이해하는 데 도움을 주었다.일부 상피들은 성숙한 처녀성의 알려진 구조에서 부분적으로 또는 완전히 접근할 수 없다.따라서 해당 항체는 37°C에서 바이러스의 대체 또는 과도기적 순응에 바인딩되는 것으로 가정한다.[citation needed]
- 뮤린 항체 E111은 DENV1을 중화시킨다.그것의 Fab 조각과 scFv 조각은 DENV1의 ED3 도메인과 함께 복합적으로 결정되었다.그것의 에피토프는 ED3의 β-스트랜즈 C와 C' 그리고 중간 루프 주위에 위치한다.[39]
- 뮤린 항체 1A1D-2는 DENV1, DENV2, DENV3를 강력하게 중화시킨다.그것의 Fab 파편은 DENV2의 ED3 영역과 함께 복합적으로 결정되었다.ED3의 비문은 β-스트레이트 A와 G이다.[40]
- 뮤린 항체 2H12는 4개의 DENV 세로형과 교차 작용한다.DENV2를 제외한 해당 바이러스를 중화시킨다.그것의 Fab 파편은 DENV1, DENV3, DENV4의 ED3 도메인으로 복합적으로 결정되었다.그것의 비문은 ED3의 보존된 AB 루프 주위에 있다.[41]
- 뮤린 항체 4E11은 효능이 다양한 4개의 DENV 세로형을 모두 중화시킨다.그것의 scFv 파편은 4개의 DENV serotype의 ED3 도메인으로 복잡하게 결정되었다.1A1D-2의 상피와 마찬가지로 ED3의 β-스트레이트 A와 G.[42][43]2.0 å 분해능의 구조는 단백질 인터페이스 내에서 물 분자의 역할과 상호작용과 교차 인식에서 이러한 인터페이스 외부의 체체 과대 교류의 역할을 분석할 수 있게 했다.[44]
- 침팬지 항체 5H2는 DENV4를 강력하게 중화시킨다.그것의 Fab 파편은 DENV4의 sE 단백질로 복합적으로 결정되었다.E단백질 1번 영역(ED1)에 비문이 포함되어 있다.[45]
- 인간 항체 Ede1-C10, Ede2-A11, Ede2-B7은 4개의 DENV 세로형을 모두 강력하게 중화시킨다.그들의 Fab 또는 scFv 파편들은 DENV2의 sE 단백질로 복합적으로 결정되었다.이러한 항체의 인식 결정요인은 E 조광기 인터페이스의 세로형-인바리어스 부지에 있으며 E 융접 루프의 노출된 측면 사슬과 보존된 두 개의 글리칸 측면 체인을 포함한다.[46]
병
뎅기열의 일반적인 명칭은 골절열, 구토, 댄디열이다. 뎅기 출혈열과 뎅기충격증후군은 심각한 형태다.[47]덩굴은 전 세계 열대 및 아열대 기후에서 발견되며, 주로 도시 및 반도시 지역에서 발견된다.[48]감염된 모기에 노출된 모든 연령대의 사람들은 뎅기열의 희생자가 될 수 있다.이 병은 동남아시아, 남아시아, 남아메리카의 열대 국가에서 장마철에 가장 자주 발생하며, 감염된 모기 수가 많다.[49]이 바이러스는 감염된 암컷 모기의 물림을 통해 인간에게 전염되지만, 인간은 질병을 전염시킬 수 없고 전염되지 않는다.[48][50][49]잠복기는 3~14일이고, 발병 기간은 3~7일이다.[50][51]징후와 증상은 심한 두통, 복강경통, 근육, 관절, 뼈 통증, 황반 또는 황반경 발진, 그리고 페테치아, 경미한 출혈 징후를 포함할 수 있다.[52]최근 체계적 검토와 메타분석을 통해 알레르기 증상이 뎅기 중증도와 높은 연관성이 있는 핵심 증상 중 하나라는 것을 알 수 있었다.[53]
감염 메커니즘
- 뎅기 바이러스' (DENV) E 봉투 단백질은 세포 수용체에 결합된다.세포 수용기의 정확한 성질은 아직 완전히 해명되지 않았다.
- DENV는 내분포증을 겪는다.엔도솜의 산성화는 E의 순응적 변화를 유도하여, 엔도솜막과의 융합을 촉진하는 융합 펩타이드 시퀀스를 노출시켜 처녀막 캡시드를 세포질 속으로 방출시킨다.
- 세포질에서 탈코팅이 일어난다.
- 호스트 변환 기계(리보솜)가 (+)ssRNA를 단일 폴리펩타이드로 변환
- 세포와 바이러스성 단백질은 ER 막에 박혀 있는 동안 폴리펩타이드(Polyptide)를 10개의 단백질(E, M, C, 7개의 비구조성/진정성 단백질)로 분해한다.
- 기능 RNA 의존 RNA 중합효소가 합성되는 즉시 RNA 복제가 시작될 수 있다.합성은 비대칭으로, 양감 가닥이 음감보다 10배 더 많이 만들어진다.
- 조립은 ER(ER 멤브레인에서 외피를 형성하는)으로 싹이 트는 세포내 막에서 발생한다.이후 ER에서 Golgi를 거쳐 Vesicle로 싹트면 glycosylation 및 pH 변환 재배열과 같은 변환 후 수정을 통해 성숙할 수 있다.
- 탈출은 외피를[54] 통해 일어난다.
중증질환
어떤 사람들은 뎅기 출혈열과 같은 더 심한 형태의 뎅기열을 앓는다.다른 면역 배경을 가진 사람들과 상호작용하는 다른 종류의 바이러스들은 복잡한 상호작용으로 이어진다.가능한 원인으로는 항체 의존성 강화라고 알려진 메커니즘을 통한 교차형 면역반응이 있는데, 이는 이전에 뎅기균에 감염된 사람이 두 번째, 세 번째, 네 번째 감염되었을 때 발생한다.뎅기 바이러스의 오래된 변종에 대한 이전의 항체는 현재 변종에 대한 면역 반응을 방해하고, 역설적으로 더 많은 바이러스 유입과 흡수를 유도한다.[55]
면역계 상호작용
최근 몇 년간, 많은 연구들이 미각 바이러스, 특히 뎅기 바이러스는 감염 기간 동안 선천적인 면역 반응을 억제하는 능력을 가지고 있다는 것을 보여주었다.[56][57]실제로 뎅기 바이러스는 선천적인 면역체계 반응의 다양한 매개체를 억제할 수 있는 비구조적 단백질을 많이 가지고 있다.이 단백질은 두 가지 수준으로 작용한다.
신호 변환기 차단에 의한 인터페론 신호 억제
NS4B는 소포체 망막과 관련하여 위치한 소수성 단백질이다.인터페론 타입 I 알파 & 베타 유도 후 STAT 1의 인산화작용을 차단할 수 있다.실제로 뎅기 바이러스와 관련하여 Tyk2 kinase의 활성도가 감소함에 따라 STAT 1 인산화도 감소한다.[58]더욱이, 앞서 언급한 'NS4B' 단백질에 의해 인터페론 자극 유전자(ISG)의 발현이 제한되면서 바이러스에 대한 선천적인 면역체계의 반응은 더욱 축축해진다.NS2A와 NS4A의 공동 인자 또한 STAT 1 억제에 참여할 수 있다.[59]
NS5 - 이 105-kDa 단백질의 존재는 단독으로 표현되었을 때 STAT2가 (인터페론에 대한 반응의 신호 전도를 통해) 비활성화됨을 초래한다.[60]NS5를 프로테아제(NS2B3)에 의해 NS4B로 분해하면 STAT2가 저하될 수 있다.실제로 프로테아제(Protease)에 의한 NS5의 갈라진 후, STAT2와의 E3 리가제 연관성이 발생하며, E3 리가제는 STAT2의 열화를 목표로 한다.[61][62]
I형 인터페론 반응 억제
NS2B3-b 프로테아제 콤플렉스는 NS2B의 마지막 40개 아미노산과 NS3의 첫 180개 아미노산으로 구성된 프로테롤리틱 코어다.NS2B3 전구체의 갈라짐은 프로테아제 복합체를 활성화시킨다.[63]
이 프로테아제 콤플렉스는 IFN-베타 프로모터의 활동을 줄임으로써 I형 인터페론의 생산을 억제할 수 있게 한다. NS2B3 프로테아제 콤플렉스는 IRF3의 인산화 억제에 관여한다.[64]NS2B3 프로테아제 복합제 IRF3 활성화가 가능한 단백질 MITA 억제(절단 처리)[65]
모기 D7 침 단백질
뎅기 바이러스는 모기의 종인 Aedes aegeti에 의해 전염되는데, 이 종은 단백질 계열 D7을 포함한 100개 이상의 독특한 단백질을 함유한 침을 생산한다.[66] 과학자들은 A. aegeti 침이 전염될 때 실제로 체내의 뎅기 바이러스를 강화시켰다고 믿곤 했다.모기의 침은 숙주의 면역 반응이 약해져 바이러스가 더 빨리 퍼지는 것으로 생각되었다.그러나, 최근의 연구는 D7 단백질이 숙주 세포로 바이러스의 전달을 방해한다는 것을 발견했다.[66]
외국 바이러스를 퇴치하려는 항체의 면역 반응은 실제로 전염을 증가시키고 감염을 악화시킨다.뎅기감염 모기의 침샘에는 감염되지 않은 모기에 비해 단백질 D7의 수치가 더 많다.[66]D7은 모기 침에서 발견되며, 혈액을 공급하는 과정을 돕는 것으로 생각되었다.이전의 가정에도 불구하고, D7은 바이러스 감염을 막기 위해 숙주 세포를 조절하고 바이러스에 대항하여 행동할 수 있다.[66]불행히도 D7 단백질은 면역 반응을 자극해 항D7 항체 수준을 높인다.이러한 항체는 D7 단백질의 기능을 억제하여 뎅기 바이러스의[citation needed] 전달을 강화한다.D7 단백질에 대한 면역 반응은 항바이러스 활동을 손상시킬 수 있지만, DENV가 아닌 피험자는 감염된 피험자보다 약간 더 높은 항D7 IgG 수치를 보인다는 연구 결과가 나왔다.[67]따라서 D7 단백질군에 대한 더 많은 연구가 DENV 감염에 대한 역할과 의약품에 대한 적용 가능성을 설명하기 위해 필요하다.
백신연구
현재 뎅기 백신은 11개국(멕시코, 필리핀, 인도네시아, 브라질, 엘살바도르, 코스타리카, 파라과이, 과테말라, 페루, 태국, 싱가포르)에서 1개만 허가받고 있다.[68][69][70]몇몇 백신은 민간 및 공공 연구자들에 의해 개발되고 있다.[71]그 질병에 대한 백신을 개발하는 것은 어려운 일이다.질병을 유발할 수 있는 네 가지 다른 종류의 바이러스로, 백신은 네 가지 유형의 바이러스에 대해 모두 예방접종을 해야 효과가 있다.[3]한 세로타입에 대한 예방접종은 항체 의존성 강화로 인해 다른 세로타입에 감염되었을 때 심각한 뎅기 출혈성 쇼크를 초래할 수 있다.뎅기 바이러스에 감염되었을 때, 면역 체계는 그 특정한 세로타입에 면역을 제공하는 교차반응 항체를 생성한다.그러나 이러한 항체는 재감염 시 다른 세로형을 중화시킬 수 없으며 실제로 바이러스 복제를 증가시킨다.대식세포가 '중립화된' 바이러스를 소비할 때, 그 바이러스는 대식세포 내에서 복제될 수 있어 질병을 유발한다.이러한 상호반응적이고 비효율적인 항체는 대식세포로의 바이러스 접근을 용이하게 하여 더 심각한 질병(덴구 출혈열, 뎅기충격증후군)을 유도한다.뎅기내과성 부위에서 흔히 직면하는 문제는 산모들이 뎅기열에 감염되었을 때인데, 출산 후 자손들은 산모로부터 면역력을 지니고 다른 세 가지 세 종류의 세로타입 중 하나에 감염되면 출혈열에 걸리기 쉽다.[72]2012년에 한 백신은 3단계 실험에 들어갔고 백신 사용과 효과 감시를 위한 계획이 시작되었다.[73]
2009년 사노피-파스퇴르는 리옹(프랑스) 교외인 뉴빌-서르사우네(fr)에 새로운 시설을 짓기 시작했다.본 제품에서는 3상 시험을 위한 4상형 백신을 생산한다.2014년 9월 사노피-파스퇴르 CEO는 라틴아메리카에서 3단계 임상 효능 연구의 초기 결과를 발표했다.세로타입(ST)당 효능은 ST2 42.3%, ST1 50.3%, ST3 74.0%, ST4 77.7% 등 다양했다.라틴 아메리카-캐리빈 3단계 연구의 데이터에 대한 완전한 분석은 외부 전문가들에 의해 검토된 후에 동료들이 검토한 과학 학술지에 발표될 것이다.주요 결과는 2014년 11월 2일부터 6일까지 뉴올리언스에서 열린 미국열대의학위생학회 연례회의에서 발표되어야 한다.[74]
2012년 9월, 백신 중 하나가 임상 실험에서 좋은 성과를 거두지 못한 것으로 보고되었다.[3]
2015년 말과 2016년 초, 사노피-파스퇴르의 첫 뎅박시아(CYD-TDV) 백신이 여러 나라에 등록되어 풍토 지역에 거주하는 9-45세의 개인에게 사용됐다.
미국 식품의약품안전청은 2019년 5월 1일 실험실에서 뎅기 감염이 확인되고 풍토지역에 거주하는 9~16세의 모든 뎅기 바이러스 세로형으로 인한 뎅기병 예방을 위한 최초의 백신인 뎅기아(Dngvaxia)의 승인을 발표했다.덩굴은 미국령인 아메리칸사모아, 괌, 푸에르토리코, 그리고 미국령 버진아일랜드에 서식한다.[75]
약물 연구
뎅기열에 대한 승인된 직접 항바이러스 치료법은 없다.뎅기감염에 대한 대부분의 항바이러스제 연구는 NS2B/NS3 프로테아제 또는 NS5 단백질의 억제에 초점을 맞추고 있다.보고된 프로테아제 억제제 접근방식은 주로 표적 공밸런트 억제제에 초점을 맞추고 있다.[76][77]용도변경된 C형 간염 NS5 중합효소 억제제인 발라피라비르(Balapiravir)는 임상 2상까지 진행하다가 효능 부족으로 중단됐다.[78][79]
참조
- ^ a b c Rodenhuis-Zybert IA, Wilschut J, Smit JM (August 2010). "Dengue virus life cycle: viral and host factors modulating infectivity". Cellular and Molecular Life Sciences. 67 (16): 2773–86. doi:10.1007/s00018-010-0357-z. PMID 20372965. S2CID 4232236.
- ^ WHO (2009). Dengue Guidelines for Diagnosis, Treatment, Prevention and Control (PDF). World Health Organization. ISBN 978-92-4-154787-1.
- ^ a b c d Normile D (October 2013). "Tropical medicine. Surprising new dengue virus throws a spanner in disease control efforts". Science. 342 (6157): 415. Bibcode:2013Sci...342..415N. doi:10.1126/science.342.6157.415. PMID 24159024.
- ^ a b 드와비디, 브이디, 트리파티, 아이피, 트립파티, R. C., 바르하드와이, S. & 미샤, S. K. (2017)뎅기 바이러스의 유전체학, 단백질학, 진화.기능성 게놈 설명.16(4): 217–227, https://doi.org/10.1093/bfgp/elw040
- ^ a b Taylor-Robinson, Andrew W. (2016-03-03). "A Putative Fifth Serotype of Dengue - Potential Implications for Diagnosis, Therapy and Vaccine Design". International Journal of Clinical & Medical Microbiology. 2016. doi:10.15344/2456-4028/2016/101. ISSN 2456-4028.
- ^ "A new understanding of Dengue virus". ScienceDaily. September 18, 2015. Retrieved May 7, 2016.
- ^ "A Second Time Dengue Infection Can be Life-Threatening Says Research". NDTV. United Kingdom. September 18, 2015. Retrieved 2016-05-07.
- ^ Vogels CB, Rückert C, Cavany SM, Perkins TA, Ebel GD, Grubaugh ND (January 2019). "Arbovirus coinfection and co-transmission: A neglected public health concern?". PLOS Biology. 17 (1): e3000130. doi:10.1371/journal.pbio.3000130. PMC 6358106. PMID 30668574.
- ^ Bhatt S, Gething PW, Brady OJ, Messina JP, Farlow AW, Moyes CL, Drake JM, Brownstein JS, Hoen AG, Sankoh O, Myers MF, George DB, Jaenisch T, Wint GR, Simmons CP, Scott TW, Farrar JJ, Hay SI (April 2013). "The global distribution and burden of dengue". Nature. 496 (7446): 504–7. Bibcode:2013Natur.496..504B. doi:10.1038/nature12060. PMC 3651993. PMID 23563266.
- ^ Mustafa, M. S.; Rasotgi, V.; Jain, S.; Gupta, V. (2015). "Discovery of fifth serotype of dengue virus (DENV-5): A new public health dilemma in dengue control". Medical Journal, Armed Forces India. 71 (1): 67–70. doi:10.1016/j.mjafi.2014.09.011. ISSN 0377-1237. PMC 4297835. PMID 25609867.
- ^ Costa RL, Voloch CM, Schrago CG (2012) 뎅기 바이러스 세로형의 비교 진화 역학감염 유전 진화 12:309-314
- ^ "Dengue virus". Pathogen Information (PathInfo). Virginia Bioinformatics Institute, Virginia Tech. Archived from the original on 2010-08-30.
- ^ Holmes EC, Twiddy SS (May 2003). "The origin, emergence and evolutionary genetics of dengue virus". Infection, Genetics and Evolution. 3 (1): 19–28. doi:10.1016/s1567-1348(03)00004-2. PMID 12797969.
- ^ Halstead SB (January 1988). "Pathogenesis of dengue: challenges to molecular biology". Science. 239 (4839): 476–81. Bibcode:1988Sci...239..476H. doi:10.1126/science.3277268. PMID 3277268.
- ^ Haddow AD, Guzman H, Popov VL, Wood TG, Widen SG, Haddow AD, Tesh RB, Weaver SC (June 2013). "First isolation of Aedes flavivirus in the Western Hemisphere and evidence of vertical transmission in the mosquito Aedes (Stegomyia) albopictus (Diptera: Culicidae)". Virology. 440 (2): 134–9. doi:10.1016/j.virol.2012.12.008. PMID 23582303.
- ^ Thongyuan S, Kittayapong P (30 August 2017). "First evidence of dengue infection in domestic dogs living in different ecological settings in Thailand". PLOS ONE. 12 (8): e0180013. Bibcode:2017PLoSO..1280013T. doi:10.1371/journal.pone.0180013. PMC 5576688. PMID 28854207.
- ^ Ghosh Roy S, Sadigh B, Datan E, Lockshin RA, Zakeri Z (May 2014). "Regulation of cell survival and death during Flavivirus infections". World Journal of Biological Chemistry. 5 (2): 93–105. doi:10.4331/wjbc.v5.i2.93 (inactive 28 February 2022). PMC 4050121. PMID 24921001.
{{cite journal}}: CS1 maint : 2022년 2월 현재 DOI 비활성화(링크) - ^ Datan E, Roy SG, Germain G, Zali N, McLean JE, Golshan G, Harbajan S, Lockshin RA, Zakeri Z (March 2016). "Dengue-induced autophagy, virus replication and protection from cell death require ER stress (PERK) pathway activation". Cell Death & Disease. 7 (e2127): e2127. doi:10.1038/cddis.2015.409. PMC 4823927. PMID 26938301.
- ^ a b McLean JE, Wudzinska A, Datan E, Quaglino D, Zakeri Z (June 2011). "Flavivirus NS4A-induced autophagy protects cells against death and enhances virus replication". The Journal of Biological Chemistry. 286 (25): 22147–59. doi:10.1074/jbc.M110.192500. PMC 3121359. PMID 21511946.
- ^ Zakeri Z, Ghosh-Roy S, Datan E, McLean JE, Zandi K, Germain G (2015). "Cell death and virus infection – a short review". 20 Years of Cell Death. 1 (1): 292–325. doi:10.13140/RG.2.2.35359.97447.
- ^ Neufeldt CJ, Cortese M, Acosta EG, Bartenschlager R (February 2018). "Rewiring cellular networks by members of the Flaviviridae family". Nature Reviews. Microbiology. 16 (3): 125–142. doi:10.1038/nrmicro.2017.170. PMC 7097628. PMID 29430005.
- ^ Hanley KA, Weaver SC, eds. (2010). Frontiers in Dengue Virus Research. Caister Academic. p. 13. ISBN 978-1-904455-50-9. Retrieved 22 September 2020.
- ^ Modis Y, Ogata S, Clements D, Harrison SC (June 2003). "A ligand-binding pocket in the dengue virus envelope glycoprotein". Proceedings of the National Academy of Sciences of the United States of America. 100 (12): 6986–91. Bibcode:2003PNAS..100.6986M. doi:10.1073/pnas.0832193100. PMC 165817. PMID 12759475.
- ^ a b c d e f Perera R, Kuhn RJ (August 2008). "Structural proteomics of dengue virus". Current Opinion in Microbiology. 11 (4): 369–77. doi:10.1016/j.mib.2008.06.004. PMC 2581888. PMID 18644250.
- ^ Tassaneetrithep B, Burgess TH, Granelli-Piperno A, Trumpfheller C, Finke J, Sun W, Eller MA, Pattanapanyasat K, Sarasombath S, Birx DL, Steinman RM, Schlesinger S, Marovich MA (April 2003). "DC-SIGN (CD209) mediates dengue virus infection of human dendritic cells". The Journal of Experimental Medicine. 197 (7): 823–9. doi:10.1084/jem.20021840. PMC 2193896. PMID 12682107.
- ^ Krishnan MN, Sukumaran B, Pal U, Agaisse H, Murray JL, Hodge TW, Fikrig E (May 2007). "Rab 5 is required for the cellular entry of dengue and West Nile viruses". Journal of Virology. 81 (9): 4881–5. doi:10.1128/JVI.02210-06. PMC 1900185. PMID 17301152.
- ^ Jindadamrongwech S, Thepparit C, Smith DR (May 2004). "Identification of GRP 78 (BiP) as a liver cell expressed receptor element for dengue virus serotype 2". Archives of Virology. 149 (5): 915–27. doi:10.1007/s00705-003-0263-x. PMID 15098107. S2CID 12062084.
- ^ Miller JL, de Wet BJ, deWet BJ, Martinez-Pomares L, Radcliffe CM, Dwek RA, Rudd PM, Gordon S (February 2008). "The mannose receptor mediates dengue virus infection of macrophages". PLOS Pathogens. 4 (2): e17. doi:10.1371/journal.ppat.0040017. PMC 2233670. PMID 18266465.
- ^ Zidane N, Ould-Abeih MB, Petit-Topin I, Bedouelle H (December 2012). "The folded and disordered domains of human ribosomal protein SA have both idiosyncratic and shared functions as membrane receptors". Bioscience Reports. 33 (1): 113–24. doi:10.1042/BSR20120103. PMC 4098866. PMID 23137297.
- ^ Hussain, Mazhar; Idrees, Muhammad; Afzal, Samia (2015-07-22). "Development of Global Consensus of Dengue Virus Envelope Glycoprotein for Epitopes Based Vaccine Design". Current Computer-Aided Drug Design. 11 (1): 84–97. doi:10.2174/1573409911666150529130134. ISSN 1573-4099. PMID 26022067.
- ^ Zidane N, Dussart P, Bremand L, Bedouelle H (July 2013). "Cross-reactivities between human IgMs and the four serotypes of dengue virus as probed with artificial homodimers of domain-III from the envelope proteins". BMC Infectious Diseases. 13: 302. doi:10.1186/1471-2334-13-302. PMC 3701519. PMID 23815496.
- ^ Zidane N, Dussart P, Bremand L, Villani ME, Bedouelle H (June 2013). "Thermodynamic stability of domain III from the envelope protein of flaviviruses and its improvement by molecular design". Protein Engineering, Design & Selection. 26 (6): 389–99. doi:10.1093/protein/gzt010. PMID 23479674.
- ^ Brandler S, Ruffie C, Najburg V, Frenkiel MP, Bedouelle H, Desprès P, Tangy F (September 2010). "Pediatric measles vaccine expressing a dengue tetravalent antigen elicits neutralizing antibodies against all four dengue viruses". Vaccine. 28 (41): 6730–9. doi:10.1016/j.vaccine.2010.07.073. PMID 20688034.
- ^ Miller S, Kastner S, Krijnse-Locker J, Bühler S, Bartenschlager R (March 2007). "The non-structural protein 4A of dengue virus is an integral membrane protein inducing membrane alterations in a 2K-regulated manner". The Journal of Biological Chemistry. 282 (12): 8873–82. doi:10.1074/jbc.M609919200. PMID 17276984. S2CID 19927382.
- ^ Lee CM, Xie X, Zou J, Li SH, Lee MY, Dong H, Qin CF, Kang C, Shi PY (June 2015). "Determinants of Dengue Virus NS4A Protein Oligomerization". Journal of Virology. 89 (12): 6171–83. doi:10.1128/JVI.00546-15. PMC 4474302. PMID 25833044.
- ^ Zou J, Xie X, Wang QY, Dong H, Lee MY, Kang C, Yuan Z, Shi PY (April 2015). "Characterization of dengue virus NS4A and NS4B protein interaction". Journal of Virology. 89 (7): 3455–70. doi:10.1128/JVI.03453-14. PMC 4403404. PMID 25568208.
- ^ Zali N, Roy SG, Datan E, McLean J, Alvarez L, Lockshin RA, Zakeri Z (October 2018). "The NS4A Proteins from 4 Dengue Serotypes, Substantially Different in Sequence, Function Similary to Induce Autophagy and Protect Mammalian Cells using ATM Pathways". Journal of Emerging Diseases and Virology. 4 (2): 1–7. doi:10.16966/2473-1846.144.
- ^ Austin SK, Dowd KA, Shrestha B, Nelson CA, Edeling MA, Johnson S, Pierson TC, Diamond MS, Fremont DH (2012). "Structural basis of differential neutralization of DENV-1 genotypes by an antibody that recognizes a cryptic epitope". PLOS Pathogens. 8 (10): e1002930. doi:10.1371/journal.ppat.1002930. PMC 3464233. PMID 23055922.
- ^ Lok SM, Kostyuchenko V, Nybakken GE, Holdaway HA, Battisti AJ, Sukupolvi-Petty S, Sedlak D, Fremont DH, Chipman PR, Roehrig JT, Diamond MS, Kuhn RJ, Rossmann MG (March 2008). "Binding of a neutralizing antibody to dengue virus alters the arrangement of surface glycoproteins". Nature Structural & Molecular Biology. 15 (3): 312–7. doi:10.1038/nsmb.1382. PMID 18264114. S2CID 64886.
- ^ Midgley CM, Flanagan A, Tran HB, Dejnirattisai W, Chawansuntati K, Jumnainsong A, Wongwiwat W, Duangchinda T, Mongkolsapaya J, Grimes JM, Screaton GR (May 2012). "Structural analysis of a dengue cross-reactive antibody complexed with envelope domain III reveals the molecular basis of cross-reactivity". Journal of Immunology. 188 (10): 4971–9. doi:10.4049/jimmunol.1200227. PMC 3364712. PMID 22491255.
- ^ Lisova O, Hardy F, Petit V, Bedouelle H (September 2007). "Mapping to completeness and transplantation of a group-specific, discontinuous, neutralizing epitope in the envelope protein of dengue virus". The Journal of General Virology. 88 (Pt 9): 2387–97. doi:10.1099/vir.0.83028-0. PMID 17698647.
- ^ Cockburn JJ, Navarro Sanchez ME, Fretes N, Urvoas A, Staropoli I, Kikuti CM, Coffey LL, Arenzana Seisdedos F, Bedouelle H, Rey FA (February 2012). "Mechanism of dengue virus broad cross-neutralization by a monoclonal antibody". Structure. 20 (2): 303–14. doi:10.1016/j.str.2012.01.001. PMID 22285214.
- ^ Lisova O, Belkadi L, Bedouelle H (April 2014). "Direct and indirect interactions in the recognition between a cross-neutralizing antibody and the four serotypes of dengue virus". Journal of Molecular Recognition. 27 (4): 205–14. doi:10.1002/jmr.2352. PMID 24591178. S2CID 5416842.
- ^ Cockburn JJ, Navarro Sanchez ME, Goncalvez AP, Zaitseva E, Stura EA, Kikuti CM, Duquerroy S, Dussart P, Chernomordik LV, Lai CJ, Rey FA (February 2012). "Structural insights into the neutralization mechanism of a higher primate antibody against dengue virus". The EMBO Journal. 31 (3): 767–79. doi:10.1038/emboj.2011.439. PMC 3273384. PMID 22139356.
- ^ Rouvinski A, Guardado-Calvo P, Barba-Spaeth G, Duquerroy S, Vaney MC, Kikuti CM, Navarro Sanchez ME, Dejnirattisai W, Wongwiwat W, Haouz A, Girard-Blanc C, Petres S, Shepard WE, Desprès P, Arenzana-Seisdedos F, Dussart P, Mongkolsapaya J, Screaton GR, Rey FA (April 2015). "Recognition determinants of broadly neutralizing human antibodies against dengue viruses" (PDF). Nature. 520 (7545): 109–13. Bibcode:2015Natur.520..109R. doi:10.1038/nature14130. hdl:10044/1/34173. PMID 25581790. S2CID 4394235.
- ^ 위아트렉, 멜리사뎅기열.http://www.austincc.edu/microbio/2993p/df.htm 웨이백 머신에 2018-07-26 보관
- ^ a b 세계보건기구뎅기둥과 심한 뎅기둥.2017년 4월.http://www.who.int/mediacentre/factsheets/fs117/en/
- ^ a b 컬럼비아 보건부 구역입니다뎅기열 팩트시트.https://doh.dc.gov/sites/default/files/dc/sites/doh/publication/attachments/Dengue_Fever.pdf
- ^ a b 더 나은 건강.뎅기 바이러스병.https://www.betterhealth.vic.gov.au/health/conditionsandtreatments/Dengue-virus-disease?viewAsPdf=true
- ^ 질병 통제 및 예방 센터.역학https://www.cdc.gov/dengue/epidemiology/
- ^ 질병 통제 및 예방 센터.뎅기.https://wwwnc.cdc.gov/travel/yellowbook/2016/infectious-diseases-related-to-travel/dengue
- ^ Kien ND, El-Qushayri AE, Ahmed AM, Safi A, Mageed SA, Mehyar SM, et al. (February 2020). "Association of Allergic Symptoms with Dengue Infection and Severity: A Systematic Review and Meta-analysis". Virologica Sinica. 35 (1): 83–92. doi:10.1007/s12250-019-00165-6. PMC 7035405. PMID 31637633.
- ^ Acheson, Nicholas H. (2011). Fundamentals of Molecular Virology, 2nd ed. Wiley.
- ^ Dejnirattisai W, Jumnainsong A, Onsirisakul N, Fitton P, Vasanawathana S, Limpitikul W, Puttikhunt C, Edwards C, Duangchinda T, Supasa S, Chawansuntati K, Malasit P, Mongkolsapaya J, Screaton G (May 2010). "Cross-reacting antibodies enhance dengue virus infection in humans". Science. 328 (5979): 745–8. Bibcode:2010Sci...328..745D. doi:10.1126/science.1185181. PMC 3837288. PMID 20448183.
- ^ Diamond MS (September 2009). "Mechanisms of evasion of the type I interferon antiviral response by flaviviruses". Journal of Interferon & Cytokine Research. 29 (9): 521–30. doi:10.1089/jir.2009.0069. PMID 19694536.
- ^ Jones M, Davidson A, Hibbert L, Gruenwald P, Schlaak J, Ball S, Foster GR, Jacobs M (May 2005). "Dengue virus inhibits alpha interferon signaling by reducing STAT2 expression". Journal of Virology. 79 (9): 5414–20. doi:10.1128/JVI.79.9.5414-5420.2005. PMC 1082737. PMID 15827155.
- ^ Ho LJ, Hung LF, Weng CY, Wu WL, Chou P, Lin YL, Chang DM, Tai TY, Lai JH (June 2005). "Dengue virus type 2 antagonizes IFN-alpha but not IFN-gamma antiviral effect via down-regulating Tyk2-STAT signaling in the human dendritic cell". Journal of Immunology. 174 (12): 8163–72. doi:10.4049/jimmunol.174.12.8163. PMID 15944325. S2CID 83577905.
- ^ Muñoz-Jordan JL, Sánchez-Burgos GG, Laurent-Rolle M, García-Sastre A (November 2003). "Inhibition of interferon signaling by dengue virus". Proceedings of the National Academy of Sciences of the United States of America. 100 (24): 14333–8. Bibcode:2003PNAS..10014333M. doi:10.1073/pnas.2335168100. PMC 283592. PMID 14612562.
- ^ Ashour J, Laurent-Rolle M, Shi PY, García-Sastre A (June 2009). "NS5 of dengue virus mediates STAT2 binding and degradation". Journal of Virology. 83 (11): 5408–18. doi:10.1128/JVI.02188-08. PMC 2681973. PMID 19279106.
- ^ Mazzon M, Jones M, Davidson A, Chain B, Jacobs M (October 2009). "Dengue virus NS5 inhibits interferon-alpha signaling by blocking signal transducer and activator of transcription 2 phosphorylation". The Journal of Infectious Diseases. 200 (8): 1261–70. doi:10.1086/605847. PMID 19754307.
- ^ Morrison J, Aguirre S, Fernandez-Sesma A (March 2012). "Innate immunity evasion by Dengue virus". Viruses. 4 (3): 397–413. doi:10.3390/v4030397. PMC 3347034. PMID 22590678.
- ^ Yusof R, Clum S, Wetzel M, Murthy HM, Padmanabhan R (April 2000). "Purified NS2B/NS3 serine protease of dengue virus type 2 exhibits cofactor NS2B dependence for cleavage of substrates with dibasic amino acids in vitro". The Journal of Biological Chemistry. 275 (14): 9963–9. doi:10.1074/jbc.275.14.9963. PMID 10744671. S2CID 30345627.
- ^ Rodriguez-Madoz JR, Belicha-Villanueva A, Bernal-Rubio D, Ashour J, Ayllon J, Fernandez-Sesma A (October 2010). "Inhibition of the type I interferon response in human dendritic cells by dengue virus infection requires a catalytically active NS2B3 complex". Journal of Virology. 84 (19): 9760–74. doi:10.1128/JVI.01051-10. PMC 2937777. PMID 20660196.
- ^ Yu CY, Chang TH, Liang JJ, Chiang RL, Lee YL, Liao CL, Lin YL (June 2012). Diamond MS (ed.). "Dengue virus targets the adaptor protein MITA to subvert host innate immunity". PLOS Pathogens. 8 (6): e1002780. doi:10.1371/journal.ppat.1002780. PMC 3386177. PMID 22761576.
- ^ a b c d Conway MJ, Londono-Renteria B, Troupin A, Watson AM, Klimstra WB, Fikrig E, Colpitts TM (September 2016). "Aedes aegypti D7 Saliva Protein Inhibits Dengue Virus Infection". PLOS Neglected Tropical Diseases. 10 (9): e0004941. doi:10.1371/journal.pntd.0004941. PMC 5025043. PMID 27632170.
- ^ Londono-Renteria BL, Shakeri H, Rozo-Lopez P, Conway MJ, Duggan N, Jaberi-Douraki M, Colpitts TM (2018). "Aedes aegypti D7 Salivary Proteins in Colombia". Frontiers in Public Health. 6: 111. doi:10.3389/fpubh.2018.00111. PMC 5968123. PMID 29868532.
- ^ "Sanofi's dengue vaccine approved in 11 countries". Reuters. 2016. Retrieved 13 August 2017.
- ^ East, Susie (6 April 2016). "World's first dengue fever vaccine launched in the Philippines". CNN. Retrieved 17 October 2016.
- ^ "Dengue Fever Vaccine Available in Indonesia". October 17, 2016.
- ^ 2012년 11월, 뎅기백신 이니셔티브 웨이백머신에 보관된 백신 개발, 2013년 11월 5일에 액세스
- ^ Schmaljohn AL, McClain D (1996). "Ch. 54: Alphaviruses (Togaviridae) and Flaviviruses (Flaviviridae)". In Baron S (ed.). Medical Microbiology (4th ed.). University of Texas Medical Branch at Galveston. ISBN 978-0-9631172-1-2. NBK7633.
- ^ Torresi J, Tapia-Conyer R, Margolis H (2013). "Preparing for dengue vaccine introduction: recommendations from the 1st dengue v2V International Meeting". PLOS Neglected Tropical Diseases. 7 (9): e2261. doi:10.1371/journal.pntd.0002261. PMC 3784468. PMID 24086776.
- ^ "Sanofi Pasteur Dengue Vaccine Aces Second Phase III Trial". GEN News Highlights. Genetic Engineering & Biotechnology News. 3 September 2014.
- ^ 고질적인 지역에서 뎅기 질환 예방을 위한 FDA 승인 첫 백신 https://www.fda.gov/news-events/press-announcements/first-fda-approved-vaccine-prevention-dengue-disease-endemic-regions
- ^ Leung, D.; Schroder, K.; White, H.; Fang, N. X.; Stoermer, M. J.; Abbenante, G.; Martin, J. L.; Young, P. R.; Fairlie, D. P. (2001-12-07). "Activity of recombinant dengue 2 virus NS3 protease in the presence of a truncated NS2B co-factor, small peptide substrates, and inhibitors". The Journal of Biological Chemistry. 276 (49): 45762–45771. doi:10.1074/jbc.M107360200. ISSN 0021-9258. PMID 11581268. S2CID 26124089.
- ^ Dražić, Tonko; Kopf, Sara; Corridan, James; Leuthold, Mila M.; Bertoša, Branimir; Klein, Christian D. (2020-01-09). "Peptide-β-lactam Inhibitors of Dengue and West Nile Virus NS2B-NS3 Protease Display Two Distinct Binding Modes". Journal of Medicinal Chemistry. 63 (1): 140–156. doi:10.1021/acs.jmedchem.9b00759. ISSN 0022-2623. PMID 31804823. S2CID 208768169.
- ^ Nguyen NM, Tran CN, Phung LK, Duong KT, Huynh HA, Farrar J, et al. (May 2013). "A randomized, double-blind placebo controlled trial of balapiravir, a polymerase inhibitor, in adult dengue patients". The Journal of Infectious Diseases. 207 (9): 1442–50. doi:10.1093/infdis/jis470. PMC 3610419. PMID 22807519.
- ^ Chen YL, Abdul Ghafar N, Karuna R, Fu Y, Lim SP, Schul W, et al. (February 2014). "Activation of peripheral blood mononuclear cells by dengue virus infection depotentiates balapiravir". Journal of Virology. 88 (3): 1740–7. doi:10.1128/JVI.02841-13. PMC 3911617. PMID 24257621.
외부 링크
| 스콜리아는 뎅기 바이러스의 주제 프로파일을 가지고 있다. |
- 전자파 데이터 뱅크(EMDB)의 뎅기 바이러스의 3D 전자 현미경 구조
- "Brazil releases 'good' mosquitoes to fight dengue fever". BBC News Latin America & Caribbean. 24 September 2014.



