아르보바이러스
Arbovirus이 문서는 갱신할 필요가 있습니다.(2015년 9월) |
| 아르보바이러스 감염 | |
|---|---|
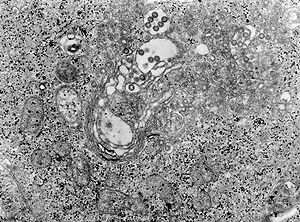 | |
| 리프트 밸리 바이러스에 감염된 조직 | |
| 전문 | 전염병 |
아르보바이러스는 절지동물 벡터에 의해 전염되는 모든 바이러스의 비공식 이름이다.아르보바이러스라는 용어는 포르만테오어(절지동물 매개 바이러스)[1]입니다.티보바이러스는 때때로 [2]절지동물 내의 상목인 진드기에 의해 전염되는 바이러스를 더 구체적으로 묘사하기 위해 사용된다.아르보바이러스는 동물과 [3]식물 모두에 영향을 미칠 수 있습니다.사람에게서, 아르보 바이러스 감염의 증상은 보통 바이러스에 노출된 후 3일에서 15일 사이에 발생하며, 3~4일 동안 지속된다.감염의 가장 일반적인 임상적 특징은 발열, 두통, 질병이지만 뇌염과 바이러스성 출혈열도 발생할 [4]수 있다.
징후 및 증상
잠복기(감염이 발생하고 증상이 나타나는 시간)는 바이러스에 따라 다르지만, 보통 아르보바이러스의 [5]경우 2일에서 15일 사이에 제한된다.그러나 대부분의 감염은 증상이 [6]없다.증상이 나타나는 경우 중 증상은 비특이적인 경향이 있어 독감 유사 질병과 유사하며 특정 원인 물질을 나타내지 않는다.이러한 증상에는 발열, 두통, 불쾌감, 발진, 피로가 포함된다.드물게 구토와 출혈열이 발생할 수 있다.간혹 뇌염과 뇌수막염이 [7]관찰되기 때문에 중추신경계도 감염의 영향을 받을 수 있다.예후는 대부분의 사람들에게 좋으나, 심각한 증상을 보이는 사람들에게는 좋지 않으며, 바이러스에 따라 이 집단에서 사망률이 최대 20%에 이른다.매우 어린 나이든 임산부, 그리고 면역 결핍이 있는 사람들은 심각한 [citation needed]증상이 나타날 가능성이 더 높다.
| 아르보바이러스 | 질병 | 잠복기 | 증상 | 증상의 지속 시간 | 합병증 | 환자 치사율 | 벡터 | 프라이머리 호스트 | 지리적 분포 | 감염이 평생 면역을 제공하나요? |
|---|---|---|---|---|---|---|---|---|---|---|
| 뎅기열바이러스 | 뎅기열 | 3~14일 | 대부분의 경우 증상이 없음; 발열, 두통, 발진, 근육통, 관절통 | 7~10일 | 충격, 내부 출혈 및 장기 손상 | 치료 시 1% 미만, 치료 시 1~5% 미만, 중증의 경우 약 25% | 이집트 모기, 특히 이집트 모기 | 인간 | 지구적으로 적도 부근 | 다양[note 1]. |
| 일본뇌염바이러스 | 일본뇌염 | 5~15일 | 대부분의 경우 증상이 없음: 발열, 두통, 피로, 메스꺼움, 구토 | 뇌염, 발작, 마비, 혼수, 장기 뇌손상 | 뇌염의 경우 20~30% | 꽃모기, 특히 꽃모기 | 가축 돼지 및 섭금류 | 동남아시아 및 동아시아 | 네. | |
| 리프트밸리열바이러스 | 리프트밸리 열풍 | 2 ~ 6 일 | 발열, 두통, 근육통, 간 이상 | 4 ~ 7 일 | 출혈열, 뇌수막염 | 사람의 1%; 임신한 가축의 경우 태아의 치사율이 100%이다. | 쿠렉스트리테니오린쿠스와 에데스벡산스 | 미크로테로푸스 고질균과 히포시데로스아베 | 동부, 남부 및 서부 아프리카 | 네. |
| 진드기 매개성 뇌염 바이러스 | 진드기 매개성 뇌염 | 7~14일 | 발열, 두통, 근육통, 메스꺼움, 구토, 뇌수막염 | 마비와 장기 뇌손상 | 1–2% | 견갑상어, 견갑상어, 견갑상어 및 견갑상어 | 작은 설치류 | 동유럽 및 러시아 남부 | 네. | |
| 서나일바이러스 | 웨스트 나일 열, 뇌염 | 2 ~ 15 일 | 대부분의 경우 증상이 없음: 발열, 두통, 피로, 메스꺼움, 구토, 발진 | 3~6일 | 림프절 부종, 수막염, 뇌염, 급성 박리 마비 | 중증일 경우 3~15% | 꽃모기 | 참새목 | 북미, 유럽, 서·중앙 아시아, 오세아니아, 아프리카 | 네. |
| 황열 바이러스 | 황열병 | 3~6일 | 발열, 두통, 요통, 식욕부진, 메스꺼움, 구토 | 3~4일 | 황달, 간 손상, 위장 출혈, 반복 발열 | 일반적으로 3%, 심각한 합병증이 있는 경우 20% | 이집트 모기, 특히 이집트 모기 | 영장류 | 남아메리카와 아프리카의 열대 및 아열대 지역 | 네. |
- ^ 감염은 질병을 일으키는 특정 혈청형에는 평생 면역력을 제공하지만 다른 혈청형에는 일시적으로 면역력을 제공한다.
원인
전송
아르보바이러스는 바이러스를 옮기는 숙주와 바이러스를 다른 [9]유기체로 옮기고 옮기는 벡터(벡터) 사이의 순환을 통해 자연 그대로를 유지한다.아르보 바이러스의 경우, 벡터는 일반적으로 영양가나 발육을 목적으로 [11]척추동물의 피를 소비하는 모기, 진드기, 모래파리[10] 및 다른 절지동물이다.혈액을 섭취한 척추동물은 숙주 역할을 하며, 각 벡터는 일반적으로 특정 종의 혈액에 대한 친화력을 가지며,[12] 이러한 종들은 숙주로 만든다.
벡터와 숙주 사이의 전염은 벡터가 척추동물의 혈액을 섭취할 때 발생하며, 여기서 벡터의 침샘에 감염을 확립한 바이러스가 숙주의 [13][14]혈액과 접촉한다.바이러스가 숙주 안에 있는 동안,[15] 그것은 증폭이라고 불리는 과정을 거친다. 여기서 바이러스는 혈액 속에 많은 수의 바이러스가 존재하는 바이러스인 바이러스 혈증을 유발하기에 충분한 수준으로 복제된다.숙주의 혈액에 있는 풍부한 바이러스는 숙주가 혈액을 소비할 경우 바이러스를 다른 유기체에 전염시킬 수 있게 해준다.감염되지 않은 벡터가 먹이로 감염되면, 그들은 바이러스를 감염되지 않은 숙주로 전염시킬 수 있고, 바이러스 집단의 증폭을 재개한다.척추동물에서 바이러스 감염이 되지 않으면 바이러스가 다시 [16]벡터로 전염되지 않기 때문에 종말 숙주라고 부를 수 있다.
이 벡터-호스트 관계의 예는 웨스트 나일 바이러스의 전염에서 관찰될 수 있습니다.Culex속 암컷 모기는 참새의 피를 먹는 것을 선호하며,[17] 참새들을 바이러스의 숙주로 만듭니다.이 새들이 감염되면, 바이러스는 증폭되어 피를 [15]먹고 사는 여러 모기들을 잠재적으로 감염시킨다.이 감염된 모기들은 더 많은 새들에게 바이러스를 전염시킬 수도 있다.만약 모기가 선호하는 먹이를 찾을 수 없다면, 모기는 다른 먹이를 선택할 것이다.인간의 혈액은 가끔 소비되지만, 웨스트 나일 바이러스는 포유류에서 그렇게 잘 복제되지 않기 때문에, 인간은 막다른 [16][18]숙주로 여겨진다.
인간에게는
아르보바이러스의 사람 대 사람 전염은 흔하지는 않지만 발생할 수 있다.만약 바이러스가 기증자의 혈액이나 장기에 [19][20][21]존재한다면 수혈, 장기 이식, 그리고 혈액제제의 사용은 아르보바이러스를 전염시킬 수 있다.이 때문에 혈액과 장기는 [21][22]투여하기 전에 바이러스 검사를 받는 경우가 많다.드물게[23], 수직 전염, 즉 모자 간 전염이 감염된 임산부와 모유 수유 [24]여성들에게서 관찰되었다.감염된 사람이나 [25]동물에 의해 사용된 경우 사용된 바늘에 노출되면 아르보바이러스가 전염될 수 있습니다.이로 인해 정맥 내 약물 사용자 및 의료 종사자들은 아르보바이러스가 사람에게 [21][23]퍼질 수 있는 지역에서 감염될 위험에 처하게 됩니다.
바이러스학
이 섹션에서는 제임스타운 캐니언 바이러스, 라크로스 바이러스, 포와산 바이러스, 동부 말 뇌염 바이러스, 세인트루이스 뇌염, 서부 말 뇌염 바이러스 등에 대한 정보가 누락되어 있습니다.(2015년 9월) |
아르보바이러스는 다양한 바이러스 속에 속하며 따라서 다른 바이러스학적 특성을 보이는 다계통군이다.
| 아르보바이러스 | 게놈형 | 게놈 길이 | 직경 | 캡시드 모양 | 봉투를 쓴다고요? | 바이러스 엔트리 | 레플리케이션 사이트 | 바이러스 배출 | 감염된 셀 | 유전적 변이성 |
|---|---|---|---|---|---|---|---|---|---|---|
| 아프리카돼지열바이러스 | dsDNA | 170 ~ 100 킬로베이스 | 최대 200 nm | 이십면체 | 네. | 엔도사이토시스 | 핵 | 싹트다 | 내피세포 및 적혈구 및 백혈구 | 22 유전자형 |
| 치쿤구냐바이러스(CHIKV) | +ssRNA | 11.6킬로베이스 | 60~70 nm | 이십면체 | 네. | 막융합 | 세포질 | 싹트다 | 상피세포, 내피세포, 1차섬유아세포 및 대식세포 | 3가지 유전자형 |
| 뎅기열바이러스 | +ssRNA | 최대 11,000개의 핵염기 | 최대 50 nm | 이십면체 | 네. | 막융합 | 세포질 | 싹트다 | 랑게르한과 백혈구 | 4가지 혈청형 |
| 일본뇌염바이러스 | +ssRNA | 최대 11,000개의 핵염기 | 최대 50 nm | 이십면체 | 네. | 막융합 | 세포질 | 싹트다 | 다섯 가지 유전자형 | |
| 리프트밸리열바이러스 | - ssRNA | 구면 | 네. | 세포질 | 싹트다 | 없음[note 1] | ||||
| 진드기 매개성 뇌염 바이러스 | +ssRNA | 최대 11,000개의 핵염기 | 40~50 nm | 이십면체 | 네. | 막융합 | 세포질 | 싹트다 | 신경 세포 | 다섯 가지 유전자형 |
| 서나일바이러스 | +ssRNA | 최대 11,000개의 핵염기 (11~12킬로 베이스) | 45~50 nm | 이십면체 | 네. | 막융합 | 세포질 | 싹트다 | ||
| 황열 바이러스 | +ssRNA | 최대 11,000개의 핵염기 | 40~60 nm | 이십면체 | 네. | 막융합 | 세포질 | 싹트다 | 간세포 및 백혈구 | |
| 지카바이러스 | +ssRNA | 10794 핵염기 | 40 nm | 이십면체 | 네. | 막융합 | 세포질 | 싹트다 |
- ^ 최근의 공통 조상을 가진 종으로 인해 유의미한 유전적 개체군은 존재하지 않는다.
진단.
아르보 바이러스 감염의 예비 진단은 대개 감염이 [26]발생한 곳의 증상, 여행 장소 및 날짜, 활동 및 역학 이력에 대한 임상적 표시를 기반으로 합니다.최종 진단은 일반적으로 혈액검사, 특히 면역학적, 혈청학적 및/또는 바이러스학적 기술(ELISA,[26][27] 보체고정,[27] 중합효소 연쇄반응,[27][28] 중화시험 [29]및 혈응집억제시험 [30]등)의 조합을 사용하여 실험실에서 이루어진다.
분류
과거에 아르보바이러스는 A, B, C, D의 네 가지 그룹 중 하나로 조직되었다.그룹 A는 알파바이러스속,[31][32] 그룹 B는 [33]플라비바이러스속,[34] 그룹 C는 오르토부니아바이러스속 C 혈청그룹으로 분류된다.D그룹은 1950년대 중반 과마그룹으로 이름이 바뀌어 현재는 오르토부니아바이러스속에 속하는 과마 [35]혈청그룹이다.현재 바이러스는 볼티모어 분류와 표준 생물학적 분류에 따른 바이러스 특이 시스템에 따라 공동 분류된다.Asfarviridae 계열의 바이러스를 제외하고 임상적으로 중요한 모든 아르보바이러스는 다음 4개 그룹 [citation needed]중 하나에 속합니다.
- Bunyavirales 주문(볼티모어 클래스 V)
- 플라비바이러스과 (볼티모어 클래스 IV)
- 플라비바이러스속
- 모기가 매개하는 바이러스
- 뎅기바이러스군
- 일본뇌염바이러스군
- 스폰드웨니바이러스군
- 황열 바이러스군
- 황열 바이러스
- 진드기 매개 바이러스
- 포유동물 진드기 매개 바이러스군
- 캬사누르 산림병 바이러스
- 진드기 매개성 뇌염 바이러스
- 포유동물 진드기 매개 바이러스군
- 모기가 매개하는 바이러스
- 플라비바이러스속
- 레오바이러스과 (볼티모어 클래스 III)
- 토가바이러스과 (볼티모어 클래스 IV)
- 알파바이러스속
- 치쿤구냐 바이러스'
- 동부 말 뇌염 바이러스
- 로스리버바이러스
- 베네수엘라 말 뇌염 바이러스
- 서부 말 뇌염 바이러스'
- 알파바이러스속
예방
벡터 제어 수단, 특히 모기 제어는 아르보바이러스에 의한 질병 전염을 줄이는데 필수적이다.서식지 관리는 늪을 배수하고 종종 모기의 번식지로 사용되는 다른 고인 물 웅덩이(예: 오래된 타이어, 대형 야외 화분, 빈 깡통 등)를 제거하는 것을 포함한다.살충제는 시골과 도시 지역, 주택과 다른 건물 내부, 또는 야외 환경에 적용할 수 있다.그들은 종종 절지동물 개체수 조절에 매우 효과적이지만, 이러한 화학물질 중 일부는 논란이 되고 있으며, 일부 유기인산염과 유기염화물(DDT 등)은 많은 국가에서 금지되어 있다.일부 지역에서는 관련 모기 종의 번식률을 낮추기 위해 불임 수컷 모기가 도입되고 있다.라르비시드는 전 세계적으로 모기 퇴치 프로그램에도 사용된다.테메포스는 일반적인 모기 [36]살충제이다.
사람들은 또한 모기장 아래서 잠을 자고, 보호복을 입고, 옷과 노출된 피부에 페르메트린과 DEET와 같은 방충제를 바르고, 가능한 한 절지동물이 많이 서식하는 것으로 알려진 지역을 피함으로써 절지동물에 물릴 위험을 줄일 수 있다.아르보바이러스 뇌염은 크게 두 가지 방법으로 예방할 수 있다: 개인 보호 조치와 감염된 모기 개체 수를 줄이기 위한 공중 보건 조치.개인적인 조치로는 특히 초저녁 시간에 야외에서 시간을 줄이고, 긴 바지와 긴 소매 셔츠를 입고, 노출된 피부 부위에 모기약을 바르는 것이 포함된다.공중 보건 대책은 종종 어린(애벌레)과 성충 [37]모기를 죽이기 위한 살충제 살포를 요구한다.
예방 접종
백신은 다음과 같은 아르보바이러스 질환에 사용할 수 있습니다.
백신은 다음과 같은 아보바이러스성 질환에 대해 개발 중입니다.
치료
아르보바이러스 뇌염은 바이러스성 질환이기 때문에 항생제는 효과적인 치료법이 아니며 효과적인 항바이러스제는 아직 발견되지 않았다.치료는 뇌의 붓기, 뇌의 자동 호흡 활동의 상실, 그리고 세균성 [1]폐렴과 같은 다른 치료 가능한 합병증과 같은 문제들을 다루려고 시도하면서 도움이 됩니다.
아스피린과 이부프로펜은 뎅기열의 경우 출혈의 위험을 증가시키고 뎅기 쇼크 [47]증후군을 일으킬 수 있기 때문에 복용해서는 안 된다.
역학
대부분의 아르보바이러스는 열대 지역에 있지만, 집단으로 전 세계에 분포하고 있습니다.열대 지역에서 발견되는 따뜻한 기후 조건은 절지동물 벡터에 의한 연중 전염을 가능하게 한다.절지동물 벡터의 지리적 분포를 결정하는 다른 중요한 요소에는 강우, 습도, [48]초목이 포함된다.
지리정보시스템(GIS)과 GPS와 같은 지도 방법은 아르보바이러스의 공간적, 시간적 분석을 가능하게 했다.지리적으로 케이스나 번식지에 태그를 붙이면 벡터 [49]전달을 더 자세히 조사할 수 있습니다.
특정 아르보바이러스의 역학을 확인하기 위해 다음 자료에는 아르보바이러스와 아르보바이러스 유행에 대한 지도, 팩트시트 및 보고서가 수록되어 있습니다.
| 자원 | 묘사 | 링크 |
|---|---|---|
| 세계보건기구 | WHO는 특정 바이러스의 분포, 위험 요소 및 예방에 대한 연구와 지도를 수집합니다. WHO는 또한 Dengue Net을 호스트하고 있습니다.Dengue Net은 Dengue 사례에 대해 문의할 수 있는 데이터베이스입니다. | http://www.who.int/en/ |
| CDC ArboNet 다이내믹 맵 | 이 대화형 맵은 CDC ArboNET 데이터를 사용하여 USGS에 의해 작성됩니다.그것은 인간의 사례와 미국의 벡터의 분포 지도를 제공한다. | https://web.archive.org/web/20161215234534/http://diseasemaps.usgs.gov/mapviewer/ |
| 질병관리센터 ArboCatalog | ArboCatalog는 질병통제센터가 기록한 아르보바이러스를 기록하고 바이러스에 대한 자세한 정보를 제공한다. | https://wwwn.cdc.gov/Arbocat/Default.aspx |
역사
| 연도 | 이벤트 |
|---|---|
| 1800년대 | 뎅기열은 전 세계적으로 유행한다 |
| 1898–1914 | 아르보바이러스 감염을 막기 위한 최초의 대규모 노력 플로리다, 아바나, 파나마 운하 지대에서 열린다. |
| 1901 | 첫 번째 아르보바이러스는 황열 바이러스입니다. |
| 1906 | 뎅기열 전염이 발견되다 |
| 1936 | 진드기 매개 뇌염 바이러스 발견 |
| 1937 | 황열병 백신이 발명되었다. |
| 1937 | 웨스트 나일 바이러스가 발견되다 |
| 1950년대 | 일본 뇌염 백신이 발명되었다 |
| 1980년대 | 살충제 처리 모기장 개발 |
| 1999 | 서나일 바이러스는 서반구에 도달한다. |
| 1900년대 후반 | 뎅기열은 전 세계적으로 퍼진다 |
아르보바이러스는 세균 이론과 바이러스가 다른 미생물과 구별된다는 이해와 함께 현대 의학이 등장할 때까지 존재한다고 알려져 있지 않았다.절지동물과 질병의 연관성은 1881년 쿠바의 의사이자 과학자인 카를로스 핀레이가 황열병은 사람의 [50]접촉 대신 모기에 의해 전염될 수 있다고 제안할 때까지 가정되지 않았다.[51] 이는 1901년 월터 리드 소령에 의해 입증되었다.1차 벡터인 Aedes aegypti는 세계화와 노예 [52]무역의 결과로 15세기에서 19세기에 걸쳐 전 세계로 퍼져나갔다.이 지리적 확산은 18세기와 19세기에 [53]걸쳐 뎅기열 유행병을 일으켰고, 이후 1906년 에이데스 모기에 의한 전염이 확인되면서 황열과 뎅기열이 바이러스에 [54]의한 첫 번째 두 질병이 되었다.
Thomas Milton Rivers는 [55][56]1927년에 박테리아와 구별되는 바이러스에 대한 최초의 명확한 설명을 발표했다.웨스트 나일 바이러스는 [57]1937년에 발견되었고, 그 이후로 아프리카, 중동, 그리고 유럽 전역에 전염병을 일으키는 Culex 개체군에서[58] 발견되었다.이 바이러스는 1999년에 서반구에 도입되어 일련의 [59]전염병을 일으켰다.20세기 후반 동안, Dengue을 세계적인 질환으로, 바이러스는 지리적으로 도시화, 인구 성장, 증가하는 국제 여행, 세계 warming,[60]때문에, 일년에 최소 5000만 감염을 계속해서 확산을,이 뎅기열 가장고 임상적으로 중요한 공통의 a를 만들고 reemergedrecibo영수증.바이러스성 [61][62]질환
황열병은 말라리아와 함께 파나마 운하 건설에 큰 걸림돌이었다.1880년대 프랑스의 이 프로젝트는 이러한 질병들 때문에 실패했고,[63] 1889년에 이 프로젝트를 포기해야만 했다.1900년대 초반 운하를 건설하기 위한 미국의 노력 동안, 윌리엄 C. 아바나의 최고 위생 책임자인 고가스는 노동자들의 건강을 감독하는 임무를 맡았다.그는 과거 플로리다와 아바나에서 물웅덩이의 물을 빼내고, 풀을 베고, 유충을 죽이기 위해 연못과 늪 가장자리에 기름을 바르고,[64] 낮 동안 실내에 남아있던 성충 모기를 잡아 모기의 개체 수를 줄임으로써 이 병을 근절하는데 성공했다.운하 구역의 수석 위생 검사관인 Joseph Augustin LePrince는 카볼산, 수지, 그리고 가성 소다를 혼합한 최초의 시판 살충제를 발명하여 운하 [65]구역 전체에 사용되었습니다.이러한 위생 조치의 시행은 10년의 건설 기간 동안 말라리아를 억제할 뿐만 아니라 사망하는 노동자의 수를 극적으로 감소시키고 궁극적으로 운하 지대의 황열병을 근절시켰다.이러한 질병 예방 방법의 성공으로 인해,[63][66] 그것들은 세계의 다른 지역에서 채택되고 개선되었다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b "CDC Information on Arboviral Encephalitides". Archived from the original on January 27, 2007. Retrieved 2007-02-07.
- ^ Hubálek, Z.; Rudolf, I. (2012). "Tick-borne viruses in Europe". Parasitology Research. 111 (1): 9–36. doi:10.1007/s00436-012-2910-1. PMID 22526290. S2CID 18713459.
- ^ "Plant arboviruses: major threats to food security". Microbiology Society. Microbiology Society. Retrieved 20 May 2022.
- ^ Stephen J. Schueler; John H. Beckett; D. Scott Gettings (2 April 2008). "Arbovirus Infection Symptoms". freeMD. Archived from the original on 8 September 2008. Retrieved 22 June 2013.
- ^ Mostashari, F.; Bunning, M. L.; Kitsutani, P. T.; Singer, D. A.; Nash, D.; Cooper, M. J.; Katz, N.; Liljebjelke, K. A.; Biggerstaff, B. J.; Fine, A. D.; Layton, M. C.; Mullin, S. M.; Johnson, A. J.; Martin, D. A.; Hayes, E. B.; Campbell, G. L. (2001). "Epidemic West Nile encephalitis, New York, 1999: Results of a household-based seroepidemiological survey". The Lancet. 358 (9278): 261–264. doi:10.1016/S0140-6736(01)05480-0. PMID 11498211. S2CID 13074756.
- ^ Reiter, P. (2010). "Yellow Fever and Dengue: A threat to Europe?". Eurosurveillance. 15 (10): 19509. doi:10.2807/ese.15.10.19509-en. PMID 20403310.
- ^ Davis, L. E.; Debiasi, R.; Goade, D. E.; Haaland, K. Y.; Harrington, J. A.; Harnar, J. B.; Pergam, S. A.; King, M. K.; Demasters, B. K.; Tyler, K. L. (2006). "West Nile virus neuroinvasive disease". Annals of Neurology. 60 (3): 286–300. doi:10.1002/ana.20959. PMID 16983682. S2CID 30778922.
- ^ "Human blood contains the secret ingredient for mosquito eggs". May 4, 2011. Archived from the original on June 30, 2013. Retrieved 6 April 2013.
- ^ Last, J., ed. (2001). A Dictionary of Epidemiology. New York: Oxford University Press. pp. 185–186. ISBN 978-0-19-514169-6. OCLC 207797812.
- ^ Depaquit, J.; Grandadam, M.; Fouque, F.; Andry, P. E.; Peyrefitte, C. (2010). "Arthropod-borne viruses transmitted by Phlebotomine sandflies in Europe: A review". Euro Surveillance. 15 (10): 19507. PMID 20403307.
- ^ "Life cycle of Hard Ticks that Spread Disease". Centers for Disease Control and Prevention (CDC). 26 July 2012. Retrieved 26 June 2013.
- ^ Kuno, G.; Chang, G. -J. J. (2005). "Biological Transmission of Arboviruses: Reexamination of and New Insights into Components, Mechanisms, and Unique Traits as Well as Their Evolutionary Trends". Clinical Microbiology Reviews. 18 (4): 608–637. doi:10.1128/CMR.18.4.608-637.2005. PMC 1265912. PMID 16223950.
- ^ Wasserman, H. A.; Singh, S.; Champagne, D. E. (2004). "Saliva of the Yellow Fever mosquito, Aedes aegypti, modulates murine lymphocyte function". Parasite Immunology. 26 (6–7): 295–306. doi:10.1111/j.0141-9838.2004.00712.x. PMID 15541033. S2CID 32742815.
- ^ Schneider, B. S.; McGee, C. E.; Jordan, J. M.; Stevenson, H. L.; Soong, L.; Higgs, S. (2007). Baylis, Matthew (ed.). "Prior Exposure to Uninfected Mosquitoes Enhances Mortality in Naturally-Transmitted West Nile Virus Infection". PLOS ONE. 2 (11): e1171. Bibcode:2007PLoSO...2.1171S. doi:10.1371/journal.pone.0001171. PMC 2048662. PMID 18000543.
- ^ a b Weaver, S. C. (2005). "Host range, amplification and arboviral disease emergence". Archives of Virology. Supplementum (19): 33–44. doi:10.1007/3-211-29981-5_4. ISBN 3-211-24334-8. PMID 16358422.
- ^ a b Bowen, R. A.; Nemeth, N. M. (2007). "Experimental infections with West Nile virus". Current Opinion in Infectious Diseases. 20 (3): 293–297. doi:10.1097/QCO.0b013e32816b5cad. PMID 17471040. S2CID 28937401.
- ^ Lura, T.; Cummings, R.; Velten, R.; De Collibus, K.; Morgan, T.; Nguyen, K.; Gerry, A. (2012). "Host (avian) biting preference of southern California Culex mosquitoes (Diptera: Culicidae)". Journal of Medical Entomology. 49 (3): 687–696. doi:10.1603/ME11177. PMID 22679878. S2CID 20531226.
- ^ Amraoui, F.; Krida, G.; Bouattour, A.; Rhim, A.; Daaboub, J.; Harrat, Z.; Boubidi, S. C.; Tijane, M.; Sarih, M.; Failloux, A. B. (2012). Ikegami, Tetsuro (ed.). "Culex pipiens, an Experimental Efficient Vector of West Nile and Rift Valley Fever Viruses in the Maghreb Region". PLOS ONE. 7 (5): e36757. Bibcode:2012PLoSO...736757A. doi:10.1371/journal.pone.0036757. PMC 3365064. PMID 22693557.
- ^ Tambyah, P. A.; Koay, E. S. C.; Poon, M. L. M.; Lin, R. V. T. P.; Ong, B. K. C.; Transfusion-Transmitted Dengue Infection Study Group (2008). "Dengue Hemorrhagic Fever Transmitted by Blood Transfusion". New England Journal of Medicine. 359 (14): 1526–1527. doi:10.1056/NEJMc0708673. PMID 18832256.
- ^ Iwamoto, M.; Jernigan, D. B.; Guasch, A.; Trepka, M. J.; Blackmore, C. G.; Hellinger, W. C.; Pham, S. M.; Zaki, S.; Lanciotti, R. S.; Lance-Parker, S. E.; Diazgranados, C. A.; Winquist, A. G.; Perlino, C. A.; Wiersma, S.; Hillyer, K. L.; Goodman, J. L.; Marfin, A. A.; Chamberland, M. E.; Petersen, L. R.; West Nile Virus in Transplant Recipients Investigation Team (2003). "Transmission of West Nile Virus from an Organ Donor to Four Transplant Recipients". New England Journal of Medicine. 348 (22): 2196–2203. doi:10.1056/NEJMoa022987. PMID 12773646.
- ^ a b c Teo, D.; Ng, L. C.; Lam, S. (2009). "Is dengue a threat to the blood supply?". Transfusion Medicine. 19 (2): 66–77. doi:10.1111/j.1365-3148.2009.00916.x. PMC 2713854. PMID 19392949.
- ^ Centers for Disease Control and Prevention (CDC) (2004). "Update: West Nile virus screening of blood donations and transfusion-associated transmission--United States, 2003". MMWR. Morbidity and Mortality Weekly Report. 53 (13): 281–284. PMID 15071426.
- ^ a b Wiwanitkit, V. (2009). "Unusual mode of transmission of dengue". Journal of Infection in Developing Countries. 4 (1): 51–54. doi:10.3855/jidc.145. PMID 20130380.
- ^ Centers for Disease Control and Prevention (CDC) (2002). "Possible West Nile virus transmission to an infant through breast-feeding--Michigan, 2002". MMWR. Morbidity and Mortality Weekly Report. 51 (39): 877–878. PMID 12375687.
- ^ Venter, M.; Swanepoel, R. (2010). "West Nile Virus Lineage 2 as a Cause of Zoonotic Neurological Disease in Humans and Horses in Southern Africa". Vector-Borne and Zoonotic Diseases. 10 (7): 659–664. doi:10.1089/vbz.2009.0230. hdl:2263/16794. PMID 20854018. S2CID 25170132.
- ^ a b "Arboviral Diagnostic Testing". Centers for Disease Control and Prevention (CDC). Retrieved April 17, 2013.
- ^ a b c "Arbovirus Antibodies Test". Medical Health Tests. March 27, 2012. Retrieved April 17, 2013.
- ^ Huang, C.; Slater, B.; Campbell, W.; Howard, J.; White, D. (2001). "Detection of arboviral RNA directly from mosquito homogenates by reverse-transcription-polymerase chain reaction". Journal of Virological Methods. 94 (1–2): 121–128. doi:10.1016/s0166-0934(01)00279-8. PMID 11337046.
- ^ Seawright, G. L.; Harding, G.; Thomas, F. C.; Hanson, R. P. (1974). "Microculture Plaque Neutralization Test for California Group Arboviruses". Applied Microbiology. 28 (5): 802–806. doi:10.1128/AEM.28.5.802-806.1974. PMC 186828. PMID 4216288.
- ^ Mettler, N. E.; Clarke, D. H.; Casals, J. (1971). "Hemagglutination Inhibition with Arboviruses: Relationship Between Titers and Source of Erythrocytes". Applied Microbiology. 22 (3): 377–379. doi:10.1128/AEM.22.3.377-379.1971. PMC 376317. PMID 5165837.
- ^ Dalrymple, J. M.; Vogel, S. N.; Teramoto, A. Y.; Russell, P. K. (1973). "Antigenic components of group a arbovirus virions". Journal of Virology. 12 (5): 1034–1042. doi:10.1128/JVI.12.5.1034-1042.1973. PMC 356734. PMID 4128825.
- ^ Tesh, R. B.; Gajdusek, D. C.; Garruto, R. M.; Cross, J. H.; Rosen, L. (1975). "The distribution and prevalence of group a arbovirus neutralizing antibodies among human populations in Southeast Asia and the Pacific islands". The American Journal of Tropical Medicine and Hygiene. 24 (4): 664–675. doi:10.4269/ajtmh.1975.24.664. PMID 1155702.
- ^ Lvov, D. K.; Tsyrkin, Y. M.; Karas, F. R.; Timopheev, E. M.; Gromashevski, V. L.; Veselovskaya, O. V.; Osipova, N. Z.; Fomina, K. B.; Grebenyuk, Y. I. (1973). "'Sokuluk' Virus, a new group B arbovirus isolated from Vespertilio pipistrellus Schreber, 1775, bat in the Kirghiz S.S.R". Archiv für die Gesamte Virusforschung. 41 (3): 170–174. doi:10.1007/BF01252762. PMID 4727779. S2CID 625707.
- ^ Mezencio, J. M. S.; Peixoto, M. L. P.; Ferreira, P. C. P.; Golgher, R. R. (1978). "Induction of interferon by group C arboviruses". Archives of Virology. 58 (4): 355–358. doi:10.1007/BF01317828. PMID 104697. S2CID 39810753.
- ^ Shope, R. E.; Woodall, J. P.; da Rosa, A. T. (1988). Monath, T. P. (ed.). The Arboviruses: Epidemiology and Ecology (PDF). Vol. 3. CRC Press. p. 38. ISBN 978-0849343872. Retrieved 16 June 2013.
- ^ Walsh, J. A; Warren, K. S (1980). "Selective primary health care: An interim strategy for disease control in developing countries". Social Science & Medicine. Part C: Medical Economics. 14 (2): 145–63. doi:10.1016/0160-7995(80)90034-9. PMID 7403901.
- ^ "Preventing Mosquito Bites". North Carolina Department of Health and Human Services.
- ^ "Japanese Encephalitis Vaccine, What You Need to Know" (PDF). Centers for Disease Control and Prevention (CDC). December 7, 2011. Archived from the original (PDF) on 9 March 2013. Retrieved 20 March 2013.
- ^ "Yellow Fever Vaccine, What You Need to Know" (PDF). Centers for Disease Control and Prevention (CDC). March 30, 2011. Retrieved 20 March 2013.
- ^ "Tick-borne Encephalitis". World Health Organization (WHO). Archived from the original on October 4, 2014. Retrieved 5 November 2019.
- ^ a b Ikegami, Tetsuro (2019). "Candidate vaccines for human Rift Valley fever". Expert Opin Biol Ther. 19 (Sep 3): 1333–1342. doi:10.1080/14712598.2019.1662784. PMID 31478397. S2CID 201805546.
- ^ "Database Access - UNSW Library".
- ^ "Dengue fever vaccine program". Global Vaccines. Archived from the original on 9 January 2013. Retrieved 20 March 2013.
- ^ Pandya, Jyotsna; Gorchakov, Rodion; Wang, Eryu; Leal, Grace; Weaver, Scott C (2012). "A vaccine candidate for eastern equine encephalitis virus based on IRES-mediated attenuation". Vaccine. 30 (7): 1276–82. doi:10.1016/j.vaccine.2011.12.121. PMC 3283035. PMID 22222869.
- ^ Young, S. (August 12, 2012). "Few Options in the West Nile Fight". MIT Technology Review. Retrieved 20 March 2013.
- ^ Tharmarajah, Kothila; Mahalingam, Suresh; Zaid, Ali (2017). "Chikungunya: vaccines and therapeutics". F1000Research. 6 (Dec 8): 2114. doi:10.12688/f1000research.12461.1. PMC 5728195. PMID 29259782.
- ^ "WHO the human".
- ^ Gubler, Duane J (2002). "The Global Emergence/Resurgence of Arboviral Diseases As Public Health Problems". Archives of Medical Research. 33 (4): 330–42. doi:10.1016/S0188-4409(02)00378-8. PMID 12234522.
- ^ Petersen, L. R; Busch, M. P (2010). "Transfusion-transmitted arboviruses". Vox Sanguinis. 98 (4): 495–503. doi:10.1111/j.1423-0410.2009.01286.x. PMID 19951309. S2CID 29858335.
- ^ Chaves-Carballo, E. (2005). "Carlos Finlay and yellow fever: Triumph over adversity". Military Medicine. 170 (10): 881–885. doi:10.7205/milmed.170.10.881. PMID 16435764.
- ^ Russell, F. F. (1934). "Permanent Value of Major Walter Reed's Work on Yellow Fever *". American Journal of Public Health and the Nation's Health. 24 (1): 1–7. doi:10.2105/AJPH.24.1.1. PMC 1558495. PMID 18013904.
- ^ Simmons, C. P.; Farrar, J. J.; Nguyen, N.; Wills, B. (2012). "Dengue". New England Journal of Medicine. 366 (15): 1423–1432. doi:10.1056/NEJMra1110265. hdl:11343/191104. PMID 22494122.
- ^ Gubler, D. J. (1998). "Dengue and dengue hemorrhagic fever". Clinical Microbiology Reviews. 11 (3): 480–496. doi:10.1128/CMR.11.3.480. PMC 88892. PMID 9665979.
- ^ Henchal, E. A.; Putnak, J. R. (1990). "The dengue viruses". Clinical Microbiology Reviews. 3 (4): 376–396. doi:10.1128/CMR.3.4.376. PMC 358169. PMID 2224837.
- ^ Rivers, TM (October 1927). "Filterable Viruses a Critical Review". Journal of Bacteriology. 14 (4): 217–58. doi:10.1128/jb.14.4.217-258.1927. PMC 374955. PMID 16559270.
- ^ Calisher, Charles H. (2013). Lifting the impenetrable veil : from yellow fever to Ebola hemorrhagic fever and SARS (1st ed.). Red Feather Lakes, Colo.: Rockpile Press. ISBN 978-0615827735.
- ^ Smithburn, K. C.; Hughes, T. P.; Burke, A. W.; Paul, J. H. (1940). "A Neurotropic Virus Isolated from the Blood of a Native of Uganda". American Journal of Tropical Medicine and Hygiene. 20 (4): 471–472. doi:10.4269/ajtmh.1940.s1-20.471.
- ^ Taylor, R. M.; Hurlbut, H. S.; Dressler, H. R.; Spangler, E. W.; Thrasher, D. (1953). "Isolation of West Nile virus from Culex mosquitoes". The Journal of the Egyptian Medical Association. 36 (3): 199–208. PMID 13084817.
- ^ Sun, L. H. (13 September 2012). "West Nile epidemic on track to be deadliest ever: CDC". The Washington Post. Archived from the original on 24 June 2013. Retrieved 19 June 2013.
- ^ Whitehorn, J.; Farrar, J. (2010). "Dengue". British Medical Bulletin. 95: 161–173. doi:10.1093/bmb/ldq019. PMID 20616106. S2CID 215154729.
- ^ Rodenhuis-Zybert, I. A.; Wilschut, J.; Smit, J. M. (2010). "Dengue virus life cycle: Viral and host factors modulating infectivity". Cellular and Molecular Life Sciences. 67 (16): 2773–2786. doi:10.1007/s00018-010-0357-z. PMID 20372965. S2CID 4232236.
- ^ Guzman, M. G.; Halstead, S. B.; Artsob, H.; Buchy, P.; Farrar, J.; Gubler, D. J.; Hunsperger, E.; Kroeger, A.; Margolis, H. S.; Martínez, E.; Nathan, M. B.; Pelegrino, J. L.; Simmons, C.; Yoksan, S.; Peeling, R. W. (2010). "Dengue: A continuing global threat". Nature Reviews Microbiology. 8 (12): S7–16. doi:10.1038/nrmicro2460. PMC 4333201. PMID 21079655.
- ^ a b "Tropical Diseases and the Construction of the Panama Canal, 1904–1914". Contagion: Historical Views of Diseases and Epidemics. Retrieved 19 June 2013.
- ^ "Malaria: The Panama Canal". Centers for Disease Control and Prevention (CDC). 8 February 2010. Retrieved 19 June 2013.
- ^ Lapointe, P. M. (1987). "Joseph Augustin LePrince: His battle against mosquitoes and malaria". The West Tennessee Historical Society Papers. West Tennessee Historical Society. 41: 48–61. PMID 12862098.
- ^ "Yellow Fever and Malaria in the Canal". PBS. American Experience. Retrieved 19 June 2013.
외부 링크
- Beran, G. W., ed. (1994). Handbook of Zoonoses. CRC Press. ISBN 9780849332067.





