트랜스글루타미나아제
Transglutaminase| 트랜스글루타미나아제 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
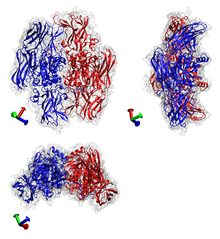 트랜스글루타미나아제 예: 사람 혈액의 응고 인자 XIII.PDB 코드: 1EVU. | |||||||||
| 식별자 | |||||||||
| EC 번호 | 2.3.2.13 | ||||||||
| CAS 번호 | 80146-85-6 | ||||||||
| 데이터베이스 | |||||||||
| 인텐츠 | IntEnz 뷰 | ||||||||
| 브렌다 | 브렌다 엔트리 | ||||||||
| ExPASy | NiceZyme 뷰 | ||||||||
| 케그 | KEGG 엔트리 | ||||||||
| 메타사이크 | 대사 경로 | ||||||||
| 프라이머리 | 프로필 | ||||||||
| PDB 구조 | RCSB PDB PDBe PDBum | ||||||||
| |||||||||
트랜스글루타미네이스는 본질적으로 글루타민 잔기 곁사슬의 γ-카르복사미드 그룹(-(C=O)NH2)과 리신 잔기 곁사슬의 γ-카르복사미드 그룹(-NH2) 사이의 이소펩타이드 결합 형성을 촉매하고 후속 암모니아(-NH)를3 방출하는 효소이다.리신과 글루타민 잔기는 펩타이드 또는 단백질에 결합되어야 하며, 따라서 이러한 가교(분리된 분자 간) 또는 분자 내(동일한 분자 내)[1] 반응이 일어날 수 있다.트랜스글루타미나아제에 의해 형성된 결합은 단백질 분해(단백질 분해)[2]에 대한 높은 내성을 나타낸다.반응이[1]...
트랜스글루타미네이스는 또한 1차 아민(RNH)을 단백질/펩타이드 결합 글루타민 잔기의 측쇄 카르복시아미드 그룹에2 결합하여 이소펩타이드[1] 결합을 형성할 수 있다.
- Gln-(C=O)NH2 + RNH2 → Gln-(C=O) NHR + NH3
이러한 효소는 또한 물이 존재하는[1] 상태에서 글루타민 잔류물을 글루탐산 잔류물로 탈아미드화할 수 있다.
- Gln-(C=O)NH22 + HO → Gln-COOH + NH3
예를 들어 Streptomyces mobaraensis -bacteria에서 분리된 트랜스글루타미나아제는 칼슘의존성 효소이다.다른 트랜스글루타미나아제 중 포유류의 트랜스글루타미나아제는 보조인자로 [1]Ca 이온을 필요로2+ 한다.
트랜스글루타미나아제는 [3]1959년에 처음 기술되었다.1968년 [4]혈액응고단백질인자 XII에서 트랜스글루타미나아제의 정확한 생화학적 활성이 발견되었다.
예
9가지의 트랜스글루타미나아제(transglutaminase)가 [5]인체에서 특징지어졌으며, 그 중 8개는 트랜스글루타미드 반응을 촉매한다.이러한 TGases는 중앙 촉매 도메인을 둘러싼 면역 글로불린 유사 도메인과 함께 3개 또는 4개 도메인 조직을 가지고 있다.핵심 도메인은 파파인 유사 단백질분해효소 슈퍼패밀리(CA clan)에 속하며 Cys-His-Asp 촉매 [2]삼합체를 사용한다.단백질 4.2(밴드 4.2라고도 함)는 인간 트랜스글루타미나아제군의 촉매적으로 비활성화된 구성원으로, 촉매 [6]삼합체에서 Cys to Ala 치환을 가지고 있습니다.
| 이름. | 진 | 활동 | 염색체 | 옴 |
|---|---|---|---|---|
| 인자 XIII(섬유소 안정화 인자) 체인 A | F13A1 | 응고 | 6p25-p24 | 134570 |
| 케라티노사이트트랜스글루타미나아제 | TGM1 | 피부. | 14분기 11.2 | 190195 |
| 조직트랜스글루타미나아제 | TGM2 | 유비쿼터스 | 20q11.2-q12 | 190196 |
| 표피 트랜스글루타미나아제 | TGM3 | 피부. | 2012년 20분기 | 600238 |
| 전립선 트랜스글루타미나아제 | TGM4 | 전립선 | 3p22-p21.33 | 600585 |
| TGM X | TGM5[7] | 피부. | 15/15.2 | 603805 |
| TGM Y | TGM6 | 신경, CNS | 20Q11-15 | 613900 |
| TGM Z | TGM7 | 고환, 폐 | 15/15.2 | 606776 |
| 단백질 4.2 | EPB42 | 적혈구, 골수, 비장 | 15/15.2 | 177070 |
세균의 트랜스글루타미나아제들은 비슷하게 접힌 핵을 가진 단일 도메인 단백질이다.일부 박테리아에서 발견되는 트랜스글루타미나아제는 Cys-Asp [8]디아드에서 실행됩니다.
|
|
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
생물학적 역할
트랜스글루타미나아제들은 광범위하게 가교된, 일반적으로 불용성 단백질 중합체를 형성한다.이러한 생물학적 중합체는 유기체가 장벽과 안정된 구조를 만드는데 필수적이다.예를 들어 혈전(응고인자 XII)과 피부 및 머리카락이 있습니다.촉매 반응은 일반적으로 돌이킬 수 없는 것으로 간주되며, 광범위한 [2]제어 메커니즘을 통해 면밀하게 모니터링해야 합니다.
질병에서의 역할
인자 XIII(희귀한 유전적 상태)의 결핍은 출혈을 일으키기 쉽다. 농축 효소는 이상을 교정하고 출혈 [2]위험을 줄이기 위해 사용될 수 있다.
항트랜스글루타미나아제 항체는 셀리악 질환에서 발견되며 이러한 상태를 [2]특징짓는 식이 글리아딘에 반응하여 소장 손상에 역할을 할 수 있습니다.소장의 변화가 자주 발견되고 글리아딘 함유 밀제품의 식이제외에 반응하는 관련 조건에서 표피 트랜스글루타미나제는 지배적인 자가항원이다.[9]
최근 연구에 따르면 헌팅턴병이나[10] 파킨슨병과[11] 같은 신경계 질환을 앓고 있는 환자들은 비정상적으로 높은 수준의 트랜스글루타미나아제인 조직 트랜스글루타미나제를 가지고 있을 수 있다.조직의 트랜스글루타미나아제가 [2][12]헌팅턴병을 일으키는 단백질 응집체의 형성에 관여할 수 있다는 가설은 가장 필요하지 않을 수 있다.
케라티노사이트 트랜스글루타미나아제 돌연변이는 층상 어혈증에 관련된다.
구조 연구
2007년 말 현재 이 등급의 효소에 대해 PDB 가입 코드 1EVU, 1EX0, 1F13, 1FIE, 1G0D, 1GGT, 1GU, 1GGGY, 1IU4, 1KV3, 1L9MN9, 1L9로 19개의 구조가 해결되었다.
산업용 및 요리용 응용 프로그램

상업적인 식품 가공에서 트랜스글루타미나아제는 단백질을 결합시키기 위해 사용된다.트랜스글루타미나아제를 사용하여 만든 음식으로는 모조 게살이나 어묵을 들 수 있다.Streptoverticillium mobaraense 발효(P81453)에 의해 상업적으로 생산되거나 동물의 [13]혈액에서 추출되며, 가공육 및 생선 생산 등 다양한 공정에 사용된다.
트랜스글루타미나아제는 스리미나 [14]햄 등 단백질이 풍부한 식품의 질감을 개선하기 위한 결합제로 사용할 수 있다.
소와 돼지에게서 나온 트롬빈-피브리노겐 "고기 접착제"는 2010년 [15]유럽연합 전체에서 식품 첨가물로 금지되었다.트랜스글루타미나아제는 최종 제품에 남아 있는 첨가제가 아닌 가공 보조제로 간주되기 때문에 허용되며 선언할 필요가 없습니다.
분자요리
트랜스글루타미나아제는 또한 분자 미식술에서 새로운 질감을 기존의 맛과 혼합하기 위해 사용된다.이러한 주요 용도 외에도, 트랜스글루타미나아제는 몇 가지 특이한 음식을 만들기 위해 사용되어 왔다.영국의 요리사 헤스턴 블루멘탈은 현대 요리에 트랜스글루타미나제를 도입한 것으로 알려져 있다.
뉴욕 아방가르드 레스토랑 wd~50 셰프인 와일리 듀프레인은 블루멘탈로부터 트랜스글루타미나제를 소개받아 트랜스글루타미나아제 [16]덕분에 95% 이상의 새우로 만든 파스타를 개발했다.
동의어
- 단백질-글루타민 감마-글루타밀전달효소(계통적)
- 피브리놀리가아제
- 글루타미닐펩타이드γ-글루타밀전달효소
- 단백질-글루타민:아민-글루카밀전달효소
- R-글루타미닐펩타이드:아민 감마-글루타밀전달효소
「 」를 참조해 주세요.
레퍼런스
- ^ a b c d e DeJong GA, Koppelman SJ (2002). "Transglutaminase Catalyzed Reactions: Impact on Food Applications". Journal of Food Science. 67 (8): 2798–2806. doi:10.1111/j.1365-2621.2002.tb08819.x.
- ^ a b c d e f Griffin M, Casadio R, Bergamini CM (December 2002). "Transglutaminases: nature's biological glues". The Biochemical Journal. 368 (Pt 2): 377–96. doi:10.1042/BJ20021234. PMC 1223021. PMID 12366374.
- ^ Clarke DD, Mycek MJ, Neidle A, Waelsch H (1959). "The incorporation of amines into proteins". Arch Biochem Biophys. 79: 338–354. doi:10.1016/0003-9861(59)90413-8.
- ^ Pisano JJ, Finlayson JS, Peyton MP (May 1968). "[Cross-link in fibrin polymerized by factor 13: epsilon-(gamma-glutamyl)lysine]". Science. 160 (3830): 892–3. Bibcode:1968Sci...160..892P. doi:10.1126/science.160.3830.892. PMID 4967475. S2CID 95459438.
- ^ Grenard P, Bates MK, Aeschlimann D (August 2001). "Evolution of transglutaminase genes: identification of a transglutaminase gene cluster on human chromosome 15q15. Structure of the gene encoding transglutaminase X and a novel gene family member, transglutaminase Z". The Journal of Biological Chemistry. 276 (35): 33066–78. doi:10.1074/jbc.M102553200. PMID 11390390.
- ^ Eckert RL, Kaartinen MT, Nurminskaya M, Belkin AM, Colak G, Johnson GV, Mehta K (April 2014). "Transglutaminase regulation of cell function". Physiological Reviews. 94 (2): 383–417. doi:10.1152/physrev.00019.2013. PMC 4044299. PMID 24692352.
- ^ Aeschlimann D, Koeller MK, Allen-Hoffmann BL, Mosher DF (February 1998). "Isolation of a cDNA encoding a novel member of the transglutaminase gene family from human keratinocytes. Detection and identification of transglutaminase gene products based on reverse transcription-polymerase chain reaction with degenerate primers". The Journal of Biological Chemistry. 273 (6): 3452–60. doi:10.1074/jbc.273.6.3452. PMID 9452468.
- ^ Kashiwagi T, Yokoyama K, Ishikawa K, Ono K, Ejima D, Matsui H, Suzuki E (November 2002). "Crystal structure of microbial transglutaminase from Streptoverticillium mobaraense". The Journal of Biological Chemistry. 277 (46): 44252–60. doi:10.1074/jbc.M203933200. PMID 12221081.
- ^ Sárdy M, Kárpáti S, Merkl B, Paulsson M, Smyth N (March 2002). "Epidermal transglutaminase (TGase 3) is the autoantigen of dermatitis herpetiformis". The Journal of Experimental Medicine. 195 (6): 747–57. doi:10.1084/jem.20011299. PMC 2193738. PMID 11901200.
- ^ Karpuj MV, Becher MW, Steinman L (January 2002). "Evidence for a role for transglutaminase in Huntington's disease and the potential therapeutic implications". Neurochemistry International. 40 (1): 31–6. doi:10.1016/S0197-0186(01)00060-2. PMID 11738470. S2CID 40198925.
- ^ Vermes I, Steur EN, Jirikowski GF, Haanen C (October 2004). "Elevated concentration of cerebrospinal fluid tissue transglutaminase in Parkinson's disease indicating apoptosis". Movement Disorders. 19 (10): 1252–4. doi:10.1002/mds.20197. PMID 15368613. S2CID 102503.
- ^ Lesort M, Chun W, Tucholski J, Johnson GV (January 2002). "Does tissue transglutaminase play a role in Huntington's disease?". Neurochemistry International. 40 (1): 37–52. doi:10.1016/S0197-0186(01)00059-6. PMID 11738471. S2CID 7983848.
- ^ Köhler W (22 August 2008). "Gelijmde slavink" (in Dutch). NRC Handelsblad. Archived from the original on 20 February 2009. Retrieved 5 March 2009.
- ^ Yokoyama K, Nio N, Kikuchi Y (May 2004). "Properties and applications of microbial transglutaminase". Applied Microbiology and Biotechnology. 64 (4): 447–54. doi:10.1007/s00253-003-1539-5. PMID 14740191. S2CID 19068193.
- ^ "EU Bans 'Meat Glue' - Food Safety News". foodsafetynews.com. 24 May 2010. Archived from the original on 5 April 2018. Retrieved 6 May 2018.
- ^ Jon B (11 February 2005). "Noodles, reinvented". NBC News. Retrieved 2 April 2008.
추가 정보
- Fesus L, Hitomi K, Kojima S (2015). Transglutaminases: Multiple Functional Modifiers and Targets for New Drug Discovery. Springer Japan. ISBN 978-4-431-55823-1.
- Nuijens T, Schmidt M (2019). Enzyme-mediated ligation methods. Humana, New York, NY. ISBN 978-1-4939-9545-5.
- Kuddus M (2018). Enzymes in food technology : improvements and innovations. Springer, Singapore. ISBN 978-981-13-1932-7.
- Kelleher JB (11 May 2012). "Industry defends ingredient critics deride as "meat glue"". Chicago Tribune. Retrieved 20 July 2012.
- 미국 특허 5,156,956 – Ca가 없는2+ 상태에서 펩타이드 또는 단백질 사슬에서 글루타민 잔기의 δ-카르복시아미드 그룹의 아실 전달 반응을 촉매하는 트랜스글루타미나아제