뉴클레오폴린
Nucleoporin| 뉴클레오폴린 133/155, N 단자 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
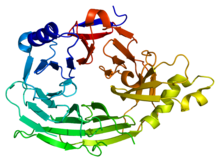 이 도메인은 7-블레이드 베타-프로펠러 구조(PDB 1XKS)를 가지고 있다. | |||||||||
| 식별자 | |||||||||
| 기호 | 뉴클레오폴린_n | ||||||||
| Pfam | PF08801 | ||||||||
| 인터프로 | IPR014908 | ||||||||
| SCOP2 | 1XKS / SCOPe / SUPFAM | ||||||||
| |||||||||
| 뉴클레오폴린 133/155, C 단자(ACE2) | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
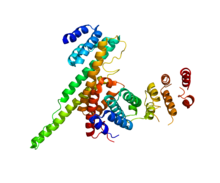 NUP133(이 도메인, 오른쪽)은 NUP107(PDB 3CQC)과 상호 작용한다. | |||||||||||
| 식별자 | |||||||||||
| 기호 | 뉴클레오폴린_c | ||||||||||
| Pfam | PF03177 | ||||||||||
| 인터프로 | IPR007187 | ||||||||||
| |||||||||||
| FG 반복 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| 식별자 | |||||||||
| 기호 | 뉴클레오폴린_FG | ||||||||
| Pfam | PF13634 | ||||||||
| Pfam 씨 | CL0647 | ||||||||
| 인터프로 | IPR025574 | ||||||||
| |||||||||
핵포폴린은 핵공기 복합체(NPC)의 구성 요소인 단백질 계열이다.[1]핵공극단지는 내핵막과 외핵막이 융합되는 현장의 핵외피에 내장된 거대한 구조물로 세포핵과 세포질 사이의 고분자 흐름을 조절하는 관문을 형성하고 있다.핵 모공은 핵 봉투를 가로질러 분자의 수동적이고 촉진된 수송을 가능하게 한다.30여 개의 단백질로 구성된 핵포폴린은 진핵세포에서 핵공기 복합체의 주요 성분이다.뉴클레오폴린 62는 이 계열의 가장 풍부한 구성원이다.[2]핵포폴린은 분자들을 매우 높은 속도로 핵 봉투를 가로질러 운반할 수 있다.단일 NPC는 1분마다 6만개의 단백질 분자를 핵 봉투에 옮길 수 있다.[3]
함수
뉴클레오폴린은 진핵에서 세포핵과 세포질 사이의 고분자 수송을 중재한다.뉴클레오폴린 계열의 특정 구성원은 핵공기단지의 구조 비계를 형성한다.그러나 핵포폴린은 주로[4] 카리오페린이라고도 알려진 운반 분자와 상호 작용하여 기능한다. 이러한 카리오페린은 아미노산 페닐알라닌(F)과 글리신(G) FG 펩타이드 반복의 반복 시퀀스를 포함하는 핵포폴린과 상호 작용한다.[5]그렇게 함으로써, 카리오페린은 핵 봉투를 가로질러 그들의 화물을 셔틀로 수송할 수 있다.핵포폴린은 40kDa 이상의 대형 친수성 분자 수송에만 필요한데, 이는 보다 작은 분자가 수동적 확산을 통해 핵공공을 통과하기 때문이다.뉴클레폴로핀은 전사 후 mRNA를 핵에서 세포질로 옮기는 데 중요한 역할을 한다.[6]그 기능에 따라 특정 뉴클레오폴린은 핵공기 복합체의 세포질 또는 핵소포체로 국부화된다.다른 뉴클레오폴린은 양쪽에서 발견될 수 있다.FG 뉴클레오폴린은 핵 모공 복합체(NPC)를 통한 분자 이동을 어떻게 규제하는지에 대한 통찰력을 제공하는 그들의 시퀀스에 암호화되어 있는 특정한 진화 보존 특징을 가지고 있다는 것이 최근 밝혀졌다.[7][8]
구조
핵포폴린 골재는 핵 기공 콤플렉스를 형성하는데, 핵 봉투를 가로지르는 팔각 고리다.이 링은 8개의 비계 하부 복합체로 구성되어 있으며, 두 개의 COPII 같은 코팅 구조 층이 모공에 줄지어 있는 일부 단백질을 샌드위치 시킨다.세포질에서 핵질까지 고리단지의 세 층은 각각 세포질, 내공, 핵질 고리로 명명된다.서로 다른 단백질 세트가 양쪽 고리에 연관되어 있고, 일부 투과성 단백질은 지질의 빌레이어에 어셈블리를 고정시킨다.[9]
비계 하위 콤플렉스에서 세포질 링과 핵플라스틱 링은 모두 Y-콤플렉스로 이루어져 있는데, 그 중에서도 NUP133과 NUP107로 이루어진 단백질 복합체다.8개의 비석 각 끝에는 2개의 Y형 콤플렉스가 있어 모공당 최대 32개의 콤플렉스가 추가된다.[9]Y 콤플렉스와 핵공극의 막 곡률 관계는 COPII 코팅된 음낭의 신생 형성과 유사하다고 볼 수 있다.[3]내부 모공 안에 있는 단백질은 NUP62 콤플렉스를 구성한다.[9]
핵소체 쪽에서는 링과 관련된 여분의 단백질들이 "핵 바구니"를 형성하는데, 핵포도핀을 핵 라미나와 게놈의 특정 부분까지 테더링할 수 있는 복합체다.[9]세포질 끝은 8개의 필라멘트가 세포질 속으로 투영되면서 덜 정교하다.그들은 핵 수입에서 역할이 없는 것 같다.[10]
막 뉴클레오폴린은 비계와 핵막 둘 다와 연관되어 있다.GP210과 같이 일부(NUP98과 같이)는 전체 막을 가로지르고, 다른 (NUP98과 같이) 막에 펀칭하는 부분뿐만 아니라 안감을 위한 구조적인 부분을 가진 못처럼 작용한다.[9]NUP98은 이전에 FG-뉴클레오폴린으로 생각되었는데, 그 안에 있는 "FG"가 코일 코일 접이식이라는 것이 증명되기 전까지는 그랬다.[9]
일부 뉴클레오폴린에는 FG-repeat가 함유되어 있다.페닐알라닌과 글리신에서 이름을 딴 FG-repeats는 수산화 아미노산의 긴 스트레칭을 분해하는 작은 소수성 부분이다.이러한 유연한 부품은 고정된 구조 없이 펼쳐지거나 흐트러진 세그먼트를 형성한다.[11]그것들은 체인의 덩어리를 형성하여 작은 분자들이 확산되도록 하지만 큰 친수성 고분자는 제외한다.이 큰 분자들은 핵포폴린의 FG-반복 부분과 일시적으로 상호작용하는 신호 분자를 동반할 경우에만 핵공공을 건널 수 있다.FG-뉴클레오폴린도 핵공기 복합체에 부착하기 위한 닻 역할을 하는 구상체 부분을 포함하고 있다.[3]
핵포폴린은 서로 다양한 하위 복합체를 형성하는 것으로 나타났다.이들 단지의 가장 흔한 단지는 NUP62, NUP58, NUP54, NUP45로 구성된 집합체인 NUP62 단지다.[12]그러한 콤플렉스의 또 다른 예는 많은 다른 핵포폴로핀으로 구성된 Y(NUP107-160) 콤플렉스다.NUP107-160 단지는 키네토코르에 국부화돼 유사분열 역할을 하고 있다.[13]
진화
많은 구조 뉴클레오폴린은 솔레노이드 단백질 도메인을 포함하고 있으며, 대량 건물 블록으로 함께 쌓을 수 있는 반복실험으로 구성된다.WD40 반복과 유사한 베타 프로펠러 영역이 있으며, 보다 흥미로운 것은 독특한 형태의 알파 솔레노이드(나선의 번들)가 그들 자신의 한 종류인 조상들의 복토머 요소(ACE)를 형성하는 반복이다.현재까지 두 등급의 ACE가 확인되었다.ACE1은 COPII의 성분인 SEC31뿐만 아니라 많은 비계 핵단백질에서 발견되는 28헥스 도메인이다. ACE2는 효모 Nup157/Nup170 (인간 Nup155)과 Nup133에서 발견된다.어느 경우든, 공유된 도메인은 이름에서 알 수 있듯이, 핵단백질 내부와 핵단백질 및 요람 사이에서 모두 공유된 조상을 나타낸다.[14]
모든 살아있는 진핵생물들은 NPC의 많은 중요한 요소들을 공유하는데, 이것은 완전한 콤플렉스가 그들의 공통 조상에 존재한다는 것을 나타낸다.[15]
운송 메커니즘
뉴클레오폴린은 핵 외피를 통한 고분자 이동을 전달 분자 카리오페린과의 상호작용을 통해 조절한다.카리오페린은 화물에 묶이고 핵포폴린에서 FG-repeats와 역방향으로 상호작용한다.카리오페린과 그 화물은 FG-반복 사이에 통과되어 FG-반복구도를 낮추고 핵공기단지를 통과한다.카리오페린은 임베핀(핵으로 단백질을 이동시키는 것)이나 엑스포틴(핵 밖으로 단백질을 이동시키는 것)의 역할을 할 수 있다.[3]카리오페린 방출은 G단백질인 란에 의해 추진된다.란(Ran)은 핵포도핀과 상호작용하지 않고 핵공극을 통해 농축도하로 확산될 수 있을 정도로 작다.Ran은 GTP나 GDP에 속박될 것이고 카리오페린의 화물 친화력을 바꿀 수 있는 능력을 가지고 있다.핵 내부에서 RanGTP는 수입 카리오페린이 순응을 변경하도록 하여 화물을 방출할 수 있게 한다.또한 RanGTP는 카리오페린 수출에 바인딩되어 핵공극을 통과할 수 있다.일단 사이토솔에 도달하면 란GTP를 란GDP로 가수분해할 수 있어 수출입 화물이 풀릴 수 있다.[16]
병리학
몇몇 질병들은 뉴클레오폴린 병리학, 특히 당뇨병, 일차 담도경화증, 파킨슨병, 알츠하이머병과 연관되어 있다.서로 다른 핵포폴린을 암호화하는 유전자의 과도한 압박도 암종양의 형성과 관련이 있는 것으로 나타났다.
뉴클레오폴린은 포도당 농도 변화에 매우 민감한 것으로 나타났다.그러므로 당뇨병에 걸린 개인은 종종 뉴클레오폴린, 특히 뉴클레오폴린 62의 글리코실화 증가를 보인다.[2]
p62 콤플렉스를 억제하는 항 p62 항체와 같은 자가면역 질환은 간 담즙관을 파괴하는 1차 담도 간경변과 관련이 있다.[12]
p62 복합체의 생산량 감소는 많은 신경퇴행성 질환에 흔히 나타난다.산화에 의한 p62 프로모터의 수정은 다른 신경퇴행성 질환들 중에서도 알츠하이머병, 헌팅턴병, 파킨슨병과 상관관계가 있다.[17]
뉴클레오폴린 88을 위해 인코딩하는 NUP88 유전자의 증가된 발현은 보통 사전성 이형성증과 악성 신엽종에서 발견된다.[18]
핵포폴린 단백질 알라딘은 핵공기 복합체의 성분이다.알라딘 유전자의 돌연변이는 자가 열성 신경내분비증후군인 트리플A 증후군의 원인이 된다.돌연변이 알라딘은 핵 단백질 수입의 선택적 실패와 산화 스트레스에 대한 과민성을 유발한다.[19]DNA보수단백질인 aprataxin과 dna ligase I의 수입은 선택적으로 감소하며, 이는 세포사멸을 유발하는 산화적 스트레스 유발손상에 대한 세포 DNA의 취약성을 증가시킬 수 있다.[19]
예
각각의 개별 뉴클레오폴린은 분자량(킬로 달튼)에 따라 이름 지어진다.다음은 뉴클레오폴린 계열의 단백질에 대한 몇 가지 예시들이다.
- NUP35, NUP37, NUP43, NUP50
- NUP54, NUP62, NUP85, NUP88, NUP93, NUP98
- NUP107, NUP133, NUP153, NUP155, NUP160, NUP188
- NUP205, NUP210, NUP214
참조
- ^ Doye V, Hurt E (June 1997). "From nucleoporins to nuclear pore complexes". Current Opinion in Cell Biology. 9 (3): 401–11. doi:10.1016/S0955-0674(97)80014-2. PMID 9159086.
- ^ a b Han I, Oh ES, Kudlow JE (August 2000). "Responsiveness of the state of O-linked N-acetylglucosamine modification of nuclear pore protein p62 to the extracellular glucose concentration". The Biochemical Journal. 350 Pt 1: 109–14. doi:10.1042/0264-6021:3500109. PMC 1221231. PMID 10926833.
- ^ a b c d Lodish H (2013). Molecular Cell Biology (Seventh ed.). New York: Worth Publ. ISBN 978-1-4292-3413-9.
- ^ Allen NP, Patel SS, Huang L, Chalkley RJ, Burlingame A, Lutzmann M, Hurt EC, Rexach M (December 2002). "Deciphering networks of protein interactions at the nuclear pore complex". Molecular & Cellular Proteomics. 1 (12): 930–46. doi:10.1074/mcp.t200012-mcp200. PMID 12543930.
- ^ Peters R (2006). Introduction to nucleocytoplasmic transport: molecules and mechanisms. Methods in Molecular Biology. Vol. 322. pp. 235–58. doi:10.1007/978-1-59745-000-3_17. PMID 16739728.
- ^ Marfori M, Mynott A, Ellis JJ, Mehdi AM, Saunders NF, Curmi PM, Forwood JK, Bodén M, Kobe B (September 2011). "Molecular basis for specificity of nuclear import and prediction of nuclear localization". Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1813 (9): 1562–77. doi:10.1016/j.bbamcr.2010.10.013. PMID 20977914.
- ^ Peyro M, Soheilypour M, Lee BL, Mofrad MR (November 2015). "Evolutionarily Conserved Sequence Features Regulate the Formation of the FG Network at the Center of the Nuclear Pore Complex". Scientific Reports. 5: 15795. Bibcode:2015NatSR...515795P. doi:10.1038/srep15795. PMC 4635341. PMID 26541386.
- ^ Ando D, Colvin M, Rexach M, Gopinathan A (2013-09-16). "Physical motif clustering within intrinsically disordered nucleoporin sequences reveals universal functional features". PLOS ONE. 8 (9): e73831. Bibcode:2013PLoSO...873831A. doi:10.1371/journal.pone.0073831. PMC 3774778. PMID 24066078.
- ^ a b c d e f Beck, Martin; Hurt, Ed (21 December 2016). "The nuclear pore complex: understanding its function through structural insight". Nature Reviews Molecular Cell Biology. 18 (2): 73–89. doi:10.1038/nrm.2016.147. PMID 27999437. S2CID 35394962. Retrieved 10 April 2019.
- ^ Walther, TC; Pickersgill, HS; Cordes, VC; Goldberg, MW; Allen, TD; Mattaj, IW; Fornerod, M (8 July 2002). "The cytoplasmic filaments of the nuclear pore complex are dispensable for selective nuclear protein import". The Journal of Cell Biology. 158 (1): 63–77. doi:10.1083/jcb.200202088. PMC 2173022. PMID 12105182.
- ^ Denning D, Patel S, Uversky V, Fink A, Rexach M (2003). "Disorder in the nuclear pore complex: The FG repeat regions of nucleoporins are natively unfolded". Proc Natl Acad Sci USA. 100 (5): 2450–5. Bibcode:2003PNAS..100.2450D. doi:10.1073/pnas.0437902100. PMC 151361. PMID 12604785.
- ^ a b Miyachi K, Hankins RW, Matsushima H, Kikuchi F, Inomata T, Horigome T, Shibata M, Onozuka Y, Ueno Y, Hashimoto E, Hayashi N, Shibuya A, Amaki S, Miyakawa H (May 2003). "Profile and clinical significance of anti-nuclear envelope antibodies found in patients with primary biliary cirrhosis: a multicenter study". Journal of Autoimmunity. 20 (3): 247–54. doi:10.1016/S0896-8411(03)00033-7. PMID 12753810.
- ^ Loïodice I, Alves A, Rabut G, Van Overbeek M, Ellenberg J, Sibarita JB, Doye V (July 2004). "The entire Nup107-160 complex, including three new members, is targeted as one entity to kinetochores in mitosis". Molecular Biology of the Cell. 15 (7): 3333–44. doi:10.1091/mbc.E03-12-0878. PMC 452587. PMID 15146057.
- ^ Whittle, JR; Schwartz, TU (9 October 2009). "Architectural nucleoporins Nup157/170 and Nup133 are structurally related and descend from a second ancestral element". The Journal of Biological Chemistry. 284 (41): 28442–52. doi:10.1074/jbc.M109.023580. PMC 2788893. PMID 19674973.
- ^ Neumann, N; Lundin, D; Poole, AM (8 October 2010). "Comparative genomic evidence for a complete nuclear pore complex in the last eukaryotic common ancestor". PLOS ONE. 5 (10): e13241. Bibcode:2010PLoSO...513241N. doi:10.1371/journal.pone.0013241. PMC 2951903. PMID 20949036.
- ^ Avis JM, Clarke PR (October 1996). "Ran, a GTPase involved in nuclear processes: its regulators and effectors". Journal of Cell Science. 109 ( Pt 10) (10): 2423–7. doi:10.1242/jcs.109.10.2423. PMID 8923203.
- ^ Du Y, Wooten MC, Wooten MW (August 2009). "Oxidative damage to the promoter region of SQSTM1/p62 is common to neurodegenerative disease". Neurobiology of Disease. 35 (2): 302–10. doi:10.1016/j.nbd.2009.05.015. PMC 2718328. PMID 19481605.
- ^ "엔트레스 진: NUP88 핵포폴린 88kDa"
- ^ a b Hirano M, Furiya Y, Asai H, Yasui A, Ueno S (February 2006). "ALADINI482S causes selective failure of nuclear protein import and hypersensitivity to oxidative stress in triple A syndrome". Proc. Natl. Acad. Sci. U.S.A. 103 (7): 2298–303. Bibcode:2006PNAS..103.2298H. doi:10.1073/pnas.0505598103. PMC 1413683. PMID 16467144.