전사(생물학)
Transcription (biology)전사는 DNA의 일부를 RNA로 복사하는 과정이다.단백질을 인코딩할 수 있는 RNA 분자로 변환된 DNA의 부분은 메신저 RNA를 생성한다고 한다.DNA의 다른 부분들은 비코드 RNA라고 불리는 RNA 분자로 복사된다.특정 조직의 여러 세포 유형에 걸쳐 평균화된 mRNA의 양은 ncRNA의 10배 이상이다(단일 세포 유형 ncRNA는 mRNA를 [1]초과할 수 있다).세포에서 mRNA의 일반적인 우위는 인간 게놈의 2% 미만이 mRNA(인간 게놈#코드 대 비코드 DNA)로 전사될 수 있지만, 포유류의 게놈 DNA의 최소 80%는 (하나 이상의 세포 유형에서) 능동적으로 전사될 수 있으며, 이 80%의 대부분은 NCRNA로 [2]간주된다.
DNA와 RNA는 모두 핵산인데, 이것은 상호 보완적인 언어로서 염기쌍의 뉴클레오티드를 사용합니다.전사하는 동안, DNA 배열은 RNA 중합효소에 의해 읽혀지며, 이것은 1차 전사라고 불리는 상보적인 역평행 RNA 가닥을 생성한다.
문자 변환은, 다음의 일반적인 순서로 진행됩니다.
- RNA 중합효소는 하나 이상의 일반적인 전사 인자와 함께 프로모터 DNA에 결합합니다.
- RNA 중합효소는 DNA 나선의 두 가닥을 분리하는 전사 거품을 생성한다.이것은 상보적인 DNA 뉴클레오티드 사이의 수소 결합을 파괴함으로써 이루어진다.
- RNA 중합효소는 RNA 뉴클레오티드를 첨가한다.
- RNA 당인산 백본은 RNA 중합효소로부터 도움을 받아 형성되어 RNA 가닥을 형성한다.
- RNA-DNA 나선의 수소 결합이 끊어지면서 새로 합성된 RNA 가닥이 해방됩니다.
- 세포에 핵이 있으면 RNA는 더 처리될 수 있다.여기에는 폴리아데닐화, 캡핑 및 스플라이싱이 포함될 수 있습니다.
- RNA는 핵에 남아있을 수도 있고 핵공 복합체를 통해 세포질로 나갈 수도 있다.
DNA의 스트레치가 단백질을 코드하는 RNA 분자로 전사되면 RNA는 메신저 RNA(mRNA)라고 불리며, mRNA는 번역을 통해 단백질 합성을 위한 템플릿 역할을 한다.다른 DNA의 스트레칭은 리보솜 RNA(rRNA)와 같은 더 큰 비코드 RNA(rRNA)와 같은 더 큰 비코드 RNA(long-coding RNA)뿐만 아니라 마이크로RNA, 전달 RNA(tRNA), 작은 핵소립 RNA(snoRNA), 또는 리보젬이라고[3] 불리는 효소 RNA 분자와 같은 작은 비코드 RNA(long-coding RNA)로 전사될 수 있다.전반적으로, RNA는 단백질의 합성, 조절, 과정을 돕는다. 따라서 RNA는 세포 내에서 기능을 수행하는데 있어 기본적인 역할을 한다.
바이러스학에서 전사라는 용어는 RNA 분자로부터의 mRNA 합성을 언급할 때 사용될 수도 있다(즉, RNA 복제와 동일).예를 들어, 음의 단가닥 RNA(sssRNA -) 바이러스의 게놈은 양의 단가닥 RNA(sssRNA +)[clarification needed]의 템플릿일 수 있다.이것은 긍정적인 감각의 가닥이 바이러스 복제에 필요한 바이러스 단백질을 번역하는데 필요한 배열 정보를 포함하고 있기 때문이다.이 과정은 바이러스 RNA 복제효소에 [4][clarification needed]의해 촉매된다.
배경
단백질을 코드하는 DNA 전사 유닛은 단백질로 변환되는 코드 배열과 해당 단백질의 합성을 지시 및 조절하는 조절 배열을 모두 포함할 수 있다.부호화 시퀀스의 전(후진) 규제 시퀀스를 5개의 주요 미번역 영역(5'UTR)이라고 하고, 부호화 시퀀스를 3개의 주요 미번역 영역(3'UTR)[3]이라고 한다.
DNA 복제와 반대로, 전사는 DNA 보체에서 티민(T)이 발생했을 모든 경우에 뉴클레오티드 우라실(U)을 포함하는 RNA 보체를 초래한다.
두 개의 DNA 가닥 중 하나만 전사의 템플릿 역할을 합니다.DNA의 안티센스 가닥은 전사 중에 RNA 중합효소에 의해 3' 말단에서 5' 말단으로 읽힌다(3' → 5').상보적 RNA는 반대 방향인 5' → 3' 방향으로 생성되며, 티민에 대한 유라실 전환을 제외하고 감지 가닥의 염기서열과 일치한다.이러한 방향성은 RNA 중합효소가 성장하는 mRNA 사슬의 3' 끝에만 뉴클레오티드를 첨가할 수 있기 때문입니다.이 3' → 5' DNA 가닥만을 사용하면 DNA [3]복제에서 볼 수 있는 오카자키 단편이 필요하지 않다.이것은 또한 DNA 복제에서와 같이 RNA 합성을 시작하기 위한 RNA 프라이머의 필요성을 제거한다.
DNA의 비템플릿(감지) 가닥은 코드 가닥이라고 불리는데, 그 배열이 새로 생성된 RNA 전사물과 동일하기 때문이다(티민 대신 우라실을 제외).이것은 DNA [5]염기서열을 제시할 때 관례적으로 사용되는 가닥이다.
전사에는 몇 가지 교정 메커니즘이 있지만, 그것들은 DNA를 복사하는 것에 대한 통제보다 덜 효과적이고 덜 효과적이지 않다.그 결과, 전사는 DNA [6]복제보다 복제 충실도가 낮다.
주요 단계
전사는 개시, 프로모터 이스케이프, 신장 및 [7]종료로 나뉜다.
문자 변환 설정
포유류 전사의 증강제, 전사인자, 매개체 복합체 및 DNA 루프

포유동물에서의 전사를 위한 설정은 유전자의 전사가 시작되는 부위 근처에 위치한 핵심 프로모터 및 프로모터-근접 요소를 포함한 많은 시스 조절 요소에 의해 조절된다.일반적인 전사 인자와 결합된 핵심 프로모터는 전사의 시작을 지시하기에 충분하지만, 일반적으로 기초 활성이 [8]낮습니다.다른 중요한 시스 조절 모듈은 전사 시작 부위에서 멀리 떨어진 DNA 영역에 국소화된다.여기에는 강화제, 소음기, 절연체 및 테더링 [9]요소가 포함됩니다.이러한 요소 집합 중 증강제 및 그와 관련된 전사 인자는 유전자 [10]전사의 개시에 주도적인 역할을 한다.유전자의 프로모터에서 떨어진 DNA 영역에 국소화된 인핸서는 유전자 전사에 매우 큰 영향을 미칠 수 있으며, 일부 유전자는 활성화된 [11]인핸서에 의해 최대 100배까지 전사가 증가된다.
증강제는 유전자 조절의 주요 요소인 게놈의 영역이다.인핸서는 세포 유형별 유전자 전사 프로그램을 제어하는데, 대부분의 경우 그들의 [12]표적 유전자의 촉진자와 물리적으로 근접하기 위해 먼 거리를 순환합니다.수십만 개의 강화제 DNA [13]영역이 있는 반면, 특정 유형의 조직에서는 특정 강화제만 그들이 조절하는 촉진제와 근접하게 됩니다.뇌 피질 뉴런에 대한 연구에서 24,937개의 루프가 발견되었고, 이것은 그들의 목표 [11]촉진자들에게 강화제를 가져다주었다.종종 그들의 표적 유전자와는 각각 수만 또는 수십만 개의 뉴클레오티드에 있는 여러 개의 강화제들은 그들의 표적 유전자 프로모터에 루프하고 그들의 공통 표적 [12]유전자의 전사를 조절하기 위해 서로 협력할 수 있다.
이 섹션의 도식 그림은 표적 유전자의 프로모터와 물리적으로 근접하기 위해 루프 주변을 도는 인핸서를 보여준다.루프는 커넥터 단백질의 이합체(예: CTCF 또는 YY1)에 의해 안정화되며, 이합체의 한 부재는 인핸서의 결합 모티브에 고정되고 다른 부재는 프로모터의 결합 모티브에 고정됩니다([14]그림에서 빨간색 지그재그로 표시됨).몇 가지 세포기능특이전사인자(인간세포에는[15] 약 1,600개의 전사인자가 있다)는 일반적으로 인핸서의[16] 특정 모티브에 결합하고 이들 인핸서 결합전사인자의 소규모 조합은 DNA 루프를 통해 프로모터에 근접하면 표적유전자의 전사인 수준을 제어한다.중개자(통상 상호작용 구조에서 약 26개의 단백질로 이루어진 복합체)는 촉진제 DNA 결합 전사인자에서 프로모터에 결합하는 [17]RNA 중합효소 II(pol II) 효소로 직접 조절 신호를 전달한다.
활성 상태일 때 RNA 중합효소가 [18]두 가지 다른 방향으로 작용하여 그림에 표시된 바와 같이 두 개의 증강 RNA(eRNA)를 생성하면서 일반적으로 양쪽 DNA 가닥에서 전사된다.불활성전사인자는 불활성전사인자에 의해 결합되어 있어도 된다.전사 인자의 인산화는 그것을 활성화 시킬 수 있고, 그 활성화된 전사 인자는 그것이 결합되어 있는 인핸서를 활성화시킬 수 있다([19]그림에서 전사 인자의 인산화를 나타내는 작은 붉은 별 참조).활성 증강제는 표적 유전자에서 [20]메신저 RNA의 전사를 활성화하기 전에 RNA의 전사를 시작합니다.
CpG섬 메틸화 및 탈메틸화
프로모터의 약 60%에서 전사 조절은 또한 CpG 디뉴클레오티드 내의 세포신 메틸화에 의해 제어된다(여기서 5' 시토신은 3' 구아닌 또는 CpG 부위).5-메틸시토신(5-mC)은 DNA 염기 시토신의 메틸화 형태이다(그림 참조).5-mC는 주로 CpG 부위에서 발견되는 후생유전자 마커이다.인간 [21]게놈에는 약 2800만 개의 CpG 디뉴클레오티드가 존재한다.포유류의 대부분의 조직에서는 평균적으로 CpG 세포질의 70~80%가 메틸화된다(5-메틸CpG 또는 5-mCpG [22]형성).5'시토신-구아닌 3' 배열 내의 메틸화 사이토신은 종종 CpG 섬이라고 불리는 그룹에서 발생한다.프로모터 배열의 약 60%가 CpG 섬을 가지며, 인핸서 배열의 약 6%만이 CpG [23]섬을 가진다.CpG 섬은 유전자 프로모터에서 CpG 섬이 메틸화되면 유전자 [24]전사를 줄이거나 억제할 수 있기 때문에 조절 순서를 구성합니다.
DNA 메틸화는 MeCP2, MBD1, MBD2와 같은 메틸결합 도메인(MBD) 단백질과의 상호작용을 통해 유전자 전사를 조절한다.이러한 MBD 단백질은 고도로 메틸화된 CpG [25]섬에 가장 강하게 결합한다.이러한 MBD 단백질은 메틸-CpG 결합 도메인과 전사 억제 [25]도메인을 모두 가지고 있다.이들은 메틸화 DNA에 결합하고 염색질 리모델링 및/또는 히스톤 수정 활성을 통해 단백질 복합체를 메틸화 CpG 섬으로 유도 또는 유도한다.MBD 단백질은 일반적으로 억제성 히스톤 마크의 도입을 촉매하거나 뉴클레오솜 리모델링 및 염색질 [25]재구성을 통해 전체적인 억제성 염색질 환경을 조성함으로써 국소 염색질을 억제한다.
이전 절에서 언급했듯이, 전사 인자는 유전자의 발현을 조절하기 위해 특정 DNA 배열에 결합하는 단백질이다.DNA의 전사 인자에 대한 결합 배열은 보통 10 또는 11 뉴클레오티드 길이입니다.2009년에 요약한 바와 같이, Vaquerizas 등은 인간 게놈에 약 1,400개의 다른 전사인자가 인간 단백질 코드 유전자의 [26]약 6%를 구성하는 유전자에 의해 코드된다고 밝혔다.신호 반응 유전자와 관련된 전사 인자 결합 부위(TFBS)의 약 94%가 촉진제에서 발생하는 반면, 그러한 TFBS의 약 6%만이 [16]촉진제에서 발생한다.
EGR1 단백질은 CpG섬의 메틸화 조절에 중요한 특정 전사 인자이다.EGR1 전사인자 결합부위는 인핸서 또는 프로모터 [27]배열에 자주 위치한다.포유류의 게놈에는 약 1만2000개의 EGR1 결합 부위가 있으며 EGR1 결합 부위의 절반가량은 프로모터에, 절반은 인핸서에 [27]있다.표적 DNA 결합 부위에 대한 EGR1의 결합은 DNA의 [27]시토신 메틸화에 둔감하다.
자극이 없는 세포에서는 소량의 EGR1 전사인자 단백질이 검출되지만, 자극 후 1시간 이내에 EGR1 유전자가 단백질로 변환되는 [28]것은 현저하게 증가한다.다양한 유형의 세포에서 EGR1 전사인자 단백질의 생산은 성장인자, 신경전달물질, 호르몬, 스트레스 및 [28]손상에 의해 촉진될 수 있다.뇌에서, 뉴런이 활성화되면, EGR1 단백질은 상향 조절되고 그들은 뉴런에서 대량으로 생성되는 기존의 TET1 효소에 결합한다.TET 효소는 5-메틸시토신의 탈메틸화를 촉매할 수 있다.EGR1 전사인자가 프로모터의 EGR1 결합 부위에 TET1 효소를 가져오면 TET 효소는 프로모터에서 메틸화된 CpG 섬을 탈메틸화할 수 있습니다.탈메틸화되면, 이러한 촉진제는 그들의 표적 유전자의 전사를 시작할 수 있다.TET1의 EGR1 모집을 통해 뉴런 활성화 후 촉진제의 [27]메틸화 조절 배열을 통해 뉴런 내 수백 개의 유전자가 차등 발현된다.
프로모터의 메틸화도 신호에 따라 변화한다.세 개의 포유동물 DNA 메틸전달효소(DNMT1, DNMT3A, DNMT3B)는 DNA의 세포신에 메틸기를 첨가하는 촉매 작용을 한다.DNMT1은 "유지" 메틸전달효소인 반면, DNMT3A 및 DNMT3B는 새로운 메틸화를 수행할 수 있다.또한 DNMT3A 유전자로부터 생성된 DNA 메틸전달효소 단백질 DNMT3A1과 DNMT3A2의 [29]두 가지 스플라이스 단백질 아이소폼이 있다.
스플라이스 아이소폼 DNMT3A2는 고전적인 즉시-초기 유전자의 산물처럼 행동하며, 예를 들어 신경 활성화 [30]후 견고하고 일시적으로 생성된다.여기서 DNA 메틸전달효소 아이소폼 DNMT3A2는 세포진에 메틸기를 결합하고 첨가한다.[31][32][33]
한편 신경활성화는 평가대상 [34]프로모터의 메틸화 감소를 수반하는 DNMT3A1의 분해를 일으킨다.
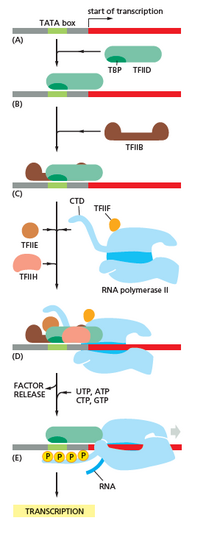
개시
전사는 RNA 중합효소가 하나 이상의 일반적인 전사인자와 함께 "프로모터"라고 불리는 특정 DNA 배열에 결합하여 RNA 중합효소-프로모터 "닫힌 복합체"를 형성하면서 시작됩니다."닫힌 복합체"에서 프로모터 DNA는 여전히 완전히 이중 [7]가닥이다.
RNA 중합효소는 하나 이상의 일반적인 전사 인자의 도움을 받아 약 14개의 염기쌍의 DNA를 풀어 RNA 중합효소-프로모터 "개방 복합체"를 형성한다."개방 복합체"에서 프로모터 DNA는 부분적으로 풀리고 단일 가닥이다.노출된 단일 가닥 DNA를 "전사 거품"이라고 합니다."[7]
RNA중합 효소, 하나 또는 더 많은 일반 전사 인자에 의해 지원을 받고 초기 RNA제품을 산출하기 위해 채권 형성 catalyzes은 전사 거품에 전사 시작 사이트, 선도적 NTP과 증량 NTP에 뭉치게(또는 짧은 RNA시발체와 증량 NTP)은 전사 시작하 사이트 순서로 보완을 선택한다.[7]
박테리아에서 RNA 중합효소 홀로엔자임은 2α 서브유닛, 1β 서브유닛, 1β 서브유닛, 1β' 서브유닛의 5개의 서브유닛으로 구성된다.박테리아에는 시그마 인자로 알려진 하나의 일반적인 RNA 전사 인자가 있습니다.RNA 중합효소 핵심효소는 세균 일반전사(시그마) 인자에 결합해 RNA 중합효소 홀로엔진을 형성하고 [7]프로모터에 결합한다(RNA 중합효소는 2α 서브유닛, 1β 서브유닛, 1β' 서브유닛으로 이루어진 코어유닛에 시그마 서브유닛이 결합되면 홀로엔아제라고 불린다.진핵생물과는 달리 초기 세균 mRNA의 개시 뉴클레오티드는 변형된 구아닌 뉴클레오티드로 덮이지 않는다.세균전사의 개시 뉴클레오티드는 5'3인산(5'-PPP)을 함유하고 있으며, 이는 전사 개시 [35]부위의 게놈 전체 매핑에 사용될 수 있다.
고세균 및 진핵생물에서 RNA 중합효소는 박테리아 중 5개의 RNA 중합효소 서브유닛 각각과 상동하는 서브유닛을 포함하고, 또한 추가적인 서브유닛을 포함한다.고세균과 진핵생물에서 세균의 일반전사인자 시그마의 기능은 [7]함께 작용하는 복수의 일반전사인자에 의해 이루어진다.고고학에는 TBP, TFB 및 TFE의 세 가지 일반적인 전사 인자가 있습니다.진핵생물에서 RNA 중합효소 II의존성 전사에는 TFIIA, TFIIB(고고고 TFB의 직교), TFIID(주요 서브유닛인 TBP가 고고 TFI의 직교인자), TFIIE(고고고고고고고 TBP의 직교인자)의 6가지 일반 전사 인자가 있다.TFIID는 TBP 결합으로 인해 DNA에 결합하는 첫 번째 성분이며, TFIIH는 모집되는 마지막 성분입니다.고세균과 진핵생물에서, RNA 중합효소-프로모터 폐쇄 복합체는 보통 "사전 개시 복합체"[36]라고 불립니다.
전사개시는 활성화제 및 억제제로 알려진 추가 단백질 및 일부 경우에는 전사개시복합체의 [7]형성과 기능을 조절하는 관련 공활성제 또는 코어프레서에 의해 조절된다.
프로모터 이스케이프
첫 번째 결합이 합성된 후 RNA 중합효소는 프로모터를 빠져나가야 한다.이 기간 동안 RNA 전사물을 방출하고 잘린 전사물을 생성하는 경향이 있다.이것은 중단 개시라고 불리며, 진핵 생물과 원핵 [37]생물 모두에게 공통적이다.약 10뉴클레오티드의 역치 길이의 RNA 생성물이 합성될 때까지 중단 개시가 계속되며, 이때 프로모터가 탈출하여 전사 신장 복합체가 형성된다.
기계적으로, 프로모터 탈출은 DNA 스크런치를 통해 일어나 RNA 중합효소 [38]홀로엔자임과 프로모터 사이의 상호작용을 끊는 데 필요한 에너지를 제공한다.
박테리아에서는 시그마 인자가 프로모터 클리어런스 후에 확실히 방출되는 것으로 생각되었다.이 이론은 의무 릴리스 모델로 알려져 있었습니다.그러나 이후 데이터에 따르면 프로모터 클리어런스에 따라 확률적 방출 모델로 알려진 [39]확률적 모델에 따라 시그마 인자가 방출된다.
진핵생물에서는 RNA 중합효소 II의존성 프로모터에서 프로모터 클리어런스 시에 TFIIH는 RNA 중합효소 II의 카르복시 말단 도메인에서 세린 5를 인산화하여 캡핑효소([40][41]CE)를 채용한다.CE가 어떻게 진핵생물에서 프로모터 클리어런스를 유도하는지에 대한 정확한 메커니즘은 아직 알려지지 않았다.
신장
DNA의 한 가닥인 템플릿 가닥(또는 비코드 가닥)은 RNA 합성을 위한 템플릿으로 사용됩니다.전사가 진행됨에 따라 RNA 중합효소는 템플릿 가닥을 통과하고 DNA 템플릿과의 염기쌍 상보성을 사용하여 RNA 복사본(횡단 동안 연장)을 생성합니다.RNA 중합효소는 3' → 5'에서 템플릿 가닥을 가로지르지만, 코드화(비결정) 가닥과 새로 형성된 RNA를 참조점으로 사용할 수도 있으므로 전사가 5' → 3' 발생이라고 할 수 있다.이것은 코드 가닥의 정확한 복사본인 5' → 3'로부터 RNA 분자를 생성한다(티미네는 우라실로 대체되고, 뉴클레오티드는 DNA가 당-인산염 [citation needed]골격에 디옥시리보스(산소 원자 1개 감소)를 가진 리보스(5-탄소) 당으로 구성된다).
mRNA 전사는 단일 DNA 템플릿에 여러 개의 RNA 중합효소 및 여러 번의 전사(특정 mRNA의 증폭)를 포함할 수 있으므로,[citation needed] 많은 mRNA 분자는 한 개의 유전자 복사본에서 빠르게 생성될 수 있습니다.원핵생물과 진핵생물의 특징적인 신장률은 약 10-100 nts/[42]초이다.그러나 진핵생물에서 뉴클레오솜은 전사가 [43][44]늘어나는 동안 중합효소를 전사하는 데 주요 장벽으로 작용한다.이들 유기체에서 뉴클레오솜에 의해 유도되는 일시정지는 TFIIS [44]등의 전사신장인자에 의해 조절될 수 있다.
신장에는 잘못 통합된 염기를 대체할 수 있는 교정 메커니즘도 포함됩니다.진핵생물에서 이는 적절한 RNA 편집 인자가 결합할 수 있도록 하는 전사 중 짧은 일시 중지와 일치할 수 있습니다.이러한 일시정지는 RNA 중합효소 또는 염색질 [citation needed]구조에 기인할 수 있다.
종료
박테리아는 전사 종료를 위해 Rho 비의존적 종단과 Rho 의존적 종단의 두 가지 다른 전략을 사용한다.Rho의존성 전사종단에서 새롭게 합성된 RNA 분자가 G-C가 풍부한 헤어핀 루프를 형성하고 이어서 Us가 실행되면 RNA 전사가 정지된다.헤어핀이 형성되면 기계적 응력이 약한 rU-dA 결합을 파괴하여 DNA-RNA 교배체를 채웁니다.그러면 폴리 U 전사가 RNA 중합효소의 활성 부위에서 당겨져 전사가 종료됩니다."Rho-dependent" 유형의 종단에서는 "Rho"라고 불리는 단백질 인자가 템플릿과 mRNA 사이의 상호작용을 불안정하게 하여 신장 [45]복합체로부터 새롭게 합성된 mRNA를 방출한다.
진핵생물에서의 전사 종료는 박테리아에서보다 잘 이해되지 않지만,[46] 폴리아데닐화라고 불리는 과정에서 새로운 3' 말단에서 템플릿에 의존하지 않는 아데닌의 첨가를 수반한다.
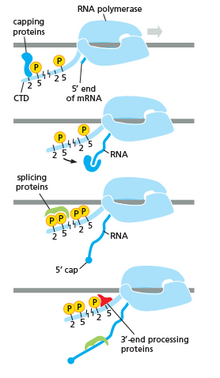
RNA의 전사 후 변화에서 RNA 중합효소의 역할
RNA 중합효소는 RNA의 전사 후 변화를 포함한 모든 단계에서 매우 중요한 역할을 한다.
오른쪽 그림과 같이 CTD(C Terminal Domain)는 모양이 변화하는 꼬리임을 [47]알 수 있습니다. 이 꼬리는 왼쪽 그림과 같이 스플라이싱, 캡핑 및 폴리아데닐화의 운반체로 사용됩니다.
억제제
전사억제제는 예를 들어 병원성 박테리아(항균제) 및 곰팡이(항진균제)에 대한 항생제로 사용될 수 있다.이러한 항균제의 예로는 리팜피신이 있으며, 리팜피신은 그 베타 서브유닛과 결합함으로써 DNA의 mRNA로의 세균 전사를 억제하고, 8-히드록시퀴놀린은 항진균 전사인 [48]억제제이다.히스톤 메틸화의 효과는 또한 전사의 작용을 억제하기 위해 작용할 수 있다.일반전사인자 TFIIH의 XPB 서브유닛 억제를 통해 포유류의 전사를 저해하는 트립톨라이드 등의 잠재력이 있는 생체활성 천연생물은 최근 포도당 수송체 [49]생산이 증가한 저산소암세포를 대상으로 하는 포도당 결합체로 보고되고 있다.
내인성 억제제
척추동물에서 대부분의 유전자 촉진제는 다수의 CpG [50]부위가 있는 CpG 섬을 포함한다.유전자의 프로모터 CpG 부위의 많은 부분이 메틸화되면 유전자는 억제된다([51]침묵화된다).대장암은 일반적으로 3~6명의 운전자 돌연변이와 33~66명의 히치하이커 또는 승객 [52]돌연변이가 있다.그러나 암으로의 진행을 일으키는 데 돌연변이보다 전사 억제(침묵)가 더 중요할 수 있다.예를 들어 대장암의 경우 약 600~800개의 유전자가 CpG 섬 메틸화에 의해 전사적으로 억제된다(암에서의 전사 조절 참조).암에서의 전사 억제는 마이크로RNA의 [53]생성 변화와 같은 다른 후생유전 메커니즘에 의해서도 발생할 수 있다.유방암에서 BRCA1의 전사 억제는 BRCA1 프로모터의 과메틸화보다 과잉 생산된 마이크로RNA-182에 의해 더 자주 발생할 수 있다(유방암과 난소암에서 BRCA1의 낮은 발현 참조).
전사 공장
활성 전사 단위는 전사 공장 또는 에크로마틴이라고 불리는 개별 부위의 핵에 집적되어 있습니다.이러한 부위는 관여된 중합효소가 태그 부착 전구체(Br-UTP 또는 Br-U)에서 전사체를 연장하고 태그 부착 신생 RNA를 면역 라벨링함으로써 시각화할 수 있다. 전사 공장은 현장에서의 형광 교배 또는 중합효소에 대한 항체를 사용하여 국소화할 수도 있다.HeLa 세포의 핵플라스마에는 약 10,000개의 공장이 있으며, 그 중 약 8,000개의 중합효소 II 공장과 약 2,000개의 중합효소 III 공장이 있습니다.각 중합효소 II 공장에는 최대 8개의 중합효소가 포함되어 있습니다.대부분의 활성 전사 단위는 하나의 중합효소에만 관련되므로, 각 공장에는 보통 최대 8개의 다른 전사 단위가 있습니다.이러한 유닛은 프로모터 및/또는 인핸서를 통해 관련지어지며,[54] 루프가 요인 주위에 "클라우드"를 형성합니다.
역사
유전물질이 단백질로 구현될 수 있도록 하는 분자는 프랑수아 자코브와 자크 모노에 의해 처음 가설화 되었다.세베로 오초아는 1959년 유전자 코드를 해독하는 데 유용한 폴리뉴클레오티드 포스포릴라아제와 시험관내 RNA를 합성하는 과정을 개발한 공로로 노벨 생리의학상을 수상했다.RNA 중합효소에 의한 RNA 합성은 1965년까지 여러 실험실에서 확립되었다. 그러나, 이러한 효소에 의해 합성된 RNA는 전사를 올바르게 종료하는 데 [citation needed]필요한 추가 인자의 존재를 암시하는 특성을 가지고 있었다.
1972년, 월터 피어스는 말단 효소의 존재를 실제로 증명한 최초의 사람이 되었다.
로저 D. 콘버그는 "진핵생물 [55]전사의 분자 기반에 대한 연구"로 2006년 노벨 화학상을 수상했다.
측정 및 검출
문자 변환은 다양한 방법으로 [citation needed]측정 및 검출할 수 있습니다.
- G-Less 카세트 전사 검사: 프로모터 강도 측정
- Run-off transcription assay: TSS(전사 시작 사이트) 식별
- Nuclear run-on assay: 새로 형성된 트랜스크립트의 상대적 농도를 측정합니다.
- KAS-seq: RNA 중합효소에 의해 생성된 단가닥 DNA를 측정합니다. 1,000개의 [56]세포로 작동할 수 있습니다.
- RNase 보호 분석 및 RNAP ChIP 칩: 활성 전사 부위 검출
- RT-PCR: 전사율과 다를 수 있는 총 또는 핵 RNA 수준의 절대적 농도를 측정한다.
- DNA 마이크로어레이: 전지구적 총 또는 핵 RNA 수준의 상대적 풍요도를 측정합니다. 단, 이것들은 전사율과 다를 수 있습니다.
- 현장 하이브리드화: 스크립트의 존재를 검출합니다.
- MS2 태깅: MS2와 같은 RNA 줄기 루프를 유전자에 포함시킴으로써, 이것들은 새롭게 합성된 RNA에 통합된다.다음으로 스템 루프는 GFP와 MS2 코팅 단백질의 융합을 사용하여 검출할 수 있으며, MS2 스템 루프는 MS2 스템 루프와 높은 친화성, 배열 특이적 상호작용을 가진다.전사 부위에 대한 GFP의 모집은 단일 형광 점으로 시각화된다.이 새로운 어프로치에서는, 트랜스크립션이 불연속 버스트(펄스)로 발생하는 것이 밝혀졌습니다(「트랜스크립션 버스트」를 참조).주목할 만한 현장 기술을 제외하고, 대부분의 다른 방법들은 세포 집단 평균을 제공하며 [57]유전자의 이러한 근본적인 특성을 검출할 수 없다.
- 노던 블롯: 전통적인 방법, 그리고 가장 정량적인 RNA-Seq가 등장할 때까지
- RNA-Seq: 차세대 시퀀싱 기술을 적용하여 전체 전사체를 배열합니다.이 기술을 통해 RNA의 상대적 풍부성을 측정할 수 있을 뿐만 아니라 융합 유전자, 전사 후 편집 및 새로운 스플라이스 사이트와 같은 추가 변이를 검출할 수 있습니다.
- 단세포 RNA-Seq: 조직, 배아 및 암의 RNA를 상세하게 분석할 수 있도록 격리된 세포에서 부분 전사체를 증폭하여 읽습니다.
역문자 변환
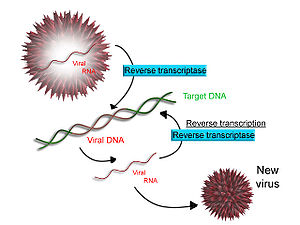
에이즈의 원인인 HIV와 같은 몇몇 바이러스들은 RNA를 DNA로 전사하는 능력을 가지고 있다.HIV는 DNA로 역전되는 RNA 게놈을 가지고 있다.결과 DNA는 숙주 세포의 DNA 게놈과 결합될 수 있다.RNA 템플릿에서 DNA 합성을 담당하는 주요 효소는 역전사효소라고 불린다.
HIV의 경우 역전사효소는 바이러스 RNA 게놈에 상보적인 DNA 가닥(cDNA)을 합성하는 역할을 한다.리보핵산가수분해효소 H는 RNA 가닥을 소화시키고, 역전사효소는 DNA의 상보적인 가닥을 합성하여 이중나선 DNA 구조("cDNA")를 형성한다.cDNA는 숙주세포가 새로운 바이러스 입자로 재결합하는 바이러스 단백질을 생성하도록 하는 효소 인테그레이스에 의해 숙주세포의 게놈에 통합된다.HIV에서는, 그 후에, 숙주 세포는 프로그램 된 세포사멸, 즉 T세포의 [58]아포토시스를 겪습니다.그러나 다른 레트로바이러스에서는 바이러스가 세포 밖으로 싹트면서 숙주세포는 그대로 남아 있다.
몇몇 진핵 세포들은 텔로머라아제라고 불리는 역전사 활성을 가진 효소를 포함하고 있다.텔로머라아제는 선형 염색체의 끝을 길게 하는 역전사효소이다.텔로머라아제는 DNA의 반복되는 배열, 즉 "정크" DNA를 합성하는 RNA 템플릿을 가지고 있습니다.이 반복되는 DNA 배열은 텔로미어라고 불리며 염색체의 "캡"이라고 생각할 수 있습니다.이것은 선형 염색체가 복제될 때마다 짧아지기 때문에 중요하다.염색체 끝에 있는 이 "정크" DNA 또는 "캡"으로, 단축은 염색체 끝에서 더 멀리 떨어져 있는 단백질을 암호화하는 DNA 배열보다는 필수적이지 않은 반복 배열의 일부를 제거한다.
텔로머라아제는 종종 암세포가 중요한 단백질 코드 DNA 염기서열을 잃지 않고 그들의 게놈을 무한히 복제할 수 있도록 하기 위해 암세포에서 활성화된다.텔로머라아제의 활성화는 암세포가 불멸하게 하는 과정의 일부가 될 수 있다.텔로머라아제에 의한 텔로미어 연장을 통한 암의 불멸화 인자는 생체 내 모든 발암성 종양의 90%에서 발생하며, 나머지 10%는 대체 텔로미어 [59]유지 경로인 ALT 또는 Alternative Lengthing of Telomeres를 사용하여 발생하는 것으로 입증되었다.
「 」를 참조해 주세요.
- 인생
- 세포(생물학)
- 세포분열
- DBTSS
- 유전자
- 유전자 조절
- 유전자 발현
- 후생유전학
- 게놈
- 전사의 산물인 mRNA가 폴리펩타이드를 형성하기 위해 번역되는 크릭의 중심 교의, 그리고 반대 과정이 결코 일어나지 않는다고 주장되는 곳
- 유전자 조절
- 긴 비코드 RNA
- 미센스 mRNA
- 스플라이싱 - 전구체 메신저 RNA(pre-mRNA)에서 인트론을 제거하여 메신저 RNA(mRNA)를 만드는 과정
- 문자 변환학
- 번역(생물학)
레퍼런스
- ^ Liu SJ, Nowakowski TJ, Pollen AA, Lui JH, Horlbeck MA, Attenello FJ, He D, Weissman JS, Kriegstein AR, Diaz AA, Lim DA (April 2016). "Single-cell analysis of long non-coding RNAs in the developing human neocortex". Genome Biol. 17: 67. doi:10.1186/s13059-016-0932-1. PMC 4831157. PMID 27081004.
- ^ Li J, Liu C (2019). "Coding or Noncoding, the Converging Concepts of RNAs". Front Genet. 10: 496. doi:10.3389/fgene.2019.00496. PMC 6538810. PMID 31178900.
- ^ a b c 엘드라 P.솔로몬, 린다 R.버그, 다이애나 W. 마틴생물학, 제8판, 국제 학생판톰슨 브룩스/콜ISBN 978-0495317142
- ^ Koonin EV, Gorbalenya AE, Chumakov KM (July 1989). "Tentative identification of RNA-dependent RNA polymerases of dsRNA viruses and their relationship to positive strand RNA viral polymerases". FEBS Letters. 252 (1–2): 42–6. doi:10.1016/0014-5793(89)80886-5. PMID 2759231. S2CID 36482110.
- ^ "DNA Strands". www.sci.sdsu.edu. Archived from the original on 27 October 2017. Retrieved 1 May 2018.
- ^ Berg J, Tymoczko JL, Stryer L (2006). Biochemistry (6th ed.). San Francisco: W. H. Freeman. ISBN 0-7167-8724-5.
- ^ a b c d e f g Watson JD, Baker TA, Bell SP, Gann AA, Levine M, Losick RM (2013). Molecular Biology of the Gene (7th ed.). Pearson.
- ^ Haberle V, Stark A (October 2018). "Eukaryotic core promoters and the functional basis of transcription initiation". Nat Rev Mol Cell Biol. 19 (10): 621–637. doi:10.1038/s41580-018-0028-8. PMC 6205604. PMID 29946135.
- ^ Verheul TC, van Hijfte L, Perenthaler E, Barakat TS (2020). "The Why of YY1: Mechanisms of Transcriptional Regulation by Yin Yang 1". Front Cell Dev Biol. 8: 592164. doi:10.3389/fcell.2020.592164. PMC 7554316. PMID 33102493.
- ^ Spitz F, Furlong EE (September 2012). "Transcription factors: from enhancer binding to developmental control". Nat Rev Genet. 13 (9): 613–26. doi:10.1038/nrg3207. PMID 22868264. S2CID 205485256.
- ^ a b Beagan JA, Pastuzyn ED, Fernandez LR, Guo MH, Feng K, Titus KR, Chandrashekar H, Shepherd JD, Phillips-Cremins JE (June 2020). "Three-dimensional genome restructuring across timescales of activity-induced neuronal gene expression". Nat Neurosci. 23 (6): 707–717. doi:10.1038/s41593-020-0634-6. PMC 7558717. PMID 32451484.
- ^ a b Schoenfelder S, Fraser P (August 2019). "Long-range enhancer-promoter contacts in gene expression control". Nat Rev Genet. 20 (8): 437–455. doi:10.1038/s41576-019-0128-0. PMID 31086298. S2CID 152283312.
- ^ Pennacchio LA, Bickmore W, Dean A, Nobrega MA, Bejerano G (April 2013). "Enhancers: five essential questions". Nat Rev Genet. 14 (4): 288–95. doi:10.1038/nrg3458. PMC 4445073. PMID 23503198.
- ^ Weintraub AS, Li CH, Zamudio AV, Sigova AA, Hannett NM, Day DS, Abraham BJ, Cohen MA, Nabet B, Buckley DL, Guo YE, Hnisz D, Jaenisch R, Bradner JE, Gray NS, Young RA (December 2017). "YY1 Is a Structural Regulator of Enhancer-Promoter Loops". Cell. 171 (7): 1573–1588.e28. doi:10.1016/j.cell.2017.11.008. PMC 5785279. PMID 29224777.
- ^ Lambert SA, Jolma A, Campitelli LF, Das PK, Yin Y, Albu M, Chen X, Taipale J, Hughes TR, Weirauch MT (February 2018). "The Human Transcription Factors". Cell. 172 (4): 650–665. doi:10.1016/j.cell.2018.01.029. PMID 29425488.
- ^ a b Grossman SR, Engreitz J, Ray JP, Nguyen TH, Hacohen N, Lander ES (July 2018). "Positional specificity of different transcription factor classes within enhancers". Proc Natl Acad Sci U S A. 115 (30): E7222–E7230. doi:10.1073/pnas.1804663115. PMC 6065035. PMID 29987030.
- ^ Allen BL, Taatjes DJ (March 2015). "The Mediator complex: a central integrator of transcription". Nat Rev Mol Cell Biol. 16 (3): 155–66. doi:10.1038/nrm3951. PMC 4963239. PMID 25693131.
- ^ Mikhaylichenko O, Bondarenko V, Harnett D, Schor IE, Males M, Viales RR, Furlong EE (January 2018). "The degree of enhancer or promoter activity is reflected by the levels and directionality of eRNA transcription". Genes Dev. 32 (1): 42–57. doi:10.1101/gad.308619.117. PMC 5828394. PMID 29378788.
- ^ Li QJ, Yang SH, Maeda Y, Sladek FM, Sharrocks AD, Martins-Green M (January 2003). "MAP kinase phosphorylation-dependent activation of Elk-1 leads to activation of the co-activator p300". EMBO J. 22 (2): 281–91. doi:10.1093/emboj/cdg028. PMC 140103. PMID 12514134.
- ^ Carullo NV, Phillips I RA, Simon RC, Soto SA, Hinds JE, Salisbury AJ, Revanna JS, Bunner KD, Ianov L, Sultan FA, Savell KE, Gersbach CA, Day JJ (September 2020). "Enhancer RNAs predict enhancer-gene regulatory links and are critical for enhancer function in neuronal systems". Nucleic Acids Res. 48 (17): 9550–9570. doi:10.1093/nar/gkaa671. PMC 7515708. PMID 32810208.
- ^ Lövkvist C, Dodd IB, Sneppen K, Haerter JO (June 2016). "DNA methylation in human epigenomes depends on local topology of CpG sites". Nucleic Acids Res. 44 (11): 5123–32. doi:10.1093/nar/gkw124. PMC 4914085. PMID 26932361.
- ^ Jabbari K, Bernardi G (May 2004). "Cytosine methylation and CpG, TpG (CpA) and TpA frequencies". Gene. 333: 143–9. doi:10.1016/j.gene.2004.02.043. PMID 15177689.
- ^ Steinhaus R, Gonzalez T, Seelow D, Robinson PN (June 2020). "Pervasive and CpG-dependent promoter-like characteristics of transcribed enhancers". Nucleic Acids Res. 48 (10): 5306–5317. doi:10.1093/nar/gkaa223. PMC 7261191. PMID 32338759.
- ^ Bird A (January 2002). "DNA methylation patterns and epigenetic memory". Genes Dev. 16 (1): 6–21. doi:10.1101/gad.947102. PMID 11782440.
- ^ a b c Du Q, Luu PL, Stirzaker C, Clark SJ (2015). "Methyl-CpG-binding domain proteins: readers of the epigenome". Epigenomics. 7 (6): 1051–73. doi:10.2217/epi.15.39. PMID 25927341.
- ^ Vaquerizas JM, Kummerfeld SK, Teichmann SA, Luscombe NM (April 2009). "A census of human transcription factors: function, expression and evolution". Nat. Rev. Genet. 10 (4): 252–63. doi:10.1038/nrg2538. PMID 19274049. S2CID 3207586.
- ^ a b c d Sun Z, Xu X, He J, Murray A, Sun MA, Wei X, Wang X, McCoig E, Xie E, Jiang X, Li L, Zhu J, Chen J, Morozov A, Pickrell AM, Theus MH, Xie H (August 2019). "EGR1 recruits TET1 to shape the brain methylome during development and upon neuronal activity". Nat Commun. 10 (1): 3892. Bibcode:2019NatCo..10.3892S. doi:10.1038/s41467-019-11905-3. PMC 6715719. PMID 31467272.
- ^ a b Kubosaki A, Tomaru Y, Tagami M, Arner E, Miura H, Suzuki T, Suzuki M, Suzuki H, Hayashizaki Y (2009). "Genome-wide investigation of in vivo EGR-1 binding sites in monocytic differentiation". Genome Biol. 10 (4): R41. doi:10.1186/gb-2009-10-4-r41. PMC 2688932. PMID 19374776.
- ^ Bayraktar G, Kreutz MR (April 2018). "Neuronal DNA Methyltransferases: Epigenetic Mediators between Synaptic Activity and Gene Expression?". Neuroscientist. 24 (2): 171–185. doi:10.1177/1073858417707457. PMC 5846851. PMID 28513272.
- ^ Oliveira AM, Hemstedt TJ, Bading H (July 2012). "Rescue of aging-associated decline in Dnmt3a2 expression restores cognitive abilities". Nat Neurosci. 15 (8): 1111–3. doi:10.1038/nn.3151. PMID 22751036. S2CID 10590208.
- ^ Dhayalan A, Rajavelu A, Rathert P, Tamas R, Jurkowska RZ, Ragozin S, Jeltsch A (August 2010). "The Dnmt3a PWWP domain reads histone 3 lysine 36 trimethylation and guides DNA methylation". J Biol Chem. 285 (34): 26114–20. doi:10.1074/jbc.M109.089433. PMC 2924014. PMID 20547484.
- ^ Manzo M, Wirz J, Ambrosi C, Villaseñor R, Roschitzki B, Baubec T (December 2017). "Isoform-specific localization of DNMT3A regulates DNA methylation fidelity at bivalent CpG islands". EMBO J. 36 (23): 3421–3434. doi:10.15252/embj.201797038. PMC 5709737. PMID 29074627.
- ^ Dukatz M, Holzer K, Choudalakis M, Emperle M, Lungu C, Bashtrykov P, Jeltsch A (December 2019). "H3K36me2/3 Binding and DNA Binding of the DNA Methyltransferase DNMT3A PWWP Domain Both Contribute to its Chromatin Interaction". J Mol Biol. 431 (24): 5063–5074. doi:10.1016/j.jmb.2019.09.006. PMID 31634469. S2CID 204832601.
- ^ Bayraktar G, Yuanxiang P, Confettura AD, Gomes GM, Raza SA, Stork O, Tajima S, Suetake I, Karpova A, Yildirim F, Kreutz MR (November 2020). "Synaptic control of DNA methylation involves activity-dependent degradation of DNMT3A1 in the nucleus". Neuropsychopharmacology. 45 (12): 2120–2130. doi:10.1038/s41386-020-0780-2. PMC 7547096. PMID 32726795.
- ^ Boutard, Magali (2016). "Global repositioning of transcription start sites in a plant-fermenting bacterium". Nature Communications. 7: 13783. Bibcode:2016NatCo...713783B. doi:10.1038/ncomms13783. PMC 5171806. PMID 27982035.
- ^ Roeder, Robert G. (1991). "The complexities of eukaryotic transcription initiation: regulation of preinitiation complex assembly". Trends in Biochemical Sciences. 16 (11): 402–408. doi:10.1016/0968-0004(91)90164-Q. ISSN 0968-0004. PMID 1776168.
- ^ Goldman SR, Ebright RH, Nickels BE (May 2009). "Direct detection of abortive RNA transcripts in vivo". Science. 324 (5929): 927–8. Bibcode:2009Sci...324..927G. doi:10.1126/science.1169237. PMC 2718712. PMID 19443781.
- ^ Revyakin A, Liu C, Ebright RH, Strick TR (November 2006). "Abortive initiation and productive initiation by RNA polymerase involve DNA scrunching". Science. 314 (5802): 1139–43. Bibcode:2006Sci...314.1139R. doi:10.1126/science.1131398. PMC 2754787. PMID 17110577.
- ^ Raffaelle M, Kanin EI, Vogt J, Burgess RR, Ansari AZ (November 2005). "Holoenzyme switching and stochastic release of sigma factors from RNA polymerase in vivo". Molecular Cell. 20 (3): 357–66. doi:10.1016/j.molcel.2005.10.011. PMID 16285918.
- ^ Mandal SS, Chu C, Wada T, Handa H, Shatkin AJ, Reinberg D (May 2004). "Functional interactions of RNA-capping enzyme with factors that positively and negatively regulate promoter escape by RNA polymerase II". Proceedings of the National Academy of Sciences of the United States of America. 101 (20): 7572–7. Bibcode:2004PNAS..101.7572M. doi:10.1073/pnas.0401493101. PMC 419647. PMID 15136722.
- ^ Goodrich JA, Tjian R (April 1994). "Transcription factors IIE and IIH and ATP hydrolysis direct promoter clearance by RNA polymerase II". Cell. 77 (1): 145–56. doi:10.1016/0092-8674(94)90242-9. PMID 8156590. S2CID 24602504.
- ^ Milo, Ron; Philips, Rob. "Cell Biology by the Numbers: What is faster, transcription or translation?". book.bionumbers.org. Archived from the original on 20 April 2017. Retrieved 8 March 2017.
- ^ Hodges C, Bintu L, Lubkowska L, Kashlev M, Bustamante C (July 2009). "Nucleosomal fluctuations govern the transcription dynamics of RNA polymerase II". Science. 325 (5940): 626–8. Bibcode:2009Sci...325..626H. doi:10.1126/science.1172926. PMC 2775800. PMID 19644123.
- ^ a b Fitz V, Shin J, Ehrlich C, Farnung L, Cramer P, Zaburdaev V, Grill SW (2016). "Nucleosomal arrangement affects single-molecule transcription dynamics". Proceedings of the National Academy of Sciences. 113 (45): 12733–12738. doi:10.1073/pnas.1602764113. PMC 5111697. PMID 27791062.
- ^ Richardson JP (September 2002). "Rho-dependent termination and ATPases in transcript termination". Biochimica et Biophysica Acta (BBA) - Gene Structure and Expression. 1577 (2): 251–260. doi:10.1016/S0167-4781(02)00456-6. PMID 12213656.
- ^ Lykke-Andersen S, Jensen TH (October 2007). "Overlapping pathways dictate termination of RNA polymerase II transcription". Biochimie. 89 (10): 1177–82. doi:10.1016/j.biochi.2007.05.007. PMID 17629387.
- ^ Cramer, P.; Armache, K.-J.; Baumli, S.; Benkert, S.; Brueckner, F.; Buchen, C.; Damsma, G.E.; Dengl, S.; Geiger, S.R.; Jasiak, A.J.; Jawhari, A. (June 2008). "Structure of Eukaryotic RNA Polymerases". Annual Review of Biophysics. 37 (1): 337–352. doi:10.1146/annurev.biophys.37.032807.130008. ISSN 1936-122X. PMID 18573085.
- ^ http://www.sigmaaldrich.com/US/en/product/sial/h6878 SIGMA-ALDRICH의 8-히드록시퀴놀린.2022-02-15 취득
- ^ Datan E, Minn I, Peng X, He QL, Ahn H, Yu B, Pomper MG, Liu JO (2020). "A Glucose-Triptolide Conjugate Selectively Targets Cancer Cells under Hypoxia". iScience. 23 (9): 101536. Bibcode:2020iSci...23j1536D. doi:10.1016/j.isci.2020.101536. PMC 7509213. PMID 33083765.
- ^ Saxonov S, Berg P, Brutlag DL (January 2006). "A genome-wide analysis of CpG dinucleotides in the human genome distinguishes two distinct classes of promoters". Proceedings of the National Academy of Sciences of the United States of America. 103 (5): 1412–7. Bibcode:2006PNAS..103.1412S. doi:10.1073/pnas.0510310103. PMC 1345710. PMID 16432200.
- ^ Bird A (January 2002). "DNA methylation patterns and epigenetic memory". Genes & Development. 16 (1): 6–21. doi:10.1101/gad.947102. PMID 11782440.
- ^ Vogelstein B, Papadopoulos N, Velculescu VE, Zhou S, Diaz LA, Kinzler KW (March 2013). "Cancer genome landscapes". Science. 339 (6127): 1546–58. Bibcode:2013Sci...339.1546V. doi:10.1126/science.1235122. PMC 3749880. PMID 23539594.
- ^ Tessitore A, Cicciarelli G, Del Vecchio F, Gaggiano A, Verzella D, Fischietti M, Vecchiotti D, Capece D, Zazzeroni F, Alesse E (2014). "MicroRNAs in the DNA Damage/Repair Network and Cancer". International Journal of Genomics. 2014: 820248. doi:10.1155/2014/820248. PMC 3926391. PMID 24616890.
- ^ Papantonis A, Kohro T, Baboo S, Larkin JD, Deng B, Short P, Tsutsumi S, Taylor S, Kanki Y, Kobayashi M, Li G, Poh HM, Ruan X, Aburatani H, Ruan Y, Kodama T, Wada Y, Cook PR (November 2012). "TNFα signals through specialized factories where responsive coding and miRNA genes are transcribed". The EMBO Journal. 31 (23): 4404–14. CiteSeerX 10.1.1.919.1919. doi:10.1038/emboj.2012.288. PMC 3512387. PMID 23103767.
- ^ "Chemistry 2006". Nobel Foundation. Archived from the original on March 15, 2007. Retrieved March 29, 2007.
- ^ Wu, T (April 2020). "Kethoxal-assisted single-stranded DNA sequencing captures global transcription dynamics and enhancer activity in situ". Nature Methods. 17 (5): 515–523. doi:10.1038/s41592-020-0797-9. PMC 7205578. PMID 32251394. S2CID 214810294.
- ^ Raj A, van Oudenaarden A (October 2008). "Nature, nurture, or chance: stochastic gene expression and its consequences". Cell. 135 (2): 216–26. doi:10.1016/j.cell.2008.09.050. PMC 3118044. PMID 18957198.
- ^ Kolesnikova IN (2000). "Some patterns of apoptosis mechanism during HIV-infection". Dissertation (in Russian). Archived from the original on July 10, 2011. Retrieved February 20, 2011.
- ^ Cesare AJ, Reddel RR (May 2010). "Alternative lengthening of telomeres: models, mechanisms and implications". Nature Reviews Genetics. 11 (5): 319–30. doi:10.1038/nrg2763. PMID 20351727. S2CID 19224032.
외부 링크
- 문자 변환 시작을 위한 대화형 Java 시뮬레이션.2011-07-22 Niels Bohr Institute의 Wayback Machine for Life 센터에서 보관.
- 박테리아 바이러스의 프로모터 우위 게임인 전사 간섭에 대한 대화형 Java 시뮬레이션.2011년 8월 26일 Niels Bohr Institute의 Wayback Machine for Life 센터에서 보관.
- 가상 셀 애니메이션 컬렉션, 문자 변환 소개