다니엘 세포
Daniell cell다니엘 셀은 1836년 영국의 화학자이자 기상학자 존 프레데릭 다니엘에 의해 발명된 전기화학 셀의 한 종류로 황산과 아연 전극이 채워진 유리되지 않은 토기 용기를 담근 황산동(II) 용액이 채워진 구리 냄비로 구성되어 있다.그는 볼타이트 더미에서 발견되는 수소 거품 문제를 제거할 방법을 찾고 있었고, 그의 해결책은 첫 번째에 의해 생성된 수소를 소비하기 위해 두 번째 전해질을 사용하는 것이었다.황산에는 황산아연을 치환해도 된다.Daniell 셀은 배터리 개발 초기에 사용되던 기존 기술보다 크게 향상되었습니다.중력 셀 또는 까마귀발 셀이라고 불리는 다니엘 셀의 이후 변형은 1860년대에 칼로라는 이름의 프랑스인에 의해 발명되었고 전기 전신을 위한 인기 있는 선택이 되었다.
다니엘 셀은 또한 국제 단위계에서 기전력의 단위인 볼트의 현대적 정의에 대한 역사적 근거가 됩니다.1881년 국제 전기 기술자 회의에서 제안된 전기 장치의 정의는 다니엘 셀의 기전력이 [1][2]약 1.0V가 되도록 설계되었다.현재 정의에서 25°C에서 다니엘 전지의 표준 전위는 실제로 1.10V이다.[3]
화학
다니엘 셀에서는 구리와 아연 전극이 구리 용액에 침지되어 있다.II) 황산염 및 황산아연양극(부극)에서 아연은 다음과 같은 반작용으로 산화된다.
음극(양극)에서는 다음과 같은 반응에 의해 구리가 환원된다.
- Cu2+
(aq) + 2e− → Cu
(s) . (표준전극 환원전위 +0.199V )
양전하를 띤 구리 이온은 화학 에너지의 감소에 의해 양전극 쪽으로 이동한다는 점에 유의하십시오.
전체 반응은 다음과 같습니다.
이러한 과정을 통해 음극에 고체 구리가 축적되고 아연 전극이 아연 양이온으로 용액에 부식됩니다.
강의실 시연에서는 단순성 때문에 두 개의 반전지로 알려진 다니엘 셀의 형태가 종종 사용됩니다.두 개의 반전지는 각각 위에서 설명한 반응의 절반을 지원합니다.와이어와 전구가 두 전극을 연결할 수 있습니다.아연 금속의 산화에 의해 생성된 여분의 전자는 양극에서 "밀려나가"고, 따라서 음극인 와이어를 통해 이동하며 구리 이온의 감소에 의해 소비되는 구리 음극으로 "끌어당겨"집니다.그러면 전구를 밝히는 전류가 공급됩니다.
어느 반작용도 다른 반작용과 독립적으로 일어나지 않기 때문에, 두 반세포는 이온이 자유롭게 이동할 수 있도록 연결되어야 한다.황산염 이온의 흐름을 허용하면서 두 용액을 분리하기 위해 다공질 장벽 또는 세라믹 디스크를 사용할 수 있다.절반 셀을 완전히 다른 두 개의 개별 용기에 넣을 때, 소금 브릿지가 종종 두 셀을 연결하는 데 사용됩니다.소금 브릿지는 일반적으로 높은 농도의 질산칼륨을 포함하고 있습니다.상기 방전 중의 습식 전지에서는 Zn2+
이온의 증가를 평형화하기 위해 염교 내의 질산 음이온이 아연 반전지 내로 이동한다.동시에 구리 전극에 침전되는 Cu2+
이온을 치환하기 위해 소금 브릿지로부터의 칼륨 이온이 구리 하프 셀 안으로 이동한다.
전원의 전위차가 셀 emf(1.1V)보다 약간 높아지도록 전지를 전위 전원(예: 배터리 충전기)에 연결하면 전류 흐름이 역전되어 반응이 다음과 같이 될 수 있다.
- Zn2+
(aq) + 2e− → Zn
(s) - Cu
(s) → Cu2+
(aq) + 2e−
또는,
- Zn2+
(aq) + Cu
(s) → Zn
(s) + Cu2+
(aq)
따라서 다니엘 셀에서 유입되는 전류가 작을 경우 다니엘 셀은 가역적입니다.다니엘 셀은 전기를 '발생'하거나 전극을 소비하거나 전기를 저장하는 데 사용할 수 있습니다.
발전
다니엘의 원래 구조
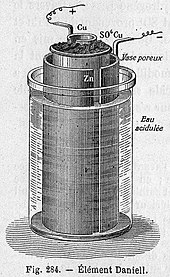
다니엘은 [6]1836년에 처음으로 그의 감방을 만들었다.그의 원래 디자인은 직경 3.5인치 구리 실린더로 구성되었다.다수의 구멍이 뚫린 구리 디스크가 위에서 아래로 오목한 실린더를 가로질러 배치되었다.구멍이 뚫린 구리 원반 중앙의 큰 구멍에 소 굴렛 튜브가 매달려 있었다.나무 받침에 매달린 이 소굴관 안에는 지름 0.5인치짜리 아연 막대가 매달려 있다.구리 용기에는 황산구리를 적신 황산용액이 다공 원반 높이 이상으로 채워져 있었다.소굴관은 황산용액으로 채워져 있었다.구멍이 뚫린 구리 디스크에 황산구리 결정을 쌓아 올려 용액을 포화 상태로 유지했습니다.소굴은 이온을 통과시키는 다공질 막 역할을 한다.다니엘은 실용적인 편의를 위해 소 굴레 대신 다공질 토기 튜브를 사용할 수 있지만 이 배열은 더 적은 전력을 생산할 것이라고 말한다.다니엘은 구리를 백금으로, 황산구리를 염화 백금으로 대체하자는 제안도 내놓았지만, 그는 "이러한 배열은 완벽할 것이지만, 일반 용도에는 너무 비싸다"[7]고 말했다.전신에 널리 쓰이게 된 것은 다공질 항아리 형태입니다.
다공질 포트 셀
다공질 포트 셀은 황산아연 용액이 포함된 다공질 토기 포트에 담근 중앙 아연 양극으로 구성됩니다.다공질 포트는 구리 [clarification needed]캔에 포함된 황산구리 용액에 담그는데, 이는 셀의 음극 역할을 합니다.다공질 장벽을 사용하면 이온이 통과할 수 있지만 용액이 혼합되는 것을 막을 수 있습니다.이 장벽이 없으면 전류가 유입되지 않으면 구리 이온이 아연 양극으로 표류하여 전류를 생성하지 않고 감소하므로 배터리 수명이 [8]단축됩니다.황산을 황산아연으로 대체한 것이 J. F.의 혁신이었다.1853년에 풀러.그것은 [9]세포의 수명을 연장시킨다.
시간이 지남에 따라 구리 축적은 토기 장벽의 모공을 막아 배터리 수명을 단축시킵니다.그럼에도 불구하고 전해질이 절연체인 수소가 아닌 전도체인 구리를 음극에 퇴적시켰기 때문에 다니엘 셀은 Voltaic 파일보다 더 길고 신뢰할 수 있는 전류를 제공한다.그것은 또한 더 안전하고 덜 부식성이 있다.약 1.1볼트의 동작전압으로 1860년대 [10]후반 르클랑제 셀로 대체될 때까지 전신망에서 널리 사용되었습니다.
중력 전지
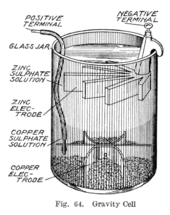
1860년대 중에, 칼로라는 이름의 프랑스인이 다공질 [10]장벽이 없는 다니엘 세포 변형을 발명했다.대신 황산아연 층이 황산구리 층 위에 있고, 두 액체는 종종 증발을 방지하기 위해 기름 층이 위에 추가되어 서로 다른 밀도로 분리되어 있습니다.이렇게 하면 시스템의 내부 저항이 감소하므로 배터리가 더 강한 전류를 생성합니다.
중력 전지라고 불리는 이 변형은 구리 음극이 바닥에 놓여 있고 아연 양극이 황산 아연 층의 테두리 아래에 매달려 있는 유리 병으로 구성되어 있습니다.황산구리 결정을 음극과 병 주위에 산란시킨 후 증류수를 채운다.전류가 흐를 때 양극 주위에 황산아연 용액층이 형성된다.이 상부층은 낮은 밀도와 셀의 극성으로 인해 하부 황산구리층과 분리되어 있습니다.중력전지의 단점은 확산에 의해 두 용액이 혼합되는 것을 막기 위해 지속적으로 전류를 끌어내야 하기 때문에 간헐적으로 사용하기에 적합하지 않다는 것이다.또한 전류가 너무 많이 유입되면 무결성 상실에 취약하여 층이 혼합될 수 있습니다.
전극의 독특한 모양 때문에 크로풋 셀이라고 불리기도 하는 이 배열은 대형 멀티셀 배터리에 비해 비용이 적게 들며 미국과 영국의 전신 네트워크에서 빠르게 선택되는 배터리가 되었습니다.대부분의 전신선이 모터 발전기에 의해 전력을 공급받기 시작한 후에도 중력 배터리는 적어도 [11]1950년대까지는 국부 회로에 전력을 공급하는 방식으로 계속 사용되었다.전신업계에서 이 배터리는 종종 전신노동자가 직접 현장에서 조립하여 소모된 부품을 [12]교체하여 교체할 수 있었습니다.황산 아연 층은 진한 파란색 황산동 층과 대조적으로 투명하며, 이를 통해 정비사는 배터리 수명을 한눈에 확인할 수 있습니다.한편, 이 설정에서는, 배터리를 고정 어플라이언스에서만 사용할 수 있습니다.그렇지 않으면, 용액이 혼재하거나 유출되는 일이 있습니다.
전기금속에 사용
새의 세포
다니엘 세포의 변형은 1837년 가이의 병원 의사 골딩 버드에 의해 발명되었는데, 골딩 버드는 용액을 분리하기 위해 파리 장벽의 회반죽을 사용했습니다.이 세포에 대한 새의 실험은 전기 금속학의 새로운 분야에 어느 정도 중요했지만, 버드 자신은 이 분야를 추구하지 않았습니다. 그의 관심은 전기 치료에 있었습니다.Bird의 실험에서 놀라운 결과는 금속 전극과 접촉하지 않고 다공질 석고와 금속 전극을 통해 흐르는 정맥에 구리가 퇴적된 것입니다.사실, 마이클 패러데이를 포함한 전기화학 연구자들이 처음에는 이 사실을 믿지 않았다는 것은 매우 놀라운 일이다.Bird 본인은 결과를 확신하기 전에 구리 "수염"의 성장을 통해 의도치 않은 접촉이 없는지 그의 장비를 주의 깊게 조사해야 했다.구리와 다른 금속의 퇴적은 이전에 언급되었지만, 이전에는 항상 금속 [13][14]전극에 금속이 있었습니다.
일렉트로타이핑
1838년 리버풀의 악기 제조업체인 존 댄서는 구리 도금용 다니엘 셀의 독특한 특징을 상업적으로 최초로 이용했다.현재는 일렉트로타이핑이라고 알려진 공정에서 그는 다공질 장벽을 금형으로 사용함으로써 원하는 형태로 물체를 만들 수 있다는 것을 알게 되었다.하지만 다른 많은 사람들은 같은 발견을 했고 토마스 스펜서와의 특허 분쟁에서 버드가 이 원리에 대한 우선권을 가지고 있다는 것이 지적되었다.전기 타이핑의 발명에 대한 공적은 보통 러시아의 모리츠 폰 [13]야코비에게 돌아간다.
「 」를 참조해 주세요.
레퍼런스
- ^ Borvon, Gérard (September 10, 2012). "History of the electrical units". Association S-EAU-S.
- ^ Hamer, Walter J. (January 15, 1965). Standard Cells: Their Construction, Maintenance, and Characteristics (PDF). National Bureau of Standards Monograph #84. US National Bureau of Standards.
- ^ Spencer, James N.; Bodner, George M.; Rickard, Lyman H. (2010). Chemistry: Structure and Dynamics (Fifth ed.). John Wiley & Sons. p. 564. ISBN 9780470587119.
- ^ Michael Clugston, Rosalind Flemming, Advanced Chemistry, 224, Oxford University Press, 2000 ISBN 0199146330.
- ^ 미국 표준, 아연 및 그 합금국, 페이지 40, 미국 정부 인쇄국, 1931 OCLC 954241601.
- ^ 엘리자베스 H. Oakes, STS 사이언티스트의 A to Z, 페이지 72, Infobase Publishing, 2009 ISBN 1438109253.
- ^ John Frederic Daniell, An Study of Chemical Philosophics, 504–505, John W. Parker, 1843 OCLC 315534231(1839판 OCLC 7841489쪽 438-439쪽)
- ^ Giorgio Carboni, 전기화학 실험; 2010년 7월 30일에 마지막으로 접속.
- ^ Thomas Kingston Derry, Trevor Iltyd Williams, A Short History of Technology from the Early Times to A.D. 1900, 611, Courier Corporation, 1960 ISBN 9780486274720.
- ^ a b James B. Calvert. "The Electromagnetic Telegraph". Archived from the original on 2007-08-04. Retrieved 2010-07-30.
- ^ Tools of Telegraphy Archived 2011-07-23 Wayback Machine, Telegraph Lore, 2010년 7월 30일 최종 액세스
- ^ Gregory S. Raven, Recemptions of a Narrow Gauge Lightninger, 2011-07-23 Archived at the Wayback Machine, 2010년 7월 30일에 마지막으로 액세스.
- ^ a b Watt, Alexander; Philip, Arnold (2005). Electroplating and Electrorefining of Metals. Watchmaker Publishing. pp. 90–92. ISBN 1929148453. 1889년 단행본의 전재.
- ^ 골딩버드, 영국과학진흥회 제7차 회의 보고서, 제6권 (1837년), 페이지 45, 런던: J. 머레이, 1838.
추가 정보
- Saslow, Wayne M. (1999), "Voltaic cells for physicists: Two surface pumps and an internal resistance", American Journal of Physics, 67 (7): 574–583, Bibcode:1999AmJPh..67..574S, doi:10.1119/1.19327
- Lester, James C.; Vicari, Rosa Maria; Paraguaçu, Fábio (2004), Lester, James C.; Vicari, Rosa Maria; Paraguaçu, Fábio (eds.), A Qualitative Model of Daniell Cell for Chemical Education, Lecture Notes in Computer Science, vol. 3220, doi:10.1007/b100137, hdl:10092/340, ISBN 978-3-540-22948-3, S2CID 24433795