수은 전지
Mercury battery수은 배터리(수은 산화물 전지, 수은 전지, 버튼 전지 또는 루벤-몰러리라고도[1] 함)는 비충전식 전기화학 배터리, 1차 전지입니다.수은 배터리는 알칼리성 전해질에서 산화수은과 아연 전극 사이의 반응을 사용합니다.방전 시 전압은 1.35V로 실질적으로 일정하게 유지되며 용량은 비슷한 크기의 아연-탄소 배터리보다 훨씬 큽니다.수은 배터리는 시계, 보청기, 카메라, 계산기용 버튼 셀 모양과 다른 용도용 큰 형태로 사용되었습니다.
제2차 세계대전 중과 이후 한동안, 수은으로 만들어진 배터리는 휴대용 전자기기의 인기 있는 동력원이 되었다.독성 수은의 함량과 폐기 환경에 대한 우려로 인해, 현재 많은 나라에서 [2]수은 배터리의 판매가 금지되어 있다.ANSI와 IEC 모두 수은 배터리에 대한 표준을 철회했습니다.
역사
산화수은-아연 [3]전지 시스템은 19세기부터 알려졌지만, 사무엘 루벤이 금속 탐지기, 군수품, 그리고 무전기 [1][4]같은 군사 용도에 유용한 균형 잡힌 수은 전지를 개발한 1942년까지 널리 사용되지 않았다.배터리 시스템은 긴 저장 수명(최대 10년)과 안정적인 전압 출력이 장점이었다.제2차 세계대전 이후 배터리 시스템은 심장 박동기와 보청기와 같은 소형 전자기기에 널리 적용되었다.산화 수은 배터리 크기의 축소 단추를 세포 보청기와 전자 손목 시계 등, 원통형 형태 휴대용 전자 기기, 네모난 배터리 트랜지스터 radios,[5]과 큰 멀티셀 팩 천장 기중기 라디오 원격 제어와 같은 산업적 응용에 이용되었던에 이용되었던 다양한 성격의에서 만들어졌다. sy미국에서 산화수은 배터리는 P. R. Mallory and Co Inc.(현 Duracell), 유니언 카바이드 코퍼레이션(옛 배터리 부문은 Energizer Holdings로 불림), RCA Corporation 및 Burgess Battery Company 등의 회사에 의해 제조되었습니다.
화학
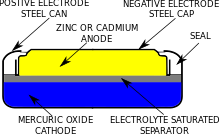
수은배터리는순수은을사용합니다.II) 산화물(HgO), 일명 수은산화물(mercuric oxide) 또는 HgO와 이산화망간(MnO2)을 음극으로 혼합한 것.산화수은은 비전도체이기 때문에 흑연과 혼합되어 있습니다.흑연은 또한 수은이 큰 물방울로 모이는 것을 방지하는 데에도 도움이 됩니다.음극에서의 반반응은 다음과 같습니다.[4]
(표준 전위는 +0.0977V)
양극은 아연(Zn)으로 만들어지며 전해질을 적신 종이층이나 다른 다공질 물질로 음극에서 분리됩니다. 이를 소금 브릿지라고 합니다.양극에서는 두 가지 반작용이 발생합니다.첫 번째 단계는 전기화학 반응 [4]단계로 구성됩니다.
다음 화학 반응 단계:산화 작용은 [4]양극에서 발생합니다.
전체 양극의 반감소:[4]
배터리의 전체적인 반응은 다음과 같습니다.
즉, 방전 중에 아연이 산화(전자를 잃음)되어 산화아연(ZnO)이 되고, 수은산화수은이 환원(전자 획득)되어 원소수은이 된다.세포에 약간의 여분의 산화수은을 넣어 수명이 [4]다한 수소가스의 진화를 막는다.
전해질
전해질로서 수산화나트륨 또는 수산화칼륨을 이용한다.수산화 나트륨 셀은 낮은 방전 전류에서 거의 일정한 전압을 가지므로 보청기, 계산기 및 전자 시계에 이상적입니다.수산화칼륨 셀은 높은 전류에서 정전압을 공급하여 플래시가 있는 사진 카메라 및 백라이트가 있는 시계와 같이 전류 서지를 필요로 하는 애플리케이션에 적합합니다.수산화칼륨 세포는 또한 낮은 온도에서 더 나은 성능을 발휘합니다.수은 전지는 10년까지 [4]매우 긴 유통기한을 가지고 있다.
산화수은 및 카드뮴
다른 형태의 수은 배터리는 산화수은과 카드뮴을 사용한다.약 0.9V의 단자 전압이 훨씬 낮기 때문에 에너지 밀도가 낮지만 최대 180℃의 특수 설계로 온도 범위가 넓습니다.카드뮴은 알칼리 전해질에서 용해도가 낮기 때문에 저장 [4]수명이 길다.이 유형의 12V 배터리는 이전에는 주택용 연기 감지기에 사용되었습니다.셀의 직렬 스택으로 설계되었으며, 여기서 한 셀은 용량이 감소하여 매우 뚜렷한 2단계 전압 방전 특성을 보였습니다.수명이 다하면 이 작은 셀이 먼저 방전되어 배터리 단자 전압이 0.9V 급강하합니다.이를 통해 대용량 셀이 장치를 정상적으로 [6]작동시키는 동안 배터리를 교체해야 한다는 사실을 사용자에게 경고할 수 있는 매우 예측 가능하고 반복 가능한 방법을 제공했습니다.
전기적 특성
수은을 사용한 수은전지(II) 산화물 음극은 방전 곡선이 매우 평평하여 전압이 급격히 떨어질 때까지 약 5%의 수명까지 1.35V(개방회로) 전압을 일정하게 유지합니다.전압은 광부하 시, 그리고 넓은 온도 범위에 걸쳐 몇 년 동안 1% 이내로 유지되므로 전자 기기 및 사진 [7]광도계에서 수은 배터리의 전압 기준으로 유용합니다.
산화수은과 이산화망간이 혼합된 캐소드가 있는 수은 배터리는 출력 전압이 1.4V이고 방전 [4]곡선이 더 기울어져 있습니다.
제품 금지
1991년 유럽위원회 지침 91/157은 회원국들이 채택할 때 수은 25mg 이상의 수은을 포함하는 특정 유형의 배터리 또는 알칼리 배터리의 경우 수은 중량에 의해 0.025% 이상 함유된 배터리의 판매를 금지했다.1998년에는 수은 [2]함유량이 0.005% 이상인 세포까지 사용이 금지되었다.
1992년 뉴저지 주는 수은 배터리의 판매를 금지했다.1996년 미국 의회는 수은 함유 배터리의 추가 판매를 금지하는 수은 함유 및 충전식 배터리 관리법을 통과시켰습니다(단추 셀당 최대 25mg의 수은을 제외).제조사가 폐배터리 및 재활용 [8][9]시설을 제공하는 경우, 수은이 함유된 대형 배터리가 계속 생산될 수 있습니다.
대체품
수은 산화물 배터리의 판매 금지는 사진작가들에게 많은 문제를 일으켰는데, 그들의 장비는 종종 그들의 유리한 방전 곡선과 긴 수명에 의존했다.사용되는 대안으로는 유사한 방전 곡선, 고용량, 그러나 훨씬 짧은 수명(수개월)과 건조한 기후에서 낮은 성능의 아연-공기 배터리, 전압이 평생에 걸쳐 크게 변화하는 알칼리 배터리, 높은 전압(1.55V)과 매우 평평한 방전 곡선을 가진 산화은 배터리 등이 있습니다.y 새로운 전압으로 미터기를 재교정한 후, 비용이 많이 들지만 가장 좋은 교체품입니다.
전압 강하 숏키 또는 게르마늄 다이오드가 있는 특수 어댑터를 사용하면 수은 배터리용으로 설계된 기기에 산화은 배터리를 사용할 수 있습니다.전압 강하는 전류 흐름의 비선형 함수이므로 전류 흐름이 크게 변화하는 애플리케이션에 대해 다이오드가 매우 정확한 솔루션을 생성하지 못합니다.기존 CdS 광도계에 의해 도출된 전류는 일반적으로 10μA ~ 200μA 범위(예: Minolta SR-T 장비 시리즈)입니다.SMD 트랜지스터[10] 또는 집적회로를[11] 이용한 다양한 종류의 능동전압조절회로가 고안되었지만 좁은 배터리실 공간에 통합하기가 어려운 경우가 많습니다.교환은 1개의 배터리 셀에 의해 생성된 이미 매우 낮은 전압에서 최소한의 전압 강하를 유지하면서 동작해야 합니다.기존의 광도계나 카메라에는[11] 전원 스위치가 없기 때문에 초저전력(ULP) 또는 초저전력(XLP) 설계가 필요합니다.또한 많은 오래된 장치들은 섀시를 음극 단자가 아닌 배터리의 양극 단자에 연결합니다. 이 단자를 변경할 수 없는 경우 필요한 음극 전압 레귤레이터 설계로 인해 적합한 전자 [11]부품의 선택이 더욱 줄어듭니다.
아연 배터리에 사용
이전에는 건전지의 아연 양극을 수은과 혼합하여 배터리 수명을 단축하는 전해질과 아연의 부작용을 방지했습니다.수은은 배터리의 화학 반응에 관여하지 않았다.제조업체는 순도 높은 아연 등급으로 변경되었기 때문에 더 이상 혼합이 필요하지 않으며 건조 셀에서 수은이 제거됩니다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b Salkind, Alvin J.; Ruben, Samuel (1986). "Mercury Batteries for Pacemakers and Other Implantable Devices". Batteries for Implantable Biomedical Devices. Springer US. pp. 261–274. doi:10.1007/978-1-4684-9045-9_9. ISBN 978-1-4684-9047-3.
- ^ a b Hunter, Rod; Muylle, Koen J., eds. (1999). European Community Deskbook. An ELI deskbook - ELR - The Environmental Law Reporter. Environmental Law Institute. p. 75. ISBN 0-911937-82-X.
- ^ Clarke, Charles Leigh (1884-06-06). Galvanic battery. US Patent 298175. [1]
- ^ a b c d e f g h i Linden, David (2002). "Chapter 11". In Reddy, Thomas B. (ed.). Handbook Of Batteries (3 ed.). New York: McGraw-Hill. ISBN 0-07-135978-8.
- ^ "Engineering data - Energizer No. E146X" (PDF). Energizer. Archived (PDF) from the original on 2018-11-18. Retrieved 2019-05-11.
- ^ Crompton, Thomas Roy. Battery reference book. pp. 5–23.
- ^ Wilson, Anton (2004). "Anton Wilson's Cinema Workshop". American Cinematographer. p. 137. ISBN 0-93557826-9.
- ^ Kreith, Frank; Tchobanoglous, George (2002). Handbook of solid waste management. McGraw-Hill Professional. pp. 6–34. ISBN 0-07-135623-1.
- ^ "IMERC Fact Sheet: Mercury Use in Batteries". Northeast Waste Management Officials' Association. January 2010. Retrieved 2013-06-20.
- ^ Paul, Matthias R. (2009-03-14). "Minolta SR-T Batterieadapter" [Using a 7×7 mm SMD transistor-based low-side voltage regulator circuit as Mercury battery replacement]. Minolta-Forum (in German). Archived from the original on 2016-03-27. Retrieved 2011-02-26.
- ^ a b c Paul, Matthias R. (2005-12-12). "Minolta SR-T Batterieadapter" [Using a Bandgap voltage reference as Mercury battery replacement]. Minolta-Forum (in German). Archived from the original on 2016-10-11. Retrieved 2011-02-26.