인산염
Phosphide화학에서 인산염은 P3− 이온이나 그에 상응하는 것을 포함하는 화합물이다. 많은 다른 인산염들이 알려져 있고, 구조는 매우 다르다.[1] 가장 일반적으로 2진 인산염에서 만나는 물질, 즉 인과 덜 전기적인 원소로만 구성된 물질이다. 다수는 음이온 사슬이나 인의 군집으로 구성된 고형분인 폴리인산화물이다. 인산염은 Hg, Pb, Sb, Bi, Te, Po를 제외한 대부분의 덜 전기적인 원소로 알려져 있다.[2] 마지막으로, 어떤 인산염은 분자다.
이항인산화물
2진 인산염은 인과 다른 한 원소를 포함한다. 그룹 1 인산염의 예로는 인산나트륨(NaP3)이 있다. 다른 주목할 만한 예로는 알루미늄 인산염(AlP)과 칼슘 인산염(CaP32)이 있는데, 이는 가수분해 시 유독 인산염을 방출하는 경향을 악용한 것이다. 인산 마그네슘(MgP32)도 습기에 민감하다. 인듐인산화(InP)와 갈륨인산화(GaP)는 반도체로 사용되며, 종종 관련 비소를 조합하여 사용된다.[3] 구리 인산염(CuP3)은 인산염에 대한 희귀한 스토이치측정법을 보여준다. 이 종들은 모든 용매에서 용해되지 않는다 - 그들은 3차원 고체 상태의 폴리머이다. 전기 금속을 사용하는 사람의 경우 물질은 다음과 같이 가수 분해된다.
- Ca3P2 + 6 H2O → 3 Ca(OH)2 + 2 PH3
폴리인산화물
폴리인산화물은 P-P 결합을 함유하고 있다. 가장 단순한 폴리인산화물은 P 이온을4−
2 포함한다. 다른 것들은 성단 P3−
11 이온과 중합체 체인 음이온(예: 나선형(P−
)
n 이온)과 복잡한 시트 또는 3-D 음이온을 포함한다.[4] 구조물의 범위는 광범위하다. 칼륨은 KP3, KP43, KP54, KP, KP46, KP37, KP, KP311 등 9개의10.315 인산염을 가지고 있다. 니켈의352542 모노 인산염과 폴리인산염은12523 다음과 같이 8가지도 존재한다.[2]
KP에서
4
3 발견된 P와4−
3 KP에서54 발견된 P라는5−
4 두 개의 폴리인산 이온은 두 화합물을 파라마그네틱으로 만드는 발란스 전자의 홀수가 있는 급진 음이온이다.[2]
인산염 및 폴리인산염 물질의 준비
인산염 화합물을 준비하는 방법에는 여러 가지가 있다. 한 가지 일반적인 방법은 불활성 대기 조건이나 진공 상태에서 금속과 적색 인(P)을 가열하는 것이다. 원칙적으로 모든 금속 인산염과 폴리인산염은 원소 인과 각각의 금속 원소에서 기압계 형태로 합성할 수 있다. 그러나 몇 가지 문제로 합성이 복잡하다. 국소 과열로 발열반응이 폭발적으로 나타나는 경우가 많다. 산화 금속 또는 심지어 금속 외면의 산화 층은 인광화를 시작하기 위해 극도의 그리고 허용할 수 없을 정도로 높은 온도를 야기한다.[5] 니켈 인산염을 생성하기 위한 열수 반응은 순수하고 잘 결정화된 니켈 인산 화합물인 NiP와2 NiP를125 생성했다. 이 화합물들은 NiCl2/12 사이의 고체-액체 반응을 통해 합성되었다.각각 2002 °C에서 24시간, 48시간 동안 HO와 적인.[6]
금속 인산염은 또한 금속 할로겐과 트리스(트리메틸실릴)인산염의 반응에 의해 생성된다. 이 방법에서 할라이드는 휘발성 트리메틸릴 염화물로 해방된다.
적인, 에산화칼륨으로부터 KP를216 준비하는 방법이 보고되었다.[7]
분자 인산염
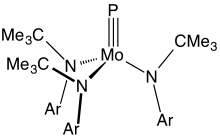
금속과 인 사이의 삼중 결합을 가진 화합물은 드물다. 주요 예로는 R이 부피가 큰 유기물 대체물인 3Mo(P)(NR2)라는 공식이 있다.[8]
유기인산화물
많은 유기인산염들이 알려져 있다. 일반적인 예로는 RPM이라는2 공식이 있는데 여기서 RPM은 유기 대체물이고 M은 금속이다. 한 예로 디페닐인산화리튬이 있다. 진틀 성단3−
7 P는 다양한 알칼리 금속 유도체로 얻는다.
자연적 예
광물 슈레이버사이트(Fe,Ni)3P는 일부 운석에서는 흔히 볼 수 있다.
참조
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ a b c 본 슈링, H.G.와 Hönle , W. (1994년) 무기화학 백과사전의 "인산염 - 고체 상태의 화학" R. 브루스 킹(에드). 존 와일리 & 선즈 ISBN 0-471-93620-0
- ^ Blackman, C. S.; Carmalt, C. J.; O'Neill, S. A.; Parkin, I. P.; Molloy, K. C.; Apostolico, L. (2003). "Chemical vapour deposition of group Vb metal phosphide thin films" (PDF). Journal of Materials Chemistry. 13 (8): 1930. doi:10.1039/b304084b.
- ^ Jeitschko, W.; Möller, M. H. (1987). "Phosphides and Polyphosphides of the Transition Metals". Phosphorus and Sulfur and the Related Elements. 30 (1–2): 413–416. doi:10.1080/03086648708080608.
- ^ von Schnering, Hans-Georg; Hönle, Wolfgang (1988). "Bridging Chasms with Phosphides". Chemical Reviews. 88: 243–273. doi:10.1021/cr00083a012.
- ^ Liu, Zongyi; Huang, Xiang; Zhu, Zhibin; Dai, Jinhui (2010). "A simple mild hydrothermal route for the synthesis of nickel phosphide powders". Ceramics International. 36 (3): 1155–1158. doi:10.1016/j.ceramint.2009.12.015.
- ^ Dragulescu-Andrasi, Alina; Miller, L. Zane; Chen, Banghao; McQuade, D. Tyler; Shatruk, Michael (March 14, 2016). "Facile Conversion of Red Phosphorus into Soluble Polyphosphide Anions by Reaction with Potassium Ethoxide". Angewandte Chemie International Edition. 55 (12): 3904–3908. doi:10.1002/anie.201511186. PMID 26928980.
- ^ Cossairt, B. M.; Piro, N. A.; Cummins, C. C. (2010). "Early-Transition-Metal-Mediated Activation and Transformation of White Phosphorus". Chemical Reviews. 110 (7): 4164–77. CiteSeerX 10.1.1.666.8019. doi:10.1021/cr9003709. PMID 20175534.