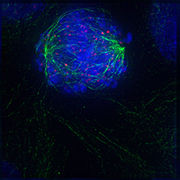
유사분열
Mitosis



a. 비 dividing구
b. 분열을 준비하는 핵 (첨탑 단계)
c. 유사분열 수치를 보이는 세포 분열
e. 분열 직후의 한 쌍의 딸 세포
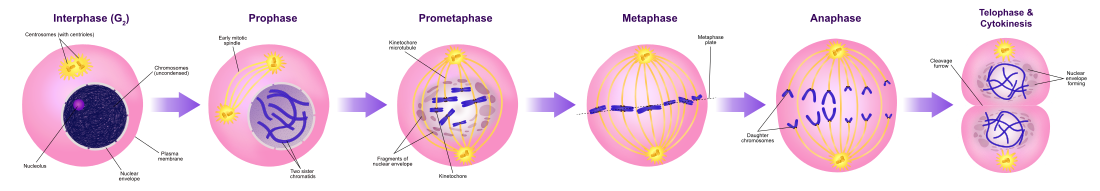
유사분열(/ma ɪˈ to ɪs ʊs/)은 복제된 염색체가 두 개의 새로운 핵으로 분리되는 세포 주기의 한 부분입니다.유사분열에 의한 세포 분열은 전체 염색체 수가 유지되는 유전적으로 동일한 세포를 생성하는 등분화입니다.[1][2]유사분열은 (DNA 복제가 일어나는 동안) 단계간의 S 단계에 선행하고 텔로파아제와 사이토카인이 뒤따릅니다; 이것은 한 세포의 세포질, 소기관 그리고 세포막을 이 세포 성분들의 거의 동등한 공유를 포함하는 두 개의 새로운 세포로 나눕니다.[3]유사분열의 다른 단계들은 모두 세포 주기의 유사분열 단계(M상)를 정의합니다. 즉, 모세포를 유전적으로 동일한 두 개의 딸 세포로 분할하는 것입니다.[4]
유사분열의 과정은 한 세트의 활동의 완료와 다음 활동의 시작에 해당하는 단계로 나뉩니다.이 단계들은 (식물 세포에 특화된) 전단계, 전단계, 전단계, 전단계, 전단계, 전단계, 전단계, 전단계, 전단계입니다.유사분열 동안, 이미 복제된 염색체들은 각 염색체의 한 복사본을 세포의 반대편으로 끌어당기는 방추 섬유에 응축되고 부착됩니다.[5]그 결과 유전적으로 동일한 두 딸핵이 탄생했습니다.나머지 세포는 사이토카인에 의해 계속 분열되어 두 개의 딸 세포를 생성할 수 있습니다.[6]유사분열의 다양한 단계들은 라이브 세포 이미징을 사용하여 실시간으로 시각화될 수 있습니다.[7]
유사분열에서 오류가 발생하면 정상적인 두 개의 세포 대신 세 개 이상의 딸 세포가 생성될 수 있습니다.이것은 각각 3극 유사분열과 다극 유사분열이라고 불립니다.이러한 오류는 이식에 실패하는 생존 불가능한 배아의 원인이 될 수 있습니다.[8]유사분열 동안의 다른 오류는 유사분열 재앙, 세포 자멸(프로그램화된 세포 사멸) 또는 돌연변이를 유발할 수 있습니다.특정한 종류의 암은 그러한 변이로부터 발생할 수 있습니다.[9]
유사분열은 진핵세포에서만 일어나고 유기체마다 다릅니다.[10]예를 들어, 동물 세포는 염색체가 분리되기 전에 핵 외피가 분해되는 개방형 유사분열을 겪는 반면, 곰팡이 세포는 염색체가 온전한 세포 핵 안에서 분열되는 폐쇄형 유사분열을 겪습니다.[11][12]대부분의 동물 세포는 유사분열을 시작할 때 구형에 가까운 형태를 채택하기 위해 유사분열 세포 라운딩으로 알려진 형태 변화를 겪습니다.대부분의 인간 세포는 유사분열 세포 분열로 생성됩니다.중요한 예외는 감수분열에 의해 생성되는 생식체 – 정자와 난자 세포 – 를 포함합니다.핵이 없는 원핵생물, 박테리아 그리고 고균은 이항핵분열이라고 불리는 다른 과정에 의해 나뉩니다.[13]
디스커버리
세포 분열에 대한 다양한 기술들은 다양한 정도의 정확도를 가지고 18세기와 19세기에 이루어졌습니다.[14]1835년 독일의 식물학자 휴고 폰 몰(Hugo von Mohl)은 녹조인 클라도포라 사구체타(Cladophora glomerata)에서 세포 분열을 설명하면서 세포의 증식이 세포 분열을 통해 일어난다고 말했습니다.[15][16][17]1838년, 마티아스 야콥 슐라이덴은 "식물에서 세포 증식을 위한 일반적인 규칙"이라고 단언했는데, 이 견해는 나중에 로버트 레막과 다른 사람들의 기여로 인해 몰의 모델에 찬성하지 않았습니다.[18]
동물 세포에서 유사분열증을 동반한 세포 분열은 1873년 개구리, 토끼, 고양이 각막 세포에서 발견되었고 1875년 폴란드의 조직학자 Wacwaw Mayzel에 의해 처음으로 기술되었습니다.[19][20]
뷔츨리, 슈나이더, 폴은 또한 현재 "미토시스"라고 알려진 과정의 발견을 주장했을 수도 있습니다.[14]1873년, 독일의 동물학자 오토 뷔츨리는 선충에 대한 관찰 자료를 발표했습니다.몇 년 후, 그는 그 관찰을 바탕으로 유사분열증을 발견하고 묘사했습니다.[21][22][23]
"미토시스"라는 용어는 1882년 발터 플레밍(Walder Flemming)이 만든 그리스어 μ ίτος(mitos, "warp thread")에서 유래했습니다.예를 들어 1878년 슐라이허가 도입한 용어인 핵분열(핵분열)이나 [28][29]1887년 아우구스트 바이스만이 제안한 등분할 수 있는 이름들이 있습니다.[27][30]그러나 일부 저자들은 "미토시스(mitosis)"라는 용어를 넓은 의미로 사용하여 카료키네시스(karyokinesis)와 사이토키네시스(cytokinesis)를 함께 언급하기도 합니다.[31]현재, "방정식 분할"은 감수분열과 가장 유사한 감수분열의 부분인 감수분열 II를 지칭하는 데 더 일반적으로 사용됩니다.[32]
페이즈
개요
유사분열과 사이토카인의 주요 결과는 부모 세포의 게놈이 두 개의 딸 세포로 전이되는 것입니다.게놈은 적절한 세포 기능에 필수적인 유전 정보를 포함하고 있는 팽팽하게 감긴 DNA의 복합체인 다수의 염색체로 구성되어 있습니다.[33]각각의 결과적인 딸 세포는 모세포와 유전적으로 동일해야 하기 때문에, 모세포는 유사분열 전에 각 염색체의 복사본을 만들어야 합니다.이것은 S 단계의 인터페이즈 동안 발생합니다.[34]염색체 복제는 중심부에서 응집 단백질에 의해 결합된 두 개의 동일한 자매 염색질을 생성합니다.
유사분열이 시작되면 염색체는 응결되고 눈에 띕니다.예를 들어 동물과 같은 일부 진핵생물에서는 세포질로부터 DNA를 분리하는 핵외피가 작은 소포체로 분해됩니다.세포 안에서 리보솜을 만드는 뉴클레오러스도 사라집니다.미세관은 세포의 양쪽 끝에서 튀어나와 중심부에 붙어 세포 내에서 염색체를 정렬합니다.그리고 나서 미세관은 각 염색체의 자매 염색질을 떼어놓도록 수축합니다.[35]이 시점에서 자매 염색질은 딸 염색체라고 불립니다.세포가 길어지면서, 상응하는 딸 염색체들이 세포의 반대쪽 끝으로 당겨지고 최대로 후기 아나프 단계에서 응축됩니다.새로운 핵 포락선은 각 딸 염색체 집합 주위에 형성되며, 이 염색체들은 응축하여 상간 핵을 형성합니다.
유사분열이 진행되는 동안, 전형적으로 아나페이즈가 시작된 후, 세포는 사이토카인을 겪을 수 있습니다.동물의 세포에서, 세포막은 두 발달하는 핵 사이를 안쪽으로 찔러서 두 개의 새로운 세포를 생산합니다.식물세포에서 세포판은 두개의 핵 사이에 형성됩니다.사이토카인이 항상 발생하는 것은 아닙니다; 조세포 (다핵 상태의 한 종류) 세포는 사이토카인이 없이 유사분열을 겪습니다.
인터페이즈
중간 단계는 상대적으로 짧은 M 단계보다 셀 주기의 훨씬 더 긴 단계입니다.중간 단계 동안 세포는 세포 분열 과정을 준비합니다.인터페이즈는 G1(첫 번째 갭), S(합성), G2(두 번째 갭)의 세 가지 하위 페이즈로 나뉩니다.세포는 세 단계의 중간 단계 동안 모두 단백질과 세포질 소기관을 생성함으로써 성장합니다.그러나 염색체는 S기 동안에만 복제됩니다.따라서, 세포는 성장하고(G1), 염색체를 복제하면서 계속 성장하고(S), 더 성장하고 유사분열을 준비하고(G2), 그리고 순환을 다시 시작하기 전에(M) 분열합니다.[34]세포 주기의 이러한 모든 단계들은 사이클린, 사이클린 의존성 키나아제 및 기타 세포 주기 단백질에 의해 고도로 조절됩니다.각 단계는 엄격한 순서로 서로 따라가며, 한 단계에서 다른 단계로 진행 여부를 알려주는 세포 주기 체크포인트가 있습니다.[36]세포는 또한 세포 주기를 일시적 또는 영구적으로 벗어나 G 단계로 들어가0 분열을 멈출 수 있습니다.이것은 세포가 과밀화될 때(밀도 의존 억제) 또는 인간의 심장 근육 세포와 뉴런의 경우처럼 유기체를 위한 특정 기능을 수행하기 위해 분화할 때 발생할 수 있습니다.일부 G0 세포는 세포 주기에 재진입하는 능력을 가지고 있습니다.
DNA 이중 가닥 절단은 두 가지 주요 과정에 의해 중간 단계 동안 복구될 수 있습니다.[37]첫 번째 과정인 비동상적 말단 접합(NHEJ)은 중간 단계의 G1, S, G2 단계에서 DNA의 두 부서진 말단을 접합할 수 있습니다.두 번째 과정인 상동 재조합 수리(HRR)는 이중 가닥 절단을 수리하는 데 있어 NHEJ보다 더 정확합니다.HRR은 두 개의 인접한 상동체를 필요로 하기 때문에 DNA 복제가 부분적으로 완료되거나 완료된 후에 단계 간 S 및 G2 단계 동안 활성화됩니다.
중간 단계는 유사분열을 위한 세포 준비를 돕습니다.유사분열 세포 분열의 발생 여부를 결정합니다.그것은 세포의 DNA가 손상되거나 중요한 단계를 마치지 못할 때마다 세포가 진행되는 것을 조심스럽게 막습니다.유사분열이 성공적으로 완료되는지 여부를 결정하기 때문에 중간 단계는 매우 중요합니다.그것은 손상된 세포의 양과 암세포의 생성을 줄일 것입니다.후자가 잠재적으로 암세포를 생성할 수 있기 때문에 주요 단계 간 단백질에 의한 잘못된 계산은 매우 중요할 수 있습니다.[38]
유사분열

전생식기(식물세포)
식물 세포에서만 프로페이즈는 전프로페이즈 단계가 선행됩니다.고도로 진공화된 식물 세포에서 핵은 유사분열을 시작하기 전에 세포의 중심으로 이동해야 합니다.이것은 세포 분열의 미래 평면을 따라 세포를 양분하는 세포질의 가로 시트인 프라그모솜의 형성을 통해 달성됩니다.프래그모좀 형성 이외에도, 프리프로파아제는 미래의 유사분열 스핀들의 적도면 주위의 플라즈마 막 아래에 미세관 및 액틴 필라멘트의 고리(프리프로파아제 밴드라고 함)가 형성되는 것을 특징으로 합니다.이 밴드는 셀이 최종적으로 분할되는 위치를 표시합니다.꽃이 피는 식물과 같은 고등 식물의 세포에는 구심점이 부족합니다. 대신 미세관은 핵의 표면에 방추형을 형성하고 핵 외피가 분해된 후 염색체 자체에 의해 방추형으로 구성됩니다.[39]프리프로파아제 밴드는 프로메타페이즈에서 핵 포락선 파괴 및 스핀들 형성 중에 사라집니다.[40]: 58–67
프로페이즈


G간기2 이후에 발생하는 프로페이즈 동안, 세포는 염색체를 단단히 응축시키고 유사분열 방추 형성을 시작함으로써 분열을 준비합니다.중간 단계 동안, 핵 안의 유전 물질은 느슨하게 포장된 크로마틴으로 구성됩니다.프로페이즈가 시작될 때, 크로마틴 섬유는 빛 현미경을 통해 일반적으로 고배율에서 보이는 이산 염색체로 응축됩니다.이 단계에서 염색체는 길고 가늘며 실과 같습니다.각각의 염색체는 2개의 염색체를 가지고 있습니다.두 색각체는 중심부에서 결합됩니다.
유전자 전사는 프로페이즈 동안 중단되고 후기 아나프 페이즈에서 초기1 G 페이즈까지 재개되지 않습니다.[41][42][43]핵은 초기의 프로페이즈 동안에도 사라집니다.[44]
동물 세포의 핵 가까이에는 느슨한 단백질 집합으로 둘러싸인 한 쌍의 중심체로 구성된 centrosome이라고 불리는 구조가 있습니다.중심체는 세포의 미세관을 조정하는 중심체입니다.세포는 세포 분열에서 하나의 중심체를 물려받는데, 이것은 새로운 유사분열이 시작되기 전에 세포에 의해 복제되어 한 쌍의 중심체를 제공합니다.두 개의 중심체는 튜불린을 중합시켜 미세 튜브 스핀들 장치를 형성합니다.운동 단백질은 이 미세관을 따라 중심체를 세포의 반대편으로 밀어냅니다.센트로좀이 미세소관 조립을 구성하는 데 도움이 되지만,[39] 식물에는 없기 때문에 스핀들 장치의 형성에 필수적인 것은 아니며 동물 세포 유사분열에 절대적으로 필요하지도 않습니다.[45]
프로메타파지
동물 세포에서 프로메타페이즈가 시작될 때, 핵 라민의 인산화는 핵 외피가 작은 막 소포로 분해되게 합니다.이렇게 되면 미세관이 핵 공간을 침범하게 됩니다.이것은 개방형 유사분열이라고 불리며, 일부 다세포 생물에서 발생합니다.곰팡이와 조류 또는 트리코모나드와 같은 일부 보호생물들은 스핀들이 핵 안에서 형성되거나 미세관이 온전한 핵 외피를 관통하는 폐쇄 유사분열이라고 불리는 변화를 겪습니다.[46][47]
후기 프로메타페이즈에서, 키네토코어 미세소관은 염색체 키네토코어를 탐색하고 부착하기 시작합니다.[48]키네토코어(Kinetochore)는 말기 프로페이즈 동안 염색체 센트로미어 상에 형성되는 단백질질 미세관 결합 구조입니다.[48][49]다수의 극미소관은 유사분열 스핀들을 형성하기 위해 반대쪽 중심체로부터 대응하는 극미소관을 찾아 상호작용합니다.[50]키네토코어의 구조와 기능에 대해서는 아직 완전히 이해되지는 않았지만, 어떤 형태의 분자 모터를 포함하고 있는 것으로 알려져 있습니다.[51]미세한 튜브가 키네토키네토키네토키네토키네토키네토키네토키네토키네토키네토키네토키네토키네토키네토키네토키네토키네토키네토키네토키네토키네토키네토키네토키네토키이 운동 활동은 미세소관의 중합 및 해중합과 함께 나중에 염색체의 두 염색체를 분리하는 데 필요한 당김력을 제공합니다.[51]
메타파제


미세소관이 프로메타파상에 있는 키네토키네토키네토키네토키네토키네토키네토키네토키네토키네토키네토키네토키네토키네토키네토키네토키네토키네토키네토키네토키네토키네토키결과적인 긴장은 염색체들이 적도면에서 메타파아제 판을 따라 정렬하게 하는데, 이는 두 중심체(대략 세포의 중간선) 사이에 중앙에 위치하는 상상의 선입니다.[50]유사분열이 끝날 때 염색체의 공평한 분포를 보장하기 위해, 메타파아제 체크포인트는 유사분열 방추에 운동신경세포가 적절하게 부착되고 염색체가 메타파아제 판을 따라 정렬되는 것을 보장합니다.[52]만일 세포가 성공적으로 메타페이즈 체크포인트를 통과하면, 그것은 아포페이즈로 진행됩니다.
애너페이즈

A 병기 동안 자매 염색질을 결합하는 응집제는 분해되어 두 개의 동일한 딸 염색체를 형성합니다.[53]미세소관에 대한 키네토키네토키네토키네토키네토키네토키네토키네토키네토키네토키네토키네토키네토키네토키네토키네토키B단계 동안, 극지방 미세관들이 서로 밀어내면서 세포가 늘어나게 합니다.[54]후기 아나프 단계에서 염색체는 또한 염색체 분리와 핵의 재형성을 돕기 위해 전체적인 최대 응축 수준에 도달합니다.[55]대부분의 동물 세포에서, 아나프상 A는 아나프상 B보다 앞서지만, 일부 척추동물 난자 세포들은 사건의 반대 순서를 보여줍니다.[53]
텔로파이즈

텔로페이즈(Telophase)는 그리스어로 "끝"을 의미하는 τελος에서 유래한 것입니다.텔로파상에서, 극세관은 세포를 훨씬 더 길게 하면서 계속해서 늘어납니다.핵포락이 분해된 경우, 부모 세포의 오래된 핵포락의 막 소포를 사용하여 새로운 핵포락이 형성됩니다.새로운 외피는 분리된 각 딸 염색체 세트 주위에 형성되며(심층을 둘러싸지는 않지만) 핵이 다시 나타납니다.이제 새로운 핵막으로 둘러싸인 두 염색체 세트 모두 "긴장 완화" 또는 "결로" 시작합니다.유사분열은 끝났습니다.각각의 딸 핵은 동일한 염색체 집합을 가지고 있습니다.이때 세포분열은 유기체에 따라 일어날 수도 있고 일어나지 않을 수도 있습니다.
사이토카인

사이토카인 분해는 유사분열의 단계가 아니라 세포 분열을 완료하는 데 필요한 별도의 과정입니다.동물 세포에서는 수축 고리를 포함한 갈라진 고랑(pinch)이 분리된 핵을 꼬집으면서 메타파아제 판이 있던 곳에서 생깁니다.[56]동물 세포와 식물 세포 모두에서, 세포 분열은 골지체에서 파생된 소포에 의해서도 이루어지며, 이 소포들은 미세한 관을 따라 세포의 중간까지 이동합니다.[57]식물에서 이 구조는 프라그모플라스틱의 중심에 있는 세포판으로 합쳐지고 두 개의 핵을 분리하는 세포벽으로 발전합니다.프라그모플라스틱은 고등 식물에 전형적인 미세관 구조인 반면, 일부 녹조류는 사이토카인이 발생하는 동안 파이코플라스틱 미세관 배열을 사용합니다.[40]: 64–7, 328–9 각각의 딸 세포는 부모 세포의 게놈의 완전한 복사본을 가지고 있습니다.사이토카인의 종말은 M-phase의 종말을 의미합니다.
유사분열과 사이토카인이 분리되어 여러 개의 핵을 가진 단일 세포를 형성하는 세포가 많습니다.이 중 가장 눈에 띄는 것은 곰팡이, 점액곰팡이, 코에노시틱 조류 중에 있지만, 이 현상은 다른 여러 생물체에서 발견됩니다.동물에서도 사이토카인 발생과 유사분열은 독립적으로 일어날 수 있는데, 예를 들어 초파리 배아 발달의 특정 단계 동안에 발생할 수 있습니다.[58]
기능.
유사분열의 기능 또는 중요성은 염색체 집합을 유지하는 것입니다; 각각의 형성된 세포는 부모 세포의 염색체와 구성이 같고 수가 같은 염색체를 받습니다.
유사분열은 다음과 같은 경우에 발생합니다.
- 개발 및 성장:한 유기체 안에 있는 세포의 수는 유사분열에 의해 증가합니다.이것은 단일 세포, 즉 자이고테로부터 다세포체가 발달하는 기초이자 다세포체 성장의 기초이기도 합니다.
- 셀 교체:피부와 소화관과 같은 신체의 일부 부분에서는 세포들이 지속적으로 털리고 새로운 세포로 대체됩니다.[59]새로운 세포들은 유사분열에 의해 형성되며, 대체되는 세포들의 정확한 복사본들 또한 마찬가지입니다.마찬가지로 적혈구는 수명이 짧고(약 3개월) 유사분열로 인해 새로운 RBC가 형성됩니다.[60]
- 재생성:어떤 유기체들은 신체 일부를 재생시킬 수 있습니다.이러한 경우에 새로운 세포의 생성은 유사분열에 의해 이루어집니다.예를 들면, 불가사리는 유사분열을 통해 잃어버린 팔을 재생합니다.
- 무성생식:어떤 유기체들은 무성생식을 통해 유전적으로 비슷한 자손을 만들어냅니다.예를 들어, 히드라는 싹을 틔움으로써 무성생식을 합니다.히드라의 표면에 있는 세포들은 유사분열을 겪으며 꽃봉오리라고 불리는 덩어리를 형성합니다.유사분열은 싹의 세포에서 계속되고 이것은 새로운 개체로 성장합니다.같은 분열은 무성생식이나 식물의 번식 과정에서 일어납니다.
변주곡
유사분열의 형태
진핵생물의 세포에서 유사분열 과정은 유사한 패턴을 따르지만, 세 가지 주요 세부 사항에서 변화가 있습니다."닫힌" 유사분열과 "열린" 유사분열은 핵 포락선이 온전하게 남아있거나 분해되는 것을 기준으로 구별될 수 있습니다.핵 외피가 부분적으로 분해되는 중간 형태를 "반개방형" 유사분열이라고 합니다.비유기 동안 스핀들 장치의 대칭과 관련하여, 대략 축 대칭(중심) 형태는 유사분열 장치가 양쪽 대칭을 갖는 "플루로미토시스"의 편심 스핀들과 구별되는 "직교양"이라고 불립니다.마지막으로, 세 번째 기준은 폐쇄성 흉막증의 경우 중심 스핀들의 위치입니다: "핵외"(세포질에 위치한 스핀들)[10] 또는 "핵내"(핵내).
-
폐쇄적인
핵내의
흉막염 -
폐쇄적인
핵외의
흉막염 -
폐쇄적인
정형외과 -
반열린
흉막염 -
반열린
정형외과 -
열다.
정형외과
박테리아와 고세균이 핵을 가지고 있지 않기 때문에 핵분열은 진핵생물 영역의 유기체의 세포분열은 박테리아와 고세균은 핵을 가지고 있지 않기 때문입니다.박테리아와 고균은 다른 형태의 분열을 겪습니다.[61][62]각각의 진핵생물 초군 내에서 열린 형태의 유사분열은 단세포 유사분열을 제외하고,[63] 닫힌 유사분열뿐만 아니라 발견될 수 있습니다.다음으로, 진핵생물에서 유사분열 형태의 발생:[10][64]
- 폐쇄성 핵내 흉막증은 전형적인 포라미니페라, 일부 프라시노모나디다, 일부 키네토플라스티다, 옥시모나디다, 하플로스포리디아, 많은 균류(사이트리드, 오미케테스, 자이고마이케테스, 아스코미케테스), 그리고 일부 방사균(스푸멜라리아와 아칸타리아)에 속하며, 가장 원시적인 유형인 것으로 보입니다.
- 폐쇄형 핵외 흉막증은 트리코모나디다와 다이노플라겔라타에서 발생합니다.
- 폐쇄성 오르토미토시스는 규조류, 섬모, 일부 마이크로스포리디아, 단세포 효모, 그리고 일부 다세포 곰팡이 사이에서 발견됩니다.
- 반개열성 흉막염은 대부분의 아피콤플렉스에서 전형적인 증상입니다.
- 일부 아메배(Lobosa)와 일부 녹색 편모체(예: Raphidophyta 또는 Volvox)에서 다양한 변형과 함께 반개열 정형증이 발생합니다.
- 개방형 오르토미토시스는 포유류와 기타 메타조아, 육지 식물에서 전형적으로 나타나지만, 일부 보호자들에게서도 발생합니다.
오류 및 기타 변형

오류는 유사분열, 특히 인간의 초기 배아 발달 중에 발생할 수 있습니다.[65]유사분열의 각 단계 동안에는 일반적으로 유사분열의 정상적인 결과를 제어하는 검사점도 있습니다.[66]하지만 간혹 실수가 있을 수도 있습니다.유사분열 오류는 암과 관련된 질환인 하나 이상의 염색체가 너무 적거나 많은 유엽세포를 만들 수 있습니다.[67][68]초기 인간 배아, 암세포, 감염되거나 만취된 세포는 또한 세 개 이상의 딸 세포로 병리학적으로 분열되어 염색체 보체에 심각한 오류를 초래할 수 있습니다.[8]
비접합에서는 자매 크로마티스가 애너페이즈 동안 분리되지 못합니다.[69]하나의 딸 세포는 비접합 염색체로부터 자매 염색질을 모두 받고 다른 하나의 세포는 하나도 받지 못합니다.결과적으로, 전자의 세포는 세 개의 염색체 사본을 얻는데, 이것은 삼합법이라고 알려진 상태이고, 후자는 단합법이라고 알려진 상태인 한 개의 염색체 사본만 가질 것입니다.때때로 세포들이 비분리를 경험할 때, 그들은 사이토카인을 완성하지 못하고 하나의 세포에 두 개의 핵을 보유하게 되고, 그 결과 이핵화된 세포가 됩니다.[70]
병기 지연은 병기 중에 하나의 염색질의 이동이 방해될 때 발생합니다.[69]유사분열 스핀들이 염색체에 제대로 부착되지 않아 발생할 수 있습니다.두 핵 모두에서 뒤떨어진 크로마토이드가 제외되어 소실됩니다.따라서 딸 세포 중 하나는 그 염색체에 대한 단핵세포가 될 것입니다.
세포내 복제(또는 세포내 복제)는 염색체가 복제되지만 세포가 나중에 분열하지 않을 때 발생합니다.이것은 다배체 세포 또는 염색체가 반복적으로 복제되면 폴리텐 염색체를 낳습니다.[69][71]내복원은 많은 종에서 발견되며 발달의 정상적인 부분으로 보입니다.[71]자궁내종증(endomitosis)은 세포가 S기 동안 염색체를 복제하여 유사분열로 들어가지만 조기에 종결되는 내복종의 한 변종입니다.복제된 염색체는 두 개의 새로운 딸핵으로 나뉘는 대신 원래의 핵 안에 유지됩니다.[58][72]그리고 나서 세포들은1 G와 S 단계로 다시 들어가 그들의 염색체를 다시 복제합니다.[72]이것은 여러 번 발생할 수 있으며, 각 복제 및 내생종에 따라 염색체 수가 증가합니다.혈소판을 생성하는 거대핵세포는 세포 분화 중에 자궁내막증을 겪습니다.[73][74]
섬모와 동물 태반 조직에서 유사체가 생기면 부모의 대립유전자가 무작위로 분포하게 됩니다.
사이토카인이 없는 카료키네시스는 코엔세포라고 불리는 다핵세포를 발생시킵니다.
진단 마커

조직병리학에서 유사분열률(유사분열수 또는 유사분열지수)은 진단뿐만 아니라 종양의 공격성을 더욱 구체화하기 위한 다양한 유형의 조직 샘플에서 중요한 매개 변수입니다.예를 들어, 유방암 분류에는 유사분열수의 정량화가 일상적으로 존재합니다.[75]유사분열 활성이 가장 높은 영역에서 유사분열을 계산해야 합니다.이러한 부위를 육안으로 식별하는 것은 유사분열 활성이 매우 높은 종양에서는 어렵습니다.[76]또한 비전형적인 유사분열 형태의 검출은 진단 마커와 예후 마커로 모두 사용될 수 있습니다.[citation needed]예를 들어, lag-type 유사분열증(mitotic figure의 영역에서 비부착 축합 염색질)은 고위험 인유두종 바이러스 감염 관련 자궁경부암을 나타냅니다.[citation needed]유사분열 계수의 재현성과 정확성을 향상시키기 위해 딥러닝 기반 알고리즘을 이용한 자동화된 영상 분석이 제안되었습니다.[77]그러나 이러한 알고리즘을 일상적인 진단에 사용하기 위해서는 추가적인 연구가 필요합니다.
-
암세포에서 나타나는 정상적이고 비전형적인 유사분열 형태.A, 정상 유사분열증; B, 염색교; C, 다극 유사분열증; D, 고리 유사분열증; E, 분산 유사분열증; F, 비대칭 유사분열증; G, 래그형 유사분열증; 및 H, 미세핵.H&E 얼룩.
관련 셀프로세스
셀 라운딩

동물 조직에서, 대부분의 세포는 유사분열 동안 거의 구형에 가까운 모양으로 둥글게 됩니다.[78][79][80]상피 및 표피에서 효율적인 라운딩 과정은 적절한 유사분열 스핀들 정렬 및 후속 딸 세포의 올바른 위치설정과 상관관계가 있습니다.[79][80][81][82]게다가, 연구원들은 라운딩이 심하게 억제되면 주로 극이 갈라지고 염색체를 효율적으로 포획하지 못하는 스핀들 결함을 초래할 수 있다는 것을 발견했습니다.[83]따라서 유사분열 세포 반올림은 정확한 유사분열을 보장하는 보호 역할을 하는 것으로 생각됩니다.[82][84]
F-actin과 미오신(actomyosin)을 수축성 균질한 세포 피질로 재구성하여 1) 세포 주변을[84][85][86] 경직시키고 2) 세포 내 정수압을 생성하는 것을 용이하게 하는 반올림력을 촉진합니다.[87][88][89]세포 내 압력의 생성은 구속 상태에서 특히 중요한데, 이는 외부 힘이 주변 세포 및/또는 세포 외 기질과 반올림하기 위해 생성되어야 하는 조직 시나리오에서 중요합니다.압력의 생성은 포민-매개 F-액틴 핵생성[89] 및 Rho 키나아제(ROCK)-매개 미오신 II 수축에 의존하며,[85][87][89] 둘 다 Cdk1의 활성을 통해 신호 경로 RhoA 및 ECT2에[85][86] 의해 상류에서 조절됩니다.[89]유사분열에 있어서의 중요성 때문에, 유사분열 악토마이오신 피질의 분자적 성분과 역학은 활발한 연구의 한 분야입니다.
유사분열 재조합
세포 주기의 G1 단계에서 X선이 조사된 유사분열 세포는 주로 상동 염색체 간의 재조합에 의해 재조합 DNA 손상을 복구합니다.[90]G2 단계에서 조사된 유사분열 세포는 자매-염색체 재조합에 의해 그러한 손상을 우선적으로 복구합니다.[90]재조합에 사용되는 효소를 암호화하는 유전자의 돌연변이는 세포가 다양한 DNA 손상제에 의해 죽음에 대한 민감성을 증가시키는 원인이 됩니다.[91][92][93]이러한 연구 결과는 유사분열 재조합이 치명적일 가능성이 있는 DNA 손상을 치료하기 위한 적응임을 시사합니다.
진화


진핵 유사분열의 모든 핵심 분자(예를 들어, 액틴, 튜불린)의 원핵 상동체가 있습니다.보편적인 진핵생물의 특성으로, 유사분열은 아마도 진핵생물 나무의 밑부분에서 발생했을 것입니다.감수분열은 감수분열보다 덜 복잡하기 때문에 감수분열 후 감수분열이 발생했을 수 있습니다.[94]그러나 감수분열을 수반하는 성적 생식은 진핵생물의 원시적인 특징이기도 합니다.[95]따라서 감수분열과 유사분열은 모두 조상의 원핵생물 과정으로부터 동시에 진화했을 수 있습니다.
박테리아 세포 분열에서, DNA의 복제 후, 두 개의 원형 염색체가 세포막의 특별한 영역에 부착됩니다. 진핵 유사분열은 보통 많은 선형 염색체의 존재로 특징지어지는데, 그 선형 염색체의 키네토코어는 방추의 미세관에 부착됩니다.유사분열의 형태와 관련하여 폐쇄형 핵내 흉막분열증은 세균 분열과 더 유사하기 때문에 가장 원시적인 유형인 것으로 보입니다.[10]
갤러리
유사분열 세포는 형광 항체와 염료로 염색함으로써 현미경으로 시각화될 수 있습니다.
-
초기의 프로페이즈: 녹색 가닥으로 보이는 극소세관은 현재 온전한 핵 주위에 행렬을 형성하고 응축 염색체는 파란색입니다.빨간 결절은 센트로미어입니다.
-
초기 홍보문:핵막이 막 분해되어 미세소관이 응축 염색체의 중심체에 모이는 운동신경세포와 빠르게 상호작용할 수 있게 되었습니다.
-
비유:중심체는 세포의 극으로 이동하여 유사분열 방추를 형성합니다.염색체들은 메타파아제 판에서 모였습니다.
-
비유상: 키네토코어 미세관이 두 세트의 염색체를 분리시키고, 길어지는 극소관은 염색체가 최대한 응축되는 동안 분열하는 세포의 반을 더 멀리 밀어냅니다.
-
텔로파이즈:프로페이즈 및 프로메타페이즈 이벤트의 반전으로 세포 주기가 완료됩니다.
참고 항목
참고문헌
- ^ "Cell division and growth". britannica.com. ENCYCLOPÆDIA BRITANNICA. Archived from the original on 2018-10-28. Retrieved 2018-11-04.
- ^ "Explain why mitosis is called equational and meiosis class 11 biology CBSE". www.vedantu.com. Retrieved 2021-05-29.
- ^ Carter JS (2014-01-14). "Mitosis". biology.clc.uc.edu. Archived from the original on 2012-10-27. Retrieved 2019-11-12.
- ^ "Mitosis - an overview ScienceDirect Topics". www.sciencedirect.com. Retrieved 2020-11-24.
- ^ "Cell Division: Stages of Mitosis Learn Science at Scitable". www.nature.com. Archived from the original on 2015-11-14. Retrieved 2015-11-16.
- ^ Maton A, Hopkins JJ, LaHart S, Quon Warner D, Wright M, Jill D (1997). Cells: Building Blocks of Life. New Jersey: Prentice Hall. pp. 70–4. ISBN 978-0-13-423476-2.
- ^ Sandoz PA (December 2019). "Image-based analysis of living mammalian cells using label-free 3D refractive index maps reveals new organelle dynamics and dry mass flux". PLOS Biology. 17 (12): e3000553. doi:10.1371/journal.pbio.3000553. PMC 6922317. PMID 31856161.
- ^ a b Kalatova B, Jesenska R, Hlinka D, Dudas M (January 2015). "Tripolar mitosis in human cells and embryos: occurrence, pathophysiology and medical implications". Acta Histochemica. 117 (1): 111–25. doi:10.1016/j.acthis.2014.11.009. PMID 25554607.
- ^ Kops GJ, Weaver BA, Cleveland DW (October 2005). "On the road to cancer: aneuploidy and the mitotic checkpoint". Nature Reviews. Cancer. 5 (10): 773–85. doi:10.1038/nrc1714. PMID 16195750. S2CID 2515388.
- ^ a b c d Raikov IB (1994). "The diversity of forms of mitosis in protozoa: A comparative review". European Journal of Protistology. 30 (3): 253–69. doi:10.1016/S0932-4739(11)80072-6.
- ^ De Souza CP, Osmani SA (September 2007). "Mitosis, not just open or closed". Eukaryotic Cell. 6 (9): 1521–7. doi:10.1128/EC.00178-07. PMC 2043359. PMID 17660363.
- ^ Boettcher B, Barral Y (2013). "The cell biology of open and closed mitosis". Nucleus. 4 (3): 160–5. doi:10.4161/nucl.24676. PMC 3720745. PMID 23644379.
- ^ Patil, C. s. Cell Biology. APH Publishing. ISBN 978-81-313-0416-7.
- ^ a b 로스, 안나 E. "인간 해부학 & 생리학 I: 유사분열증에 대한 설명 연대표"크리스천 브라더스 대학2018년 5월 2일 검색.Wayback Machine에서 Archived 2016-05-12 링크.
- ^ von Mohl H (1835). Ueber die Vermehrung der Pflanzenzellen durch Theilung. Inaugural-Dissertation (Thesis). Tübingen.
- ^ Karl Mägdefrau (1994), "Mohl, Hugo von", Neue Deutsche Biographie (in German), vol. 17, Berlin: Duncker & Humblot, pp. 690–691Karl Mägdefrau (1994), "Mohl, Hugo von", Neue Deutsche Biographie (in German), vol. 17, Berlin: Duncker & Humblot, pp. 690–691(온라인 전체 텍스트)
- ^ "노트 및 메모:고인이 된 폰 몰 교수."계간 미시 과학 저널, v. XV, New Series, p. 178-181, 1875. 링크
- ^ 웨이어스, 볼프강 (2002)150년의 세포 분열.피부병리학: 실용적이고 개념적인, Vol. 8, No. 2 링크 Wayback Machine에서 2019-04-02 아카이브
- ^ Komender J (2008). "Kilka słów o doktorze Wacławie Mayzlu i jego odkryciu" [On Waclaw Mayzel and his observation of mitotic division] (PDF). Postępy Biologii Komórki (in Polish). 35 (3): 405–407. Archived (PDF) from the original on 2012-10-27.
- ^ Iłowiecki M (1981). Dzieje nauki polskiej. Warszawa: Wydawnictwo Interpress. p. 187. ISBN 978-83-223-1876-8.
- ^ 뷔츨리, O. (1873)베이트래게 주르 케른트니스 데어 프릴레벤덴 네마토덴.Nova Acta der Kaiserlich Leopoldinisch-Carolinischen Deutschen Academie der Naturforscher 36, 1-144. 링크 Wayback Machine에서 2018-08-11 보관.
- ^ 뷔츨리, O. (1876)Studien über dieersten Entwicklungsvorgänge der Eizelle, die Zelleilung und die Conjugation der Infusorien.Abh.d. 센켄브. 네이처프. Ges. Frankfurt a. M. 10, 213-452. 링크 Wayback Machine에서 2018-08-09 보관.
- ^ Fokin SI (2013). "Otto Bütschli (1848–1920) Where we will genuflect?" (PDF). Protistology. 8 (1): 22–35. Archived (PDF) from the original on 2014-08-08. Retrieved 2014-08-06.
- ^ Sharp LW (1921). Introduction To Cytology. New York: McGraw Hill Book Company Inc. p. 143.
- ^ "mitosis". Online Etymology Dictionary. Archived from the original on 2017-09-28. Retrieved 2019-11-12.
- ^ μ ίτος. 리델, 헨리 조지; 스콧, 로버트; 페르세우스 프로젝트의 그리스-영어 어휘록
- ^ Battaglia E (2009). "Caryoneme alternative to chromosome and a new caryological nomenclature" (PDF). Caryologia. 62 (4): 1–80. Archived from the original (PDF) on 2016-03-04.
- ^ Schleicher W (1878). "Die Knorpelzelltheilung". Arch. Mirkroskop. Anat. 16: 248–300. doi:10.1007/BF02956384. S2CID 163374324. Archived from the original on 2018-08-11.
- ^ Toepfer G. "Karyokinesis". BioConcepts. Archived from the original on 2018-05-03. Retrieved 2 May 2018.
- ^ Battaglia E (1987). "Embryological questions: 12. Have the Polygonum and Allium types been rightly established?". Ann Bot. Rome. 45: 81–117.
p. 85: Already in 1887, Weismann gave the names Aequationstheilung to the usual cell division, and Reduktionstheilungen to the two divisions involved in the halving process of the number of Kernsegmente
- ^ Mauseth JD (1991). Botany: an Introduction to Plant Biology. Philadelphia: Saunders College Publishing. ISBN 9780030302220.
p. 102: Cell division is cytokinesis, and nuclear division is karyokinesis. The words "mitosis" and "meiosis" technically refer only to karyokinesis but are frequently used to describe cytokinesis as well.
- ^ Cooper, Geoffrey M. (2000). "Meiosis and Fertilization". The Cell: A Molecular Approach. 2nd Edition.
- ^ Brown, Terence A. (2002). The Human Genome. Wiley-Liss.
- ^ a b Blow JJ, Tanaka TU (November 2005). "The chromosome cycle: coordinating replication and segregation. Second in the cycles review series". EMBO Reports. 6 (11): 1028–34. doi:10.1038/sj.embor.7400557. PMC 1371039. PMID 16264427.
- ^ Zhou J, Yao J, Joshi HC (September 2002). "Attachment and tension in the spindle assembly checkpoint". Journal of Cell Science. 115 (Pt 18): 3547–55. doi:10.1242/jcs.00029. PMID 12186941.
- ^ Biology Online (28 April 2020). "Mitosis". Biology Online.
- ^ Shibata A (2017). "Regulation of repair pathway choice at two-ended DNA double-strand breaks". Mutat Res. 803–805: 51–55. doi:10.1016/j.mrfmmm.2017.07.011. PMID 28781144.
- ^ Bernat, R. L.; Borisy, G. G.; Rothfield, N. F.; Earnshaw, W. C. (1990-10-01). "Injection of anticentromere antibodies in interphase disrupts events required for chromosome movement at mitosis". The Journal of Cell Biology. 111 (4): 1519–1533. doi:10.1083/jcb.111.4.1519. ISSN 0021-9525. PMC 2116233. PMID 2211824.
- ^ a b Lloyd C, Chan J (February 2006). "Not so divided: the common basis of plant and animal cell division". Nature Reviews. Molecular Cell Biology. 7 (2): 147–52. doi:10.1038/nrm1831. PMID 16493420. S2CID 7895964.
- ^ a b Raven PH, Evert RF, Eichhorn SE (2005). Biology of Plants (7th ed.). New York: W. H. Freeman and Co. ISBN 978-0716710073.
- ^ Prasanth KV, Sacco-Bubulya PA, Prasanth SG, Spector DL (March 2003). "Sequential entry of components of the gene expression machinery into daughter nuclei". Molecular Biology of the Cell. 14 (3): 1043–57. doi:10.1091/mbc.E02-10-0669. PMC 151578. PMID 12631722.
- ^ Kadauke S, Blobel GA (April 2013). "Mitotic bookmarking by transcription factors". Epigenetics & Chromatin. 6 (1): 6. doi:10.1186/1756-8935-6-6. PMC 3621617. PMID 23547918.
- ^ Prescott DM, Bender MA (March 1962). "Synthesis of RNA and protein during mitosis in mammalian tissue culture cells". Experimental Cell Research. 26 (2): 260–8. doi:10.1016/0014-4827(62)90176-3. PMID 14488623.
- ^ Olson MO (2011). The Nucleolus. Vol. 15 of Protein Reviews. Berlin: Springer Science & Business Media. p. 15. ISBN 9781461405146.
- ^ Basto R, Lau J, Vinogradova T, Gardiol A, Woods CG, Khodjakov A, Raff JW (June 2006). "Flies without centrioles". Cell. 125 (7): 1375–86. doi:10.1016/j.cell.2006.05.025. PMID 16814722. S2CID 2080684.
- ^ Heywood P (June 1978). "Ultrastructure of mitosis in the chloromonadophycean alga Vacuolaria virescens". Journal of Cell Science. 31: 37–51. doi:10.1242/jcs.31.1.37. PMID 670329.
- ^ Ribeiro KC, Pereira-Neves A, Benchimol M (June 2002). "The mitotic spindle and associated membranes in the closed mitosis of trichomonads". Biology of the Cell. 94 (3): 157–72. doi:10.1016/S0248-4900(02)01191-7. PMID 12206655. S2CID 29081466.
- ^ a b Chan GK, Liu ST, Yen TJ (November 2005). "Kinetochore structure and function". Trends in Cell Biology. 15 (11): 589–98. doi:10.1016/j.tcb.2005.09.010. PMID 16214339.
- ^ Cheeseman IM, Desai A (January 2008). "Molecular architecture of the kinetochore-microtubule interface". Nature Reviews. Molecular Cell Biology. 9 (1): 33–46. doi:10.1038/nrm2310. PMID 18097444. S2CID 34121605.
- ^ a b Winey M, Mamay CL, O'Toole ET, Mastronarde DN, Giddings TH, McDonald KL, McIntosh JR (June 1995). "Three-dimensional ultrastructural analysis of the Saccharomyces cerevisiae mitotic spindle". The Journal of Cell Biology. 129 (6): 1601–15. doi:10.1083/jcb.129.6.1601. PMC 2291174. PMID 7790357.
- ^ a b Maiato H, DeLuca J, Salmon ED, Earnshaw WC (November 2004). "The dynamic kinetochore-microtubule interface" (PDF). Journal of Cell Science. 117 (Pt 23): 5461–77. doi:10.1242/jcs.01536. PMID 15509863. S2CID 13939431. Archived (PDF) from the original on 2017-08-18. Retrieved 2018-04-20.
- ^ Chan GK, Yen TJ (2003). "The mitotic checkpoint: a signaling pathway that allows a single unattached kinetochore to inhibit mitotic exit". Progress in Cell Cycle Research. 5: 431–9. PMID 14593737.
- ^ a b FitzHarris G (March 2012). "Anaphase B precedes anaphase A in the mouse egg" (PDF). Current Biology. 22 (5): 437–44. doi:10.1016/j.cub.2012.01.041. PMID 22342753. Archived (PDF) from the original on 2018-07-24. Retrieved 2019-09-17.
- ^ Miller KR, Levine J (2000). "Anaphase". Biology (5th ed.). Pearson Prentice Hall. pp. 169–70. ISBN 978-0-13-436265-6.
- ^ European Molecular Biology Laboratory (12 June 2007). "Chromosome condensation through mitosis". Science Daily. Archived from the original on 13 June 2007. Retrieved 4 October 2020.
- ^ Glotzer M (March 2005). "The molecular requirements for cytokinesis". Science. 307 (5716): 1735–9. Bibcode:2005Sci...307.1735G. doi:10.1126/science.1096896. PMID 15774750. S2CID 34537906.
- ^ Albertson R, Riggs B, Sullivan W (February 2005). "Membrane traffic: a driving force in cytokinesis". Trends in Cell Biology. 15 (2): 92–101. doi:10.1016/j.tcb.2004.12.008. PMID 15695096.
- ^ a b Lilly MA, Duronio RJ (April 2005). "New insights into cell cycle control from the Drosophila endocycle". Oncogene. 24 (17): 2765–75. doi:10.1038/sj.onc.1208610. PMID 15838513.
- ^ Sunderland (2000). The Cell: A Molecular Approach. 2nd edition (2nd ed.). Sinauer Associates.
- ^ Franco, Robert (27 August 2012). "Measurement of Red Cell Lifespan and Aging". Transfusion Medicine and Hemotherapy. 39 (5): 302–307. doi:10.1159/000342232. PMC 3678251. PMID 23801920.
- ^ Hogan (August 23, 2011). "Archaea". Encyclopedia of Life.
- ^ "Binary Fission and other Forms of Reproduction in Bacteria". Cornell College of Agriculture and Life Sciences.
- ^ Boettcher B, Barral Y (2013). "The cell biology of open and closed mitosis". Nucleus. 4 (3): 160–5. doi:10.4161/nucl.24676. PMC 3720745. PMID 23644379.
- ^ R. 데살, B.쉬어워터:동물 진화의 핵심적인 변화.CRC Press, 2010, 페이지 12, Wayback Machine에서의 Archived 2019-01-02 링크
- ^ Mantikou E, Wong KM, Repping S, Mastenbroek S (December 2012). "Molecular origin of mitotic aneuploidies in preimplantation embryos". Biochimica et Biophysica Acta (BBA) - Molecular Basis of Disease. 1822 (12): 1921–30. doi:10.1016/j.bbadis.2012.06.013. PMID 22771499.
- ^ Wassmann, Katja; Benezra, Robert (2001-02-01). "Mitotic checkpoints: from yeast to cancer". Current Opinion in Genetics & Development. 11 (1): 83–90. doi:10.1016/S0959-437X(00)00161-1. ISSN 0959-437X. PMID 11163156.
- ^ Draviam VM, Xie S, Sorger PK (April 2004). "Chromosome segregation and genomic stability". Current Opinion in Genetics & Development. 14 (2): 120–5. doi:10.1016/j.gde.2004.02.007. PMID 15196457.
- ^ Santaguida S, Amon A (August 2015). "Short- and long-term effects of chromosome mis-segregation and aneuploidy". Nature Reviews. Molecular Cell Biology. 16 (8): 473–85. doi:10.1038/nrm4025. hdl:1721.1/117201. PMID 26204159. S2CID 205495880.
- ^ a b c Iourov IY, Vorsanova SG, Yurov YB (2006). "Chromosomal Variations in Mammalian Neuronal Cells: Known Facts and Attractive Hypotheses". In Jeon KJ (ed.). International Review Of Cytology: A Survey of Cell Biology. Vol. 249. Waltham, MA: Academic Press. p. 146. ISBN 9780080463506.
- ^ Shi Q, King RW (October 2005). "Chromosome nondisjunction yields tetraploid rather than aneuploid cells in human cell lines". Nature. 437 (7061): 1038–42. Bibcode:2005Natur.437.1038S. doi:10.1038/nature03958. PMID 16222248. S2CID 1093265.
- ^ a b Edgar BA, Orr-Weaver TL (May 2001). "Endoreplication cell cycles: more for less". Cell. 105 (3): 297–306. doi:10.1016/S0092-8674(01)00334-8. PMID 11348589. S2CID 14368177.
- ^ a b Lee HO, Davidson JM, Duronio RJ (November 2009). "Endoreplication: polyploidy with purpose". Genes & Development. 23 (21): 2461–77. doi:10.1101/gad.1829209. PMC 2779750. PMID 19884253.
- ^ Italiano JE, Shivdasani RA (June 2003). "Megakaryocytes and beyond: the birth of platelets". Journal of Thrombosis and Haemostasis. 1 (6): 1174–82. doi:10.1046/j.1538-7836.2003.00290.x. PMID 12871316. S2CID 24325966.
- ^ Vitrat N, Cohen-Solal K, Pique C, Le Couedic JP, Norol F, Larsen AK, Katz A, Vainchenker W, Debili N (May 1998). "Endomitosis of human megakaryocytes are due to abortive mitosis". Blood. 91 (10): 3711–23. doi:10.1182/blood.V91.10.3711. PMID 9573008.
- ^ "Infiltrating Ductal Carcinoma of the Breast (Carcinoma of No Special Type)". Stanford University School of Medicine. Archived from the original on 2019-09-11. Retrieved 2019-10-02.
- ^ Bertram CA, Aubreville M, Gurtner C, Bartel A, Corner SM, Dettwiler M, et al. (March 2020). "Computerized Calculation of Mitotic Count Distribution in Canine Cutaneous Mast Cell Tumor Sections: Mitotic Count Is Area Dependent" (PDF). Veterinary Pathology. 57 (2): 214–226. doi:10.1177/0300985819890686. PMID 31808382. S2CID 208767801.
- ^ Bertram, Christof A; Aubreville, Marc; Donovan, Taryn A; Bartel, Alexander; Wilm, Frauke; Marzahl, Christian; Assenmacher, Charles-Antoine; Becker, Kathrin; Bennett, Mark; Corner, Sarah; Cossic, Brieuc; Denk, Daniela; Dettwiler, Martina; Gonzalez, Beatriz Garcia; Gurtner, Corinne; Haverkamp, Ann-Kathrin; Heier, Annabelle; Lehmbecker, Annika; Merz, Sophie; Noland, Erika L; Plog, Stephanie; Schmidt, Anja; Sebastian, Franziska; Sledge, Dodd G; Smedley, Rebecca C; Tecilla, Marco; Thaiwong, Tuddow; Fuchs-Baumgartinger, Andrea; Meuten, Donald J; Breininger, Katharina; Kiupel, Matti; Maier, Andreas; Klopfleisch, Robert (2021). "Computer-assisted mitotic count using a deep learning–based algorithm improves interobserver reproducibility and accuracy". Veterinary Pathology. 59 (2): 211–226. doi:10.1177/03009858211067478. PMC 8928234. PMID 34965805. S2CID 245567911.
- ^ Sauer FC (1935). "Mitosis in the neural tube". Journal of Comparative Neurology. 62 (2): 377–405. doi:10.1002/cne.900620207. S2CID 84960254.
- ^ a b Meyer EJ, Ikmi A, Gibson MC (March 2011). "Interkinetic nuclear migration is a broadly conserved feature of cell division in pseudostratified epithelia". Current Biology. 21 (6): 485–91. doi:10.1016/j.cub.2011.02.002. PMID 21376598.
- ^ a b Luxenburg C, Pasolli HA, Williams SE, Fuchs E (March 2011). "Developmental roles for Srf, cortical cytoskeleton and cell shape in epidermal spindle orientation". Nature Cell Biology. 13 (3): 203–14. doi:10.1038/Ncb2163. PMC 3278337. PMID 21336301.
- ^ Nakajima Y, Meyer EJ, Kroesen A, McKinney SA, Gibson MC (August 2013). "Epithelial junctions maintain tissue architecture by directing planar spindle orientation". Nature. 500 (7462): 359–62. Bibcode:2013Natur.500..359N. doi:10.1038/nature12335. PMID 23873041. S2CID 4418619.
- ^ a b Cadart C, Zlotek-Zlotkiewicz E, Le Berre M, Piel M, Matthews HK (April 2014). "Exploring the function of cell shape and size during mitosis". Developmental Cell. 29 (2): 159–69. doi:10.1016/j.devcel.2014.04.009. PMID 24780736.
- ^ Lancaster OM, Le Berre M, Dimitracopoulos A, Bonazzi D, Zlotek-Zlotkiewicz E, Picone R, Duke T, Piel M, Baum B (May 2013). "Mitotic rounding alters cell geometry to ensure efficient bipolar spindle formation". Developmental Cell. 25 (3): 270–83. doi:10.1016/j.devcel.2013.03.014. PMID 23623611.
- ^ a b Lancaster OM, Baum B (October 2014). "Shaping up to divide: coordinating actin and microtubule cytoskeletal remodelling during mitosis". Seminars in Cell & Developmental Biology. 34: 109–15. doi:10.1016/j.semcdb.2014.02.015. PMID 24607328.
- ^ a b c Maddox AS, Burridge K (January 2003). "RhoA is required for cortical retraction and rigidity during mitotic cell rounding". The Journal of Cell Biology. 160 (2): 255–65. doi:10.1083/jcb.200207130. PMC 2172639. PMID 12538643.
- ^ a b Matthews HK, Delabre U, Rohn JL, Guck J, Kunda P, Baum B (August 2012). "Changes in Ect2 localization couple actomyosin-dependent cell shape changes to mitotic progression". Developmental Cell. 23 (2): 371–83. doi:10.1016/j.devcel.2012.06.003. PMC 3763371. PMID 22898780.
- ^ a b Stewart MP, Helenius J, Toyoda Y, Ramanathan SP, Muller DJ, Hyman AA (January 2011). "Hydrostatic pressure and the actomyosin cortex drive mitotic cell rounding". Nature. 469 (7329): 226–30. Bibcode:2011Natur.469..226S. doi:10.1038/nature09642. PMID 21196934. S2CID 4425308.
- ^ Fischer-Friedrich E, Hyman AA, Jülicher F, Müller DJ, Helenius J (August 2014). "Quantification of surface tension and internal pressure generated by single mitotic cells". Scientific Reports. 4 (6213): 6213. Bibcode:2014NatSR...4E6213F. doi:10.1038/srep06213. PMC 4148660. PMID 25169063.
- ^ a b c d Ramanathan SP, Helenius J, Stewart MP, Cattin CJ, Hyman AA, Muller DJ (February 2015). "Cdk1-dependent mitotic enrichment of cortical myosin II promotes cell rounding against confinement". Nature Cell Biology. 17 (2): 148–59. doi:10.1038/ncb3098. PMID 25621953. S2CID 5208968.
- ^ a b Kadyk LC, Hartwell LH (October 1992). "Sister chromatids are preferred over homologs as substrates for recombinational repair in Saccharomyces cerevisiae". Genetics. 132 (2): 387–402. doi:10.1093/genetics/132.2.387. PMC 1205144. PMID 1427035.
- ^ Botthof JG, Bielczyk-Maczyńska E, Ferreira L, Cvejic A (May 2017). "rad51 leads to Fanconi anemia-like symptoms in zebrafish". Proceedings of the National Academy of Sciences of the United States of America. 114 (22): E4452–E4461. doi:10.1073/pnas.1620631114. PMC 5465903. PMID 28512217.
Here we provide in vivo evidence that the decrease in HSPC numbers in adult fish indeed stems from a combination of decreased proliferation and increased apoptosis during embryonic development. This defect appears to be mediated via p53(10), as our p53/rad51 double mutants did not display any observable hematological defects in embryos or adults.
- ^ Stürzbecher HW, Donzelmann B, Henning W, Knippschild U, Buchhop S (April 1996). "p53 is linked directly to homologous recombination processes via RAD51/RecA protein interaction". The EMBO Journal. 15 (8): 1992–2002. doi:10.1002/j.1460-2075.1996.tb00550.x. PMC 450118. PMID 8617246.
- ^ Sonoda E, Sasaki MS, Buerstedde JM, Bezzubova O, Shinohara A, Ogawa H, et al. (January 1998). "Rad51-deficient vertebrate cells accumulate chromosomal breaks prior to cell death". The EMBO Journal. 17 (2): 598–608. doi:10.1093/emboj/17.2.598. PMC 1170409. PMID 9430650.
- ^ Wilkins AS, Holliday R (January 2009). "The evolution of meiosis from mitosis". Genetics. 181 (1): 3–12. doi:10.1534/genetics.108.099762. PMC 2621177. PMID 19139151.
- ^ 번스타인, H. 번스타인, C.감수분열의 진화적 기원과 적응 기능"Meiosis"에서, Intech Public (Carol Bernstein and Harris Bernstein 에디터들), 3장: 41-75 (2013)
추가열람
- Morgan DL (2007). The cell cycle: principles of control. London: Published by New Science Press in association with Oxford University Press. ISBN 978-0-9539181-2-6.
- Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P (2002). "Mitosis". Molecular Biology of the Cell (4th ed.). Garland Science. Retrieved 2006-01-22.
- Campbell N, Reece J (December 2001). "The Cell Cycle". Biology (6th ed.). San Francisco: Benjamin Cummings/Addison-Wesley. pp. 217–224. ISBN 978-0-8053-6624-2.
- Cooper G (2000). "The Events of M Phase". The Cell: A Molecular Approach (2nd ed.). Sinaeur Associates, Inc. Retrieved 2006-01-22.
- Freeman S (2002). "Cell Division". Biological Science. Upper Saddle River, NJ: Prentice Hall. pp. 155–174. ISBN 978-0-13-081923-9.
- Lodish H, Berk A, Zipursky L, Matsudaira P, Baltimore D, Darnell J (2000). "Overview of the Cell Cycle and Its Control". Molecular Cell Biology (4th ed.). W. H. Freeman. Retrieved 2006-01-22.
외부 링크
- 유사분열과 감수분열을 비교한 플래시 애니메이션
- 칸아카데미, 강연
- 배양된 포유동물 세포의 유사분열 연구
- [연구보고] K-12 승모균 일반교실 자원
- 셀-사이클 온톨로지
- WormWeb.org : C. elegans 세포 계보의 대화형 시각화 – 선충 C. elegans의 전체 세포 계보 트리 및 모든 세포 분열 시각화