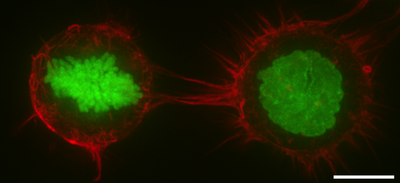
세포피질
Cell cortex액틴피질 또는 액토모신피질이라고도 알려진 세포피질은 세포막 내면에 있는 세포질 단백질의 특화된 층이다. 그것은 막 거동과 세포 표면 특성의 변조기 역할을 한다.[1][2][3] 세포벽이 없는 대부분의 진핵 세포에서 피질은 F-actin 필라멘트, 미오신 모터, 액틴 결합 단백질로 구성된 액틴이 풍부한 네트워크다.[4][5] 액토모신 피질은 ERM 단백질이라고 불리는 막 부착 단백질을 통해 세포막에 부착되며 세포 형태 조절에 중심적인 역할을 한다.[1][6] 피질의 단백질 성분은 빠른 회전을 겪으며, 피질이 기계적으로 경직되고 고도로 플라스틱화되는데, 이는 그 기능에 필수적인 두 가지 특성이다. 대부분의 경우 피질은 두께가 100~1000나노미터에 이른다.
몇몇 동물 세포에서는 단백질 분광체가 피질에 존재할 수 있다. 스펙트린은 교차 연결된 액틴 필라멘트로 네트워크를 만드는 데 도움을 준다.[3] 분광과 액틴의 비율은 세포 유형에 따라 다르다.[7] 분광 단백질과 액틴 마이크로필라멘트는 그 사이에 단백질을 부착함으로써 트랜스엠브레인 단백질에 부착된다. 세포피질은 분광 단백질과 액틴 마이크로필라멘트가 메쉬 같은 구조를 형성하는 세포에서 플라즈마 막의 내측 세포질 표면에 부착되며, 중합, 탈고, 분지에 의해 지속적으로 리모델링된다.
많은 단백질들이 피질 조절과 역학 작용에 관여하는데, 액틴 중합에 역할을 하는 폼인, 액틴 분지 및 캡팅 단백질을 발생시키는 Arp2/3 콤플렉스를 포함한다. 분지 과정과 액틴 피질의 밀도 때문에 피질 세포골격은 프랙탈 구조와 같은 매우 복잡한 메쉬워크를 형성할 수 있다.[8] 특화된 세포는 보통 매우 특정한 피질 액틴 시토스켈레톤으로 특징지어진다. 예를 들어 적혈구에서 세포피질은 오각형 또는 육각형의 대칭을 가진 2차원 교차연계 탄성망으로 구성되어 있으며, 혈장막에 연결되고 주로 분광, 액틴, 앤키린에 의해 형성된다.[9] 뉴런 축에서 액틴/스펙트럼 시토스켈레톤은 주기적인 고리의 배열을 형성하고 정자 평판에서는 나선 구조를 형성한다.[11]
식물 세포에서, 세포 피질은 혈장 막 아래에 있는 피질 미세 관에 의해 강화된다. 이 피질 미세관들의 방향은 세포가 자랄 때 어느 방향으로 길어지는가를 결정한다.
기능들
- 유사분열에서 F-actin과 myosin II는 높은 수축성과 균일한 피질을 형성하여 유사 세포 반올림을 촉진한다. 액토모신 피질 활동에 의해 발생하는 표면 장력은 반올림을 용이하게 하기 위해 주변 물체를 대체할 수 있는 세포내 정수압을 생성한다.[12][13]
- 사이토키네시스에서는 세포피질이 미오신이 풍부한 수축고리를 만들어 분열된 세포를 두 딸세포로 수축시키는 중심 역할을 한다.[14]
- 세포피질 수축성은 많은 암세포 전이 사건의 아메보아달형 세포이동의 핵심이다.[1][15]
참조
- ^ a b c Salbreux G, Charras G, Paluch E (October 2012). "Actin cortex mechanics and cellular morphogenesis". Trends in Cell Biology. 22 (10): 536–45. doi:10.1016/j.tcb.2012.07.001. PMID 22871642.
- ^ Pesen D, Hoh JH (January 2005). "Micromechanical architecture of the endothelial cell cortex". Biophysical Journal. 88 (1): 670–9. doi:10.1529/biophysj.104.049965. PMC 1305044. PMID 15489304.
- ^ a b Alberts, Bruce; Johnson, Alexander; Lewis, Julian; Raff, Martin; Roberts, Keith; Walter, Peter (2002). "Cross-linking Proteins with Distinct Properties Organize Different Assemblies of Actin Filaments". Molecular Biology of the Cell (4th ed.). New York: Garland Science. ISBN 0-8153-3218-1.
- ^ Gunning PW, Ghoshdastider U, Whitaker S, Popp D, Robinson RC (June 2015). "The evolution of compositionally and functionally distinct actin filaments". Journal of Cell Science. 128 (11): 2009–19. doi:10.1242/jcs.165563. PMID 25788699.
- ^ Clark AG, Wartlick O, Salbreux G, Paluch EK (May 2014). "Stresses at the cell surface during animal cell morphogenesis". Current Biology. 24 (10): R484-94. doi:10.1016/j.cub.2014.03.059. PMID 24845681.
- ^ Fehon RG, McClatchey AI, Bretscher A (April 2010). "Organizing the cell cortex: the role of ERM proteins". Nature Reviews. Molecular Cell Biology. 11 (4): 276–87. doi:10.1038/nrm2866. PMC 2871950. PMID 20308985.
- ^ Machnicka B, Grochowalska R, Bogusławska DM, Sikorski AF, Lecomte MC (January 2012). "Spectrin-based skeleton as an actor in cell signaling". Cellular and Molecular Life Sciences. 69 (2): 191–201. doi:10.1007/s00018-011-0804-5. PMC 3249148. PMID 21877118.
- ^ Sadegh S, Higgins JL, Mannion PC, Tamkun MM, Krapf D (2017). "Plasma Membrane is Compartmentalized by a Self-Similar Cortical Actin Meshwork". Physical Review X. 7 (1). doi:10.1103/PhysRevX.7.011031. PMC 5500227. PMID 28690919.
- ^ Gov NS (January 2007). "Active elastic network: cytoskeleton of the red blood cell". Physical Review E. 75 (1 Pt 1): 011921. doi:10.1103/PhysRevE.75.011921. PMID 17358198.
- ^ Xu K, Zhong G, Zhuang X (January 2013). "Actin, spectrin, and associated proteins form a periodic cytoskeletal structure in axons". Science. 339 (6118): 452–6. doi:10.1126/science.1232251. PMC 3815867. PMID 23239625.
- ^ Gervasi MG, Xu X, Carbajal-Gonzalez B, Buffone MG, Visconti PE, Krapf D (June 2018). "The actin cytoskeleton of the mouse sperm flagellum is organized in a helical structure". Journal of Cell Science. 131 (11): jcs215897. doi:10.1242/jcs.215897. PMC 6031324. PMID 29739876.
- ^ Stewart MP, Helenius J, Toyoda Y, Ramanathan SP, Muller DJ, Hyman AA (January 2011). "Hydrostatic pressure and the actomyosin cortex drive mitotic cell rounding". Nature. 469 (7329): 226–30. doi:10.1038/nature09642. PMID 21196934.
- ^ Ramanathan SP, Helenius J, Stewart MP, Cattin CJ, Hyman AA, Muller DJ (February 2015). "Cdk1-dependent mitotic enrichment of cortical myosin II promotes cell rounding against confinement". Nature Cell Biology. 17 (2): 148–59. doi:10.1038/ncb3098. PMID 25621953.
- ^ Green RA, Paluch E, Oegema K (November 2012). "Cytokinesis in animal cells". Annual Review of Cell and Developmental Biology. 28: 29–58. doi:10.1146/annurev-cellbio-101011-155718. PMID 22804577.
- ^ Olson MF, Sahai E (April 2009). "The actin cytoskeleton in cancer cell motility". Clinical & Experimental Metastasis. 26 (4): 273–87. doi:10.1007/s10585-008-9174-2. PMID 18498004.