라이브 셀 이미징
Live-cell imaging
살아있는 세포 이미징은 시간 경과 현미경을 이용한 살아있는 세포에 대한 연구이다.그것은 세포역학에 [1]대한 연구를 통해 생물학적 기능에 대한 더 나은 이해를 얻기 위해 과학자들에 의해 사용된다.라이브 셀 이미징은 21세기 첫 10년에 처음 시작되었습니다.성게알의 [2]수정과 발달을 보여주는 최초의 시한부 세포 마이크로사이노그래피 필름 중 하나는 줄리어스 리스에 의해 만들어졌다.그 이후로, 살아있는 세포를 더 적은 노력으로 더 자세히 연구하기 위해 몇 가지 현미경 검사 방법이 개발되었습니다.양자 도트가 [3]더 안정적인 것으로 나타나기 때문에 양자 도트를 사용하는 새로운 유형의 이미징이 사용되었습니다.홀로토모그래피 현미경의 개발은 세포의 굴절률에 [4][5]기초한 디지털 염색법을 시행함으로써 광독성 및 다른 염색 유래의 단점을 무시해 왔다.
개요
생물학적 시스템은 생명이라고 불리는 현상을 만들기 위해 4차원에 걸쳐 상호작용하는 셀 수 없이 많은 세포 구성 요소들의 복잡한 상호작용으로 존재한다.기존의 정적 이미징 도구를 수용하기 위해 살아있는 유기체를 무생물 표본으로 줄이는 것이 일반적이지만 표본이 고유 조건에서 더 벗어날수록 문제의 섬세한 과정이 [6]동요를 나타낼 가능성이 높아진다.따라서 살아있는 조직의 진정한 생리학적 정체성을 포착하는 부담스러운 작업은 부모 [7]유기체 내의 시공간 모두에 걸쳐 고해상도 시각화를 필요로 한다.실시간으로 세포하 사건의 시공간 이미지를 제공하도록 설계된 살아있는 세포 이미징의 기술적 발전은 실험 중에 관찰된 생리적 변화의 생물학적 관련성을 입증하는 데 중요한 역할을 한다.생리적 조건과의 인접 관계 때문에, 활세포 분석은 복잡하고 역동적인 세포 [8]이벤트를 탐색하는 표준으로 간주된다.이동, 세포 발달, 세포 내 밀매와 같은 동적 과정이 생물학 연구의 초점이 되면서, 세포 네트워크(in situ)와 전체 유기체(in vivo)에 대한 3차원 데이터를 실시간으로 포착할 수 있는 기술은 생물 시스템을 이해하는 데 없어서는 안 될 도구가 될 것이다.라이브 세포 이미징의 일반적인 수용은 시술자 수의 급속한 확대로 이어졌고 [9]세포의 건강을 해치지 않고 공간 및 시간 분해능을 높일 필요성을 확립했다.
사용되는 현미경 검사 유형
위상 대비
위상 대비 현미경이 도입되기 전에는 살아있는 세포를 관찰하기가 어려웠다.살아있는 세포는 반투명하기 때문에 기존의 빛 현미경으로 보이려면 염색해야 한다.불행히도, 세포를 염색하는 과정은 일반적으로 그들을 죽인다.위상 대비 현미경의 발명에 의해, 배양되지 않은 살아있는 세포를 자세하게 관찰할 수 있게 되었다.1940년대에 도입된 후, 살아있는 세포 영상은 위상 대비 [11]현미경을 이용하여 빠르게 인기를 끌었다.위상 대비 현미경은 사진 필름 [12]카메라를 사용하여 녹화한 일련의 시간 경과 영화(비디오 참조)를 통해 대중화되었습니다.그것의 발명가인 Frits Zernike는 [13]1953년에 노벨상을 받았다.비조절 세포를 관찰하기 위해 사용된 다른 후기 위상 대비 기법은 호프만 변조와 차등 간섭 조영 현미경법이다.
형광체
위상 대비 현미경 검사는 세포의 복잡한 기구를 형성하는 특정 단백질이나 다른 유기 화학 화합물을 관찰할 수 있는 능력을 가지고 있지 않다.따라서 합성 및 유기 형광 얼룩은 이러한 화합물을 표시하기 위해 개발되었으며 형광 현미경 검사로 관찰할 수 있습니다(동영상 [15]참조).그러나 형광 얼룩은 관찰 시 광독성, 침습성 및 표백제입니다.이것은 장기간에 걸쳐 살아있는 세포를 관찰할 때 그들의 사용을 제한한다.따라서 비침습적 위상 대비 기법은 라이브 세포 [16][17]영상 애플리케이션에서 형광 현미경을 보완하는 중요한 기술로 자주 사용됩니다.
정량적 위상 대비
디지털 이미지 센서의 화소 밀도가 급격히 높아짐에 따라 양적 위상 대비 현미경이 라이브 셀 [19][20]촬영의 대체 현미경 방법으로 떠올랐다.양적 위상 대비 현미경은 비침습적이고 양적이라는 점에서 형광 및 위상 대비 현미경보다 유리하다.
종래의 현미경 검사의 좁은 초점 깊이 때문에, 라이브 셀의 이미징은 현재, 단일 평면상의 세포를 관찰하는 것에 크게 한정되어 있다.정량적 위상 대비 현미경을 구현하면 단일 노출에서 서로 다른 초점 평면에 영상을 생성하고 초점을 맞출 수 있습니다.이를 통해 형광기법에 의한 3차원 생세포 촬영의 미래 가능성을 열 수 있다.[21]회전 스캔을 사용한 정량적 위상 대비 현미경 검사를 통해 살아있는 세포의 3D 시간 경과 영상을 [22][23][24]고해상도로 획득할 수 있습니다.
홀로토모그래피
홀로토모그래피(HT)는 생체 세포나 조직과 같은 현미경 샘플의 3차원 굴절률(RI) 단층 사진을 측정하는 레이저 기술입니다.RI는 투명 또는 위상 물체에 대한 고유한 영상 조영제 역할을 할 수 있으므로, RI Tomogram(단층 사진) 측정에서는 현미경 위상 물체의 라벨 없는 정량적 영상을 제공할 수 있습니다.HT는 시료의 3D RI Tomogram을 측정하기 위해 홀로그래픽 이미징과 역산란 원리를 사용한다.일반적으로 샘플의 여러 2D 홀로그래픽 이미지를 다양한 조명 각도로 측정하여 간섭 이미징 원리를 사용합니다.그 후, 시료중의 빛의 산란을 역분해해, 이러한 복수의 2D 홀로그래픽 화상으로부터 시료의 3D RI Tomogram을 재구성한다.
HT의 원리는 X선 컴퓨터 단층 촬영(CT) 또는 CT 스캔과 매우 유사합니다.CT 스캔은 다양한 조명 각도에서 인체의 여러 2D X선 영상을 측정한 후 역산란 이론을 사용하여 3D Tomogram(X선 흡수율)을 검색한다.X선 CT와 레이저 HT는 모두 동일한 지배 방정식인 단색 파장의 파동 방정식을 공유합니다.HT는 광학 회절 단층 촬영으로도 알려져 있습니다.
홀로그래피와 회전 스캔의 조합으로 라벨이 없는 라이브 셀의 장기 기록을 가능하게 합니다.
비침습적 광나노시경은 준2µ-홀로그래픽 검출 스킴과 복잡한 디콘볼루션(deconvolution)을 사용하여 이러한 가로 해상도를 달성할 수 있다.이미징된 세포의 공간 주파수는 인간의 눈에는 전혀 의미가 없다.그러나 이 산란된 주파수는 홀로그램으로 변환되어 밴드패스를 합성합니다.이것은 통상 사용 가능한 것보다 2배의 해상도를 가지고 있습니다.홀로그램은 시료 평면에 다른 조명 방향에서 기록되며 시료의 서브파장 단층 변화를 관찰한다.나노스케일 개구부는 단층촬영 재구성을 보정하고 간섭성 전달 기능을 통해 영상 시스템을 특징짓는 역할을 합니다.이를 통해 사실적인 역 필터링이 발생하고 진정한 복잡한 필드 [25]재구성이 보장됩니다.
결론적으로 (i)광학해상도(실제)와 (ii)샘플해상도(화면상)의 2개의 용어를 분리하여 3D홀로토모그래피 현미경을 제작한다.
계장 및 광학
라이브 셀 이미징은 고해상도 이미지를 획득하는 것과 세포를 가능한 [26]한 오래 생존시키는 것 사이의 신중한 타협을 나타냅니다.그 결과, 살아있는 세포 현미경 과학자들은 고정된 표본으로 작업할 때 종종 간과되는 독특한 도전에 직면합니다.또한 라이브 셀 이미징은 종종 특수 광학 시스템과 검출기 규격을 사용한다.예를 들어, 살아있는 세포 영상에 사용되는 현미경은 높은 신호 대 잡음 비, 세포 외 사건의 시간 경과 비디오를 캡처하기 위한 빠른 이미지 획득 속도를 가지며,[27] 세포의 장기적 생존 가능성을 유지할 수 있다.단, 이미지 수집의 단일 측면이라도 최적화하는 것은 자원을 많이 소비하기 때문에 케이스 바이 케이스로 검토할 필요가 있습니다.
렌즈 디자인
저배율 "건조"
시료 작업을 위해 대상물과 시료 사이에 여분의 공간이 필요한 경우 건식 렌즈를 사용할 수 있으며, 잠재적으로 대상물 내 렌즈의 위치를 변경하는 보정 칼라의 추가 조정이 필요할 수 있습니다. 이는 이미지 챔버 간의 차이를 설명하기 위한 것입니다.특수 대물 렌즈는 커버 슬립 두께를 고려하면서 구면 수차를 보정하는 보정 칼라가 장착되어 있습니다.고수치 건식 대물렌즈(NA)에서 보정 칼라 조정링은 렌즈 바깥이 중심에 대해 빛을 집중하는 방법의 차이를 고려하도록 가동 렌즈군의 위치를 변경한다.렌즈 수차는 모든 렌즈 설계에 내재되어 있지만 해상도 유지가 [28]중요한 건식 렌즈에서는 더욱 문제가 됩니다.
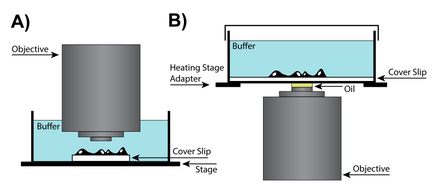
유침 고NA
오일침몰은 렌즈와 시료를 굴절률이 높은 오일에 담가 영상 해상도를 높일 수 있는 기술이다.굴절률이 다른 매체 사이를 통과할 때 빛이 굴절되기 때문에 렌즈와 슬라이드 사이에 유리와 같은 굴절률의 오일을 배치함으로써 굴절률 간의 2회 전이를 [29]피할 수 있다.그러나 살아있는 셀은 수성 환경을 필요로 하고 오일과 물의 혼합은 심각한 구면 이상을 일으킬 수 있기 때문에 대부분의 애플리케이션에서 고정된(죽은) 시료와 함께 오일 침지를 사용하는 것이 좋습니다.일부 애플리케이션의 경우 실리콘 오일을 사용하여 보다 정확한 영상 재구성을 생성할 수 있습니다.실리콘 오일은 생체 세포에 가까운 굴절률을 갖고 있어 구면 [28]수차를 최소화하면서 고해상도 영상을 낼 수 있어 매력적인 매체다.
수분 침투
라이브 셀 이미징에서는 커버 글라스에서 50~200마이크로미터 떨어진 수성 환경에서 샘플이 필요합니다.따라서 환경과 세포 자체가 물의 굴절률에 가깝기 때문에 수몰렌즈는 높은 분해능을 얻을 수 있다.수침 렌즈는 물의 굴절률에 적합하도록 설계되었으며 일반적으로 물체의 조절이 가능한 보정 칼라가 있습니다.또한 물의 굴절률이 높기 때문에 수침렌즈는 개구수가 높아 0µm [28]이상의 평면을 분해할 때 수침렌즈보다 뛰어난 화상을 생성할 수 있다.
담그기
라이브 셀 이미징을 위한 또 다른 솔루션은 침지 렌즈입니다.이 렌즈는 커버 슬립이 필요 없는 수침 렌즈 서브셋으로 샘플의 수성 환경에 직접 담글 수 있습니다.디핑 렌즈의 주요 장점 중 하나는 유효 작동 거리가 [30]길다는 것입니다.커버 슬립이 필요 없기 때문에 이러한 렌즈는 시료 표면에 접근할 수 있으며, 그 결과 커버 슬립의 물리적 한계보다는 구면 수차에 의해 가해지는 구속에 의해 해상도가 제한된다.렌즈를 담그는 것은 매우 유용할 수 있지만 렌즈를 "담그는" 행위는 샘플의 세포를 교란시킬 수 있기 때문에 모든 실험에 이상적인 것은 아닙니다.또한 배양실은 렌즈에 개방되어야 하므로 증발로 인한 시료환경의 변화를 면밀히 [28]관찰해야 한다.
광독성 및 광표백
오늘날 대부분의 라이브 이미징 기술은 광독성을 유발하고 세포를 교란되지 않고 시간이 지남에 따라 살아있는 능력을 손상시키는 고휘도 방식 또는 형광 라벨에 의존합니다.생물학에 대한 우리의 지식은 관찰에 의해 움직이기 때문에, 영상 기술에 의해 유발되는 섭동을 최소화하는 것이 중요하다.
공초점 현미경의 상승은 고강도 광 들뜸을 달성할 수 있는 고출력 레이저의 접근성과 밀접한 관련이 있다.다만, 고출력에서는, 민감한 형광체가 파손될 가능성이 있기 때문에, 통상,[31] 레이저의 출력은 최대 출력보다 큰폭으로 저하합니다.빛에 과도하게 노출되면 광표백 또는 광독성으로 인해 광손상이 발생할 수 있습니다.광표백의 효과는 형광 영상의 품질을 크게 떨어뜨릴 수 있으며, 최근에는 더 오래 지속되는 상용 형광체에 대한 수요가 증가하고 있다.Alexa Fluor 시리즈는 레이저 강도가 높아도 색이 바래지 [32]않습니다.
생리학적 조건 하에서 많은 세포와 조직 유형은 낮은 수준의 [33]빛에만 노출된다.그 결과,[34] DNA를 손상시키고, 세포 온도를 높이고, 광 표백을 일으킬 수 있는 자외선, 적외선 또는 형광 들뜸 파장의 높은 용량에 살아있는 세포가 노출되는 것을 최소화하는 것이 중요하다.형광체와 시료에 흡수된 고에너지 광자는 스톡스 [35]시프트에 비례하는 긴 파장으로 방출된다.그러나 광자 에너지가 [36]재방출되지 않고 화학적 및 분자적 변화를 일으키면 세포소기관들이 손상될 수 있다.살아있는 세포가 경험하는 빛에 의한 독성의 주된 원인은 형광 [33]분자의 들뜸에 의해 생성된 유리기의 결과라고 생각된다.이러한 활성산소는 매우 반응적이며 세포 성분을 파괴하여 비생리학적인 행동을 일으킬 수 있습니다.
광손상을 최소화하는 한 가지 방법은 활성산소종의 [37]형성을 방지하기 위해 샘플의 산소 농도를 낮추는 것입니다.그러나 이 방법이 라이브 셀 이미징에서 항상 가능한 것은 아니며 추가 개입이 필요할 수 있습니다.검체 내 활성산소의 효과를 감소시키는 또 다른 방법은 항균제 시약을 사용하는 것입니다.안타깝게도 대부분의 시판되는 항균제는 독성 때문에 [38]생세포 이미징에 사용할 수 없습니다.대신에, 비타민 C나 비타민 E와 같은 천연 자유 방사성 스캐빈저를 짧은 시간 [39]단위로 생리학적 행동을 크게 바꾸지 않고 사용할 수 있습니다.최근 광독성이 없는 활세포 이미징이 개발되어 상용화 되었다.홀로토모그래피 현미경은 저전력 레이저(레이저 클래스 1: 0.2mW/mm2)[4][5][40]로 광독성을 방지합니다.
「 」를 참조해 주세요.
레퍼런스
- ^ Baker M (August 2010). "Cellular imaging: Taking a long, hard look". Nature. 466 (7310): 1137–1140. Bibcode:2010Natur.466.1137B. doi:10.1038/4661137a. PMID 20740018. S2CID 205056946.
- ^ Landecker H (October 2009). "Seeing things: from microcinematography to live cell imaging". Nature Methods. 6 (10): 707–709. doi:10.1038/nmeth1009-707. PMID 19953685. S2CID 6521488.
- ^ Jaiswal JK, Goldman ER, Mattoussi H, Simon SM (October 2004). "Use of quantum dots for live cell imaging". Nature Methods. 1 (1): 73–78. doi:10.1038/nmeth1004-73. PMID 16138413. S2CID 13339279.
- ^ a b Pollaro, L.; Equis, S.; Dalla Piazza, B.; Cotte, Y. (2016). "Stain‐free 3D Nanoscopy of Living Cells". Optik & Photonik. 11: 38–42. doi:10.1002/opph.201600008.
- ^ a b Pollaro, L.; Dalla Piazza, B.; Cotte, Y. (2015). "Digital Staining: Microscopy of Live Cells Without Invasive Chemicals" (PDF). Microscopy Today. 23 (4): 12–17. doi:10.1017/S1551929515000590. S2CID 135982205.
- ^ Petroll, W. M.; Jester, J. V.; Cavanagh, H. D. (May 1994). "In vivo confocal imaging: general principles and applications". Scanning. 16 (3): 131–149. ISSN 0161-0457. PMID 8038913.
- ^ Meijering, Erik; Dzyubachyk, Oleh; Smal, Ihor (2012-01-01). Methods for Cell and Particle Tracking. Methods in Enzymology. Vol. 504. pp. 183–200. doi:10.1016/B978-0-12-391857-4.00009-4. ISBN 9780123918574. ISSN 0076-6879. PMID 22264535.
- ^ Allan, Victoria J.; Stephens, David J. (2003-04-04). "Light Microscopy Techniques for Live Cell Imaging". Science. 300 (5616): 82–86. Bibcode:2003Sci...300...82S. CiteSeerX 10.1.1.702.4732. doi:10.1126/science.1082160. ISSN 1095-9203. PMID 12677057. S2CID 33199613.
- ^ Dance, Amber (2018-03-27). "Live-cell imaging: Deeper, faster, wider". Science. AAAS. Retrieved 2018-12-17.
- ^ Michel K. "Historic time lapse movie by Dr. Kurt Michel, Carl Zeiss Jena (ca. 1943)". Zeiss Microscopy library.
- ^ Burgess M (15 October 2003). "Celebrating 50 years of Live Cell Imaging" (PDF). Carl Zeiss UK and The Royal Microscopical Society. London: The Biochemical Society.
- ^ Gundlach H. "50 Years Ago: Frits Zernike (1888-1966) Got the Nobel Prize in Physics for the Development of the Phase Contrast Method" (PDF) (Press release). Carl Zeiss AG. Archived from the original (PDF) on March 22, 2014.
- ^ "The Nobel Prize in Physics 1953". Nobel Media AB.
- ^ von Dassow G, Verbrugghe KJ, Miller AL, Sider JR, Bement WM. "Cellular division in purple urchin embryo". The Cell — an image library.
- ^ Stockert JC, Blázquez-Castro A (2017). Fluorescence Microscopy in Life Sciences. Bentham Science Publishers. ISBN 978-1-68108-519-7. Retrieved 24 December 2017.
- ^ Stephens DJ, Allan VJ (April 2003). "Light microscopy techniques for live cell imaging". Science. 300 (5616): 82–86. Bibcode:2003Sci...300...82S. CiteSeerX 10.1.1.702.4732. doi:10.1126/science.1082160. PMID 12677057. S2CID 33199613.
- ^ Ge J, Wood DK, Weingeist DM, Prasongtanakij S, Navasumrit P, Ruchirawat M, Engelward BP (June 2013). "Standard fluorescent imaging of live cells is highly genotoxic". Cytometry. Part A. 83 (6): 552–560. doi:10.1002/cyto.a.22291. PMC 3677558. PMID 23650257.
- ^ Janicke B. "Digital holographic microscopy video showing cell division of unlabeled JIMT-1 breast cancer cells". The Cell — an image library.
- ^ Park Y, Depeursinge C, Popescu, G (2018). "Quantitative phase imaging in biomedicine". Nature Photonics. 12 (10): 578–589. Bibcode:2018NaPho..12..578P. doi:10.1038/s41566-018-0253-x. PMID 26648557. S2CID 126144855.
- ^ Cuche E, Bevilacqua F, Depeursinge C (1999). "Digital holography for quantitative phase-contrast imaging". Optics Letters. 24 (5): 291–293. Bibcode:1999OptL...24..291C. doi:10.1364/OL.24.000291. PMID 18071483. S2CID 38085266.
- ^ Rosen J, Brooker G (2008). "Non-scanning motionless fluorescence three-dimensional holographic microscopy". Nature Photonics. 2 (3): 190–195. Bibcode:2008NaPho...2..190R. doi:10.1038/nphoton.2007.300. S2CID 17818065.
- ^ Wonshik C, Fang-Yen C, Badizadegan K, Oh S, Lue N, Dasari R, Feld M (2007). "Tomographic phase microscopy". Nature Methods. 4 (9): 717–719. doi:10.1038/nmeth1078. PMID 17694065. S2CID 205418034.
- ^ Cotte Y, Toy F, Jourdain P, Pavillon N, Boss D, Magistretti P, Marquet P, Depeursinge C (2013). "Marker-free phase nanoscopy". Nature Photonics. 7 (2): 113–117. Bibcode:2013NaPho...7..113C. doi:10.1038/nphoton.2012.329. S2CID 16407188.
- ^ Pollaro L, Equis S, Dalla Piazza B, Cotte Y (2016). "Stain-free 3D Nanoscopy of Living Cells". Optik & Photonik. Wiley Online Library. 11: 38–42. doi:10.1002/opph.201600008.
- ^ Cotte, Yann; Toy, Fatih; Jourdain, Pascal; Pavillon, Nicolas; Boss, Daniel; Magistretti, Pierre; Marquet, Pierre; Depeursinge, Christian (February 2013). "Marker-free phase nanoscopy". Nature Photonics. 7 (2): 113–117. Bibcode:2013NaPho...7..113C. doi:10.1038/nphoton.2012.329. ISSN 1749-4893.
- ^ Jensen EC (January 2013). "Overview of live-cell imaging: requirements and methods used". Anatomical Record. 296 (1): 1–8. doi:10.1002/ar.22554. PMID 22907880. S2CID 35790454.
- ^ Waters JC (2013). "Live-cell fluorescence imaging". Digital Microscopy. Methods in Cell Biology. Vol. 114. pp. 125–150. doi:10.1016/B978-0-12-407761-4.00006-3. ISBN 9780124077614. PMID 23931505.
- ^ a b c d Hibbs AR (2004). Confocal microscopy for biologists. New York: Kluwer Academic/Plenum Publishers. ISBN 978-0306484681. OCLC 54424872.
- ^ Mansfield SM, Kino GS (1990-12-10). "Solid immersion microscope". Applied Physics Letters. 57 (24): 2615–2616. Bibcode:1990ApPhL..57.2615M. doi:10.1063/1.103828.
- ^ Keller HE (2006), "Objective Lenses for Confocal Microscopy", Handbook of Biological Confocal Microscopy, Springer US, pp. 145–161, doi:10.1007/978-0-387-45524-2_7, ISBN 9780387259215, S2CID 34412257
- ^ Amos, W. B.; White, J. G. (2003-09-01). "How the Confocal Laser Scanning Microscope entered Biological Research". Biology of the Cell. 95 (6): 335–342. doi:10.1016/S0248-4900(03)00078-9. PMID 14519550. S2CID 34919506.
- ^ Anderson GP, Nerurkar NL (2002-12-20). "Improved fluoroimmunoassays using the dye Alexa Fluor 647 with the RAPTOR, a fiber optic biosensor 7". Journal of Immunological Methods. 271 (1–2): 17–24. doi:10.1016/S0022-1759(02)00327-7. ISSN 0022-1759. PMID 12445725.
- ^ a b Frigault MM, Lacoste J, Swift JL, Brown CM (March 2009). "Live-cell microscopy - tips and tools". Journal of Cell Science. 122 (Pt 6): 753–767. doi:10.1242/jcs.033837. PMID 19261845.
- ^ Magidson V, Khodjakov A (2013). "Circumventing photodamage in live-cell microscopy". Digital Microscopy. Methods in Cell Biology. Vol. 114. pp. 545–560. doi:10.1016/B978-0-12-407761-4.00023-3. ISBN 9780124077614. PMC 3843244. PMID 23931522.
- ^ Rost FW (1992–1995). Fluorescence microscopy. Cambridge: Cambridge University Press. ISBN 978-0521236416. OCLC 23766227.
- ^ Laissue PP, Alghamdi RA, Tomancak P, Reynaud EG, Shroff H (June 2017). "Assessing phototoxicity in live fluorescence imaging". Nature Methods. 14 (7): 657–661. doi:10.1038/nmeth.4344. hdl:21.11116/0000-0002-8B80-0. PMID 28661494. S2CID 6844352.
- ^ Ettinger A, Wittmann T (2014). "Fluorescence live cell imaging". Quantitative Imaging in Cell Biology. Methods in Cell Biology. Vol. 123. pp. 77–94. doi:10.1016/B978-0-12-420138-5.00005-7. ISBN 9780124201385. PMC 4198327. PMID 24974023.
- ^ Pawley JB (2006). Handbook of biological confocal microscopy (3rd ed.). New York, NY: Springer. ISBN 9780387455242. OCLC 663880901.
- ^ Watu A, Metussin N, Yasin HM, Usman A (2018). "The total antioxidant capacity and fluorescence imaging of selected plant leaves commonly consumed in Brunei Darussalam". AIP Conference Proceedings. 1933 (1): 020001. Bibcode:2018AIPC.1933b0001W. doi:10.1063/1.5023935.
- ^ Sandoz, Patrick A.; Tremblay, Christopher; Equis, Sebastien; Pop, Sorin; Pollaro, Lisa; Cotte, Yann; van der Goot, F. Gisou; Frechin, Mathieu (2018-09-04). "Label free 3D analysis of organelles in living cells by refractive index shows pre-mitotic organelle spinning in mammalian stem cells". bioRxiv 10.1101/407239.