바필로마이신
Bafilomycin | |
| 이름 | |
|---|---|
| IUPAC 이름 (3Z,5E,7R,8S,9S,11E,13E,15S,16R)-16-[(1S,2R,3S)-3-[(2R,4R,5S,6R)]-2,4-디히드록시-5-테트라메틸 | |
| 식별자 | |
| 첸블 | |
| 켐스파이더 | |
| 드러그뱅크 | |
| ECHA 정보 카드 | 100.150.187 |
PubChem CID | |
| 특성. | |
| C35H58O9 | |
| 몰 질량 | 622.83g/표준 |
| 외모 | 황색 가루 |
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |
바필로마이신은 다양한 스트렙토균에서 생산되는 마크로라이드 항생제이다.이들의 화학적 구조는 16원짜리 락톤 고리 [2]골격에 의해 정의된다.바필로마이신은 항종양,[3] 항기생충,[4][5] 면역억제제[6] 및 항진균[7] 활성을 포함한 광범위한 생물학적 활성을 보인다.가장 많이 사용되는 바필로마이신은 세포 자동 파지의 강력한 억제제인 바필로마이신 A1이다.바필로마이신은 또한 생체막을 가로질러 칼륨 K+를 운반하여 미토콘드리아 손상과 세포 [8]사멸을 초래하는 이오노포어 역할을 하는 것으로 밝혀졌다.
바필로마이신 A1은 세포외 환경 또는 리소좀과 같은 세포내 오르간 중 하나를 산성화하는 막간 양성자 펌프인 액포형 H+ -ATPase(V-ATPase) 효소를 특이적으로 대상으로 한다.더 높은 마이크로몰 농도에서 바필로마이신 A1은 또한 인산화 과도 [2]상태를 가진 P형 ATPase에 작용한다.
바필로마이신 A1은 많은 시험관내 연구에서 중요한 도구 화합물 역할을 하지만, 상당한 독성 [9]프로파일에 의해 임상적으로 사용이 제한된다.
검출과 이력
바필로마이신 A1, B1, C1은 1983년 [9]스트렙토마이세스 그리세우스로부터 처음 분리되었다.두 개의 심장 글리코시드와 유사한 활성을 가진 미생물 2차 대사물 식별을 위한 스크린에서 바필로마이신 C1은 k가i 11μM인 P-ATPase의 억제제로서 동정되었다.바필로마이신 C1은 랫드 시냅토솜에서 γ-아미노부티룩산(GABA)의 방출을 자극하는 것 외에 케노하브디티스 엘레건, 진드기, 촌충에 대한 활성을 가진 것으로 밝혀졌다.독립적으로 바필로마이신 A1 및 기타 유도체는 S. 그리세우스로부터 분리되었으며 일부 효모, 그램 양성 박테리아 및 [10]곰팡이에 대한 항생제 활성을 보였다.또한 바필로마이신 A1은 콘카나발린 A 자극 T세포에 항증식 효과가 있는 것으로 나타났다.그러나 높은 독성으로 인해 임상시험에 [2]사용할 수 없었다.
2년 후, 바필로마이신 D와 E도 S. 그리세우스로부터 분리되었다.2010년 9-히드록시-바필로마이신 D, 29-히드록시-바필로마이신 D 및 다수의 다른 바필로마이신들이 내생 미생물 Streptomyces sp로부터 확인되었다.YIM56209.[11]2004년부터 2011년까지 바필로마이신 F-K는 다른 Streptomyces [9]sp로부터 분리되었다.
최초로 확인되고 가장 일반적으로 사용되는 바필로마이신 A1은 특히 그 구조가 다른 모든 바필로마이신의 핵심 역할을 하기 때문에 특히 중요하다.큰 구조를 가진 바필로마이신은 여러 개의 키랄 중심과 기능군을 가지고 있어 구조를 수정하는 것이 어려우며, 이는 화합물의 관련 [9]독성을 감소시키기 위해 시도되었다.

대상
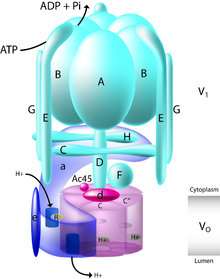
세포 내에서 바필로마이신 A1은 양성자 펌프 V-ATPase와 특이적으로 상호작용한다.이 큰 단백질은 생물학적 [3]막을 가로질러 양성자를 펌프하기 위해 아데노신 삼인산(ATP) 가수 분해에 의존합니다.1980년대에 바필로마이신과 콘카마이신과 같은 V-ATPase의 다른 억제제가 처음 발견되었을 때, 그것들은 양성자 펌프의 [12]분포를 특징짓는 특화된 세포 유형 및 조직에서 V-ATPase의 존재를 확립하는 데 사용되었다.구조적으로, V-ATPase는 [3]효소의 V 도메인과 세포질1 V 도메인을 포괄하는o 막을 구성하는 13개의 서로 다른 서브 유닛으로 구성되어 있다.Cytosol의 V 도메인은 A에서1 H까지의 서브유닛으로 구성되며, V 도메인은o a, d, e, c"[13] 서브유닛으로 구성됩니다.
V-ATPase 작용 메커니즘
막을 가로질러 양성자를 이동시키기 위해, 양성자는 먼저 세포질 헤미채널을 통해 V 도메인o 내의 서브유닛 a로 들어갑니다.이를 통해 V 서브유닛 c와 c"의o 단백질 지질 고리 내에 보존된 글루탐산 잔류물이 양성자화될 수 있다.다음으로 아데노신3인산(ATP)은 효소의 V도메인에1 의해 가수분해되며, 서브유닛 D, F 및 d로 이루어진 펌프의 중앙줄기의 회전과 단백질지질 고리의 회전을 모두 가능하게 한다.이러한 회전은 양성자화된 글루탐산 잔류물을 서브유닛 a에 위치한 내강 헤미채널과 접촉시킨다.서브유닛 a 내에서 아르기닌 잔기는 글루탐산의 탈양성자 형태를 안정시키고 양성자의 방출을 가능하게 하는 역할을 한다.이 회전과 양성자 전달은 양자를 펌프를 통해 [3][13]막을 가로질러 가져옵니다.
바필로마이신-V-ATPase 상호작용
바필로마이신이 V-ATPase 억제제로 발견된 후 10년 이상 동안 V-ATPase와의 상호작용 부위는 불분명했다.초기 연구들은 바필로마이신이 V 도메인과o 상호작용했다는 것을 암시하기 위해 크롬아핀 과립 V-ATPase를 사용했다.두 개의 추가 연구는 소 클라트린 코팅 소포의 V-ATPase를 사용하여 이 가설을 확인했습니다.그들은 바필로마이신의 적용이 V를 통한o 양성자 흐름을 억제하고 V 도메인을o 코팅된 소포에 다시 추가함으로써 이러한 억제를 극복할 수 있음을 보여주었다.바필로마이신의 상호작용 부위를 더욱 좁혀서, 그들은 단지o V 서브유닛 a의 특정한 추가가 기능을 회복시킬 수 있다는 것을 발견했다.이는 바필로마이신이 V-ATPase의 서브유닛 a와 특이적으로 상호작용을 한다는 것을 시사했다. 그러나 다른 연구는 이러한 발견과 모순되었다.한 그룹은 바필로마이신 친화성 크로마토그래피 컬럼 V-ATPase를 사용하여 정제할 수 있으며, V co 서브유닛의 억제제인 DCCD를 첨가하면 V-ATPase에 대한 바필로마이신의 친화성이 현저하게 감소한다는 것을 발견했다.이는 바필로마이신이 V 도메인의o 서브유닛 c와 더 강하게 상호작용했음을 시사했다.그 후 두 가지 추가 연구에서 방사선 라벨링과 단백질 결정화를 사용하여 이러한 상호작용을 확인했다.그러나 서브유닛 a 내 아미노산 변화도 V-ATPase-Bafilomycin 상호작용을 낮출 수 있어 서브유닛 [12]c 외에 바필로마이신 결합에서 서브유닛 a의 역할이 미미하다는 사실이 추가로 밝혀졌다.
전반적으로, 바필로마이신은 V-ATPase [3]복합체의 V c 서브유닛에o 나노몰 효율로 결합한다.구체적으로 바필로마이신은 V의 단백질o 지질 고리와 상호작용하여 양성자 [13]전위를 억제한다.바필로마이신과 V-ATPase의 상호작용은 공유가 아니지만, 약 10nM의 낮은 해리 상수는 바필로마이신의 상호작용 강도를 나타내며,[14] 바필로마이신의 효과를 되돌리기 어렵게 할 수 있다.
V-ATPase 현지화 및 기능
V-ATPase는 포유류의 세포 어디에나 존재하며 많은 세포 과정에서 중요한 역할을 한다.그것은 리소좀, 분비성 소포, 그리고 [15]엔도솜을 포함하여, 트랜스골기 네트워크와 그것으로부터 파생된 세포 조직에 국소화된다.V-ATPase는 또한 혈장막 내에서 발견될 수 있다.포유동물에서 V-ATPase의 위치는 복합체가 가지는 서브유닛 a의 특이적 등유형에 관련될 수 있다.Isoforms a1 및 a2는 각각 시냅스 소포 및 엔도솜을 대상으로 세포 내 V-ATPase를 표적으로 한다.단, 서브유닛 a3, a4는 골아세포(a3) 및 신장간격세포(a4)에서 혈장막으로의 V-ATPase 정위를 매개한다.리소좀막에 위치하면 루메날 pH가 낮아짐에 따라 리소좀의 산성화를 초래하여 리소좀 가수분해효소의 활성을 가능하게 한다.혈장막에 V-ATPase가 위치할 때 펌프를 통한 양성자 압출은 세포외 공간의 산성화를 유발하며, 이는 골아세포, 부고환 클리어 세포, 신장상피 인터칼레이션 [3]세포와 같은 특수 세포에 의해 이용된다.
세포내 기능
리소좀, 엔도솜 및 분비 소포의 산성화를 촉진하기 때문에, V-ATPase는 다음을 포함한 과정에 기여합니다.
리소좀 산화에 있어 V-ATPase는 또한 세포질로 이온과 작은 분자들, 특히 칼슘과 아미노산을 운반하는 데 중요하다.또한 낮은 pH가 리간드 방출을 유도하는 경향이 있고,[3] 노치 세포내 도메인의 방출과 같은 시그널링 이벤트에 기여하는 수용체 분열이 있기 때문에 엔도솜의 산성화는 수용체 내세포증에서 매우 중요하다.
혈장막 기능
혈장막에서 V-ATPase 기능은 골아세포와 표피 클리어 세포에서 볼 수 있는 세포외 환경의 산성화에 매우 중요하다.신장상피간격세포의 혈장막에 존재할 때 V-ATPase는 소변의 산성화에 기여하는 산 분비에 중요하다.감소된 혈장 pH에 반응하여 증가된 V-ATPase는 일반적으로 단백질 키나제 A(PKA)[3]에 의한 펌프의 인산화에 의해 이들 세포 내의 혈장 막에 전달된다.
질환의 V-ATPase
임상적으로, V-ATPase의 기능 장애는 인간의 여러 질병과 관련이 있다.이러한 질병들 중 일부는 남성 불임, 골편화증, 신장산증 [12]등을 포함한다.또한 V-ATPase는 유방암, 전립선암 및 간암을 포함한 일부 침습성 암세포의 혈장막에서 발견될 수 있다.인간 폐암 검체에서 V-ATPase 발현은 약물 [13]저항성과 상관관계가 있었다.또한 많은 수의 V-ATPase 서브유닛 돌연변이는 모낭 [3]림프종을 포함한 많은 암에서 확인되었다.
세포 작용
바필로마이신 V-ATPase의 표적이 세포 기능의 여러 측면에 관여하기 때문에 바필로마이신 처리는 세포 과정을 크게 변화시킨다.
자동 파지의 억제
바필로마이신 A1은 자가파지 [10][16]억제제로 사용되는 것으로 가장 잘 알려져 있다.오토파지는 세포가 오토파고좀의 형성을 통해 자신의 세포와 일부 단백질을 분해하는 과정이다.오토파고솜은 리소좀 단백질 분해효소에 의해 삼켜진 화물의 분해를 용이하게 하는 리소좀과 융합한다.이 과정은 영양소 결핍이나 다른 신진대사 스트레스가 [17]있을 때 세포의 아미노산 및 다른 영양소의 저장을 유지하는 데 중요합니다.바필로마이신은 리소좀의 V-ATPase와의 상호작용을 통해 산성화를 억제함으로써 이 과정을 방해한다.리소좀 산화의 부족은 카테프신과 같은 리소좀 단백질 분해효소의 활성을 막아 삼킨 화물이 더 이상 [16]분해되지 않도록 한다.

V-ATPase는 세포 내에 널리 분포하기 때문에 바필로마이신은 단시간 동안만 자가파지 억제제로서 특이하다.다른 효과는 이 짧은 창 밖에서 볼 수 있는데, 여기에는 엔도솜의 밀매와 프로테아솜 [16]억제가 포함된다.
바필로마이신은 리소좀의 산성화를 막는 것 외에도 오토파고솜과 리소좀의 [10]융합을 막는 것으로 보고되었다.이것은 처음에 야마모토 등의 논문에서 발견되었는데, 저자들은 쥐 간종 H-4-II-E 세포를 치료하기 위해 바필로마이신 A1을 사용했다.전자현미경 검사에서는 100nM 농도로 1시간 동안 바필로마이신을 사용한 후 오토파고솜-리소좀 융합이 막히는 것을 확인했다.이는 다른 연구들, 특히 100 또는 400nM의 바필로마이신을 사용한 12-24시간 치료 후 형광 현미경 검사에 의해 미토콘드리아와 리소좀의 혈소화 감소가 발견된 두 연구들에 의해 확인되었다.그러나, 더 많은 연구들은 유사한 바필로마이신 치료제와의 융접의 억제를 발견하지 못했다.이러한 모순된 결과는 치료제 간의 시간 차이와 다른 세포주 사용으로 설명되었습니다.바필로마이신이 오토파고솜-리소좀 융합에 미치는 영향은 복잡하고 각 [8][18]세포주마다 시간에 따라 다르다.
뉴런에서는 바필로마이신 치료와 함께 자가고체 마커 LC3-II의 증가가 관찰되었다.이것은 오토파고솜이 리소좀과 융합하지 못함에 따라 발생하며, 이는 보통 LC3-II의 [19]분해를 자극한다.
아포토시스 유도
PC12 세포에서 바필로마이신은 아포토시스, 즉 프로그램된 세포사멸을 [14]유도하는 것으로 밝혀졌다.또한 일부 세포주에서는 미토콘드리아의 전기화학적 구배를 교란시키고 아포토시스의 [8]개시자인 시토크롬c의 방출을 유도하는 것으로 밝혀졌다.바필로마이신은 또한 다른 [3]암 세포주뿐만 아니라 골육종[20] 세포에서 자가파지의 억제와 그에 따른 아포토시스 유도 모두를 유도하는 것으로 나타났다.
K+ 트랜스포트
바필로마이신은 이오노포어 역할을 하는데, 이것은 K이온을 생물학적 [12]막을 통해 전달할+ 수 있다는 것을 의미합니다.전형적으로 미토콘드리아 내막은 K에+ 투과하지 않고 일정한 전기화학적 구배를 유지한다.흥분성 세포에서, 미토콘드리아는 열렸을 때, 미토콘드리아의 팽창을 유도하고, 전기 화학적 구배를 변화시키고, 그리고 호흡을 자극함으로써 미토콘드리아 스트레스를 야기할 수 있는 K 채널을+ 포함할 수 있다.바필로마이신 A1 처리는 K 이온의 존재+ 하에서 미토콘드리아 팽창을 유도하고, 피리미딘 뉴클레오티드의 산화를 촉진하며, 산화적 인산화를 분리할 수 있다.바필로마이신의 상승 농도는 미토콘드리아 막을 가로지르는 K의 양을+ 선형적으로 증가시켜 이오노포어 역할을 하는 것을 확인했다.그러나 다른 이오노포어에 비해 바필로마이신은 [8]K에 대한+ 친화력이 낮다.
조사 어플리케이션
항종양성
많은 암에서 V-ATPase의 다양한 서브유닛이 상향 [13]조절되는 것으로 밝혀졌다.이러한 서브유닛의 상향조절은 종양세포 전이 증가 및 임상 결과 감소와 상관관계가 있는 것으로 보인다.바필로마이신 적용은 아포토시스의 유도에 의해 여러 암 유형에 걸쳐 다양한 암 세포주의 세포 성장을 감소시키는 것으로 나타났다.또한 시험관내 바필로마이신의 항증식효과는 정상세포보다 암세포에 특이적으로 나타나며, 이는 건강한 [3]간세포에 비해 간아종세포 증식을 선택적으로 억제하는 것으로 나타난다.
바필로마이신이 이 암 특이적 항증식 효과를 일으키는 메커니즘은 다인자이다.미토콘드리아 경로를 통한 카스파아제 의존성 아포토시스의 유도 외에도, 바필로마이신은 또한 활성 산소종의 증가 및 HIF1alpha의 발현을 증가시킨다.이러한 효과는 바필로마이신에 의한 V-ATPase의 억제가 자가파지와 궁극적인 아포토시스를 포함한 세포 스트레스 반응을 유도할 수 있음을 시사한다.아포토시스의 억제 또는 유도 측면에서 V-ATPase 억제의 이러한 다소 모순적인 효과는 바필로마이신의 기능이 세포 맥락에 심각하게 의존하며, 생존 전 또는 사망 [3][18]전 표현형을 매개할 수 있음을 보여준다.
생체내 바필로마이신은 MCF-7 및 MDA-MB-231 이종 이식 마우스 모델에서 평균 종양량을 50% 감소시켰으며 1mg/kg 용량에서 독성 효과를 나타내지 않았다.또한 바필로마이신은 소라페닙과 결합했을 때 MDA-MB-231 이종 이식 생쥐에서도 종양 퇴행의 원인이 되었다.누드 마우스를 대상으로 한 HepG2 직교향성 HCC 이종 이식 모델에서 바필로마이신은 종양 성장을 [3]막았다.
V-ATPase 조절 장애는 세포 외 환경의 비정상적인 산화가 화학 요법을 양성화시켜 [3][13]세포로의 진입을 방해할 수 있기 때문에 암 치료에 대한 내성에 영향을 미치는 것으로 생각된다.V-ATPase 규제 불량이 임상 결과 불량과 관련된 직접적인 원인인지 또는 규제 불량이 치료에 대한 반응에 일차적으로 영향을 미치는지는 불분명하다.비록 바필로마이신과 시스플라틴으로 치료한 것이 암세포 [3]독성에 상승 효과가 있었다.
안티펑갈
바필로마이신은 혈장막 ATPase(P-ATPase)와 ATP 결합 카세트(ABC) 운반체를 억제하는 것으로 나타났다.이러한 운반체는 유기체가 양이온 [7]스트레스에 대처할 수 없도록 만들기 때문에 좋은 항균 표적으로 식별된다.크립토코커스 네오포만스를 바필로마이신 처리했을 때 성장 억제가 [21]관찰되었다.바필로마이신은 또한 C. 네오포만스에서도 칼시뉴린 억제제 FK506과 함께 사용되어 상승적인 항균 [7]활성을 보였다.
구충 방지
바필로마이신은 말라리아의 원인 물질인 플라즈모듐 팔시파룸에 대해 활성인 것으로 나타났다.적혈구 감염 시, P. falciparum은 적혈구 세포질로 막 네트워크를 내보내고 또한 자신의 V-ATPase를 포함한 여러 개의 단백질을 숙주 막에 삽입합니다.이 양성자 펌프는 감염된 적혈구의 세포 내 pH를 유지하고 작은 대사물의 평형 흡수를 촉진하는 역할을 한다.기생 적혈구를 바필로마이신으로 처리함으로써 세포외 산화를 방지하고 말라리아 기생충 [4][5]주위의 세포내 pH의 저하를 일으킨다.
면역 억제제
염증성 근막증(IBM)은 50세 이상의 환자에서 비교적 흔하며 자가마법 플럭스의 과다 활성화를 수반한다.이 상태에서 자가파지가 증가하면 단백질 분해가 증가하므로 근육 내 항원펩타이드의 발현도 증가한다.이것은 면역세포의 과활성화를 야기할 수 있다.바필로마이신에 의한 치료는 리소좀의 산성화를 예방할 수 있고, 따라서 자가파지를 예방할 수 있으며, 소화되어 면역 시스템에 [6]표시되는 항원 펩타이드의 수를 줄일 수 있다.
루푸스 환자의 경우 B세포와 T세포 모두에서 자가파지 경로가 변화한 것으로 밝혀졌다.특히, T세포에서 자가포진 액포(autophagic vacuole)가 더 많이 나타났고, 자가포진(autophagy)에 대한 LC3-11 염색도 증가하여 자가포진의 증가를 나타냈다.순진한 환자 B 세포 서브셋에서도 자가파지의 증가를 볼 수 있다.바필로마이신 A1 치료제는 플라스마블라스트의 분화를 낮추고 [22]생존을 감소시켰다.
신경변성 질환의 단백질 골재 클리어런스
신경변성 질환은 전형적으로 세포 내에서 뉴런 기능 장애와 궁극적인 신경 사망에 기여하는 높은 수준의 단백질 응집체를 보인다.세포 내 단백질 분해 방법으로서 오토파지는 리소좀에서 분해되도록 이들 단백질 집적물을 수송할 수 있다.지속적인 자기파지, 즉 자기파지 플럭스가 신경의 항상성과 질병 상태에서 정확히 어떤 역할을 하는지는 불분명하지만, 신경변성 [19]질환에서 자기파지 기능 장애를 볼 수 있는 것으로 나타났다.
바필로마이신은 다른 종류의 세포들 중에서 뉴런의 이 자가마법 플럭스를 연구하는데 일반적으로 사용된다.이것을 하기 위해서, 뉴런은 먼저 영양소가 풍부한 상태로 들어가고, 그리고 영양소가 부족한 상태로 들어가 자기 파지를 자극합니다.바필로마이신은 오토파지가 자극되는 동안 오토파고솜-리소좀 융합의 마지막 단계를 차단하여 오토파고솜의 축적을 일으키도록 영양소 스트레스 상태에서 공동 투여된다.다음으로 LC3와 같은 오토파고솜과 관련된 오토파고솜 관련 단백질의 수준을 모니터링하여 영양소 [19]결핍에 의해 유도되는 오토파고솜 형성의 수준을 결정할 수 있다.
시험관내 약물 상호작용
리소소모트로피임약
클로로킨과 세르트랄린과 같은 양이온성 약물은 리소소모트로픽 약물로 알려져 있다.이 약들은 리소좀의 산성 환경에서 양성자가 되는 약한 염기들이다.이것은 양성자화가 소립자의 지질막을 통해 되돌아오는 것을 방해하기 때문에 리소좀 내에 그렇지 않은 비양성자 화합물을 가둬둡니다.이 현상을 이온 포획이라고 합니다.카티온 화합물의 포획은 또한 삼투압 효과를 통해 리소좀으로 물을 끌어들여 체외 배양 [15][23]세포에서 볼 수 있는 진공화를 초래할 수 있다.
이들 중 하나를 바필로마이신 A1과 세포에 함께 도포하면 바필로마이신 A1의 작용으로 리소좀의 산성화를 방지하여 이 [23]구획에서 이온트랩 현상을 방지할 수 있다.리소좀은 산성화할 수 없기 때문에 리소좀성 약물은 양성자가 되지 않고 바필로마이신의 존재 하에서 리소좀에 갇히게 된다.또한 세포에 시험관내 리소모트로픽 약물이 프리로드되어 바필로마이신이 처리되면 바필로마이신은 리소좀에 [15]축적된 양이온 화합물을 방출하는 작용을 한다.
카티온성 약물을 투여하기 전에 바필로마이신으로 세포를 전처리하는 것은 카티온성 화합물의 역학을 변화시킬 수 있다.토끼 수축성 분석에서는 분리된 토끼 대동맥을 치료하기 위해 바필로마이신이 사용되었습니다.α-아드레날린 수용체 작용제인 친유성 물질 자일로메타졸린은 바필로마이신 처리 후 투여 시 효과가 증가하였다.바필로마이신을 사용하면 대동맥의 수축과 이완이 빨라져 바필로마이신은 리소좀에서 자일로메타졸린의 이온 포집을 방지했다.바필로마이신에 의한 전처리 없이 기능성 V-ATPase는 리소좀을 자일로메타졸린의 저장소가 되게 하여 수축성에 [15]대한 영향을 느리게 한다.
클로로킨
리소소모트로이드 약물로서 클로로킨은 전형적으로 리소좀에 축적되어 분해 기능을 방해하고, 자가파지를 억제하며, 백스의존 메커니즘을 통해 아포토시스를 유도한다.그러나 1nM의 바필로마이신을 사용한 배양 소뇌과립뉴런(CGNs) 저치료에서는 클로로킨 저해에 영향을 주지 않고 클로로킨 유도 아포토시스를 감소시켰다.이 보호의 정확한 메커니즘은 알려지지 않았지만, 오토파고좀-리소좀 융합의 하류에 놓여있지만 아포토시스의 [10]Bax 유도 상류에는 놓여있다.
화학요법학
바필로마이신은 Bcl-xL의 미토콘드리아 보호 역할을 억제함으로써 매트릭스 메탈로프로테아제(MMP) 수치를 감소시키는 타키솔의 효과를 증강하는 것으로 나타났다.또한 시스플라틴 내성 세포 내에서는 V-ATPase 발현이 증가하는 것이 확인되었으며, 바필로마이신과 시스플라틴의 동시처리는 이들 세포를 시스플라틴 유도 세포독성으로 [3]감작시켰다.바필로마이신은 또한 항암 [24]적용에서 EGFR 억제제의 효과를 증가시키는 것으로 나타났다.
레퍼런스
- ^ Fermentek의 바필로마이신 A1 제품 페이지
- ^ a b c Dröse S, Altendorf K (January 1997). "Bafilomycins and concanamycins as inhibitors of V-ATPases and P-ATPases". The Journal of Experimental Biology. 200 (Pt 1): 1–8. PMID 9023991.
- ^ a b c d e f g h i j k l m n o p Whitton B, Okamoto H, Packham G, Crabb SJ (August 2018). "Vacuolar ATPase as a potential therapeutic target and mediator of treatment resistance in cancer". Cancer Medicine. 7 (8): 3800–3811. doi:10.1002/cam4.1594. PMC 6089187. PMID 29926527.
- ^ a b Hayashi M, Yamada H, Mitamura T, Horii T, Yamamoto A, Moriyama Y (November 2000). "Vacuolar H(+)-ATPase localized in plasma membranes of malaria parasite cells, Plasmodium falciparum, is involved in regional acidification of parasitized erythrocytes". The Journal of Biological Chemistry. 275 (44): 34353–8. doi:10.1074/jbc.M003323200. PMID 10915784.
- ^ a b Marchesini N, Vieira M, Luo S, Moreno SN, Docampo R (November 2005). "A malaria parasite-encoded vacuolar H(+)-ATPase is targeted to the host erythrocyte". The Journal of Biological Chemistry. 280 (44): 36841–7. doi:10.1074/jbc.M507727200. PMID 16135514.
- ^ a b Keller CW, Schmidt J, Lünemann JD (June 2017). "Immune and myodegenerative pathomechanisms in inclusion body myositis". Annals of Clinical and Translational Neurology. 4 (6): 422–445. doi:10.1002/acn3.419. PMC 5454400. PMID 28589170.
- ^ a b c Mayers D (2008). Antimicrobial drug resistance handbook. Volume 2, Clinical and epidemiological aspects. Totowa, N.J.: Humana. ISBN 9781603275958. OCLC 437345683.
- ^ a b c d Saris NE, Andersson MA, Mikkola R, Andersson LC, Teplova VV, Grigoriev PA, Salkinoja-Salonen MS (August 2009). "Microbial toxin's effect on mitochondrial survival by increasing K+ uptake". Toxicology and Industrial Health. 25 (7): 441–6. doi:10.1177/0748233709103405. PMID 19736254. S2CID 30966042.
- ^ a b c d Li Z, Du L, Zhang W, Zhang X, Jiang Y, Liu K, Men P, Xu H, Fortman JL, Sherman DH, Yu B, Gao S, Li S (April 2017). "Streptomyces lohii". The Journal of Biological Chemistry. 292 (17): 7095–7104. doi:10.1074/jbc.M116.751255. PMC 5409476. PMID 28292933.
- ^ a b c d Shacka JJ, Klocke BJ, Roth KA (2006). "Autophagy, bafilomycin and cell death: the "a-B-cs" of plecomacrolide-induced neuroprotection". Autophagy. 2 (3): 228–30. doi:10.4161/auto.2703. PMID 16874105.
- ^ a b Yu Z, Zhao LX, Jiang CL, Duan Y, Wong L, Carver KC, Schuler LA, Shen B (January 2011). "Bafilomycins produced by an endophytic actinomycete Streptomyces sp. YIM56209". The Journal of Antibiotics. 64 (1): 159–62. doi:10.1038/ja.2010.147. PMC 5592157. PMID 21102599.
- ^ a b c d Huss M, Wieczorek H (February 2009). "Inhibitors of V-ATPases: old and new players". The Journal of Experimental Biology. 212 (Pt 3): 341–6. doi:10.1242/jeb.024067. PMID 19151208.
- ^ a b c d e f Cotter K, Stransky L, McGuire C, Forgac M (October 2015). "Recent Insights into the Structure, Regulation, and Function of the V-ATPases". Trends in Biochemical Sciences. 40 (10): 611–622. doi:10.1016/j.tibs.2015.08.005. PMC 4589219. PMID 26410601.
- ^ a b Weisz OA (2003-01-01). "Acidification and protein traffic". International Review of Cytology. 226: 259–319. doi:10.1016/S0074-7696(03)01005-2. ISBN 9780123646309. PMID 12921239.
- ^ a b c d Marceau F, Bawolak MT, Lodge R, Bouthillier J, Gagné-Henley A, Gaudreault RC, Morissette G (February 2012). "Cation trapping by cellular acidic compartments: beyond the concept of lysosomotropic drugs". Toxicology and Applied Pharmacology. 259 (1): 1–12. doi:10.1016/j.taap.2011.12.004. hdl:20.500.11794/15930. PMID 22198553.
- ^ a b c Vinod V, Padmakrishnan CJ, Vijayan B, Gopala S (April 2014). "'How can I halt thee?' The puzzles involved in autophagic inhibition". Pharmacological Research. 82: 1–8. doi:10.1016/j.phrs.2014.03.005. PMID 24657238.
- ^ Duffy A, Le J, Sausville E, Emadi A (March 2015). "Autophagy modulation: a target for cancer treatment development". Cancer Chemotherapy and Pharmacology. 75 (3): 439–47. doi:10.1007/s00280-014-2637-z. PMID 25422156. S2CID 24642257.
- ^ a b Klionsky DJ, Elazar Z, Seglen PO, Rubinsztein DC (October 2008). "Does bafilomycin A1 block the fusion of autophagosomes with lysosomes?". Autophagy. 4 (7): 849–50. doi:10.4161/auto.6845. PMID 18758232.
- ^ a b c Lumkwana D, du Toit A, Kinnear C, Loos B (June 2017). "Autophagic flux control in neurodegeneration: Progress and precision targeting-Where do we stand?". Progress in Neurobiology. 153: 64–85. doi:10.1016/j.pneurobio.2017.03.006. PMID 28385648. S2CID 3811723.
- ^ Xie Z, Xie Y, Xu Y, Zhou H, Xu W, Dong Q (August 2014). "Bafilomycin A1 inhibits autophagy and induces apoptosis in MG63 osteosarcoma cells". Molecular Medicine Reports. 10 (2): 1103–7. doi:10.3892/mmr.2014.2281. PMID 24890793.
- ^ Weber SM, Levitz SM, Harrison TS (August 2000). "Chloroquine and the fungal phagosome". Current Opinion in Microbiology. 3 (4): 349–53. doi:10.1016/S1369-5274(00)00102-8. PMID 10972492.
- ^ Muller S, Brun S, René F, de Sèze J, Loeffler JP, Jeltsch-David H (August 2017). "Autophagy in neuroinflammatory diseases". Autoimmunity Reviews. 16 (8): 856–874. doi:10.1016/j.autrev.2017.05.015. PMID 28572049.
- ^ a b Kuzu OF, Toprak M, Noory MA, Robertson GP (March 2017). "Effect of lysosomotropic molecules on cellular homeostasis". Pharmacological Research. 117: 177–184. doi:10.1016/j.phrs.2016.12.021. PMID 28025106. S2CID 207368923.
- ^ Ravanan P, Srikumar IF, Talwar P (November 2017). "Autophagy: The spotlight for cellular stress responses". Life Sciences. 188: 53–67. doi:10.1016/j.lfs.2017.08.029. PMID 28866100.