우레미아
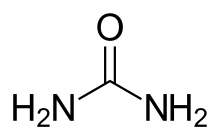
Uremia우레미아는 혈중 요소 수치가 높은 상태를 말한다. 우레아는 소변의 주요 성분 중 하나이다. 그것은 소변에서 보통 배설될 혈액 속에 있는 요소와 크레아티닌과 같은 아미노산과 단백질 대사 최종 산물의 과잉으로 정의될 수 있다. 우레믹 증후군은 신장 기능 상실(신부 기능 상실이라고도 함)[1]의 말기 임상적 발현으로 정의할 수 있다. 그것은 신장의 불충분한 배설, 규제, 내분비 기능에서 비롯되는 실험실 테스트의 징후, 증상, 결과들이다.[2] 유레미아 증후군과 유레미아 증후군은 신부전증의 결과인 매우 높은 혈장 요소 농도를 나타내기 위해 서로 교환하여 사용되어 왔다.[1] 이전의 변명은 그 기사의 나머지 부분에 사용될 것이다.
아조타혈증은 화학적으로 측정할 수 있지만 아직 증상이 나타날 정도로 심각하지 않은 요소 수치가 높은 유사하고 덜 심각한 질환이다. 우레미아는 중증 아지트혈증의 병리적, 증상적 발현을 설명한다.[1]
신장기능의 점진적인 상실을 가진 사람들에게 우레미아가 발병하는 구체적인 시기는 없다. 신장기능이 50% 이하인 사람(즉 50~60mL/min사이의 글로머 여과율[GFR])과 30세 이상 연령의 사람은 어느 정도 위레미아가 있을 수 있다. 이것은 GFR이 60 mL/min 미만인 미국에서 약 800만 명의 사람들이 극미량의 증상을 가지고 있다는 것을 의미한다.[3] 피로와 같은 증상은 매우 애매모호하여 신장기능의 저하 진단을 어렵게 할 수 있다. 치료는 투석이나 신장 이식을 통해 할 수 있지만, 일부 환자들은 증상 조절과 보수적인 치료를 대신 추구한다.[3]
징후 및 증상
고전적인 우레미아의 징후로는 진행성 허약과 쉬운 피로, 메스꺼움과 구토에 의한 식욕 상실, 근육 위축, 떨림, 비정상적인 정신 기능, 잦은 얕은 호흡, 대사산증 등이 있다. 투석이나 신장 이식을 통한 개입이 없으면 신부전으로 인한 유레미아가 진행돼 부신, 혼수, 사망 등이 발생한다.[2] 우레미아는 대부분 신부전의 결과물이기 때문에 다른 증상과 신부전의 증상이 동반되는 경우가 많다.[citation needed]
| 영향을 받는 영역 | 징후 및 증상 |
|---|---|
| 중추신경계 | 주간 졸음, 야간 불면증, 기억 및 집중 장애, 아스테니아, 두통, 혼란, 피로, 발작, 혼수, 뇌병증, 미각 저하, 딸꾹질, 세로시스염 |
| 말초신경계 | 다뇨증, 안절부절못하는 다리, 경련, 말초신경증, 산화스트레스, 체온저하 |
| 위장 | 거식증, 메스꺼움, 구토, 위염, 갑상선염, 구내염, 표피성 위궤양 |
| 혈액학 | 빈혈, 지혈 장애, 과립구, 림프구 및 혈소판 기능 장애 |
| 심혈관의 | 고혈압, 동맥경화증, 관상동맥질환, 심막염, 말초부종 및 폐부종 |
| 스킨 | 가려움증, 피부건조증, 석회화증, 우레미콘 서리(피부를 통한 요소 배출) |
| 내분비학 | 성장 장애, 발기부전, 불임, 불임, 불임, 무균, 무식증 |
| 골격 | 골연화증, β-마이크로글로불린2 아밀로이드증, 뼈질환(비타민D 결핍증, 2차 과파병증, 고인산증) |
| 영양 | 영양실조, 체중감량, 근육강화증 |
| 기타 | 극악무도한 페터 |
| 면역력 | 백신 접종에 대한 낮은 응답률, 전염병에 대한 민감도 증가, 전신 염증 |
글로머 여과율(GFR)은 매 분마다 신장을 통해 필터링되는 밀리리터의 플라즈마 양을 측정한다. GFR이 감소함에 따라 예후가 악화된다. 일부 효과는 일시적으로나마 투석을 통해 역전될 수 있다.[citation needed]
| GFR(mL/min) | 영향들 |
|---|---|
| 100–120 | 일반 GFR |
| <60 | 우레미컬 증상이 나타날 수 있으며, 웰빙이 감소한다. |
| 30–60 | 인지장애 |
| 55 | 피로와 체력저하 |
| <50 | 인슐린 저항성 |
| <30 | 증상 발생 가능성 증가 |
| ≤15 | 신장부전 |
잔류증후군
투석 중인 사람들은 "잔존증후군"이라고 알려진 것을 얻는다.[5] 잔류 증후군은 생명을 위협하지 않는 질환으로, 유레미아가 표시하는 것과 같은 많은 징후와 증상을 유발하는 독성 효과로 나타난다. 잔존증후군이 존재하는 이유에는 여러 가지 가설이 있다. 그러한 용액은 투석 상태가 불량한 큰 분자량 용액의 축적(예: β-마이크로글로불린2), 투석 상태가 불량한 단백질 결합 작은 분자량 용액의 축적(예: p-cresyl 황산염 및 인독실 황산염), 불완전하게 제거된 투석성 용액의 축적(예: 포와 같은 격리된 용액)이다.세포에 염증이 생기거나 다른 독성 용액의 불충분한 제거); 단백질의 카르바밀화, 조직 석회화 또는 호르몬 불균형의 독성 효과와 같은 간접적 현상(예:[5][6] 부갑상선 호르몬); 투석 자체의 독성 효과(예: 알려지지 않은 중요한 비타민이나 미네랄의 제거) 투석은 수명을 증가시키지만 환자의 기능이 더 제한적일 수 있다. 그들은 균형, 보행 속도, 감각 기능을 손상시키는 신체적 한계를 겪는다. 그들은 또한 주의력 손상, 기억력 손상, 고차원의 업무 수행과 같은 인지적 장애를 겪는다.[3] 환자들은 투석으로 30년 이상 유지되었지만, 평균 사망률과 입원율은 높다. 또한 환자 재활과 삶의 질은 좋지 않다.[3][5]
원인들
혈액요소가 증가하게 하는 조건은 세 가지 다른 범주로 분류된다: 전아드레날린, 신아드레날린, 후아드레날린이다.[citation needed]
아드레날린 아지토스테리아증은 신장을 통한 혈류 감소(예: 저혈압, 울혈성 심부전, 쇼크, 출혈, 탈수) 또는 고단백 식이요법을 통한 간 내 요소 생산 증가(예: 스트레스, 발열, 주요 질환, 코르티코스테로이드 치료, 위장 출혈)로 인해 발생할 수 있다.).[1]
신체의 원인은 신장 기능 저하에 기인할 수 있다. 여기에는 급성 및 만성 신부전, 급성 및 만성 글로머론증, 관상 괴사, 기타 신장질환 등이 포함된다.[1]
아드레날린의 원인은 요소 제거 감소에 기인할 수 있다. 이는 석회암, 방광이나 전립선의 종양, 또는 심각한 감염과 같은 요로유출 장애 때문일 수 있다.[1]
진단
세밀하고 정확한 역사와 신체검사를 통해 유혈증이 급성인지 만성인지 판별하는 데 도움이 될 것이다. 급성우울증의 경우 원인을 파악하여 제거할 수 있어 올바르게 치료하면 정상 신장 기능의 회복 가능성이 높아진다.[7]
혈액검사
우레미아 진단을 위해 수행되는 1차 테스트는 GFR, 혈액 요소 질소, 크레아티닌뿐만 아니라 혈청 칼륨, 인산염, 칼슘, 나트륨 수치를 평가하기 위한 혈청 칼슘과 인을 포함한 기본적인 대사 패널이다. 주된 이상은 GFR이 매우 낮다. 우레미아는 칼슘 수치 저하뿐만 아니라 요소와 크레아티닌의 상승, 높은 칼륨, 높은 인산염, 정상 또는 약간 높은 나트륨, 그리고 칼슘 수치 저하 가능성을 보여줄 것이다. 기본적인 작업으로 의사는 빈혈, 갑상선 및 부갑상선 기능도 평가할 것이다. 만성 빈혈은 확립된 신부전의 불길한 징조일 수 있다. 갑상선과 부갑상선 판넬은 피로의 어떤 증상도 치료할 수 있을 뿐만 아니라 칼슘 대사의 오랜 병이나 관련이 없는 질병과 관련이 있기 때문에 칼슘 이상을 판단하는 데 도움을 줄 것이다.[citation needed]
소변검사
채취 절차로 인해 매우 정확한 검사는 아니지만 크레아티닌 간극을 결정하기 위한 24시간 소변 채취가 대안이 될 수 있다. 고려해야 할 또 다른 실험실 테스트는 단백질, 깁스, 혈액 및 pH의 존재에 대한 현미경 검사를 통한 소변 검사다.[7]
방사성 동위원소 시험
GFR을 결정하기 위한 가장 신뢰할 수 있는 테스트는 이오탈라마이트 간극이다. 그러나, 그것은 비용 제한적이고 시간이 많이 소요될 수 있다. 임상 실험실은 일반적으로 신장 질환(MDRD) 공식 또는 Cockcroft-Gault 공식의 식단 수정으로 GFR을 계산한다.[7]
기타
또한 응고 연구는 그렇지 않으면 정상 값을 가진 출혈 시간이 길다는 것을 나타낼 수 있다.[citation needed]
메커니즘
우레미아는 많은 다른 화합물들이 신체에 의해 유지되는 결과를 낳는다. 신장의 고장으로 이 화합물들은 위험한 수준까지 쌓일 수 있다. 확인된 화합물은 90개 이상이다. 이 화합물들 중 일부는 신체에 독성이 있을 수 있다.[citation needed]
| 솔루트 그룹 | 예 | 출처[note 1] | 특성. |
|---|---|---|---|
| 펩타이드와 작은 단백질 | β-마이크로글로불린2 | 주요 조직 적합성 콤플렉스에서 탈피하다. | 큰 사이즈 때문에 투석 상태가 좋지 않다. |
| 구아니딘 | 구아니디노수친산 | 아르기닌 | 우레미아 증산 |
| 페놀 | 황산염 ρ-cresyl | 페닐알라닌, 티로신 | 내장의 박테리아에 의해 생성되는 단백질 결합 |
| 인돌레 | 인디케인의 | 트립토판 | 내장의 박테리아에 의해 생성되는 단백질 결합 |
| 알리파아민 | 디메틸아민 | 콜린 | 장내 박테리아에 의해 생성되는 대량의 분포 |
| 폴리올스 | CMPF | 알 수 없는 | 단백질이 단단하게 묶인 |
| 우클레오시데스 | 가성질 | tRNA | 여러 개의 변형된 RNA 종 중에서 가장 두드러진 종 |
| 디카르복실산 | 옥살이를 하다 | 아스코르브산 | 수정 퇴적물의 형성 |
| 카보닐 | 당화성의 | 당화 중간자 | 단백질과의 반응으로 고급 글리제 최종 산물 형성 |
우레믹 독소
우레믹 독소는 신장 손상으로 인해 유지되는 모든 생물학적으로 활성 화합물이다.[4] 많은 유레믹 솔트는 또한 유레믹 독소가 될 수 있다.[citation needed]
우레아는 확인된 최초의 대사물 중 한 명이었다. 제거는 환자 생존과 직결되지만 아직 몸에 미치는 영향은 분명하지 않다. 그러나 한 연구에서 혈류 질소 농도를 데킬리터당 약 90mg(약 32mmol pe)으로 유지하기 위해 혈류 질소 농도를 유지하도록 투석을 시작함으로써 우레미아 증상이 완화되었다는 사실이 밝혀졌으므로, 현재 우레미아와 관련된 증세가 실제로 과잉 요인에 의한 것인지는 확실하지 않다.r 리터).[3] 우레아는 더 독성 있는 분자의 전조가 될 수 있지만, 신체에 가해지는 손상은 효소 억제제나 세포막 이동의 방해물로 작용할 수 있는 다른 화합물들의 조합에 의한 것일 가능성이 더 높다.[2] 인닥실 황산염은 가장 잘 특징지어지는 극성 독소 중 하나이다. 인닥실 황산염은 대식세포 행동을 조절함으로써 아테롬성 동맥경화증의 혈관 염증을 악화시키는 것으로 나타났다.[8][9]
| 독소 | 효과 | 참조 |
|---|---|---|
| 요소 | 고농도 [>300 mg/dL (>50 mmol/L)]: 단백질의 두통, 구토, 피로, 카바밀화 | [2] |
| 크레아티닌 | 포도당 내성 및 적혈구 생존에 영향을 미칠 수 있음 | [2] |
| 시안산염 | 요소 분해 산물로 인한 졸림 및 고혈당, 단백질의 카르바밀화 및 단백질 기능 변화 | [2] |
| 폴리올(예: 미오이노시톨) | 말초신경증 | [2] |
| 페놀 | 지질 용해성이 강하여 세포막을 쉽게 통과할 수 있으므로 독성이 강하다. | [2] |
| "중분자"[note 2] | 복막 투석 환자는 혈액 투석 환자보다 중간 분자를 더 효율적으로 클리어한다. 그들은 혈액 투석 환자들보다 신경증의 징후가 적다. | [2] |
| β-마이크로글로불린2 | 레날 아밀로이드 | [2] |
| 황산인독산염 | 신장 기능 장애 및 심혈관 기능 장애를 유도한다. 만성 신장 질환 및 심혈관 질환과 관련됨 | [8][9][10] |
| 황산염 ρ-cresyl | 만성 신장질환에 대한 축적 및 예측 | [10] |
생화학적 특성
신체의 많은 규제 기능이 영향을 받는다. 체액 조절, 염분 보유, 산성 및 질소 대사물 배설이 모두 손상되어 광범위하게 변동할 수 있다. 체액 조절은 체액을 배설하지 못하거나 구토나 설사로 인한 체액 손실로 인해 손상된다. 소금 섭취량이 적거나 혈관 부피가 불충분할 경우 소금 조절이 저해된다. 산성 배설과 질소 대사물 배설은 신장 기능 상실로 인해 손상된다.[2]
| 보존 질소 대사물 | 유체, 산성 기반 및 전해질 장애 | 탄수화물 과민증 | 아노말 지질대사 | 변화된 내분비함수 |
|---|---|---|---|---|
| 요소 | 고정소변삼투성 | 인슐린 저항성(저혈당증도 발생할 수 있음) | 고트리글리세리혈증 | 이차과다병증항진증 |
| 시안산염 | 대사산증 | 혈장 인슐린 정상 또는 증가 | 고밀도 지단백질 콜레스테롤 감소 | 변화된 티록신 대사 |
| 크레아티닌 | 저나트륨혈증, 고산혈증 또는 고칼슘혈증 | 탄수화물 부하에 대한 지연 반응 | 고지혈증 | 고레닌혈증과 고알도스테론증 |
| 구아니딘 화합물 | 고염색증 | 고글루카곤혈증 | 저선인혈증 | |
| "중분자"[note 2] | 저칼슘혈증 | 저자극증 | ||
| 요산 | 고인산혈증 | 에리트로포이에틴 생산량 감소 | ||
| 초마그네슘혈증 | 고나달 기능 장애(프로락틴과 루틴화 호르몬 증가, 테스토스테론 감소) | |||
| 나트륨-칼륨 ATPase 활성 감소 | 혈청 위스트린 및 멜라노시스 자극 호르몬 증가 |
역사
우레아는 1797년과 1808년 사이에 결정화되어 확인되었다.[11] 우레아는 이 시기에 비뇨기 암모니아 발생원으로 가정되어 1817년에 확인되었다. 과도한 요소들이 특정한 장애로 이어질 수 있다는 가설이 제기되었다. 이후 1821년 신체가 요인을 생산하고 신장에 의해 배설된 것이 확인되었다.[11] 1827년 연구실에서 처음 요소들이 합성되어 요소들의 구성을 확인하고 최초의 합성 생물학적 물질이 되었다. 1856년, 요소들은 단백질의 산화를 통해 체외에서 생성되었다. 토마스 듀트로셰트가 반투과성 막을 통해 더 작은 분자와 더 큰 분자를 분리하는 것을 발견함으로써 투석의 생각을 시들게 한 것은 1850년이었다.[11] 특정 환자에서 혈뇨가 높아진 것은 1829년과 1831년이었다. 그들은 또한 이로 인해 위해가 발생할 수도 있다고 제안했다. 이후 연구는 혼수상태나 경련과 같은 주요 신경학적 질환이 뇌의 일반화된 부종을 포함한 신체적인 발견과 관련이 없다고 제안했다. 이것은 유레미아가 일종의 혈액 중독이라는 것을 암시했다.[11] 1851년 E.T. Frerich는 임상적 유레믹 증후군을 설명했고 독성이 그 원인의 메커니즘이라고 제안했다. J. Picard가 혈액 요소를 재현적으로 측정하는 민감한 방법을 개발한 것은 1856년이다. 그는 신장 동맥과 신장 정맥 사이의 요소 농도가 40% 감소하는 것을 감지할 수 있었다. 이 연구는 신부전이 혈액 요소의 증가와 일치한다는 사실을 확고히 했다. E.T.의 J. 피카르였다. '우레미아'라는 용어를 유행시킨 프레리히의 작품.[11]
구강 발현
유레미아의 구강 증상은 신장 환자의 최대 90%에서 발견할 수 있다. 입안에서 암모니아와 같은 맛과 냄새, 구내염, 구내염, 침출물 감소, 자궁내막염, 구내염 등이 나타날 수 있다.[12]
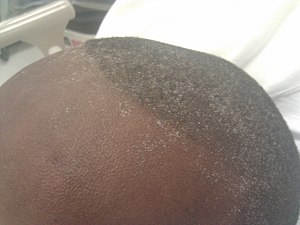
신부전증의 초기 증상들 중 하나는 무극성 페터다. 침 속의 요소 농도가 높아 암모니아로 분해되는 입안의 암모니아 냄새다.[12] 혈중 요소 질소(BUN) 수치가 높아지면 극소성 구내염이 생길 수 있다. 우뇌 구내염은 입안에 붉게 물들고 목질코트를 입은 사이비 막이나 솔직한 궤양으로 나타난다. 이러한 병변은 150 mg/dl 이상의 높은 BUN 수준과 관련될 수 있으며, 의학적 치료로 BUN 수치가 감소하면 자연적으로 사라진다. 조직 내성이 상실되고 외상성 영향을 견디지 못해 생긴 것으로 추정된다.[12] 그 외에도, 환자는 극한 서리인 희귀한 발현이 발생할 수 있다. 피부나 입안에서 발견되는 하얀색 플라그로, 땀과 침 증발 후 상피 표면에 남아 있는 요소 결정 잔류나 침전류 감소의 결과로 발생한다.[12] Xerostomia는 일반적인 구강 발견으로, 침샘의 직접적 관여, 화학적 염증, 탈수, 구강 호흡의 결합에서 비롯된다.[12] 그것은 제한된 액체 섭취, 약물 치료의 부작용 또는 낮은 침샘율 때문일 수 있다.[13] 침샘 부기는 가끔 볼 수 있다.[12]
신장질환 환자의 경우 에리트로포이에틴 감소에 따른 빈혈로 구강 점막의 창백함이 간혹 눈에 띈다. 우레아혈증은 혈소판 집적의 변화를 초래할 수 있다. 이러한 상황은 헤파린과 다른 항응고제를 혈액투석에 사용하는 것과 결합되어, 환자들은 구강 내 경락증, 페테치아이, 출혈에 걸리기 쉽다.[13] 또한 점막염과 광택염으로 이어져 혀와 구강 점막의 통증과 염증을 유발할 수 있다. 게다가, 환자들은 또한 맛의 감각의 변화, 이상증을 경험할 수 있고 박테리아와 칸디다스 감염에 걸리기 쉽다. 칸디다스는 면역 억제가 보편화돼 신장이식 환자에게서 더 빈번하다.[13]
신장병을 앓고 있는 어린이들에서는 1차적이고 영구적인 틀니의 에나멜 히포플라시아가 관찰되었다. 치아발달의 이상은 신진대사 장애가 발생하는 나이와 관련이 있다. 예를 들어, 원치아의 흰색 또는 갈색 변색 형태의 에나멜 히포플라시아는 초기 신질환을 가진 어린 아이들에게서 흔히 볼 수 있다.[13] 구강 위생 불량, 탄수화물이 풍부한 식단, 질병 관련 쇠약, 저대중탄성 에나멜, 저염유량, 장기 복용 등은 캐리 형성 위험을 높이는 데 기여한다.[13] 그러나 환자들은 특히 어린이들에게서 캐리 활동이 적은 편이다.[12] 이는 침 속에 요소 질소와 인산염이 고농축되면서 발생하는 고 완충과 알칼리성 침이 존재하기 때문이다. 침전 pH는 보통 에나멜의 탈미네랄화를 위해 임계 pH 수준 이상이며, 이는 캐리의 형성을 방지하는 데 도움이 된다.[13] 그 외에도 신장질환 환자에게는 맥팔이 좁아지고 석회화가 자주 발견된다.[13] 투석 중인 환자의 경우 투석 치료로 인한 메스꺼움과 구토가 심한 치아 침식으로 이어질 수 있다.[12]
치과 고려사항
신체가 부족한 환자를 치료할 때 치과의사는 ESRD 관련 질병, 처방된 투약량, 혈액 파라미터, 시기, 투석 유형 등에 특히 주의를 기울여 완전한 진료 기록을 수집해야 한다.[14] 이러한 측면들은 필요할 때 신약학자와 직접 논의할 수 있다. 약물의 변경이나 치료의 다른 측면은 반드시 종양학자가 이전에 동의해야 한다.[15]
이러한 환자에 대한 치아 검사는 치아, 치주 및 점막 조직에 대한 비침습적 전체 평가로 구성되며, 진단 과정에 도움이 되는 방사선 촬영으로 구성된다. 감염의 모든 잠재적 초점을 차단해야 한다. 여기에는 치주 및 내선성 병변, 잔류 뿌리, 부분적으로 분출되고 잘못된 세 번째 어금니, 근막염 및 점막 병변이 포함된다. 치주염이 의심되면 치주도를 기록해야 한다. 치아교정기구는 구강위생을 방해하지 않으면 유지관리가 가능하다.[14]
우레미아는 신장결핍으로 투석을 받는 환자에게서 흔히 볼 수 있다. 혈액투석 환자의 경우 치료 일정을 결정하는 것이 중요하다. 혈액 내 유독한 독소가 축적되지 않고 순환 헤파린이 없다는 여러 가지 이유로 혈액 투석 후 당일 치과 치료를 시작해야 한다. 환자들은 대개 몸이 좋지 않다고 느끼고 혈액이 헤파린화되어 과다 출혈을 일으킬 수 있으므로, 혈액 투석과 같은 날 치료가 시작되어서는 안 된다. 복막 투석을 받는 환자의 경우 선택적 절차를 연기해야 하는 급성 복막염의 경우를 제외하고는 치과 치료에 대한 금기가 없다.[12][15]
혈액투석을 위해 혈관 접근으로 팔을 압박하지 않도록 환자를 배치할 때는 각별히 주의해야 한다. 동맥경화(AV) 누공이 있는 팔에는 주사 또는 혈압 측정을 수행해서는 안 된다. AV 부위가 다리에 있는 경우 정맥 배수가 방해될 수 있으므로 환자는 장시간 앉아 있는 것을 피해야 한다. 오랜 치과 시술 동안 치과 의사는 다리에 AV 부위가 있는 환자들이 매 시간마다 잠깐 걷거나 서 있는 것을 허용해야 한다.[citation needed]
지혈 보조제는 과다 출혈의 경우 시행되어야 하는데, 이는 주로 자궁근종과 신부전증에서 나타난다. 수술 후 출혈을 관리하기 위해 1차 폐쇄 기법과 국소 지혈제를 일상적으로 사용해야 한다. 시술 중 및 시술 후 출혈을 줄이기 위해 세척 또는 구두로 투약하는 트란스산을 사용할 수 있다.[12][15]
투석을 받는 환자들은 수많은 수혈과 신부전 관련 면역억제에 노출되기 때문에 인체면역결핍바이러스(HIV)와 B형, C형 간염에 의한 감염 위험이 더 크다. 치과 내 교차 오염을 피하고 치과 인력의 노출 위험을 방지하기 위해 감염관리 조치를 취하는 것이 중요하다.[15]
대부분의 약은 신장에 의해 적어도 부분적으로 몸에서 제거된다. 신부전증으로 인해 소변 속에 정상적으로 배설되는 약물의 혈장 반감기가 길어지면서 독성이 높아진다. 일반적으로 안전하게 투여되는 많은 약물은 신장 기능이 저하된 환자에게 투여할 수 없다. 게다가 어떤 약은 줄 수 있지만 복용량은 줄여야 한다. 다만 투석을 받는 환자에서는 혈장 반감소 약물이 관찰된다.[12] 아미노글리코사이드와 테트라사이클린 계열의 항생제는 신독성 때문에 피해야 한다. 선택 항생제는 페니실린, 클린다마이신, 세팔로스포린 등으로 치료 범위가 넓어져도 정상 용량으로 투여할 수 있다.[15] 진통제의 경우 파라세타몰은 삽화통증의 경우 선택사항이다. 아스피린은 혈소판 방지 활동이 특징이므로 극소수 환자에게는 사용을 피해야 한다.[15] 신장질환 환자에 대한 약리치료의 어려움은 치료약 복용과 독성을 피하기 위해 약물의 치료 수준을 좁은 범위 내에서 유지하는 것이다.[12]
메모들
- ^ 여러 가지 출처가 있을 수 있다. 한 개만 나열되어 있다.
- ^ Jump up to: a b "중간분자"는 심방 내추럴 펩타이드, 낭성질 C, 델타 수면유도 펩타이드, 인터루킨-6, 종양 괴사 인자 알파, 그리고 부갑상선 호르몬을 포함한다.
참조
- ^ Jump up to: a b c d e f Bishop, M.L.; Fody, E.P.; Schoeff, L.E. (2010). Clinical Chemistry: Techniques, Principles, Correlations (6th ed.). Lippincott Williams and Wilkins. p. 268.
- ^ Jump up to: a b c d e f g h i j k l Burtis, C.A.; Ashwood, E.R.; Bruns, D.E. Tietz (2006). Textbook of Clinical Chemistry and Molecular Diagnostics (5th ed.). Elsevier Saunders. p. 1554.
- ^ Jump up to: a b c d e f g h i Meyer TW; Hostetter, TH (2007). "Uremia". N Engl J Med. 357 (13): 1316–25. doi:10.1056/NEJMra071313. PMID 17898101.
- ^ Jump up to: a b Almeras, C.; Argiles, A. (2009). "The General Picture of Uremia". Semin. Dial. 22 (44): 321–322. doi:10.1111/j.1525-139X.2009.00575.x. PMID 19708976. S2CID 33716788.
- ^ Jump up to: a b c d e Depner, T.A. (2001). "Uremic Toxicity: Urea and Beyond". Semin. Dial. 14 (4): 246–251. doi:10.1046/j.1525-139X.2001.00072.x. PMID 11489197. S2CID 29124176.
- ^ Dobre, M.; Meyer, T.W.; Hostetter, T.H. (2012). "Searching for Uremic Toxins". Clin J Am Soc Nephrol. 8 (2): 1–6. doi:10.2215/CJN.04260412. PMC 3562857. PMID 23024165.
- ^ Jump up to: a b c "우레미아 워크업." 브렌트 알퍼 주니어 메드스케이프
- ^ Jump up to: a b Nakano, T; Katsuki, S; Chen, M; Decano, JL; Halu, A; Lee, LH; Pestana, DVS; Kum, AST; Kuromoto, RK; Golden, WS; Boff, MS; Guimaraes, GC; Higashi, H; Kauffman, KJ; Maejima, T; Suzuki, T; Iwata, H; Barabási, AL; Aster, JC; Anderson, DG; Sharma, A; Singh, SA; Aikawa, E; Aikawa, M (2 January 2019). "Uremic Toxin Indoxyl Sulfate Promotes Proinflammatory Macrophage Activation Via the Interplay of OATP2B1 and Dll4-Notch Signaling". Circulation. 139 (1): 78–96. doi:10.1161/CIRCULATIONAHA.118.034588. PMC 6311723. PMID 30586693.
- ^ Jump up to: a b Hoyer, FF; Nahrendorf, M (2 January 2019). "Uremic Toxins Activate Macrophages". Circulation. 139 (1): 97–100. doi:10.1161/CIRCULATIONAHA.118.037308. PMC 6394415. PMID 30592654.
- ^ Jump up to: a b Zhang LS, Davies SS (April 2016). "Microbial metabolism of dietary components to bioactive metabolites: opportunities for new therapeutic interventions". Genome Med. 8 (1): 46. doi:10.1186/s13073-016-0296-x. PMC 4840492. PMID 27102537.
표 2: 미생물 대사물: 그 합성, 작용 메커니즘, 건강과 질병에 미치는 영향
그림 1: 숙주 생리와 질병에 대한 인도레와 그 대사물의 분자 작용 메커니즘 - ^ Jump up to: a b c d e Richet, Gabriel (1988). "Early history of Uremia". Kidney International. 33 (5): 1013–1015. doi:10.1038/ki.1988.102. PMID 3292814.
- ^ Jump up to: a b c d e f g h i j k l Burket's oral medicine. Glick, Michael (12th ed.). Shelton, Connecticut. ISBN 978-1-60795-280-0. OCLC 903962852.CS1 maint: 기타(링크)
- ^ Jump up to: a b c d e f g Gupta, Megha; Gupta, Mridul; Abhishek (July 2015). "Oral conditions in renal disorders and treatment considerations – A review for pediatric dentist". The Saudi Dental Journal. 27 (3): 113–119. doi:10.1016/j.sdentj.2014.11.014. ISSN 1013-9052. PMC 4501439. PMID 26236123.
- ^ Jump up to: a b Costantinides, Fulvia; Castronovo, Gaetano; Vettori, Erica; Frattini, Costanza; Artero, Mary Louise; Bevilacqua, Lorenzo; Berton, Federico; Nicolin, Vanessa; Di Lenarda, Roberto (2018-11-13). "Dental Care for Patients with End-Stage Renal Disease and Undergoing Hemodialysis". International Journal of Dentistry. 2018: 9610892. doi:10.1155/2018/9610892. ISSN 1687-8728. PMC 6258100. PMID 30538746.
- ^ Jump up to: a b c d e f Dioguardi, Mario; Caloro, Giorgia Apollonia; Troiano, Giuseppe; Giannatempo, Giovanni; Laino, Luigi; Petruzzi, Massimo; Lo Muzio, Lorenzo (2016-01-02). "Oral manifestations in chronic uremia patients". Renal Failure. 38 (1): 1–6. doi:10.3109/0886022X.2015.1103639. ISSN 0886-022X. PMID 26513593.
외부 링크
- 우레미아, WebMD.com