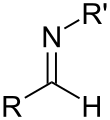
이미네
Imine이미인(/ɪˈmiːn/ 또는 /ˈɪmɪn/)은 탄소-질소 이중 결합을 포함하는 기능 그룹 또는 화학 화합물이다. 질소 원자는 수소(H) 또는 유기 그룹(R)에 부착할 수 있다. 만약 이 집단이 수소 원자가 아니라면, 그 화합물은 때때로 쉬프 기지라고 언급될 수 있다.[1] 탄소 원자는 두 개의 추가적인 단일 결합을 가지고 있다.[2][3][4] "이미네"라는 용어는 1883년 독일의 화학자 알버트 라덴버그에 의해 만들어졌다.[5]
명명 및 분류
일반적으로 이미인은 아래와 같이 RC2=NR 연결성을 가진 화합물을 가리킨다. 옛 문헌에서 이미네는 에폭시드의 아자 아날로그를 가리킨다. 따라서 에틸렌이 세 개의 암반종인 CHNH이다24.[6] 이중 결합과 단일 결합을 갖는 아민과의 이미인의 관계는 아세타미드 대 숙시니미드처럼 이미드와 아미드(amides)로 이어진다.
이미인은 산소를 NR 그룹으로 대체함으로써 케톤과 알데히드와 관련이 있다. R = H일 때 화합물은 일차 이미인이고, R이 하이드로카르빌일 때는 이차 이미인이다. 이미인은 다양한 반응성을 보이며 화학 작용 전반에 걸쳐 공통적으로 접하게 된다.[4] R이3 OH일 때는 이미인을 옥시메라고 하고, R이3 NH일2 때는 이미인을 히드라존이라고 한다.
C가 하이드로카르빌과 H에 모두 부착된 1차 이미인을 1차 알디민이라고 하며, 그러한 집단을 가진 2차 이미인을 2차 알디민이라고 한다.[7] C가 두 개의 하이드로카르빌에 붙어 있는 1차 이미인을 1차 케티민이라고 하며, 그러한 집단을 가진 2차 이미인을 2차 케티민이라고 한다.[8]
아지리딘과 그 파생상품은 이미인이라고도 한다.
알디민(aldimines)을 명명하는 한 가지 방법은 급진파의 이름을 취하고, 최종적인 "e"를 제거하고, 예를 들어 "-이미네"를 추가하는 것이다. 또는 이미인은 카보닐의 파생어로 명명되며, 소 그룹이 이미노 집단으로 대체되는 카보닐 화합물의 이름에 "이미네"라는 단어를 덧붙인다. 예를 들어 시드노네 이미네와 아세톤 이미네(아진 합성의 중간부분).
N-설비닐이미인은 질소 원자에 황비닐 그룹이 부착된 특수한 종류의 이미인이다.
이미늄 양이온(iminium cation)은 질소가 네 번째 결합을 가지고 있어 양전하를 주는 관련 기능군이다.
알디민
알디민(aldimine)은 알데히드와 유사한 이미인이다.[9] 이와 같이 알디민에는 일반적인 공식 R-CH=N-R'이 있다. 알디민(aldimines)은 케톤과 유사하며 케티민(ketimines)과 유사하다.
알디민의 중요한 하위 집합은 쉬프 베이스인데, 질소 원자(R')의 대체물이 알킬 또는 아릴 그룹(즉, 수소 원자가 아님)[10]이다.
| 명명법 | CH-CH-CH-CH322=NH | CH-CH3=N-CH3 |
|---|---|---|
| 1 | 부탄의 | N-메틸타민 |
| 2 | 부틸리데네아잔 | 에틸리딘(메틸)아잔 |
| 3 | 부틸리데네아민 | N-메틸틸리데아민 |
| 통용법 | 부티랄데히드이미인 | 아세트알데히드 N-메틸리민 |
알디민은 세 가지 다른 방식으로 명명될 수 있다.[11]
구식 명명법은 알디민을 부모 알데히드의 파생물로 취급한다.
이미인의 합성
이미인은 일반적으로 1차 아민과 알데히드의 응결에 의해 준비된다.[12][13] 케톤은 비슷한 반응을 보이지만 알데히드보다 덜 흔하다. 메커니즘의 관점에서, 그러한 반응은 헤미날 -C(OH)-를 주는 핵포함제를 통해 진행되며, 이어 이미인을 산출하기 위한 물의 제거가 뒤따른다(상세한 메커니즘은 알킬리미노-데-옥소-비산염 참조). 이 반응의 평형은 보통 카보닐 화합물과 아민을 선호하기 때문에 분자체나 황산 마그네슘과 같은 탈수제의 제제나 증류나 사용이 요구되어 이미네 형성에 유리하게 반응을 밀어낼 수 있다. 최근에는 트리스(2,2,2-트리플루오로에틸)보레이트[B(OCHCF23)],3[14] 피롤리딘[15] 또는 에토산화티타늄[Ti(OET)]4[16]과 같은 여러 시약들이 이미인 형성을 촉진하는 것으로 나타났다.
보다 전문화된 방법
이미인의 합성을 위한 몇 가지 다른 방법들이 존재한다.
- 금속 카브노이드(다이아조카르보닐 화합물에서 생산)와 유기 아지드 반응.[17]
- 니트로소 화합물과 함께 탄소산의 응축.
- 스티글리츠 재배열에서 트리틀 N-할로아민의 재배열.
- 뇌하수체 탈수증.[18]
- 슈미트 반응에서 알케인과 히드라조산의 반응에 의해.
- 호시 반응에서 니트리올, 염산, 아레네의 반응에 의해.
- Asinger 반응에서 3-thiazolines의 다중 성분 합성.
- 1차 케티민은 질소와의 그리냐드 반응을 통해 합성될 수 있다.[19][20]
반응

이미인은 해당 아민과 카보닐 화합물에 가수분해되기 쉽다. 이미인은 아민과 아미날과 반응한다. 예를 들어 쿠쿠르비투릴의 합성을 보라.
이성교체 전구체
이미인은 테트라히드롭디리딘에 대한 이미네 디엘-알데르 반응에서 디엔과 반응한다.
이미인은 이성교체 합성에서 매개체로 널리 사용된다. 방향제 이미인은 포바로프 반응에서 에놀 에테르와 퀴놀린에게 반응한다. 이미인의 C=N 결합은 사이클로더드에 대해 반응한다. 이미인은 [2+2] 사이클로아데이션에서 케틴과 열적으로 반응하여 스토딩거 합성에서 β-락탐을 형성한다. 이미인은 mCPBA(meta-cloroperoxy benzoic acid)로 산화하여 옥사지리딘을 제공할 수 있다.
토실리민은 아자-바일리스-의 아군 아민에 α,β-불포화 카보닐 화합물과 반응한다.힐만 반응.
이미인은 에슈웨일러-클라크 반응에서 아민의 알키화 작용에 있어서 매개체다.
이미인이 포함된 탄수화물 화학의 재배열은 아마도리 재배열이다.
불안정한 설포늄 이라이드에 의한 이미인의 메틸렌 전달 반응은 아지리딘 시스템을 제공할 수 있다. 이미인은 푸도빅 반응과 카바흐니크-필즈 반응에서 다이얼킬인산염과 반응한다.
산-기저반응
어버이 아민과 다소 유사하게, 이미닌은 이미늄 소금을 주기 위해 약간 기초적이고 역행적으로 양성된다. 이미늄 유도체는 특히 수소를 전달하거나 시아노보로무수화 나트륨의 계량 작용에 의해 아민의 감소에 취약하다. 비대칭 케톤에서 파생된 이미인은 프로치랄이기 때문에, 그 감소는 치랄아민 합성에 유용한 방법이다.
이미인은 조정화학에서 흔히 볼 수 있는 리간드다. 살리실알데히드와 에틸렌디아민의 응축은 살렌과 같은 이미인을 함유한 첼팅제를 가족들에게 준다.
이미인감소
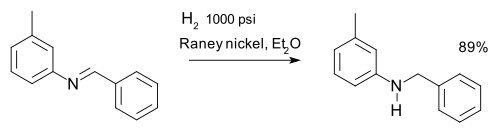
이미인은 환원적 아미네이션을 통해 감소된다. 이미인은 예를 들어 m-톨릴벤질라민의 합성에서 수소를 통해 아민으로 감소될 수 있다.[21]
다른 환원제로는 리튬 알루미늄 하이드라이드와 보로하이드리드 나트륨이 있다.[22]
최초의 비대칭 이미인 감소는 Kagan에 의해 1973년에 Chiral ligand DIOP와 Rhodium catalyst (RhCl (CHC22))를 가진 수산화에서 Ph(Me)C=NBn과 PhSiH를2 사용하여 보고되었다.22[23] 그 후 많은 시스템이 조사되었다.[24][25]
중합화
헥사히드로-1,3,5-트리아진을 주는 메틸아민과 포름알데히드의 응축에서 알 수 있듯이, 무힌드 알디민은 사이클링하는 경향이 있다.
이미네 중합체(폴리민)는 다변성 알데히드 및 아민에서 합성할 수 있다.[26] 이러한 중합 반응은 일반적으로 관련 구성 요소를 혼합할 때 계속된다.[27] 폴리머는 독성 물질로서 적용되기 때문에 특히 흥미로운 물질이다. 그것들은 쉽게 재활용이 가능하고 스스로 치유할 수 있는 것으로 알려져 있다.[28]
생물학적 역할
참고 항목
참조
- ^ IUPAC, 화학용어 종합편찬, 제2편. ("금책")(1997년). 온라인 수정 버전: (2006–) "Schiff base". doi:10.1351/골드북.S05498
- ^ IUPAC, 화학용어 종합편찬, 제2편. ("금책")(1997년). 온라인 수정 버전: (2006–) "imines". doi:10.1351/골드북.I02957
- ^ 3월 제리; (1985년). 첨단 유기 화학 반응, 메커니즘 및 구조(3차 개정판) 뉴욕: John Wiley & Sons, Inc. ISBN0-471-85472-7
- ^ a b "Amines and Imines". Nomenclature of Organic Compounds. Advances in Chemistry. Vol. 126. 1974. pp. 180–188. doi:10.1021/ba-1974-0126.ch023. ISBN 9780841201910.
- ^ Ladenburg, A. (1883) "Uber die Imine" (About imines), Berichte der Deutschen Chemischen Gesellschaft, 16 : 1149–1152; 페이지 참조. From p. 1150: "Denn offenbar gehört auch das Piperidin in die Klasse der von mir gesuchten Verbindungen, für welche der Name Imine durch die bestehende Nomenklatur angezeigt ist." (For obviously piperidine also belongs in the class of compounds that are sought by me, for which the name "imines" is indicated by the prevailing nomenclature.)
- ^ "Ethylenimine". Organic Syntheses. 30: 38. 1950. doi:10.15227/orgsyn.030.0038.
- ^ IUPAC, 화학용어 종합편찬, 제2편. ("금책")(1997년). 온라인 수정 버전: (2006–) "aldimines". doi:10.1351/골드북.A00209.html
- ^ IUPAC, 화학용어 종합편찬, 제2편. ("금책")(1997년). 온라인 수정 버전: (2006–) "ketimines". doi:10.1351/골드북.K03381.html
- ^ IUPAC, 화학용어 종합편찬, 제2편. ("금책")(1997년). 온라인 수정 버전: (2006–) "알디민". doi:10.1351/골드북.A00209
- ^ IUPAC, 화학용어 종합편찬, 제2편. ("금책")(1997년). 온라인 수정판: (2006–) "Schiff bases (Schiff's bases)" doi:10.1351/골드북.S05498
- ^ Panico R, Powell WH, Richer JC, eds. (1993). "Recommendation R-5.4.3". A Guide to IUPAC Nomenclature of Organic Compounds. IUPAC/Blackwell Science. pp. 89–90. ISBN 0-632-03488-2.
- ^ G. Wittig, A. Hesse (1970). "Directed Aldol Condensations:b-Phenylcinnamaldehyde". Organic Syntheses. 50: 66. doi:10.15227/orgsyn.050.0066.
- ^ Lucius A. Bigelow and Harry Eatough (1928). "Benzalaniline". Organic Syntheses. 8: 22. doi:10.15227/orgsyn.008.0022.
- ^ Reeves, Jonathan T.; Visco, Michael D.; Marsini, Maurice A.; Grinberg, Nelu; Busacca, Carl A.; Mattson, Anita E.; Senanayake, Chris H. (2015-05-15). "A General Method for Imine Formation Using B(OCH2CF3)3". Organic Letters. 17 (10): 2442–2445. doi:10.1021/acs.orglett.5b00949. ISSN 1523-7060. PMID 25906082.
- ^ Morales, Sara; Guijarro, Fernando G.; García Ruano, José Luis; Cid, M. Belén (2014-01-22). "A General Aminocatalytic Method for the Synthesis of Aldimines". Journal of the American Chemical Society. 136 (3): 1082–1089. doi:10.1021/ja4111418. ISSN 0002-7863. PMID 24359453.
- ^ Collados, Juan F.; Toledano, Estefanía; Guijarro, David; Yus, Miguel (2012-07-06). "Microwave-Assisted Solvent-Free Synthesis of Enantiomerically Pure N-(tert-Butylsulfinyl)imines". The Journal of Organic Chemistry. 77 (13): 5744–5750. doi:10.1021/jo300919x. ISSN 0022-3263. PMID 22694241.
- ^ Mandler, Michael; Truong, Phong; Zavalij, Peter; Doyle, Michael (Jan 14, 2014). "Catalytic Conversion of Diazocarbonyl Compounds to Imines: Applications to the Synthesis of Tetrahydropyrimidines and β-Lactams". Organic Letters. 16 (3): 740–743. doi:10.1021/ol403427s. PMID 24423056.
- ^ a b Middleton, W. J.; Carlson, H. D. (1970). "Hexafluoroacetone imine". Org. Syntheses. 50: 81–3. doi:10.15227/orgsyn.050.0081.
- ^ Koos, Miroslav; Mosher, Harry S. (1993). "α-Amino-α-trifluoromethyl-phenylacetonitrile: A potential reagent for NMR determination of enantiomeric purity of acids". Tetrahedron. 49 (8): 1541–1546. doi:10.1016/S0040-4020(01)80341-0.
- ^ Moureu, Charles; Mignonac, Georges (1920). "Les Cetimines". Annales de Chimie. 9 (13): 322–359. Retrieved 18 June 2014.
- ^ C. F. H. Allen and James VanAllan (1955). "m-Tolylbenzylamine". Organic Syntheses: 827.; Collective Volume, vol. 3
- ^ 예: ;
- ^ Langlois, N (1973). "Synthese asymetrique d'amines par hydrosilylation d'imines catalysee par un complexe chiral du rhodium". Tetrahedron Lett. 14 (49): 4865–4868. doi:10.1016/S0040-4039(01)87358-5.
- ^ Kobayashi, Shū; Ishitani, Haruro (1999). "Catalytic Enantioselective Addition to Imines". Chem. Rev. 99 (5): 1069–94. doi:10.1021/cr980414z. PMID 11749440.
- ^ J. Martens: Reduction of Imino Groups (C=N) in (G. Helmchen, R. W. Hoffmann, J. Mulzer, E. Schaumann) Houben-Weyl Stereoselective Synthesis, Workbench Edition E21 Volume 7, S. 4199-4238, Thieme Verlag Stuttgart, 1996, ISBN 3-13-106124-3.
- ^ Schoustra, Sybren K.; Groeneveld, Timo; Smulders, Maarten M. J. (2021). "The effect of polarity on the molecular exchange dynamics in imine-based covalent adaptable networks". Polymer Chemistry. 12 (11): 1635–1642. doi:10.1039/D0PY01555E.
- ^ Schoustra, Sybren K.; Dijksman, Joshua A.; Zuilhof, Han; Smulders, Maarten M. J. (2021). "Molecular control over vitrimer-like mechanics – tuneable dynamic motifs based on the Hammett equation in polyimine materials". Chemical Science. 12 (1): 293–302. doi:10.1039/d0sc05458e. ISSN 2041-6520. PMC 8178953. PMID 34163597.
- ^ Zhu, Jiaqi (2020). "A self-healing transparent polydimethylsiloxane elastomer based on imine bonds". European Polymer Journal. 123: 109382. doi:10.1016/j.eurpolymj.2019.109382. S2CID 214199868.
- ^ "Researchers look to nature to unearth the secrets of cyclic imine cleavage". EurekAlert!. Retrieved 2021-07-22.
- ^ Borchert, Andrew J.; Ernst, Dustin C.; Downs, Diana M. (2019). "Reactive enamines and imines in vivo: Lessons from the RidA paradigm". Trends in Biochemical Sciences. 44 (10): 849–860. doi:10.1016/j.tibs.2019.04.011. ISSN 0968-0004. PMC 6760865. PMID 31103411.