활성산소종
Reactive oxygen species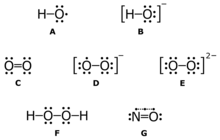
A: 하이드록실 라디칼(HO•);
B: 수산화 이온(HO−);
C: 삼중항 산소(O22•);
D: 슈퍼옥사이드 음이온(O2•−);
E: 과산화 이온(O2-2);
F: 과산화수소(HO22);
G: 산화질소(NO•)
화학과 생물학에서, 활성 산소종(ROS)은 이원자 산소(O2), 물, 과산화수소로부터 형성된 고도의 반응성 화학물질입니다.일부 눈에 띄는 ROS는 과산화수소2(OH), 과산화수소2-(O),[1] 하이드록실 라디칼(OH.), 싱글릿 산소(singlelet oxygen)[2]입니다.ROS는 풍부한 O로부터2 쉽게 생성되기 때문에 널리 사용됩니다.ROS는 유익하거나 그렇지 않은 면에서 여러 면에서 중요합니다.ROS는 생물학적 기능을 켜고 끄는 신호의 기능을 합니다.그들은 연료 전지의 중심인 O의2 산화 환원 행동의 중간체입니다.ROS는 대기 중 유기 오염 물질의 광붕괴의 중심입니다.그러나 대부분의 경우, ROR은 노화와 위험한 유전자 돌연변이를 일으키는 것에 대한 영향에 이르기까지 생물학적 맥락에서 논의됩니다.
ROS재고
ROS가 균일하게 정의되어 있지 않습니다.모든 공급원은 슈퍼옥사이드, 싱글릿 산소 그리고 하이드록실 라디칼을 포함합니다.과산화수소는 이들 종만큼 반응성이 거의 없지만 쉽게 활성화되므로 포함됩니다.[3]과산화질소와 일산화질소도 활성산소를 포함하는 종입니다.
- 하이드록실 라디칼(HO·hydroxyl radical)은 과산화수소와 철 화합물 및 관련 환원제의 펜톤 반응에 의해 생성됩니다.
- Fe(II) + HO → Fe(III)OH + HO·
하이드록실 라디칼은 순식간에 존재하면서 모든 유기 화합물과 빠르게 비가역적으로 반응합니다.
- O + e → O-2
그 형성과 경쟁하여, 슈퍼옥사이드는 불균형을 촉매하는 효소인 슈퍼옥사이드 디스뮤타아제의 작용에 의해 파괴됩니다.
- 2 O-2 + 2H → O + HO
- 싱글릿 산소(1O2)는 때때로 ROS로 포함됩니다.엽록소와 같은 광감각제는 삼중항(3O2)을 단일항 산소로 전환시킬 수 있습니다.[6]단일 산소는 불포화 유기 화합물과 반응성이 높습니다.엽록체에 포함된 카로티노이드, 토코페롤, 플라스토퀴논은 단일 산소를 억제하고 독성 효과로부터 보호합니다.싱글릿 산소의 존재로부터 발생하는 β-카로틴의 산화물은 싱글릿 산소 유도 독성으로부터 보호하거나 프로그램된 세포 사멸을 시작할 수 있는 두 번째 메신저 역할을 합니다.자스모네이트의 수준은 이러한 활성 산소종의 높은 수준에 대한 반응으로 세포 순응과 세포 사멸 사이의 결정에 중요한 역할을 합니다.[6]
생물학적 기능
생물학적 맥락에서, ROS는 산소의 정상적인 대사의 부산물입니다.ROS는 세포 신호 전달과 항상성에 역할을 합니다.[7][8][9][10]ROS는 세포 기능에 내재되어 있으며, 정상 세포에서 낮고 정지된 수준으로 존재합니다.[11]식물에서, ROS는 광 보호와 다양한 유형의 스트레스에 대한 내성과 관련된 대사 과정에 관여합니다.[12]그러나, ROS는 일부 세포 성분을 산화시키고 변형시켜 원래의 기능을 수행하는 것을 막음으로써 DNA에 비가역적인 손상을 일으킬 수 있습니다.이는 ROS가 두 가지 역할을 한다는 것을 의미합니다. 유해한 요소로 작용할지, 보호 요소로 작용할지, 신호 요소로 작용할지는 적절한 시간과 장소에서 ROS 생산과 폐기 사이의 균형에 달려 있습니다.[13][14][15]다시 말해서, 산소 독성은 조절되지 않는 생산으로부터뿐만 아니라 산화 방지제 시스템에 의한 ROS의 비효율적인 제거에 의해서도 발생할 수 있습니다.환경 스트레스 시간(예: UV 또는 열 노출)에는 ROS 수준이 급격히 증가할 수 있습니다.[9]이로 인해 셀 구조가 크게 손상될 수 있습니다.누적적으로, 이것은 산화 스트레스로 알려져 있습니다.ROS의 생성은 식물의 스트레스 인자 반응에 의해 강한 영향을 받으며, 이러한 ROS 생성을 증가시키는 요인에는 가뭄, 염도, 냉각, 병원균 방어, 영양소 결핍, 금속 독성 및 UV-B 방사선이 포함됩니다.ROS는 또한 동물과 식물의 조직 발달에 있어서 비가역적인 효과를 발생시키는 이온화 방사선과[16] 같은 외생적인 공급원에 의해서도 발생됩니다.[17]
ROS 생산원

내생원
ROS는 미토콘드리아, 퍼옥시좀 및 엽록체와 같은 소기관에서 호흡 및 광합성 과정 동안 생성됩니다.[15][20][21][22]호흡 과정 동안 미토콘드리아는 세포를 위한 에너지를 사용 가능한 형태인 아데노신 삼인산(ATP)으로 변환시킵니다.산화적 인산화라고 불리는 미토콘드리아에서 ATP가 생성되는 과정은 전자 수송 사슬을 통해 내부 미토콘드리아 막을 가로지르는 양성자(수소 이온)의 수송을 포함합니다.전자 수송 사슬에서, 전자는 산화-환원 반응을 통해 일련의 단백질을 통과하고, 사슬을 따라 있는 각각의 수용체 단백질은 이전보다 더 큰 환원 전위를 갖습니다.이 사슬을 따라 있는 전자의 마지막 목적지는 산소 분자입니다.정상적인 조건에서는 산소가 환원되어 물을 생성하지만, 사슬을 통과하는 전자의 약 0.1-2%에서 산소가 환원되어(이 숫자는 고립된 미토콘드리아에서의 연구에서 유래함, 비록 살아있는 유기체에서의 정확한 비율은 아직 완전히 합의되지 않았지만), 산소는 그 대신 너무 성급하고 불완전하게 환원되어 초산화물 라디칼(•O−
2)을 생성합니다., 가장 잘 기록된 것은 복합 I 및 복합 III입니다.[23]
동물 세포에서 ROS 생성의 또 다른 원천은 스테로이드 생성 조직에서 미토콘드리아 P450 시스템에 의해 촉매되는 전자 전달 반응입니다.[24]이러한 P450 시스템은 NADPH에서 P450으로의 전자 전달에 의존합니다.이 과정에서 일부 전자는 "누출"하여 O와2 반응하여 초산화물을 생성합니다.이러한 자연적인 ROS 공급원에 대처하기 위해, 난소와 고환의 스테로이드 생성 조직은 비타민 C(아스코르베이트)와 β-카로틴과 같은 대량의 산화 방지제와 산화 방지 효소를 가지고 있습니다.[25]
만약 미토콘드리아에 너무 많은 손상이 존재한다면, 세포는 세포자멸이나 프로그램된 세포사멸을 겪게 됩니다.[26][27]
또한, ROS는 NOX 경로를 통해 면역세포 신호전달에서 생성됩니다.호중구, 호산구, 단핵 식세포와 같은 식세포는 자극을 받으면 ROS를 생성합니다.[28][29]
엽록체에서 루비스코에 의해 촉매되는 카르복실화 및 산소화 반응은 전자 수송 사슬(ETC)의 기능이 O가2 풍부한 환경에서 발생함을 보장합니다.ETC에서 전자의 누출은 필연적으로 엽록체 내에서 ROS를 생성할 것입니다.[15]광계 I(PSI)의 ETC는 한때 엽록체의 유일한 ROS 공급원으로 여겨졌습니다.들뜬 반응 중심에서 전자의 흐름은 NADP로 향하고, 이것들은 NADPH로 환원되고, 그것들은 캘빈 사이클로 들어가 최종 전자 수용체인 CO를2 환원시킵니다.[30]ETC 과부하가 있는 경우, 전자 흐름의 일부가 페레독신에서 O로2 전환되어 (멜러 반응에 의해) 초산화물 자유 라디칼을 형성합니다.또한2, O로의 전자 누설은 PSI ETC의 2Fe-2S 및 4Fe-4S 클러스터에서도 발생할 수 있습니다.그러나 PSI는 O-를2 생성하는2 O-를 위한 전자 누출 위치(QA, QB)도 제공합니다.[31][32] PSI로부터 Superoxide (O-2)가 생성됩니다. QB는 O•-[31]의2 생성 위치로 표시됩니다.
외생성원
ROS의 형성은 오염물질, 중금속,[19] 담배, 연기, 약물, 제노바이오틱스, 미세플라스틱 또는 방사선과 같은 다양한 작용제에 의해 자극될 수 있습니다.식물에서는 건조한 비생물학적 인자의 작용 외에도 고온, 다른 생물과의 상호작용이 ROS의 생성에 영향을 미칠 수 있습니다.
전리방사선은 물과의 상호작용을 통해 손상되는 중간체를 생성할 수 있는데, 이 과정을 방사분해라고 합니다.물은 인체의 55-60%를 차지하기 때문에 전리방사선이 존재할 경우 방사선 분해 가능성이 매우 높습니다.그 과정에서 물은 전자를 잃고 고도로 반응하게 됩니다.그 후 물은 3단계 연쇄반응을 통해 하이드록실 라디칼(•OH), 과산화수소(HO22), 슈퍼옥사이드 라디칼(•O−
2), 그리고 최종적으로 산소(O2)로 순차적으로 전환됩니다.
하이드록실 라디칼은 매우 반응적이고 그 경로에 있는 어떤 분자로부터도 즉시 전자를 제거하고, 그 분자를 자유 라디칼로 바꾸어 연쇄 반응을 촉진합니다.그러나 과산화수소의 낮은 반응성은 분자가 세포의 핵 안으로 이동할 수 있는 충분한 시간을 제공하고, 그 후 DNA와 같은 거대 분자와 반응하기 때문에, 과산화수소는 실제로 하이드록실 라디칼보다 DNA에 더 손상을 입힙니다.[citation needed]
식물에서 ROS의 생성은 대사 활동의 감소 또는 중단을 초래하는 비생물학적 스트레스의 경우에 발생합니다.예를 들어, 온도 상승, 가뭄은 기공 폐쇄로 인한 CO2 가용성을 제한하는 요인으로 엽록체의 O·- 및2 O와2 같은 ROS의 생성을 증가시킵니다.[33][34]엽록체에서 O의2 생성은 클로로시스와 프로그램 된 세포 사멸로 이어지는 핵 유전자의 발현의 재프로그래밍을 일으킬 수 있습니다.[34]생물학적 스트레스의 경우, ROS의 생성은 초기에 빠르고 약하게 발생하고 이후에 더 견고해지고 지속됩니다.[35]ROS 축적의 첫 번째 단계는 식물 감염과 관련이 있으며 아마도 새로운 ROS 생성 효소의 합성과는 독립적일 것입니다.그러나 ROS 축적의 두 번째 단계는 비바이러스성 병원체에 의한 감염과만 관련이 있으며 증가된 mRNA 전사 암호화 효소에 의존하는 유도 반응입니다.
항산화효소
슈퍼옥사이드 디스뮤타아제
슈퍼옥사이드 디스뮤타아제(SOD)는 슈퍼옥사이드를 산소와 과산화수소로 전환시키는 것을 촉매하는 효소의 한 종류입니다.이와 같이, 그들은 산소에 노출된 거의 모든 세포에서 중요한 항산화 방어제입니다.포유류와 대부분의 현충류에는 세 가지 형태의 초산화 디스뮤타아제가 존재합니다.SOD1은 주로 세포질에 위치하고, SOD2는 미토콘드리아에 위치하고, SOD3는 세포외에 위치합니다.첫 번째는 이량체(2개의 단위로 구성됨)이고 나머지는 사량체(4개의 하위 단위)입니다.SOD1과 SOD3는 구리 이온과 아연 이온을 포함하고, SOD2는 반응성 중심에 망간 이온을 포함합니다.그 유전자들은 각각 21번, 6번, 4번 염색체에 위치합니다 (21q22.1, 6q25.3, 4p15.3-p15.1).
슈퍼옥사이드의 SOD 촉매 절단은 다음과 같은 반반응으로 기록될 수 있습니다.
여기서 M = Cu (n = 1); Mn (n = 2); Fe (n = 2); Ni (n = 2).이 반응에서 금속 양이온의 산화 상태는 n에서 n + 1 사이에서 진동합니다.
미토콘드리아 옆에 위치한 퍼옥시좀에 농축된 카탈라아제는 과산화수소와 반응하여 물과 산소의 형성을 촉매합니다.글루타티온 과산화효소는 반응성 과산화물의 에너지를 글루타티온이라고 불리는 황이 함유된 트리펩티드에 전달함으로써 과산화수소를 감소시킵니다.이러한 효소에 포함된 황은 반응 중심으로 작용하여 반응성 전자를 과산화물에서 글루타티온으로 운반합니다.과산화독소는 또한 미토콘드리아, 세포질, 핵 내에서 HO를22 분해합니다.
손상효과

세포 대사에 대한 ROS의 효과는 다양한 종에서 잘 기록되어 있습니다.[19]이것들은 세포 자멸(프로그램된 세포 사멸)에서의 역할뿐만 아니라 숙주 방어[36][37] 유전자의 유도와 이온 전달체의 동원과 같은 긍정적인 효과도 포함합니다.[citation needed]이것은 그들이 세포 기능을 조절하는 것을 의미합니다.특히 상처 복구 및 혈액 항상성에 관련된 혈소판은 ROS를 방출하여 부상 부위에 혈소판을 추가로 모집합니다.이것들은 또한 백혈구의 모집을 통해 적응 면역 체계에 대한 연결을 제공합니다.[citation needed]
활성 산소종은 심혈관 질환을 포함한 다양한 염증 반응에 대한 세포 활동과 관련이 있습니다.그들은 또한 높은 소리 수준에 의해 유발된 달팽이관 손상, 시스플라틴과 같은 약물의 이독성, 그리고 동물과 사람 모두의 선천적 난청을 통해 청각 장애에 관여할 수 있습니다.[citation needed]ROS는 또한 세포 사멸 또는 프로그램된 세포 사멸 및 허혈성 손상의 매개에도 관여합니다.구체적인 예로는 뇌졸중과 심장마비가 있습니다.[citation needed]
일반적으로 활성산소종이 세포에 미치는 유해한 영향은 DNA나 RNA의 손상, 지질 중의 다불포화 지방산의 산화(지질 과산화), 단백질 중의 아미노산의 산화, 산화 보조 인자에 의한 특정 효소의 산화 비활성화 등이 있습니다.[38]
병원체반응
식물이 공격하는 병원체를 인식할 때, 첫 번째 유도 반응 중 하나는 세포벽을 강화하기 위해 급속하게 과산화수소(O−
2) 또는 과산화수소(HO
2
2)를 생성하는 것입니다.이를 통해 병원체가 공장의 다른 부분으로 확산되는 것을 방지하고, 근본적으로 병원체 주위에 그물망을 형성하여 이동과 번식을 제한합니다.
포유동물 숙주에서, ROS는 항균성 방어로서 유도됩니다.[28]이 방어의 중요성을 강조하기 위해, ROS 생성에 결핍이 있는 만성 육아종성 질환을 가진 사람들은 살모넬라 장구균, 황색포도상구균, 세라티아 마르세센스 및 아스페르길루스 spp를 포함한 다양한 미생물에 의한 감염에 매우 취약합니다.
Drosophila melanogaster의 창자의 항상성에 대한 연구는 파리의 내장에서 면역 반응의 주요 성분으로서 ROS의 생성을 보여주었습니다.ROS는 세균성 DNA, RNA, 단백질을 손상시키는 동시에 상피의 수리 메커니즘을 유도하는 신호 전달 분자로서 역할을 합니다.[39]미생물에 의해 방출되는 유라실은 장에서 ROS를 생성하는 효소인 DUOX의 생성과 활성을 유발합니다.DUOX 활성은 내장의 유라실 수준에 따라 유도됩니다; 기저 조건에서, 그것은 단백질 키나아제 MkP3에 의해 하향 조절됩니다.DUOX의 엄격한 조절은 ROS의 과도한 생성을 방지하고 내장에서 양성 미생물과 손상 유발 미생물의 분화를 촉진합니다.[40]
ROS가 호스트의 미생물 침입을 방어하는 방법은 완전히 이해되지 않습니다.가장 가능성 있는 방어 수단 중 하나는 미생물 DNA 손상입니다.살모넬라균을 이용한 연구는 ROS에 의한 살상에 저항하기 위해 DNA 복구 메커니즘이 필요하다는 것을 보여주었습니다.Rig-like helicase-1 및 미토콘드리아 항바이러스 신호전달 단백질을 통해 항바이러스 방어 메커니즘에서 ROS에 대한 역할이 입증되었습니다.이 미토콘드리아 관련 항바이러스 수용체를 통한 증가된 ROS 수준은 인터페론 조절 인자(IRF)-3, IRF-7 및 핵 인자 카파 B(NF- κB)를 활성화하여 항바이러스 상태를 초래합니다.호흡기 상피세포는 인플루엔자 감염에 반응하여 미토콘드리아 ROS를 유도합니다.이러한 ROS의 유도는 유형 III 인터페론의 유도와 바이러스 복제를 제한하는 항바이러스 상태의 유도로 이어졌습니다.[42]숙주 방어에서 ROS는 역할을 하지만 직접적인 살처분은 핵심 메커니즘이 아닐 가능성이 높습니다. 오히려 ROS는 사이토카인 생산, 자가포식, 육아종 형성과 같은 ROS 의존적 신호 전달 제어에 영향을 미칠 가능성이 있습니다.[43][44]
활성 산소종 또한 T 세포의 활성화, 에너지 및 세포 자멸에 관련되어 있습니다.[45]
산화적 손상
호기성 유기체에서 생물학적 기능을 촉진하는 데 필요한 에너지는 전자 수송 사슬을 통해 미토콘드리아에서 생성됩니다.세포 손상을 일으킬 가능성이 있는 활성 산소종(ROS)이 에너지 방출과 함께 생성됩니다.ROS는 지질, DNA, RNA 및 단백질을 손상시킬 수 있으며, 이론적으로 노화의 생리에 기여합니다.
ROS는 세포 대사의 정상적인 산물로 생성됩니다.특히 산화적 손상의 주요 원인 중 하나는 과산화수소(HO22)인데, 이는 미토콘드리아에서 누출되는 과산화수소로부터 전환됩니다.카탈레이스와 슈퍼옥사이드 디스뮤타아제는 각각 과산화수소와 슈퍼옥사이드의 손상 효과를 개선하는데, 이들 화합물을 산소와 과산화수소(이후 물로 변환됨)로 변환시켜 양성 분자를 생성합니다.그러나, 이러한 전환은 100% 효율적이지 않으며, 잔류 과산화물이 세포 내에 지속됩니다.ROS는 정상적인 세포 기능의 산물로 생성되지만, 과도한 양은 해로운 영향을 일으킬 수 있습니다.[46]
인지기능장애
기억력은 나이가 들수록 저하되는데, 이는 산화적 손상의 축적을 동반하는 알츠하이머병과 같은 인간의 퇴행성 질환에서 뚜렷합니다.최근의 연구들은 산화적 손상이 노화의 원인이기 때문에 ROS의 축적이 유기체의 건강을 감소시킬 수 있다는 것을 보여줍니다.특히, 산화적 손상의 축적은 늙은 쥐에게 미토콘드리아 대사 물질을 투여한 후 인지 검사를 실시한 연구에서 입증된 바와 같이 인지 기능 장애를 초래할 수 있습니다.결과는 쥐들이 대사산물을 받은 후 더 나은 성능을 보여주었으며, 이는 대사산물이 산화적 손상을 줄이고 미토콘드리아 기능을 개선했음을 시사합니다.[47]산화적 손상이 누적되면 미토콘드리아의 효율성에 영향을 미치고 ROS 생성 속도를 더욱 증가시킬 수 있습니다.[48]산화적 손상의 축적과 노화에 대한 영향은 손상이 발생하는 특정 조직 유형에 따라 달라집니다.추가적인 실험 결과는 산화적 손상이 나이와 관련된 뇌 기능 저하의 원인임을 시사합니다.나이든 저빌은 어린 저빌에 비해 산화된 단백질의 양이 더 많은 것으로 밝혀졌습니다.늙은 쥐와 어린 쥐를 스핀 트래핑 화합물로 치료한 것은 나이 든 저빌의 산화된 단백질의 수준을 감소시켰지만 어린 저빌에게는 영향을 미치지 않았습니다.또한 나이든 저빌은 치료 중 인지 작업을 더 잘 수행했지만 치료가 중단되었을 때 기능 능력을 중단하여 산화된 단백질 수준을 증가시켰습니다.이것은 연구자들이 세포 단백질의 산화가 뇌 기능에 잠재적으로 중요하다는 결론을 내리게 했습니다.[49]
노화의 원인
노화의 자유 라디칼 이론에 따르면, 활성 산소종에 의해 개시된 산화적 손상은 노화의 특징인 기능 저하의 주요 원인입니다.무척추동물 모델에 대한 연구는 동물들이 특정한 항산화 효소(SOD와 같은)가 부족하도록 유전적으로 조작되었다는 것을 보여주지만, 일반적으로 수명이 짧아진다는 것을 보여줍니다(이론에서 예상할 수 있듯이), 반대로 조작하여 항산화 효소의 수준을 증가시킵니다.수명에 대한 일관되지 않은 효과를 산출했습니다(단, 드로소필라의 일부 연구는 MnSOD 또는 글루타티온 생합성 효소의 과발현에 의해 수명이 증가할 수 있음을 보여줍니다).또한 이 이론과 반대로, 미토콘드리아 SOD2의 삭제는 Caenorhabditis elegans에서 수명을 연장시킬 수 있습니다.[50]
쥐의 경우, 이야기는 다소 비슷합니다.과발현 연구는 지속적으로 수명을 연장시키지 못했지만, 일반적으로 항산화 효소를 삭제하면 수명이 짧아집니다.[51]조기 노화의 쥐 모델에 대한 연구는 정상적으로 노화된 대조군 쥐들보다 조기 노화된 쥐들의 뇌 신피질과 해마에서 증가된 산화 스트레스, 감소된 항산화 효소 활성, 그리고 상당히 더 큰 DNA 손상을 발견했습니다.[52]DNA 손상 8-OHdG는 DNA와의 ROS 상호작용의 산물입니다.많은[53] 연구에서 8-OHdG는 나이가 들수록 증가하는 것으로 나타났습니다(노화 DNA 손상 이론 참조).
암
ROS는 생물학적 시스템에서 지속적으로 생성되고 제거되며, 조절 경로를 구동하기 위해 필요합니다.[54]정상적인 생리적 조건에서, 세포는 ROS의 생성과 소거 시스템에 의한 제거 사이의 균형을 유지함으로써 ROS 수준을 조절합니다.그러나 산화적 스트레스 조건에서 과도한 ROS는 세포 단백질, 지질 및 DNA에 손상을 주어 세포 내에서 발암에 기여하는 치명적인 병변을 초래할 수 있습니다.
암세포는 정상 세포보다 더 큰 ROS 스트레스를 보이는데, 이는 부분적으로 온유성 자극, 증가된 대사 활동 및 미토콘드리아 기능 부전 때문입니다.ROS는 양날의 검입니다.한편, ROS는 낮은 수준에서 암세포의 생존을 촉진하는데, 성장인자와 수용체 티로신 키나아제(RTK)에 의해 유도되는 세포주기 진행은[55] 활성화를 위해 ROS를 필요로 하며, 암의 주요 매개인자인 만성염증은 ROS에 의해 조절됩니다.반면, 높은 수준의 ROS는 지속적인 세포 주기 억제제의[56][57] 활성화와 세포 사멸 유도를 통해 종양 성장을 억제할 수 있으며, 고분자를 손상시켜 노화를 유도할 수도 있습니다.실제로 대부분의 화학요법제와 방사선 치료제는 ROS 스트레스를 증가시켜 암세포를 죽입니다.[58][59]ROS 생성의 용량, 기간, 종류 및 부위에 따라 암세포가 생존 신호 또는 세포자멸 신호로서 ROS를 구별하는 능력이 조절됩니다.암세포가 생존하기 위해서는 낮은 수준의 ROS가 필요한 반면, 과도한 수준은 암세포를 죽입니다.
종양에서의 대사 적응은 세포의 에너지 필요량과 고분자 빌딩 블록에 대한 마찬가지로 중요한 필요량과 산화 환원 균형의 더 엄격한 조절의 균형을 맞춥니다.결과적으로 NADPH의 생성은 크게 향상되는데, NADPH는 거대분자 생합성을 위한 많은 효소 반응에서 환원력을 제공하고 동시에 급속 증식 시 생성되는 과도한 ROS로부터 세포를 구제하는 보조 인자로서 기능합니다.세포는 그들의 활동을 유지하기 위해 NADPH의 감소력에 의존하는 환원된 글루타티온(GSH)과 티오레독신(TRX)과 같은 항산화 분자를 생성함으로써 ROS의 해로운 영향들의 균형을 잡습니다.[60]
암과 관련된 대부분의 위험 인자는 ROS의 생성을 통해 세포와 상호 작용합니다. ROS는 활성화된 B 세포(NF- κB)의 핵인자 카파-경쇄-강화, 활성화 단백질-1(AP-1), 저산소 유도 인자-1α 및 전사 3(STAT3)의 신호 변환기 및 활성화와 같은 다양한 전사 인자를 활성화하여 다음으로 이어집니다.염증을 조절하는 단백질의 발현; 세포전환; 종양세포 생존; 종양세포 증식; 및 침입, 혈관신생 및 전이.그리고 ROS는 또한 p53, 망막아세포종 유전자(Rb), 포스파타제 및 텐신 상동성(PTEN)과 같은 다양한 종양 억제 유전자의 발현을 조절합니다.[61]
발암
DNA의 ROS 관련 산화는 돌연변이의 주요 원인 중 하나이며, 이는 비-볼륨(8-옥소구아닌 및 포름아미도피리미딘) 및 부피(사이클로푸린 및 에테노 부가물) 염기 변형, 기본 부위, 비-전통적 단일 가닥 분열, 단백질-DNA 부가물 및 인트라/인터스트랜드 DNA 가교를 포함하여 여러 유형의 DNA 손상을 생성할 수 있습니다.[62]정상적인 세포 대사를 통해 생성된 내인성 ROS는 단일 세포에서 하루에 약 20,000개의 DNA 염기를 변형시키는 것으로 추정되었으며, 8-옥소구아닌은 관찰된 다양한 산화 질소 염기 중 가장 풍부합니다.DNA 복제 동안, DNA 중합효소는 8-옥소구아닌과 아데닌을 오쌍시켜 G→T 전환 돌연변이를 일으킵니다.그로 인한 유전적 불안정은 발암에 직접적으로 기여합니다.세포 변형은 암을 유발하고 전형적인 PKC- ζ 동형체와 p47phox 대조군의 상호작용으로 블리브실드 응급 프로그램을 통한 세포자멸성 암 줄기세포의 ROS 생성 및 변형을 초래합니다.
세포증식
조절되지 않는 증식은 암세포의 특징입니다.외인성 ROS와 내인성 ROS 둘 다 암세포의 증식을 강화하는 것으로 나타났습니다.ROS 생성을 억제할 수 있는 잠재력을 가진 제제가 암세포 증식도 억제할 수 있다는 관찰은 종양 증식을 촉진하는 ROS의 역할을 더욱 뒷받침합니다.[61]비록 ROS가 종양 세포 증식을 촉진할 수 있지만, ROS의 큰 증가는 G2/M 세포 주기 정지 유도에 의한 암 세포 증식 감소와 관련이 있습니다; 아탁시아 텔랑기엑타시아 돌연변이(ATM), 체크포인트 키나제 1(Chk 1), Chk 2; 및 감소된 세포 분열 주기 25 상동성 c(CDC 25).[65]
세포사
암세포는 세포자멸, 괴사, 자가포식의 세 가지 방법으로 죽을 수 있습니다.과도한 ROS는 외인성 경로와 내재성 경로를 통해 세포 자멸을 유도할 수 있습니다.[66]세포 사멸의 외인성 경로에서 ROS는 인산화를 통한 Fas 활성화를 위한 업스트림 이벤트로 Fas ligand에 의해 생성되며, 이는 사후 도메인 및 카스파제 8뿐만 아니라 세포 사멸 유도를 포함한 Fas 관련 단백질의 후속 모집에 필요합니다.[61]내재적 경로에서, ROS는 기공-안정화 단백질(Bcl-2 및 Bcl-xL)을 활성화시키고 기공-안정화 단백질(Bcl-2 연관 X 단백질, Bcl-2 상동성 길항제/킬러)을 억제함으로써 시토크롬 c 방출을 촉진하는 기능을 합니다.[67]고유 경로는 caspase cascade라고도 알려져 있으며 사이토크롬 c의 방출을 유발하는 미토콘드리아 손상을 통해 유도됩니다. DNA 손상, 산화 스트레스 및 미토콘드리아 막 전위의 손실은 위에서 언급한 세포 사멸을 자극하는 친-아포토틱 단백질의 방출로 이어집니다.[68]미토콘드리아 손상은 세포 자멸과 밀접한 관련이 있고 미토콘드리아가 쉽게 표적이 되기 때문에 암 치료의 가능성이 있습니다.[69]
ROS의 세포 독성은 세포 사멸의 원동력이지만, 더 많은 양의 ROS는 암세포에서 조절되지 않는 세포 사멸의 한 형태인 세포 사멸과 괴사를 둘 다 초래할 수 있습니다.[70]
수많은 연구들이 ROS 수준과 세포 자멸 사이의 경로와 연관성을 보여주었지만, 새로운 연구 라인은 ROS 수준과 자가포식을 연결시켰습니다.[71]ROS는 또한 리소좀의 분해를 위해 세포질 내용물 (소진되거나 손상된 소기관 및 단백질 응집체)의 격리를 수반하는 자기 이화 과정인 오토파지를 통해 세포 사멸을 유도할 수 있습니다.[72]따라서 자가포식은 산화 스트레스를 받을 때 세포의 건강을 조절할 수도 있습니다.자가포식은 세포 내 여러 경로를 통해 ROS 수준에 의해 유도될 수 있으며, 세포 사멸을 유도하지 않고 유해 소기관을 폐기하고 발암 물질과 같은 손상을 방지하기 위한 시도입니다.[73]세포의 손상을 최소화하기 위해 세포가 스스로를 너무 많이 소화하고 더 이상 생존할 수 없는 자가포식의 과잉 표현에 의해 자가포식 세포의 죽음이 촉발될 수 있습니다.이러한 유형의 세포사가 발생할 때, 자가포식 조절 유전자의 증가 또는 감소가 일반적으로 공동으로 관찰됩니다.[74]따라서, 자가 병진 세포사에 대한 더 깊은 이해가 이루어지고 ROS와의 관계가 이루어지면, 이러한 형태의 프로그램된 세포사는 미래의 암 치료법으로 사용될 수 있습니다.자가포식과 세포사멸은 높은 수준의 ROS에 의해 야기되는 세포사멸의 별개의 메커니즘입니다.그러나 자가포식과 세포사멸은 엄격하게 독립된 경로를 통해 거의 작용하지 않습니다.ROS와 자가포식 사이에는 명확한 연관성이 있으며 과도한 양의 ROS가 세포 자멸로 이어지는 상관관계가 있습니다.[73]미토콘드리아 막의 탈분극은 자가포식 개시의 특징이기도 합니다.미토콘드리아가 손상되고 ROS가 방출되기 시작하면 손상된 소기관을 처리하기 위해 자가포식이 시작됩니다.만약 어떤 약이 미토콘드리아를 목표로 하고 ROS를 만든다면, 자가포식은 너무 많은 미토콘드리아와 다른 손상된 소기관들을 처리하여 세포가 더 이상 생존할 수 없게 될지도 모릅니다.광범위한 양의 ROS와 미토콘드리아 손상 또한 세포 사멸의 신호일 수 있습니다.세포 내에서 자가포식의 균형과 ROS에 의해 매개되는 자가포식과 세포자멸 사이의 크로스토크는 세포의 생존에 중요합니다.이러한 크로스토크와 자가포식과 세포자멸 사이의 연관성은 암 치료법의 표적이 되거나 내성이 높은 암에 대한 복합 치료에 사용될 수 있습니다.
종양세포침범, 혈관신생 및 전이
RTK의 성장인자 자극 후, ROS는 세포 외 조절 키나제(ERK), c-jun NH-2 말단 키나제(JNK) 및 p38 MAPK와 같은 세포 이동 및 침입에 관련된 신호 경로의 활성화를 유발할 수 있습니다.ROS는 또한 초점 부착 키나아제(FAK) p130Cas 및 팍실린의 인산화를 증가시킴으로써 이동을 촉진할 수 있습니다.[75]
시험관내 및 생체내 모두에서, ROS는 전사 인자를 유도하고 혈관신생(MMP, VEGF) 및 전이(AP-1, CXCR4, AKT 및 PTEN의 하향 조절)에 관여하는 신호 분자를 조절하는 것으로 나타났습니다.[61]
만성염증 및 암
지난 몇 년간의 실험적이고 역학적인 연구는 ROS, 만성 염증, 그리고 암 사이의 밀접한 연관성을 나타냈습니다.[61]ROS는 COX-2, 염증성 사이토카인(TNFα, 인터류킨1(IL-1)), IL-6, 케모카인(IL-8, CXCR4) 및 친염증 전사 인자(NF- κB)의 유도에 의해 만성 염증을 유도합니다.이러한 케모카인 및 케모카인 수용체는, 차례로, 다양한 종양 유형의 침입 및 전이를 촉진합니다.
암치료

ROS 상승 및 ROS 제거 전략은 모두 전자를 주로 사용하여 개발되었습니다.ROS 수치가 상승한 암세포는 항산화 방어 시스템에 크게 의존합니다.ROS 상승 약물은 직접적인 ROS-생성(예: motexafin gadolinium, elesclomol) 또는 SOD 억제제(예: ATN-224, 2-메톡시에스트라디올) 및 GSH 억제제(예: PEITC, 부티오닌술폭시민(BSO))와 같은 고유의 항산화 시스템을 폐기하는 제제에 의해 세포 ROS 스트레스 수준을 더욱 증가시킵니다.그 결과 세포 허용 한계치를 넘으면 세포 사멸을 유도할 수 있는 내인성 ROS의 전반적인 증가입니다.[76]반면에, 정상 세포는 낮은 기저 스트레스와 예비력 하에서 암 세포보다 추가적인 ROS 생성 모욕에 대처할 수 있는 더 높은 능력을 가지고 있는 것으로 보입니다.[77]따라서 모든 세포에서 ROS의 상승은 암세포의 선택적 사멸을 달성하는 데 사용될 수 있습니다.
방사선 치료는 또한 종양 세포를 박멸하기 위해 ROS 독성에 의존합니다.방사선 치료는 X선, γ선 뿐만 아니라 양성자, 중성자와 같은 중입자 방사선을 사용하여 ROS 매개 세포의 사멸과 유사분열 실패를 유도합니다.
ROS의 이중적인 역할로 인해 산화방지제와 산화방지제를 기반으로 한 항암제가 개발되어 왔습니다.그러나 ROS 신호전달의 조절만으로는 암세포가 ROS 스트레스에 적응하는 것, ROS 생성 항암제의 암 성장 및 독성을 지원하기 위한 중복된 경로 때문에 이상적인 접근법이 아닌 것으로 보입니다.ROS 생성 약물과 레독스 적응을 깨뜨릴 수 있는 약물의 조합은 암세포 세포 독성을 강화하는 더 나은 전략이 될 수 있습니다.[61]
제임스 왓슨(James Watson[78])과 다른 사람들은[79] 신체적 운동 부족으로 인한 세포 내 ROS의 부족이 암의 악성 진행에 기여할 수 있다고 제안했습니다. 왜냐하면 소포체의 단백질을 올바르게 접기 위해서는 ROS의 스파이크가 필요하고 따라서 낮은 ROS 수준이 종양 억제 단백질의 형성을 특히 방해할 수 있기 때문입니다.[79]신체적 운동은 일시적인 ROS의 급상승을 유도하기 때문에, 이것은 왜 신체적 운동이 암 환자의 예후에 도움이 되는지 설명할 수 있습니다.[80]게다가, 2-디옥시-D-글루코스와 같은 ROS의 높은 유도체들과 세포 스트레스의 탄수화물 기반 유도체들은 암세포의 당에 대한 높은 열정을 이용하기 때문에 암세포의 죽음을 더 강력하게 유도합니다.[81]
메모리에서 ROS의 긍정적인 역할


ROS는 메모리 형성에 매우 중요합니다.[84][85]ROS는 후성유전학적 DNA 탈메틸화에 있어서도 중심적인 역할을 하는데, 이것은 학습과 기억과[86][87] 관련이 있습니다.
포유류의 핵 DNA에서, 메틸기는 DNA 메틸트랜스퍼라제에 의해 사이토신의 5번째 탄소에 첨가되어 5mC를 형성할 수 있습니다(첫번째 그림의 상단 부근에 5mC를 형성하도록 추가된 적색 메틸기 참조).DNA 메틸트랜스퍼레이스는 디뉴클레오티드 서열 "사이토신-인산-구아닌" 내에서 5mCpG를 형성하는 경우가 가장 많습니다.이 첨가물은 후성유전학적 변화의 주요한 유형이며 유전자 발현을 침묵시킬 수 있습니다.메틸화된 사이토신은 또한 유전자의 발현을 증가시킬 수 있는 후생유전학적 변화인 탈메틸화될 수 있습니다.5mCpG의 탈메틸화에 관여하는 주요 효소는 TET1입니다.그러나, TET1은 구아닌에 ROS가 먼저 작용하여 8-하이드록시-2'-디옥시구아노신(8-OHdG)을 형성하여 5mCp-8-OHdG 다이뉴클레오티드를 생성하는 경우에만 5mCpG에 작용할 수 있습니다.[82]그러나 TET1은 염기 절제 수복효소 OGG1이 8-OHdG 병변에 즉시 절제 없이 결합할 때에만 다이뉴클레오티드의 5mC 부분에 작용할 수 있습니다.5mCp-8-OHdG 부위에 OGG1이 부착되면 TET1과 TET1이 결합한 후 첫 번째 그림과 같이 8-OHdG에 인접한 5mC를 산화시켜 두 번째 그림에 표시된 탈메틸화 경로를 개시합니다.
메모리 형성 중에 탈메틸화되는 수천 개의 CpG 사이트는 초기 단계에서 ROS에 의존합니다.뉴런 DNA 내의 유전자 촉진제에서 CpG 부위의 ROS 의존적 탈메틸화에 의해 부분적으로 조절되는 뉴런의 변화된 단백질 발현은 기억 형성의 중심입니다.[88]
참고 항목
- 폴리페놀과 천연페놀의 항산화 효과
- 요오드화물
- 멜라닌
- 미토호메시스
- 산화스트레스
- 산소독성
- 산화방지제
- 반응성질소종
- 반응성 황종
- 반응성카보닐종
- 해양 미세조류의 활성산소종 생성에 관한 연구
참고문헌
- ^ Hayyan M, Hashim MA, AlNashef IM (March 2016). "Superoxide Ion: Generation and Chemical Implications". Chemical Reviews. 116 (5): 3029–3085. doi:10.1021/acs.chemrev.5b00407. PMID 26875845.
- ^ Halliwell B, Adhikary A, Dingfelder M, Dizdaroglu M (August 2021). "Hydroxyl radical is a significant player in oxidative DNA damage in vivo". Chemical Society Reviews. 50 (15): 8355–8360. doi:10.1039/d1cs00044f. PMC 8328964. PMID 34128512.
- ^ Nosaka Y, Nosaka AY (September 2017). "Generation and Detection of Reactive Oxygen Species in Photocatalysis". Chemical Reviews. 117 (17): 11302–11336. doi:10.1021/acs.chemrev.7b00161. PMID 28777548.
- ^ a b Turrens JF (October 2003). "Mitochondrial formation of reactive oxygen species". The Journal of Physiology. 552 (Pt 2): 335–44. doi:10.1113/jphysiol.2003.049478. PMC 2343396. PMID 14561818.
- ^ Hayyan, M.; Hashim, M.A.; AlNashef, I.M. (2016). "Superoxide Ion: Generation and Chemical Implications". Chem. Rev. 116 (5): 3029–3085. doi:10.1021/acs.chemrev.5b00407. PMID 26875845.
- ^ a b Laloi C, Havaux M (2015). "Key players of singlet oxygen-induced cell death in plants". Frontiers in Plant Science. 6: 39. doi:10.3389/fpls.2015.00039. PMC 4316694. PMID 25699067.
- ^ Apel, Klaus; Hirt, Heribert (2004). "Reactive Oxygen Specues: Metabolism, Oxidative Stress, and Signal Transduction". Annual Review of Plant Biology. 55: 373–399. doi:10.1146/annurev.arplant.55.031903.141701. PMID 15377225.
- ^ Waszczak C, Carmody M, Kangasjärvi J (April 2018). "Reactive Oxygen Species in Plant Signaling". Annual Review of Plant Biology. 69 (1): 209–236. doi:10.1146/annurev-arplant-042817-040322. PMID 29489394. Archived from the original on 2022-06-15. Retrieved 2022-05-18.
- ^ a b Devasagayam TP, Tilak JC, Boloor KK, Sane KS, Ghaskadbi SS, Lele RD (October 2004). "Free radicals and antioxidants in human health: current status and future prospects". The Journal of the Association of Physicians of India. 52: 794–804. PMID 15909857.
- ^ Edreva A (2 April 2005). "Generation and scavenging of reactive oxygen species in chloroplasts: a submolecular approach". Agriculture, Ecosystems & Environment. 106 (2): 119–133. doi:10.1016/j.agee.2004.10.022. ISSN 0167-8809. Retrieved 3 November 2020.
- ^ Herb M, Gluschko A, Schramm M (September 2021). "Reactive Oxygen Species: Not Omnipresent but Important in Many Locations". Frontiers in Cell and Developmental Biology. 9 (716406): 716406. doi:10.3389/fcell.2021.716406. PMC 8452931. PMID 34557488.
- ^ Grant JJ, Loake GJ (September 2000). "Role of reactive oxygen intermediates and cognate redox signaling in disease resistance". Plant Physiology. 124 (1): 21–29. doi:10.1104/pp.124.1.21. PMC 1539275. PMID 10982418.
- ^ Herb M, Gluschko A, Schramm M (September 2021). "Reactive Oxygen Species: Not Omnipresent but Important in Many Locations". Frontiers in Cell and Developmental Biology. 9: 716406. doi:10.3389/fcell.2021.716406. PMC 8452931. PMID 34557488.
- ^ Waszczak C, Carmody M, Kangasjärvi J (April 2018). "Reactive Oxygen Species in Plant Signaling". Annual Review of Plant Biology. 69 (1): 209–236. doi:10.1146/annurev-arplant-042817-040322. PMID 29489394. Archived from the original on 2022-06-15. Retrieved 2022-05-18.
- ^ a b c Edreva A (2 April 2005). "Generation and scavenging of reactive oxygen species in chloroplasts: a submolecular approach". Agriculture, Ecosystems & Environment. 106 (2): 119–133. doi:10.1016/j.agee.2004.10.022. ISSN 0167-8809.
- ^ Sosa Torres ME, Saucedo-Vázquez JP, Kroneck P (2015). "Chapter 1, Section 3 The dark side of dioxygen". In Kroneck PM, Torres ME (eds.). Sustaining Life on Planet Earth: Metalloenzymes Mastering Dioxygen and Other Chewy Gases. Metal Ions in Life Sciences. Vol. 15. Springer. pp. 1–12. doi:10.1007/978-3-319-12415-5_1. PMID 25707464.
- ^ Mittler R (January 2017). "ROS Are Good". Trends in Plant Science. 22 (1): 11–19. doi:10.1016/j.tplants.2016.08.002. PMID 27666517.
- ^ Novo E, Parola M (October 2008). "Redox mechanisms in hepatic chronic wound healing and fibrogenesis". Fibrogenesis & Tissue Repair. 1 (1): 5. doi:10.1186/1755-1536-1-5. PMC 2584013. PMID 19014652.
- ^ a b c Muthukumar K, Nachiappan V (December 2010). "Cadmium-induced oxidative stress in Saccharomyces cerevisiae". Indian Journal of Biochemistry & Biophysics. 47 (6): 383–387. PMID 21355423.
- ^ Dietz KJ (January 2016). "Thiol-Based Peroxidases and Ascorbate Peroxidases: Why Plants Rely on Multiple Peroxidase Systems in the Photosynthesizing Chloroplast?". Molecules and Cells. 39 (1): 20–25. doi:10.14348/molcells.2016.2324. PMC 4749869. PMID 26810073.
- ^ Muller F (October 2000). "The nature and mechanism of superoxide production by the electron transport chain: Its relevance to aging". Journal of the American Aging Association. 23 (4): 227–253. doi:10.1007/s11357-000-0022-9. PMC 3455268. PMID 23604868.
- ^ Han D, Williams E, Cadenas E (January 2001). "Mitochondrial respiratory chain-dependent generation of superoxide anion and its release into the intermembrane space". The Biochemical Journal. 353 (Pt 2): 411–416. doi:10.1042/0264-6021:3530411. PMC 1221585. PMID 11139407.
- ^ Li X, Fang P, Mai J, Choi ET, Wang H, Yang XF (February 2013). "Targeting mitochondrial reactive oxygen species as novel therapy for inflammatory diseases and cancers". Journal of Hematology & Oncology. 6 (19): 19. doi:10.1186/1756-8722-6-19. PMC 3599349. PMID 23442817.
- ^ Hanukoglu I, Rapoport R, Weiner L, Sklan D (September 1993). "Electron leakage from the mitochondrial NADPH-adrenodoxin reductase-adrenodoxin-P450scc (cholesterol side chain cleavage) system". Archives of Biochemistry and Biophysics. 305 (2): 489–498. doi:10.1006/abbi.1993.1452. PMID 8396893.
- ^ Hanukoglu I (2006). "Antioxidant protective mechanisms against reactive oxygen species (ROS) generated by mitochondrial P450 systems in steroidogenic cells". Drug Metabolism Reviews. 38 (1–2): 171–196. doi:10.1080/03602530600570040. PMID 16684656. S2CID 10766948.
- ^ Curtin JF, Donovan M, Cotter TG (July 2002). "Regulation and measurement of oxidative stress in apoptosis". Journal of Immunological Methods. 265 (1–2): 49–72. doi:10.1016/s0022-1759(02)00070-4. PMID 12072178.
- ^ Alberts B, Johnson A, Lewis J, Morgan D, Raff M, Roberts K, Walter P (2014). Molecular Biology of the Cell (6th ed.). New York: Garland Science. p. 1025. ISBN 978-0-8153-4432-2.
- ^ a b Herb M, Schramm M (February 2021). "Functions of ROS in Macrophages and Antimicrobial Immunity". Antioxidants. 10 (2): 313. doi:10.3390/antiox10020313. PMC 7923022. PMID 33669824.
- ^ Chen X, Song M, Zhang B, Zhang Y (July 28, 2016). "Reactive Oxygen Species Regulate T Cell Immune Response in the Tumor Microenvironment". Oxidative Medicine and Cellular Longevity. 2016: 1580967. doi:10.1155/2016/1580967. PMC 4980531. PMID 27547291.
- ^ Huang H, Ullah F, Zhou DX, Yi M, Zhao Y (2019). "Mechanisms of ROS Regulation of Plant Development and Stress Responses". Frontiers in Plant Science. 10: 800. doi:10.3389/fpls.2019.00800. PMC 6603150. PMID 31293607.
- ^ a b Zhang S, Weng J, Pan J, Tu T, Yao S, Xu C (1 January 2003). "Study on the photo-generation of superoxide radicals in Photosystem II with EPR spin trapping techniques". Photosynthesis Research. 75 (1): 41–48. doi:10.1023/A:1022439009587. PMID 16245092. S2CID 11724647.
- ^ Cleland RE, Grace SC (September 1999). "Voltammetric detection of superoxide production by photosystem II". FEBS Letters. 457 (3): 348–352. doi:10.1016/S0014-5793(99)01067-4. PMID 10471806. S2CID 1122939.
- ^ Baniulis D, Hasan SS, Stofleth JT, Cramer WA (December 2013). "Mechanism of enhanced superoxide production in the cytochrome b(6)f complex of oxygenic photosynthesis". Biochemistry. 52 (50): 8975–8983. doi:10.1021/bi4013534. PMC 4037229. PMID 24298890.
- ^ a b Kleine T, Leister D (August 2016). "Retrograde signaling: Organelles go networking". Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1857 (8): 1313–1325. doi:10.1016/j.bbabio.2016.03.017. PMID 26997501.
- ^ Grant JJ, Loake GJ (September 2000). "Role of reactive oxygen intermediates and cognate redox signaling in disease resistance". Plant Physiology. 124 (1): 21–29. doi:10.1104/pp.124.1.21. PMC 1539275. PMID 10982418.
- ^ — Rada B, Leto TL (2008). "Oxidative innate immune defenses by Nox/Duox family NADPH oxidases". In Egesten A, Schmidt A, Herwald H (eds.). Trends in Innate Immunity. Contributions to Microbiology. Vol. 15. Basel: Karger. pp. 164–87. doi:10.1159/000136357. ISBN 978-3-8055-8548-4. PMC 2776633. PMID 18511861. 리뷰
- ^ Conner GE, Salathe M, Forteza R (December 2002). "Lactoperoxidase and hydrogen peroxide metabolism in the airway". American Journal of Respiratory and Critical Care Medicine. 166 (12 Pt 2): S57–S61. doi:10.1164/rccm.2206018. PMID 12471090.
- ^ Brooker RJ (2011). Genetics: analysis and principles (4th ed.). McGraw-Hill Science. ISBN 978-0-07-352528-0.
- ^ Buchon N, Broderick NA, Lemaitre B (September 2013). "Gut homeostasis in a microbial world: insights from Drosophila melanogaster". Nature Reviews. Microbiology. 11 (9): 615–626. doi:10.1038/nrmicro3074. PMID 23893105. S2CID 8129204.
- ^ Lee KA, Kim SH, Kim EK, Ha EM, You H, Kim B, et al. (May 2013). "Bacterial-derived uracil as a modulator of mucosal immunity and gut-microbe homeostasis in Drosophila". Cell. 153 (4): 797–811. doi:10.1016/j.cell.2013.04.009. PMID 23663779.
- ^ West AP, Shadel GS, Ghosh S (June 2011). "Mitochondria in innate immune responses". Nature Reviews. Immunology. 11 (6): 389–402. doi:10.1038/nri2975. PMC 4281487. PMID 21597473.
- ^ Kim HJ, Kim CH, Ryu JH, Kim MJ, Park CY, Lee JM, et al. (November 2013). "Reactive oxygen species induce antiviral innate immune response through IFN-λ regulation in human nasal epithelial cells". American Journal of Respiratory Cell and Molecular Biology. 49 (5): 855–865. doi:10.1165/rcmb.2013-0003OC. PMC 5455605. PMID 23786562.
- ^ Herb M, Gluschko A, Wiegmann K, Farid A, Wolf A, Utermöhlen O, et al. (February 2019). "Mitochondrial reactive oxygen species enable proinflammatory signaling through disulfide linkage of NEMO". Science Signaling. 12 (568): eaar5926. doi:10.1126/scisignal.aar5926. PMID 30755476.
- ^ Deffert C, Cachat J, Krause KH (August 2014). "Phagocyte NADPH oxidase, chronic granulomatous disease and mycobacterial infections". Cellular Microbiology. 16 (8): 1168–1178. doi:10.1111/cmi.12322. PMID 24916152. S2CID 3489742.
- ^ Belikov AV, Schraven B, Simeoni L (October 2015). "T cells and reactive oxygen species". Journal of Biomedical Science. 22: 85. doi:10.1186/s12929-015-0194-3. PMC 4608155. PMID 26471060.
- ^ Patel RP, T Cornwell T, Darley-Usmar VM (1999). "The biochemistry of nitric oxide and peroxynitrite: implications for mitochondrial function". In Packer L, Cadenas E (eds.). Understanding the process of aging: the roles of mitochondria, free radicals, and antioxidants. New York, NY: Marcel Dekker. pp. 39–56. ISBN 0-8247-1723-6.
- ^ Liu J, Head E, Gharib AM, Yuan W, Ingersoll RT, Hagen TM, et al. (February 2002). "Memory loss in old rats is associated with brain mitochondrial decay and RNA/DNA oxidation: partial reversal by feeding acetyl-L-carnitine and/or R-alpha -lipoic acid". Proceedings of the National Academy of Sciences of the United States of America. 99 (4): 2356–2361. Bibcode:2002PNAS...99.2356L. doi:10.1073/pnas.261709299. PMC 122369. PMID 11854529.
- ^ Stadtman ER (August 1992). "Protein oxidation and aging". Science. 257 (5074): 1220–1224. Bibcode:1992Sci...257.1220S. doi:10.1126/science.1355616. PMID 1355616.
- ^ Carney JM, Starke-Reed PE, Oliver CN, Landum RW, Cheng MS, Wu JF, Floyd RA (May 1991). "Reversal of age-related increase in brain protein oxidation, decrease in enzyme activity, and loss in temporal and spatial memory by chronic administration of the spin-trapping compound N-tert-butyl-alpha-phenylnitrone". Proceedings of the National Academy of Sciences of the United States of America. 88 (9): 3633–3636. Bibcode:1991PNAS...88.3633C. doi:10.1073/pnas.88.9.3633. PMC 51506. PMID 1673789.
- ^ Van Raamsdonk JM, Hekimi S (February 2009). "Deletion of the mitochondrial superoxide dismutase sod-2 extends lifespan in Caenorhabditis elegans". PLOS Genetics. 5 (2): e1000361. doi:10.1371/journal.pgen.1000361. PMC 2628729. PMID 19197346.
- ^ Muller FL, Lustgarten MS, Jang Y, Richardson A, Van Remmen H (August 2007). "Trends in oxidative aging theories". Free Radical Biology & Medicine. 43 (4): 477–503. doi:10.1016/j.freeradbiomed.2007.03.034. PMID 17640558.
- ^ Sinha JK, Ghosh S, Swain U, Giridharan NV, Raghunath M (June 2014). "Increased macromolecular damage due to oxidative stress in the neocortex and hippocampus of WNIN/Ob, a novel rat model of premature aging". Neuroscience. 269: 256–264. doi:10.1016/j.neuroscience.2014.03.040. PMID 24709042. S2CID 9934178.
- ^ Bernstein H, Payne CM, Bernstein C, Garewal H, Dvorak K (2008). "Chapter 1: Cancer and aging as consequences of un-repaired DNA damage.". In Kimura H, Suzuki A (eds.). New Research on DNA Damages. New York: Nova Science Publishers, Inc. pp. 1–47. ISBN 978-1-60456-581-2. Archived from the original on 2014-10-25. Retrieved 2018-03-15.Bernstein H, Payne CM, Bernstein C, Garewal H, Dvorak K (2008). "Chapter 1: Cancer and aging as consequences of un-repaired DNA damage.". In Kimura H, Suzuki A (eds.). New Research on DNA Damages. New York: Nova Science Publishers, Inc. pp. 1–47. ISBN 978-1-60456-581-2. Archived from the original on 2014-10-25. Retrieved 2018-03-15.
 읽기 전용입니다.
읽기 전용입니다. - ^ Dickinson BC, Chang CJ (July 2011). "Chemistry and biology of reactive oxygen species in signaling or stress responses". Nature Chemical Biology. 7 (8): 504–511. doi:10.1038/nchembio.607. PMC 3390228. PMID 21769097.
- ^ Irani K, Xia Y, Zweier JL, Sollott SJ, Der CJ, Fearon ER, et al. (March 1997). "Mitogenic signaling mediated by oxidants in Ras-transformed fibroblasts". Science. 275 (5306): 1649–1652. doi:10.1126/science.275.5306.1649. PMID 9054359. S2CID 19733670.
- ^ Ramsey MR, Sharpless NE (November 2006). "ROS as a tumour suppressor?". Nature Cell Biology. 8 (11): 1213–1215. doi:10.1038/ncb1106-1213. PMID 17077852. S2CID 21104991.
- ^ Takahashi A, Ohtani N, Yamakoshi K, Iida S, Tahara H, Nakayama K, et al. (November 2006). "Mitogenic signalling and the p16INK4a-Rb pathway cooperate to enforce irreversible cellular senescence". Nature Cell Biology. 8 (11): 1291–1297. doi:10.1038/ncb1491. PMID 17028578. S2CID 8686894.
- ^ Renschler MF (September 2004). "The emerging role of reactive oxygen species in cancer therapy". European Journal of Cancer. 40 (13): 1934–1940. doi:10.1016/j.ejca.2004.02.031. PMID 15315800.
- ^ Toler SM, Noe D, Sharma A (December 2006). "Selective enhancement of cellular oxidative stress by chloroquine: implications for the treatment of glioblastoma multiforme". Neurosurgical Focus. 21 (6): E10. doi:10.3171/foc.2006.21.6.1. PMID 17341043.
- ^ Cairns RA, Harris IS, Mak TW (February 2011). "Regulation of cancer cell metabolism". Nature Reviews. Cancer. 11 (2): 85–95. doi:10.1038/nrc2981. PMID 21258394. S2CID 8891526.
- ^ a b c d e f g h Gupta SC, Hevia D, Patchva S, Park B, Koh W, Aggarwal BB (June 2012). "Upsides and downsides of reactive oxygen species for cancer: the roles of reactive oxygen species in tumorigenesis, prevention, and therapy". Antioxidants & Redox Signaling. 16 (11): 1295–1322. doi:10.1089/ars.2011.4414. PMC 3324815. PMID 22117137.
- ^ Waris G, Ahsan H (May 2006). "Reactive oxygen species: role in the development of cancer and various chronic conditions". Journal of Carcinogenesis. 5: 14. doi:10.1186/1477-3163-5-14. PMC 1479806. PMID 16689993.
- ^ Jinesh GG, Taoka R, Zhang Q, Gorantla S, Kamat AM (April 2016). "Novel PKC-ζ to p47 phox interaction is necessary for transformation from blebbishields". Scientific Reports. 6: 23965. Bibcode:2016NatSR...623965J. doi:10.1038/srep23965. PMC 4819220. PMID 27040869.
- ^ 진시 GG, 카마트 AM.블레비쉴드 응급 프로그램: 세포전환으로의 세포자멸 경로.셀 데스 차이. 2016년 언론에서.
- ^ Ames BN (September 1983). "Dietary carcinogens and anticarcinogens. Oxygen radicals and degenerative diseases". Science. 221 (4617): 1256–1264. Bibcode:1983Sci...221.1256A. doi:10.1126/science.6351251. PMID 6351251.
- ^ Ozben T (September 2007). "Oxidative stress and apoptosis: impact on cancer therapy". Journal of Pharmaceutical Sciences. 96 (9): 2181–2196. doi:10.1002/jps.20874. PMID 17593552.
- ^ Martindale JL, Holbrook NJ (July 2002). "Cellular response to oxidative stress: signaling for suicide and survival". Journal of Cellular Physiology. 192 (1): 1–15. doi:10.1002/jcp.10119. PMID 12115731.
- ^ Maiuri MC, Zalckvar E, Kimchi A, Kroemer G (September 2007). "Self-eating and self-killing: crosstalk between autophagy and apoptosis". Nature Reviews. Molecular Cell Biology. 8 (9): 741–752. doi:10.1038/nrm2239. PMID 17717517. S2CID 3912801.
- ^ Fulda S, Galluzzi L, Kroemer G (June 2010). "Targeting mitochondria for cancer therapy". Nature Reviews. Drug Discovery. 9 (6): 447–464. doi:10.1038/nrd3137. PMID 20467424. S2CID 14643750.
- ^ Hampton MB, Orrenius S (September 1997). "Dual regulation of caspase activity by hydrogen peroxide: implications for apoptosis". FEBS Letters. 414 (3): 552–556. doi:10.1016/s0014-5793(97)01068-5. PMID 9323034. S2CID 41952954.
- ^ Gibson SB (October 2010). "A matter of balance between life and death: targeting reactive oxygen species (ROS)-induced autophagy for cancer therapy". Autophagy. 6 (7): 835–837. doi:10.4161/auto.6.7.13335. PMID 20818163.
- ^ Shrivastava A, Kuzontkoski PM, Groopman JE, Prasad A (July 2011). "Cannabidiol induces programmed cell death in breast cancer cells by coordinating the cross-talk between apoptosis and autophagy". Molecular Cancer Therapeutics. 10 (7): 1161–1172. doi:10.1158/1535-7163.MCT-10-1100. PMID 21566064.
- ^ a b Scherz-Shouval R, Elazar Z (September 2007). "ROS, mitochondria and the regulation of autophagy". Trends in Cell Biology. 17 (9): 422–427. doi:10.1016/j.tcb.2007.07.009. PMID 17804237.
- ^ Xie Z, Klionsky DJ (October 2007). "Autophagosome formation: core machinery and adaptations". Nature Cell Biology. 9 (10): 1102–1109. doi:10.1038/ncb1007-1102. PMID 17909521. S2CID 26402002.
- ^ Tochhawng L, Deng S, Pervaiz S, Yap CT (May 2013). "Redox regulation of cancer cell migration and invasion". Mitochondrion. 13 (3): 246–253. doi:10.1016/j.mito.2012.08.002. PMID 22960576.
- ^ Schumacker PT (September 2006). "Reactive oxygen species in cancer cells: live by the sword, die by the sword". Cancer Cell. 10 (3): 175–176. doi:10.1016/j.ccr.2006.08.015. PMID 16959608.
- ^ Trachootham D, Alexandre J, Huang P (July 2009). "Targeting cancer cells by ROS-mediated mechanisms: a radical therapeutic approach?". Nature Reviews. Drug Discovery. 8 (7): 579–591. doi:10.1038/nrd2803. PMID 19478820. S2CID 20697221.
- ^ Watson JD (March 2014). "Type 2 diabetes as a redox disease". Lancet. 383 (9919): 841–843. doi:10.1016/s0140-6736(13)62365-x. PMID 24581668. S2CID 1076963.
- ^ a b Molenaar RJ, van Noorden CJ (September 2014). "Type 2 diabetes and cancer as redox diseases?". Lancet. 384 (9946): 853. doi:10.1016/s0140-6736(14)61485-9. PMID 25209484. S2CID 28902284.
- ^ Irwin ML, Smith AW, McTiernan A, Ballard-Barbash R, Cronin K, Gilliland FD, et al. (August 2008). "Influence of pre- and postdiagnosis physical activity on mortality in breast cancer survivors: the health, eating, activity, and lifestyle study". Journal of Clinical Oncology. 26 (24): 3958–3964. doi:10.1200/jco.2007.15.9822. PMC 2654316. PMID 18711185.
- ^ Ndombera FT, VanHecke GC, Nagi S, Ahn YH (March 2016). "Carbohydrate-based inducers of cellular stress for targeting cancer cells". Bioorganic & Medicinal Chemistry Letters. 26 (5): 1452–1456. doi:10.1016/j.bmcl.2016.01.063. PMID 26832785.
- ^ a b Zhou X, Zhuang Z, Wang W, He L, Wu H, Cao Y, et al. (September 2016). "OGG1 is essential in oxidative stress induced DNA demethylation". Cellular Signalling. 28 (9): 1163–1171. doi:10.1016/j.cellsig.2016.05.021. PMID 27251462.
- ^ Bayraktar G, Kreutz MR (2018). "The Role of Activity-Dependent DNA Demethylation in the Adult Brain and in Neurological Disorders". Frontiers in Molecular Neuroscience. 11: 169. doi:10.3389/fnmol.2018.00169. PMC 5975432. PMID 29875631.
- ^ Massaad CA, Klann E (May 2011). "Reactive oxygen species in the regulation of synaptic plasticity and memory". Antioxidants & Redox Signaling. 14 (10): 2013–2054. doi:10.1089/ars.2010.3208. PMC 3078504. PMID 20649473.
- ^ Beckhauser TF, Francis-Oliveira J, De Pasquale R (2016). "Reactive Oxygen Species: Physiological and Physiopathological Effects on Synaptic Plasticity". Journal of Experimental Neuroscience. 10 (Suppl 1): 23–48. doi:10.4137/JEN.S39887. PMC 5012454. PMID 27625575.
- ^ Day JJ, Sweatt JD (January 2011). "Epigenetic modifications in neurons are essential for formation and storage of behavioral memory". Neuropsychopharmacology. 36 (1): 357–358. doi:10.1038/npp.2010.125. PMC 3055499. PMID 21116250.
- ^ Sweatt JD (October 2016). "Neural plasticity and behavior - sixty years of conceptual advances". Journal of Neurochemistry. 139 (Suppl 2): 179–199. doi:10.1111/jnc.13580. PMID 26875778.
- ^ Day JJ, Sweatt JD (November 2010). "DNA methylation and memory formation". Nature Neuroscience. 13 (11): 1319–1323. doi:10.1038/nn.2666. PMC 3130618. PMID 20975755.
추가열람
- Sen CK (2003). "The general case for redox control of wound repair". Wound Repair and Regeneration. 11 (6): 431–438. doi:10.1046/j.1524-475X.2003.11607.x. PMID 14617282. S2CID 40770160.
- Krötz F, Sohn HY, Gloe T, Zahler S, Riexinger T, Schiele TM, et al. (August 2002). "NAD(P)H oxidase-dependent platelet superoxide anion release increases platelet recruitment". Blood. 100 (3): 917–924. doi:10.1182/blood.V100.3.917. PMID 12130503.
- Pignatelli P, Pulcinelli FM, Lenti L, Gazzaniga PP, Violi F (January 1998). "Hydrogen peroxide is involved in collagen-induced platelet activation". Blood. 91 (2): 484–490. doi:10.1182/blood.V91.2.484. PMID 9427701.
- Guzik TJ, Korbut R, Adamek-Guzik T (December 2003). "Nitric oxide and superoxide in inflammation and immune regulation". Journal of Physiology and Pharmacology. 54 (4): 469–487. PMID 14726604.
![{\displaystyle {\begin{aligned}&{\ce {M}}^{(n+1)+}+{\ce {O2- ->[SOD]}}\ {\ce {M}}^{n+}+{\ce {O2}}\\&{\ce {M}}^{n+}+{\ce {O2- + 2H+ ->[][SOD]}}\ {\ce {M}}^{(n+1)+}+{\ce {H2O2}}\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c7f939ecda1a07badabb855bce5991e15d94a25c)
![{\displaystyle {\begin{aligned}&{\ce {2H2O2->[{\text{catalase}}]2H2O{}+O2}}\\&{\ce {2GSH{}+H2O2->[][{\text{glutathione}} \atop {\text{peroxidase}}]GS-SG{}+2H2O}}\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/699aacd6aea04d8ae2454398770976661e745d19)