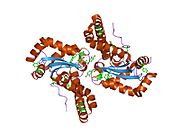
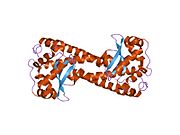
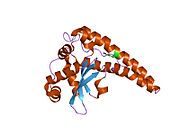
SOD2
SOD2MnSOD(망간 의존성 과산화질소 분해효소)라고도 알려진 과산화질소 분해효소 2, 미토콘드리아(SOD2)는 인간에서 6번 염색체의 SOD2 유전자에 의해 암호화된 효소다.[5][6]1번 염색체에서 관련된 유사 유전자가 확인되었다.이 유전자의 대체적인 스플라이싱은 여러 가지 대본을 변형시키는 결과를 낳는다.[5]이 유전자는 철/망간 과산화 분해효소 계열의 일원이다.호모테트라머를 형성하고 서브유닛당 1개의 망간 이온을 결합하는 미토콘드리아 단백질을 암호화한다.이 단백질은 산화 인산화물의 과산화 부산물에 결합하여 과산화수소 및 이원자 산소로 전환한다.이 유전자의 돌연변이는 특발성 심장병증, 조기 노화, 산발적인 운동 신경 질환, 그리고 암과 연관되어 왔다.[5]
구조
SOD2 유전자는 4개의 인트론에 의해 방해되는 5개의 엑손, TATA나 CAAT 대신 GC가 풍부한 지역을 소유하는 특징 없는 5개 정도의 프로모터, 그리고 두 번째 인트론에는 엔핸서가 들어 있다.hancer)를 포함한다.근위촉진지역에는 특정-1(Sp1)과 활성제단백질2(AP-2), 조기성장반응1(Egr-1) 등 전사인자에 대한 복수의 결합 사이트가 있다.[6]이 유전자는 철/망간 과산화 분해효소 계열의 미토콘드리아 성분이다.[5][7]호모테트라머를 형성하고 서브유닛당 1개의 망간 이온을 결합하는 미토콘드리아 매트릭스 단백질을 암호화한다.[5][6]망간 부위는 단백질로부터 4개의 리간드와 5번째 용제 리간드로 삼각형 2중성 기하학을 형성한다.이 용매 리간드는 효소의 전자 수용체 역할을 하는 것으로 여겨지는 수산화물이다.활성 현장 공동은 금속의 수성 리간드에서 확장되는 수소 결합과 관련된 여러 잔류물의 측면 사슬의 네트워크로 구성된다.특히, 보존도가 높은 잔류물 Tyr34는 수소 결합 네트워크에서 핵심적인 역할을 하는데, 이 잔류물의 질화작용은 단백질의 촉매 기능을 억제하기 때문이다.[8]이 단백질은 또한 그것을 미토콘드리아 매트릭스로 표적이 되는 N-단자 미토콘드리아 리더 시퀀스를 가지고 있는데, 여기서 미토콘드리아에서 생성된 활성산소를 호흡 체인에서 H2로 변환한다.[6]다른 ISO 양식을 인코딩하는 대체 전사 스플라이스 변형이 특징지어졌다.[5]
함수
이 단백질은 철/망간 과산화질소 분해효소 계열의 일원으로 미토콘드리아 전자전달체인의 부산물인 유독성 과산화수소와 이원자산소로 변형시킨다.[5]이 기능을 통해 SOD2는 미토콘드리아 반응산소종(ROS)을 클리어할 수 있으며, 그 결과 세포사멸에 대한 보호를 부여한다.[7]그 결과, 이 단백질은 산화 스트레스, 이온화 복사, 염증성 사이토카인 등에 대항하여 항갑상선 역할을 한다.[6]
메커니즘
SOD2는 주기적인 양성자 결합 전자전달 반응을 이용해 망간 금속의 산화 상태와 활성 부위의 양성 상태에 따라 과산화수소(O2•-)를 산소(O2) 또는 과산화수소(HO22)로 변환한다.
Mn3+2•-2 + O £ Mn2+ + O
Mn2+ + O2•- + 2H+ £ Mn3+ + HO22
활성 사이트의 양성자는 직접 시각화되었고 SOD2는 활성 사이트 잔여물 중 전자 전송 단계당 일련의 양성자 전송을 활용한다는 것이 밝혀졌다.[9]이번 연구결과는 주기적인 감응과 양성인 글루타민을 포함한 효소와 기대치와a 현저히 다른 pKs를 가진 아미노산이 포함된 효소의 특이한 화학작용을 입증했다.저배리어와 짧은 강도의 수소 결합은 양성자 이전을 촉진하고 매개체를 안정화함으로써 촉매변환에 기여하는 것으로 보인다.[10]
임상적 유의성
SOD2 효소는 미토콘드리아 사망 경로와 심장 근세포 세포사멸 신호의 일부로서 세포사멸 신호와 산화 스트레스에서 중요한 성분이다.[11]프로그램된 세포 죽음은 메타조인에게 필수적인 뚜렷한 유전적, 생화학적 경로다.성공적인 배아 발달과 정상적 조직 생활습관 유지를 위해서는 온전한 죽음의 통로가 필요하다.사멸은 다른 필수적인 세포 경로와 밀접하게 연관되어 있는 것으로 증명되었다.세포사망 경로에서 중요한 제어 지점의 식별은 기초 생물학에 대한 근본적인 통찰력을 제공했으며, 새로운 치료법에 대한 타당한 목표를 제공했으며, 정상적인 발생 과정 또는 세포 손상(심장마비 및 뇌졸중 중 허혈-재융 부상 등) 동안 또는 ca에서 발병 및 과정 중에 제공했다.세포핵 세포인 ncer는 세포수축, 혈장막 표백, 핵응축, DNA와 핵의 파편화를 포함한 구조적 변화를 겪는다.이것은 뒤이어 포구세포에 의해 빠르게 제거되는 세포사체로 분열되어 염증 반응을 예방한다.[12]특징적인 형태학적, 생화학적, 분자적 변화로 정의되는 세포사멸의 한 방식이다.처음에는 "수축 괴사"로 묘사되었고, 그 후 이 용어는 세포 운동학에서 유사 분열 반대 역할을 강조하기 위해 세포 사멸로 대체되었다.세포사멸의 후기에는 전체 세포가 분열되어 핵 및 세포질 원소를 포함하는 다수의 플라스마 막 경계 세포 사체를 형성한다.괴사의 초구조적 외형은 상당히 다른데, 주된 특징은 미토콘드리아 붓기, 혈장막파괴, 세포분해 등이다.사멸은 많은 생리적, 병리적 과정에서 발생한다.프로그래밍된 세포사멸로서 발생발달 중 중요한 역할을 하며, "원하지 않은" 세포를 제거하는 메커니즘의 역할을 하는 다양한 정상적인 비자발적 과정을 수반한다.
암 위험
많은 연구들이 SOD2 다형성과 암 위험 사이의 연관성을 보고했지만 결과는 일관성이 없었다.그러한 연구의 최신 메타 분석은 SOD2 다형성증이 비호지킨 림프종, 폐암, 대장암 발병과 관련이 있다는 것을 밝혀냈다.[13]
산화 응력에서의 역할
특히 심장마비(허혈성 심장병이라고도 함)의 일부로 심근에서 허혈성 재융해 손상에 의한 산화 스트레스 중 SOD2는 반응성 산소종(ROS) 방출에 중추적인 역할을 한다.주요 관상동맥 중 하나의 폐색에서 비롯되는 허혈성 심장질환은 현재도 서구사회에서 질병과 사망의 주요 원인이다.[14][15]허혈성 레퍼시퓨전 동안, ROS 방출은 세포에 직접적인 영향을 미치고 세포 사멸에 실질적으로 기여한다.SOD2는 ROS의 해로운 영향을 제한할 수 있는 용량이 있는 것으로 알려져 있다.이와 같이 SOD2는 심장 보호 효과를 위해 중요하다.[16]또한 SOD2는 심장의 허혈성 전제 조건화 중과 같은 허혈성 재융해 손상에 대한 심장내복제술에 관여했다.[17]ROS가 크게 터지면 세포 손상으로 이어진다고 알려져 있지만, 치명적이지 않은 짧은 허혈증 에피소드 중에 발생하는 미토콘드리아에서 ROS를 적당히 방출하는 것은 허혈성 전제조건의 신호 전달 경로에 있어 세포 손상 감소로 이어지는 중요한 촉발 역할을 할 수 있다.심지어 이 ROS의 출시 동안 SOD2는 세포사멸과 세포사멸을 조절함으로써 여기서 중요한 역할을 한다는 것을 관찰했다.
그것의 세포 보호 효과 때문에 SOD2의 과도한 억제는 종양 전이성의 침입성을 증가시키는 것과 연관되어 있다.[7]ROS 수치를 조절하는 역할도 노화, 암, 신경퇴행성 질환에 포함된다.[8]이 유전자의 돌연변이는 특발성 심장병증, 산발적인 운동 신경 질환, 그리고 암과 연관되어 왔다.다양한 병리학에 대한 민감성이 더 큰 것과 관련된 일반적인 다형성은 미토콘드리아 리더를 대상으로 하는 시퀀스(Val9Ala)에서 발견된다.[18]Sod2가 부족한 생쥐는 출생 직후 죽는데, 이는 확인되지 않은 수준의 과산화수소가 포유류 생명과 양립할 수 없음을 나타낸다.[19]그러나 Sod2가 50% 부족한 생쥐는 정상적인 수명과 최소한의 표현형 결함을 가지고 있지만 DNA 손상 증가와 암 발병률 증가를 겪는다.[20]Drosopila 멜라노가스터에서, Sod2의 과표현상은 한 연구에서 최대 수명을 20%,[21] 다른 연구에서는 37%까지 증가시키는 것으로 나타났다.[22]
효모 연구
야생형 싹트기 효모에서 사카로마이오스 세레비시아 핵 DNA 조각화는 세포 노화 시 3배 증가한 반면 SOD2 핵 DNA 조각화가 없을 경우 노화 시 5배 증가했다.[23]활성 산소종의 생산도 세포 나이가 들면서 증가했지만, SOD2 돌연변이 세포에서는 야생형 세포보다 더 많은 양이 증가했다.핵분열 효모인 정신분열효모세포 퐁베, SOD2 결핍에서 세포 노화를 급격히 증가시키고 성장 주기의 정지 단계에서 세포 생존성을 감소시켰다.[24]
무척추동물에서의 역할
SOD2는 산화 스트레스 관리에 있어 중요한 역할을 하므로 미토콘드리아의 필수 구성품이 된다.그 결과 SOD1과 SOD3와 유사한 SOD2는 무척추동물뿐만 아니라 척추동물에서도 보존성이 높다.연구에서 기능성의 다중 측정은 Drosopilla Sod2 돌연변이에서 병렬적이고 확률적인 방식으로 점진적인 감소를 보여준다.[25]SOD2 돌연변이는 기관 시스템 내에서 연쇄적으로 악화되었다.이러한 열화는 한 장기의 시스템이 고장나면 다른 장기의 시스템이 고장난다는 점에서 선형이 아니라 반대로 열화가 평행하다는 점에서, 다양한 시스템이 언제든지 영향을 받을 수 있다는 것을 의미한다.파리에서의 ROS의 증식은 파리들의 장기계에 그러한 방식으로 영향을 미치는데 상당한 역할을 했다. 모든 관찰된 파리가 영구적인 손상을 입지는 못했지만 관찰된 손상은 성숙한 초파리의 노화와 관련된 손상과 같았다.[20]무척추동물의 SOD2 결함에 따라 영향을 받는 조직은 근육, 심장, 뇌다.이러한 조직에 대한 ROS의 영향은 대부분의 경우 세포 기능의 상실을 초래할 뿐만 아니라 장수에 상당한 손실을 초래한다.[21]SOD2의 산화 스트레스 관리 역할은 척추동물과 무척추동물 모두에 대해 인정된 것이지만, 그 필요성은 새노르합병선충(C. elegans)을 대상으로 한 연구에서 의문을 제기해 왔다.SOD2의 결함 부족과 수명 및 기능 상실의 상관관계는 일반적으로 이해되지만 SOD2를 포함한 SOD 계열의 5개 구성원 중 일부를 제거하면 돌연변이 C.선충이 야생형에 비해 수명이 늘어난다는 사실이 밝혀졌다.[26]
동물학
동물들이 비교적 높은 작업 속도로 운동할 때, 운동 훈련은 심근 MnSOD 활동의 증가를 촉진한다.허혈/재순환(IR) 유도 심장 부정맥과 경색에 대한 최적의 훈련 유도 심장 보호 달성 MnSOD 활성 증가 MnSOD 활성의 ExTr 유도 심근 MnSOD 활성의 증가를 방지하기 위해 MnSOd에 대한 항이센스 올리고뉴클레오티드를 사용하여 심근 MnSOD 활성의 증가를 재현하는 것으로 입증되었다.IR에 의한 심근경색에 대한 교육에 의한 보호를 제공하기 위해 필요한 경우.[27]MnSOD 유전자 음소거 접근법을 사용하여, ExTr에 의한 심근 MnSOD 증가의 예방은 IR 매개 부정맥에 대한 훈련으로 인한 보호의 상실을 초래한다고 보고했다.[28]
마우스 모델에서 SOD2 결핍으로 인한 미토콘드리아 산화스트레스는 DNA 이중스트란드 균열의[29] 증가를 포함하여 세포 노화와 피부 노화 표현형을 촉진시켰다(DNA 노화 손상 이론 참조).생쥐에서 표피 SOD2의 손실은 세포 노화를 유발했고, 이는 각질세포의 일부의 증식을 불가역적으로 저지했다.[30]오래된 생쥐에서 SOD2 결핍은 상처 봉합을 지연시키고 표피 두께를 감소시켰다.
SOD2가 없는 결합조직 돌연변이 생쥐는 수명이 단축되고 체중감소, 피부 위축, 척추후만증(척추의 곡선), 골다공증, 근육 퇴화 등 노화와 관련된 표현형식의 조기발생이 있었다.[31]
SOD2 과표현상은 생쥐의 수명을 연장하는 것으로 밝혀졌다.[32]
상호작용
SOD2 유전자는 다음과 같이 결합하는 것으로 나타났다.
SOD2 단백질은 HIV-1 Tat 및 HIV-1 Vif와 상호작용하는 것으로 밝혀졌다.[33]
참조
- ^ a b c GRCh38: 앙상블 릴리스 89: ENSG00000112096 - 앙상블, 2017년 5월
- ^ a b c GRCm38: 앙상블 릴리스 89: ENSMUSG00000006818 - 앙상블, 2017년 5월
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ a b c d e f g "Entrez Gene: SOD2 superoxide dismutase 2, mitochondrial".
- ^ a b c d e f g h i j k l m Becuwe P, Ennen M, Klotz R, Barbieux C, Grandemange S (Dec 2014). "Manganese superoxide dismutase in breast cancer: from molecular mechanisms of gene regulation to biological and clinical significance". Free Radical Biology & Medicine. 77: 139–151. doi:10.1016/j.freeradbiomed.2014.08.026. PMID 25224035.
- ^ a b c Pias EK, Ekshyyan OY, Rhoads CA, Fuseler J, Harrison L, Aw TY (Apr 2003). "Differential effects of superoxide dismutase isoform expression on hydroperoxide-induced apoptosis in PC-12 cells". The Journal of Biological Chemistry. 278 (15): 13294–301. doi:10.1074/jbc.M208670200. PMID 12551919.
- ^ a b Perry JJ, Hearn AS, Cabelli DE, Nick HS, Tainer JA, Silverman DN (Apr 2009). "Contribution of human manganese superoxide dismutase tyrosine 34 to structure and catalysis". Biochemistry. 48 (15): 3417–24. doi:10.1021/bi8023288. PMC 2756076. PMID 19265433.
- ^ Azadmanesh J, Lutz WE, Coates L, Weiss KL, Borgstahl GE (April 2021). "Direct detection of coupled proton and electron transfers in human manganese superoxide dismutase". Nature Communications. 12 (1): 2079. Bibcode:2021NatCo..12.2079A. doi:10.1038/s41467-021-22290-1. PMC 8024262. PMID 33824320.
- ^ Agback P, Agback T (July 2018). "Direct evidence of a low barrier hydrogen bond in the catalytic triad of a Serine protease". Scientific Reports. 8 (1): 10078. Bibcode:2018NatSR...810078A. doi:10.1038/s41598-018-28441-7. PMC 6031666. PMID 29973622.
- ^ Danial NN, Korsmeyer SJ (January 2004). "Cell death: critical control points". Cell. 116 (2): 205–19. doi:10.1016/s0092-8674(04)00046-7. PMID 14744432. S2CID 10764012.
- ^ Kerr JF, Wyllie AH, Currie AR (Aug 1972). "Apoptosis: a basic biological phenomenon with wide-ranging implications in tissue kinetics". British Journal of Cancer. 26 (4): 239–57. doi:10.1038/bjc.1972.33. PMC 2008650. PMID 4561027.
- ^ Kang SW (2015). "Superoxide dismutase 2 gene and cancer risk: evidence from an updated meta-analysis". Int J Clin Exp Med. 8 (9): 14647–55. PMC 4658836. PMID 26628947.
- ^ Murray CJ, Lopez AD (May 1997). "Alternative projections of mortality and disability by cause 1990-2020: Global Burden of Disease Study". Lancet. 349 (9064): 1498–504. doi:10.1016/S0140-6736(96)07492-2. PMID 9167458. S2CID 10556268.
- ^ Braunwald E, Kloner RA (Nov 1985). "Myocardial reperfusion: a double-edged sword?". The Journal of Clinical Investigation. 76 (5): 1713–9. doi:10.1172/JCI112160. PMC 424191. PMID 4056048.
- ^ Maslov LN, Naryzhnaia NV, Podoksenov IuK, Prokudina ES, Gorbunov AS, Zhang I, Peĭ ZhM (Jan 2015). "[Reactive oxygen species are triggers and mediators of an increase in cardiac tolerance to impact of ischemia-reperfusion]". Rossiĭskii Fiziologicheskiĭ Zhurnal Imeni I.M. Sechenova / Rossiĭskaia Akademiia Nauk. 101 (1): 3–24. PMID 25868322.
- ^ Liem DA, Honda HM, Zhang J, Woo D, Ping P (Dec 2007). "Past and present course of cardioprotection against ischemia-reperfusion injury". Journal of Applied Physiology. 103 (6): 2129–36. doi:10.1152/japplphysiol.00383.2007. PMID 17673563.
- ^ Muller FL, Lustgarten MS, Jang Y, Richardson A, Van Remmen H (Aug 2007). "Trends in oxidative aging theories". Free Radical Biology & Medicine. 43 (4): 477–503. doi:10.1016/j.freeradbiomed.2007.03.034. PMID 17640558.
- ^ Li Y, Huang TT, Carlson EJ, Melov S, Ursell PC, Olson JL, Noble LJ, Yoshimura MP, Berger C, Chan PH, Wallace DC, Epstein CJ (Dec 1995). "Dilated cardiomyopathy and neonatal lethality in mutant mice lacking manganese superoxide dismutase". Nature Genetics. 11 (4): 376–81. doi:10.1038/ng1295-376. PMID 7493016. S2CID 10900822.
- ^ a b Van Remmen H, Ikeno Y, Hamilton M, Pahlavani M, Wolf N, Thorpe SR, Alderson NL, Baynes JW, Epstein CJ, Huang TT, Nelson J, Strong R, Richardson A (Dec 2003). "Life-long reduction in MnSOD activity results in increased DNA damage and higher incidence of cancer but does not accelerate aging". Physiological Genomics. 16 (1): 29–37. doi:10.1152/physiolgenomics.00122.2003. PMID 14679299.
- ^ a b Curtis C, Landis GN, Folk D, Wehr NB, Hoe N, Waskar M, Abdueva D, Skvortsov D, Ford D, Luu A, Badrinath A, Levine RL, Bradley TJ, Tavaré S, Tower J (2007). "Transcriptional profiling of MnSOD-mediated lifespan extension in Drosophila reveals a species-general network of aging and metabolic genes". Genome Biology. 8 (12): R262. doi:10.1186/gb-2007-8-12-r262. PMC 2246264. PMID 18067683.
- ^ Sun J, Folk D, Bradley TJ, Tower J (June 2002). "Induced overexpression of mitochondrial Mn-superoxide dismutase extends the life span of adult Drosophila melanogaster". Genetics. 161 (2): 661–72. doi:10.1093/genetics/161.2.661. PMC 1462135. PMID 12072463.
- ^ Muid KA, Karakaya HÇ, Koc A (February 2014). "Absence of superoxide dismutase activity causes nuclear DNA fragmentation during the aging process". Biochem. Biophys. Res. Commun. 444 (2): 260–3. doi:10.1016/j.bbrc.2014.01.056. hdl:11147/5542. PMID 24462872.
- ^ Ogata T, Senoo T, Kawano S, Ikeda S (January 2016). "Mitochondrial superoxide dismutase deficiency accelerates chronological aging in the fission yeast Schizosaccharomyces pombe". Cell Biol. Int. 40 (1): 100–6. doi:10.1002/cbin.10556. PMID 26507459. S2CID 205563521.
- ^ Piazza N, Hayes M, Martin I, Duttaroy A, Grotewiel M, Wessells R (2009). "Multiple measures of functionality exhibit progressive decline in a parallel, stochastic fashion in Drosophila Sod2 null mutants". Biogerontology. 10 (5): 637–48. doi:10.1007/s10522-008-9210-2. PMC 2800787. PMID 19148770.
- ^ Van Raamsdonk JM, Hekimi S (February 2009). "Deletion of the mitochondrial superoxide dismutase sod-2 extends lifespan in Caenorhabditis elegans". PLOS Genetics. 5 (2): e1000361. doi:10.1371/journal.pgen.1000361. PMC 2628729. PMID 19197346.
- ^ Yamashita N, Hoshida S, Otsu K, Asahi M, Kuzuya T, Hori M (1999). "Exercise provides direct biphasic cardioprotection via manganese superoxide dismutase activation". The Journal of Experimental Medicine. 189 (11): 1699–706. doi:10.1084/jem.189.11.1699. PMC 2193084. PMID 10359573.
- ^ Hamilton KL, Quindry JC, French JP, Staib J, Hughes J, Mehta JL, Powers SK (2004). "MnSOD antisense treatment and exercise-induced protection against arrhythmias". Free Radical Biology & Medicine. 37 (9): 1360–8. doi:10.1016/j.freeradbiomed.2004.07.025. PMID 15454275.
- ^ Velarde MC, Flynn JM, Day NU, Melov S, Campisi J (January 2012). "Mitochondrial oxidative stress caused by Sod2 deficiency promotes cellular senescence and aging phenotypes in the skin". Aging (Albany NY). 4 (1): 3–12. doi:10.18632/aging.100423. PMC 3292901. PMID 22278880.
- ^ Velarde MC, Demaria M, Melov S, Campisi J (August 2015). "Pleiotropic age-dependent effects of mitochondrial dysfunction on epidermal stem cells". Proc. Natl. Acad. Sci. U.S.A. 112 (33): 10407–12. Bibcode:2015PNAS..11210407V. doi:10.1073/pnas.1505675112. PMC 4547253. PMID 26240345.
- ^ Treiber N, Maity P, Singh K, Kohn M, Keist AF, Ferchiu F, Sante L, Frese S, Bloch W, Kreppel F, Kochanek S, Sindrilaru A, Iben S, Högel J, Ohnmacht M, Claes LE, Ignatius A, Chung JH, Lee MJ, Kamenisch Y, Berneburg M, Nikolaus T, Braunstein K, Sperfeld AD, Ludolph AC, Briviba K, Wlaschek M, Florin L, Angel P, Scharffetter-Kochanek K (April 2011). "Accelerated aging phenotype in mice with conditional deficiency for mitochondrial superoxide dismutase in the connective tissue". Aging Cell. 10 (2): 239–54. doi:10.1111/j.1474-9726.2010.00658.x. PMID 21108731. S2CID 46458295.
- ^ Hu D, Cao P, Thiels E, Chu CT, Wu GY, Oury TD, Klann E (March 2007). "Hippocampal long-term potentiation, memory, and longevity in mice that overexpress mitochondrial superoxide dismutase". Neurobiol Learn Mem. 87 (3): 372–84. doi:10.1016/j.nlm.2006.10.003. PMC 1847321. PMID 17129739.
- ^ Woollard SM, Bhargavan B, Yu F, Kanmogne GD (Jun 2014). "Differential effects of Tat proteins derived from HIV-1 subtypes B and recombinant CRF02_AG on human brain microvascular endothelial cells: implications for blood-brain barrier dysfunction". Journal of Cerebral Blood Flow and Metabolism. 34 (6): 1047–59. doi:10.1038/jcbfm.2014.54. PMC 4050250. PMID 24667918.
추가 읽기
- Zelko IN, Mariani TJ, Folz RJ (Aug 2002). "Superoxide dismutase multigene family: a comparison of the CuZn-SOD (SOD1), Mn-SOD (SOD2), and EC-SOD (SOD3) gene structures, evolution, and expression". Free Radical Biology & Medicine. 33 (3): 337–49. doi:10.1016/S0891-5849(02)00905-X. PMID 12126755.
- Faraci FM, Didion SP (Aug 2004). "Vascular protection: superoxide dismutase isoforms in the vessel wall". Arteriosclerosis, Thrombosis, and Vascular Biology. 24 (8): 1367–73. doi:10.1161/01.ATV.0000133604.20182.cf. PMID 15166009.