포스포프룩토키나아제2
Phosphofructokinase 2| 6-크루토-2-크루토 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 6-포스포프룩토-2-키나아제 이합체, 사람의 심장 | |||||||||
| 식별자 | |||||||||
| EC 번호 | 2.7.1.105 | ||||||||
| CAS 번호 | 78689-77-7 | ||||||||
| 데이터베이스 | |||||||||
| 인텐츠 | IntEnz 뷰 | ||||||||
| 브렌다 | 브렌다 엔트리 | ||||||||
| ExPASy | NiceZyme 뷰 | ||||||||
| 케그 | KEGG 엔트리 | ||||||||
| 메타사이크 | 대사 경로 | ||||||||
| 프라이머리 | 프로필 | ||||||||
| PDB 구조 | RCSB PDB PDBe PDBum | ||||||||
| 진 온톨로지 | AmiGO / QuickGO | ||||||||
| |||||||||
| 6PF2K | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 인간간6-아크루토-2-아크루토-2-아크루토-2,6-비스포스파타아제결정구조 | |||||||||
| 식별자 | |||||||||
| 기호. | 6PF2K | ||||||||
| 팜 | PF01591 | ||||||||
| 빠맘 클랜 | CL0023 | ||||||||
| 인터프로 | IPR013079 | ||||||||
| 프로 사이트 | PDOC00158 | ||||||||
| SCOP2 | 1bif/SCOPe/SUPFAM | ||||||||
| |||||||||
| 6-아크루토-2-아크롬/아크롬-비스포스파타아제-2 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
 PFK2의 구조.키나아제 도메인(cyan)과 포스파타아제 도메인(녹색)을 나타낸다. | |||||||||||
| 식별자 | |||||||||||
| 기호. | 6PF2K | ||||||||||
| 팜 | PF01591 | ||||||||||
| 인터프로 | IPR013079 | ||||||||||
| 프로 사이트 | PDOC00158 | ||||||||||
| SCOP2 | 1bif/SCOPe/SUPFAM | ||||||||||
| |||||||||||
| 과당비스포스파타아제-2 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| 식별자 | |||||||||
| 기호. | FBPase-2 | ||||||||
| 팜 | PF00316 | ||||||||
| 인터프로 | IPR028343 | ||||||||
| 프로 사이트 | PDOC00114 | ||||||||
| |||||||||
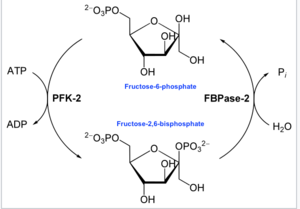
포스포프룩토키나아제-2(6-포스포프룩토-2-키나아제, PFK-2) 또는 과당 비스포스포스타아제-2(FBPase-2)는 세포에서 당분해 및 포도당합성 속도를 간접적으로 조절하는 효소이다.이것은 기질 과당-6-인산으로부터 유의한 알로스테릭 조절제인 과당-2,6-이인산(Fru-2,6-P2)의 형성과 분해를 촉매한다.Fru-2,6-P는2 당분해 경로에서 포스포프룩토키나아제1을 활성화하고 포도당생성에서는 [1]과당-1,6-비스포스파타아제1을 억제하므로 당분해 속도 결정 단계에 기여한다.Fru-2,6-P는2 당분해와 포도당생성을 차등 조절하기 때문에 반대되는 경로를 전환하는 [1]핵심 신호로 작용할 수 있다.PFK-2는 호르몬 시그널링에 반응하여 Fru-2,6-P를2 생성하기 때문에 신진대사를 보다 민감하고 효율적으로 제어하여 유기체의 해당과정의 [2]요구에 맞출 수 있다.이 효소는 과당과 만노오스 대사에 관여한다.이 효소는 간 탄수화물 대사 조절에 중요하며 간, 신장 및 심장에서 가장 많이 발견됩니다.포유동물에서, 몇몇 유전자들은 종종 조직 분포와 효소 [3]활성에서 각각 다른 다른 동질 형태를 부호화한다.여기에 설명된 군들은 ATP 유도 포스포프룩토키나아제들과 유사하지만, 그들은 과당 [4]6-인산과의 상호작용에 핵심으로 보이는 일부 잔류물에도 불구하고 배열 유사성을 거의 공유하지 않는다.
PFK-2는 주목할 만한 구조 때문에 "이관능성 효소"로 알려져 있다. 둘 다 하나의 단백질 호모디머에 위치하지만, 두 개의 도메인은 독립적으로 기능하는 [5]효소로 작용한다.한 말단은 효소 도메인(PFK-2의 경우)으로 기능하고, 다른 말단은 포스파타아제 도메인(FBPase-2)[6]으로 기능한다.
포유류에서 유전적 메커니즘은 조직 고유의 요구를 수용하기 위해 서로 다른 PFK-2 동질 형태를 부호화한다.일반적인 기능은 동일하지만, Isoforms는 효소적 특성에 약간의 차이가 있으며 다양한 조절 방법에 의해 제어된다. 이러한 차이는 아래에서 [7]설명된다.
구조.
이관능성 단백질의 단량체는 두 개의 기능 도메인으로 명확하게 구분된다.키나아제 도메인은 N [8]말단에 위치한다.이것은 5개의 평행 가닥과 7개의 α 나선형으로 둘러싸인 역평행 가장자리 가닥이 있는 [6]중앙 6가닥 β 시트로 구성되어 있다.도메인은 첫 번째 β-스트랜드의 [9]C 말단 끝에 뉴클레오티드 결합 접힘(nbf)을 포함한다.PFK-2 도메인은 아데닐산 시클라아제를 [10]포함한 모노뉴클레오티드 결합 단백질의 슈퍼패밀리와 밀접한 관련이 있는 것으로 보인다.
한편, 포스파타아제 도메인은 C [11]말단에 위치한다.그것은 포스포글리세린산 돌연변이와 [10][12]산인산가수분해효소를 포함하는 단백질 군과 유사합니다.도메인은 6가닥 중앙 β 시트와 더불어 [6]분자의 추정 활성 부위를 덮는 추가 α-나선 하위 도메인을 가진 혼합 α/β 구조를 가지고 있다.마지막으로 N말단 영역은 PFK-2 및 FBPase2 활성을 조절하고 [12][13]효소의 이합체 형태를 안정화한다.
이 중심 촉매 코어는 모든 형태의 PFK-2에서 보존된 상태로 유지되지만, 서로 다른 아미노산 배열 또는 [14]대체 스플라이싱의 결과로 Isoforms에는 약간의 구조적 변화가 존재한다.일부 사소한 예외를 제외하고, PFK-2 효소의 크기는 일반적으로 약 55 kDa이다.[1]
연구자들은 이 효소의 독특한 2관능 구조가 원시 세균 PFK-1과 원시 돌연변이 효소/[15]인산 효소 사이의 유전자 융합 사건에서 발생했다는 가설을 세웠다.
기능.
이 효소의 주요 기능은 첨부 도표와 같이 세포 또는 유기체의 해당과정 요구에 반응하여 알로스테릭 조절기 Fru-2,6-P를2 합성하거나 분해하는 것이다.
효소학에서 6-포스포프룩토-2-키나아제(EC 2.7.1.105)는 화학 반응을 촉매하는 효소이다.
- ATP + β-D-프룩토스 6-인산δ(\ ADP + β-D-프룩토스 2,6-이인산[16]
따라서, 키나아제 도메인은 ATP를 가수분해하여 과당 6-인산의 탄소-2를 인산화하여 Fru-2,6-P를2 생성하고 [17]반응 내에서. ADP A 포스포히스티딘 중간체가 형성된다.
- 다른 한쪽 말단에서는 과당-2,6-이인산2-포스파타아제(EC3.1.3.46) 도메인이 물을 첨가하여 Fru-2,6-P를2 탈인산염한다.이 반대되는 화학 반응은 다음과 같습니다.
- β-D-프룩토스 2,6-이인산염+HO2 δD-프룩토스6-인산염+인산염[18]
효소의 이중 기능 때문에 여러 패밀리로 분류할 수 있다.키나아제 반응에 의한 분류를 통해 이 효소는 전달효소 계열,[16] 특히 알코올기를 수용체로 하는 인 함유기(인산전달효소)에 속한다.한편, 포스파타아제 반응은 가수분해효소 패밀리, 특히 인산 모노에스테르 [18]결합에 작용하는 것이 특징이다.
규정
거의 모든 동질 형태에서 PFK-2는 세포의 호르몬 시그널링에 기초한 인산화/탈인산화를 통해 공유 변형을 거친다.특정 잔기의 인산화효소는 키나아제 또는 포스파타아제 도메인 기능을 안정화시키는 변화를 촉진할 수 있다.따라서 이 조절 신호는 F-2,6-P의2 합성 여부를 제어한다.[19]
또한 PFK2의 알로스테릭 조절은 PFK1의 [20]조절과 매우 유사하다.AMP 또는 인산기가 높으면 낮은 에너지 충전 상태를 의미하므로 PFK2를 자극한다.한편, 포스포에놀피루브산(PEP)과 구연산염의 고농도는 생합성 전구체가 고농도임을 의미하므로 PFK2를 억제한다.PFK1과 달리 PFK2는 ATP [21]농도의 영향을 받지 않는다.
아이소자임
단백질 동질효소는 동일한 반응을 촉매하지만 다른 아미노산 배열로 암호화되어 단백질 특성에 약간의 차이를 보이는 효소이다.사람에서 포스포프룩토키나아제2단백질을 코드하는 4개의 유전자는 PFKFB-1, PFKFB2, PFKFB3, PFKFB4를 [5]포함한다.
단백질의 다중 포유동물 동질 형태는 현재까지 보고된 바 있으며, 다른 효소의 전사 또는 대체 [22][23][24]접합에 의해 차이가 증가하고 있다.PFK-2/FBPase-2 반응을 촉매하는 구조적 코어는 이소폼 전체에 걸쳐 고도로 보존되지만, 주요 차이점은 이소폼 아미노 및 카르복실 [14]말단에서의 매우 가변적인 측면 배열에서 발생한다.이러한 영역은 종종 인산화 부위를 포함하기 때문에, 아미노산 조성이나 말단 길이의 변화는 매우 다른 효소 역학과 특성을 [1][14]야기할 수 있다.각 변종들은 발현되는 일차 조직, 단백질 키나제 조절에 대한 반응 및 키나제/포스파타아제 도메인 [25]활성의 비율이 다르다.여러 유형의 동질효소는 조직 내에 구성될 수 있지만,[26] 동질효소는 1차 조직 발현과 아래의 발견 조직으로 식별된다.
PFKB1: 간, 근육, 태아
| 6-포스포프룩토-2-키나아제: PFKB1 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 사람 간의 결정구조 6-포스프룩토-2-키나아제/프룩토스-2,6-비스포스파타아제 | |||||||||
| 식별자 | |||||||||
| EC 번호 | 2.7.1.105 | ||||||||
| CAS 번호 | 78689-77-7 | ||||||||
| 데이터베이스 | |||||||||
| 인텐츠 | IntEnz 뷰 | ||||||||
| 브렌다 | 브렌다 엔트리 | ||||||||
| ExPASy | NiceZyme 뷰 | ||||||||
| 케그 | KEGG 엔트리 | ||||||||
| 메타사이크 | 대사 경로 | ||||||||
| 프라이머리 | 프로필 | ||||||||
| PDB 구조 | RCSB PDB PDBe PDBum | ||||||||
| 진 온톨로지 | AmiGO / QuickGO | ||||||||
| |||||||||
X 염색체에 위치한 이 유전자는 특히 고도로 연구된 간 효소를 [22]암호화하기 때문에 네 가지 유전자 중 가장 잘 알려져 있다.PFKB1의 가변 mRNA 스플라이싱은 세 가지 다른 촉진제(L, M, F)를 생성하므로, [27]조절이 다른 세 가지 조직 특이 변형을 생성한다.
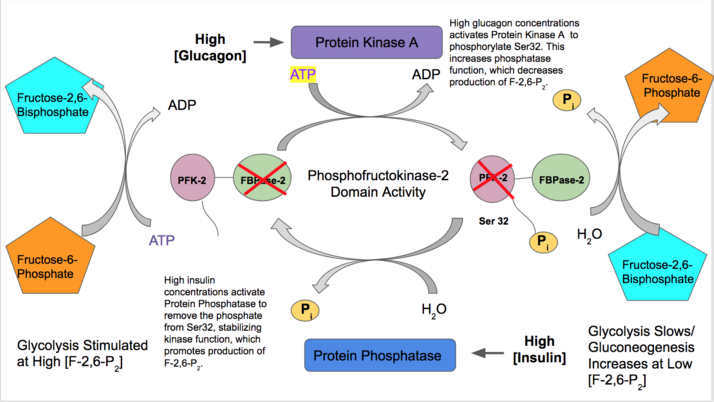
- L형 : 간조직
- 인슐린은 간 PFK-2 기능을 활성화하여 해당과정에 고농도의 혈당을 사용할 수 있음을 나타냅니다.인슐린은 PFK-2 복합체를 탈인산화하고 바람직한 PFK-2 활성을 유발하는 단백질 포스파타아제를 활성화한다.이어서 PFK-2는 F-2,6-P의2. 생산을 증가시킨다. 이 제품은 알로스테릭하게 PFK-1을 활성화하므로 해당과정을 활성화하고 글루코네제네시스 [28]생성을 억제한다.
- 반면 글루카곤은 FBPase-2 활성을 증가시킨다.저혈당 농도에서 글루카곤은 cAMP 신호 캐스케이드를 트리거하고, 이어서 단백질인산화효소A(PKA)는 N 말단 부근에서 세린32를 인산화한다.이것은 키나아제로서 작용하는 이관능성 효소의 능력을 불활성화하고 포스파타아제 활성을 안정시킨다.따라서 글루카곤은 F-2,6-P의2, 농도를 감소시켜 당분해 속도를 늦추고 글루코네시스 [29][30]경로를 자극한다.
- M-Type: 골격근 조직, F-Type: 섬유아세포 및 태아[31] 조직
- 대부분의 다른 PFK-2 조직과 달리 골격근과 태아 조직 모두에서 PFK-2는 과당-6-인산 농도에 의해 단독으로 조절된다.첫 번째 엑손 내에는 기능 변화를 유발하기 위해 인산화/탈인산화를 필요로 하는 조절 부위가 없다.고농도의 F-6-P는 키나아제 기능을 활성화하고 해당과정의 속도를 증가시키지만, 저농도의 F-6-P는 포스파타아제 [27]작용을 안정화시킨다.
| 6-포스포프룩토-2-키나아제: PFKB2 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 6-포스포프룩토-2-키나아제 이합체, 사람의 심장 조직 | |||||||||
| 식별자 | |||||||||
| EC 번호 | 2.7.1.105 | ||||||||
| CAS 번호 | 78689-77-7 | ||||||||
| 데이터베이스 | |||||||||
| 인텐츠 | IntEnz 뷰 | ||||||||
| 브렌다 | 브렌다 엔트리 | ||||||||
| ExPASy | NiceZyme 뷰 | ||||||||
| 케그 | KEGG 엔트리 | ||||||||
| 메타사이크 | 대사 경로 | ||||||||
| 프라이머리 | 프로필 | ||||||||
| PDB 구조 | RCSB PDB PDBe PDBum | ||||||||
| 진 온톨로지 | AmiGO / QuickGO | ||||||||
| |||||||||
PFKB2: 심장(H-Type)
PFKB2 유전자는 [32]1번 염색체에 있다.아드레날린 및/또는 인슐린 호르몬의 농도가 높아지면 단백질 키나제 A 경로가 활성화되어 C [3]말단에서 세린 466 또는 세린 483 중 하나를 인산화한다.또는 단백질인산화효소 B는 FBPase-2 [33]도메인의 일부인 이러한 조절 부위를 인산화시킬 수도 있다.이 세린 잔기가 인산화되면 FBPase-2 기능이 비활성화되어 더 큰 PFK-2 활성이 [27]안정화된다.
PFKB3: 뇌, 태반, 유도성
PFKB3는 10번 염색체에 위치하며 유도형과 유비쿼터스형의 [34]두 가지 주요 동질체를 전사한다.이러한 형태는 C [35]말단에서 Exon 15의 대체 스플라이싱에서 다르다.그러나 글루카곤은 고리형 AMP 경로를 활성화한다는 점에서 유사하며, 이는 단백질 키나제 A, 단백질 키나제 C 또는 AMP 활성 단백질 키나제 C가 C 말단에서 세린 461의 조절 잔류물을 인산화하여 PFK-2 키나제 [36]기능을 안정화시킨다.또한 이 유전자에서 전사된 두 아이소폼은 키나아제/포스파타아제 활성비가 700(여기서 간, 심장 및 고환 이소효소는 각각 1.5, 80, [37]4의 PFK-2/FBPase-2 비율을 가진다)인 키나아제 활성률이 특히 높은 것으로 알려져 있다.따라서 특히 PFKB3는 지속적으로 많은 양의 F-2,6-P를2 생성하며 당분해 속도가 [37][38]높다.
PFKB4: Testis(T타입)
3번 염색체에 위치한 유전자 PFKB4는 사람의 고환 조직에서 [46]PFK-2를 발현한다.PFK-4에 의해 코드된 PFK-2 효소는 약 54kDa로 간 효소에 필적하며, 근육 조직과 마찬가지로 단백질 키나제 인산화 부위를 [40]포함하지 않는다.이 등소형에 대한 조절 메커니즘이 명확해진 연구는 적지만, 연구는 5' 옆구리 영역의 다중 전사 인자의 수정이 고환 [26]조직의 발달에서 PFK-2 발현량을 조절한다는 것을 확인했다.이 아이소폼은 특히 전립선암세포의 [47]생존을 위해 수정되고 과잉 발현되는 것으로 나타났다.
임상적 의의
이 효소군은 당분해와 포도당생성의 속도를 유지하기 때문에 특히 당뇨병과 [6][25]암세포에서 신진대사의 제어를 위한 치료 작용의 큰 가능성을 제시한다.데이터는 또한 모든 PFK-2 유전자가 산소 [48]제한에 의해 활성화되었음을 보여준다.PFK-2/FBP-ase2 활성의 제어는 심장 기능, 특히 허혈 [49]및 저산소증에 대한 제어와 관련이 있는 것으로 확인되었다.연구자들은 이러한 PFK-2 유전자의 반응성이 강한 생리학적 적응일 [48]수 있다는 가설을 세운다.그러나 많은 인간 암세포 유형(백혈병, 폐암, 유방암, 대장암, 췌장암 및 난소암 포함)은 PFK3 및/또는 PFK4의 과잉 발현을 나타낸다. 이러한 신진대사의 변화는 워버그 효과에 [25][50]영향을 미칠 수 있다.
마지막으로 PFK2/FBPase2 단백질을 코드하는 Pfkfb2 유전자는 정신분열증에 [51]대한 소인과 연결되어 있다.
레퍼런스
- ^ a b c d Kurland IJ, Pilkis SJ (June 1995). "Covalent control of 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase: insights into autoregulation of a bifunctional enzyme". Protein Science. 4 (6): 1023–37. doi:10.1002/pro.5560040601. PMC 2143155. PMID 7549867.
- ^ Lenzen S (May 2014). "A fresh view of glycolysis and glucokinase regulation: history and current status". The Journal of Biological Chemistry. 289 (18): 12189–94. doi:10.1074/jbc.R114.557314. PMC 4007419. PMID 24637025.
- ^ a b Heine-Suñer D, Díaz-Guillén MA, Lange AJ, Rodríguez de Córdoba S (May 1998). "Sequence and structure of the human 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase heart isoform gene (PFKFB2)". European Journal of Biochemistry. 254 (1): 103–10. doi:10.1046/j.1432-1327.1998.2540103.x. PMID 9652401.
- ^ Wang X, Deng Z, Kemp RG (September 1998). "An essential methionine residue involved in substrate binding by phosphofructokinases". Biochem. Biophys. Res. Commun. 250 (2): 466–8. doi:10.1006/bbrc.1998.9311. PMID 9753654.
- ^ a b Rider MH, Bertrand L, Vertommen D, Michels PA, Rousseau GG, Hue L (August 2004). "6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase: head-to-head with a bifunctional enzyme that controls glycolysis". The Biochemical Journal. 381 (Pt 3): 561–79. doi:10.1042/BJ20040752. PMC 1133864. PMID 15170386.
- ^ a b c d Hasemann CA, Istvan ES, Uyeda K, Deisenhofer J (September 1996). "The crystal structure of the bifunctional enzyme 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase reveals distinct domain homologies". Structure. 4 (9): 1017–29. doi:10.1016/S0969-2126(96)00109-8. PMID 8805587.
- ^ Atsumi T, Nishio T, Niwa H, Takeuchi J, Bando H, Shimizu C, Yoshioka N, Bucala R, Koike T (December 2005). "Expression of inducible 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase/PFKFB3 isoforms in adipocytes and their potential role in glycolytic regulation". Diabetes. 54 (12): 3349–57. doi:10.2337/diabetes.54.12.3349. PMID 16306349.
- ^ Kurland I, Chapman B, Lee YH, Pilkis S (August 1995). "Evolutionary reengineering of the phosphofructokinase active site: ARG-104 does not stabilize the transition state in 6-phosphofructo-2-kinase". Biochemical and Biophysical Research Communications. 213 (2): 663–72. doi:10.1006/bbrc.1995.2183. PMID 7646523.
- ^ Walker JE, Saraste M, Runswick MJ, Gay NJ (1982). "Distantly related sequences in the alpha- and beta-subunits of ATP synthase, myosin, kinases and other ATP-requiring enzymes and a common nucleotide binding fold". The EMBO Journal. 1 (8): 945–51. doi:10.1002/j.1460-2075.1982.tb01276.x. PMC 553140. PMID 6329717.
- ^ a b Jedrzejas MJ (2000). "Structure, function, and evolution of phosphoglycerate mutases: comparison with fructose-2,6-bisphosphatase, acid phosphatase, and alkaline phosphatase". Progress in Biophysics and Molecular Biology. 73 (2–4): 263–87. doi:10.1016/S0079-6107(00)00007-9. PMID 10958932.
- ^ Li L, Lin K, Pilkis J, Correia JJ, Pilkis SJ (October 1992). "Hepatic 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase. The role of surface loop basic residues in substrate binding to the fructose-2,6-bisphosphatase domain". The Journal of Biological Chemistry. 267 (30): 21588–94. doi:10.1016/S0021-9258(19)36651-7. PMID 1328239.
- ^ a b Stryer L, Berg JM, Tymoczko JL (2008). "The Balance Between Glycolysis and Gluconeogenesis in the Liver Is Sensitive to Blood-Glucose Concentration". Biochemistry (Looseleaf). San Francisco: W. H. Freeman. pp. 466–467. ISBN 978-1-4292-3502-0.
- ^ Tominaga N, Minami Y, Sakakibara R, Uyeda K (July 1993). "Significance of the amino terminus of rat testis fructose-6-phosphate, 2-kinase:fructose-2,6-bisphosphatase". The Journal of Biological Chemistry. 268 (21): 15951–7. doi:10.1016/S0021-9258(18)82344-4. PMID 8393455.
- ^ a b c El-Maghrabi MR, Noto F, Wu N, Manes N (September 2001). "6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase: suiting structure to need, in a family of tissue-specific enzymes". Current Opinion in Clinical Nutrition and Metabolic Care. 4 (5): 411–8. doi:10.1097/00075197-200109000-00012. PMID 11568503. S2CID 6638455.
- ^ Bazan JF, Fletterick RJ, Pilkis SJ (December 1989). "Evolution of a bifunctional enzyme: 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase". Proceedings of the National Academy of Sciences of the United States of America. 86 (24): 9642–6. Bibcode:1989PNAS...86.9642B. doi:10.1073/pnas.86.24.9642. PMC 298557. PMID 2557623.
- ^ a b "ENZYME entry 2.7.1.105". enzyme.expasy.org. Retrieved 2018-03-24.
- ^ "6-phosphofructo-2-kinase (IPR013079)". InterPro. EMBL-EBI. Retrieved 2018-03-25.
- ^ a b "ENZYME entry 3.1.3.46". enzyme.expasy.org. Retrieved 2018-03-25.
- ^ Okar DA, Manzano A, Navarro-Sabatè A, Riera L, Bartrons R, Lange AJ (January 2001). "PFK-2/FBPase-2: maker and breaker of the essential biofactor fructose-2,6-bisphosphate". Trends in Biochemical Sciences. 26 (1): 30–5. doi:10.1016/S0968-0004(00)01699-6. PMID 11165514.
- ^ Van Schaftingen E, Hers HG (August 1981). "Phosphofructokinase 2: the enzyme that forms fructose 2,6-bisphosphate from fructose 6-phosphate and ATP". Biochemical and Biophysical Research Communications. 101 (3): 1078–84. doi:10.1016/0006-291X(81)91859-3. PMID 6458291.
- ^ a b Ros S, Schulze A (February 2013). "Balancing glycolytic flux: the role of 6-phosphofructo-2-kinase/fructose 2,6-bisphosphatases in cancer metabolism". Cancer & Metabolism. 1 (1): 8. doi:10.1186/2049-3002-1-8. PMC 4178209. PMID 24280138.
- ^ a b Darville MI, Crepin KM, Hue L, Rousseau GG (September 1989). "5' flanking sequence and structure of a gene encoding rat 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase". Proceedings of the National Academy of Sciences of the United States of America. 86 (17): 6543–7. Bibcode:1989PNAS...86.6543D. doi:10.1073/pnas.86.17.6543. PMC 297880. PMID 2549541.
- ^ Tsuchiya Y, Uyeda K (May 1994). "Bovine heart fructose 6-P,2-kinase:fructose 2,6-bisphosphatase mRNA and gene structure". Archives of Biochemistry and Biophysics. 310 (2): 467–74. doi:10.1006/abbi.1994.1194. PMID 8179334.
- ^ Sakata J, Abe Y, Uyeda K (August 1991). "Molecular cloning of the DNA and expression and characterization of rat testes fructose-6-phosphate,2-kinase:fructose-2,6-bisphosphatase". The Journal of Biological Chemistry. 266 (24): 15764–70. doi:10.1016/S0021-9258(18)98475-9. PMID 1651918.
- ^ a b c Novellasdemunt L, Tato I, Navarro-Sabate A, Ruiz-Meana M, Méndez-Lucas A, Perales JC, Garcia-Dorado D, Ventura F, Bartrons R, Rosa JL (April 2013). "Akt-dependent activation of the heart 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase (PFKFB2) isoenzyme by amino acids". The Journal of Biological Chemistry. 288 (15): 10640–51. doi:10.1074/jbc.M113.455998. PMC 3624444. PMID 23457334.
- ^ a b Gómez M, Manzano A, Navarro-Sabaté A, Duran J, Obach M, Perales JC, Bartrons R (January 2005). "Specific expression of pfkfb4 gene in spermatogonia germ cells and analysis of its 5'-flanking region". FEBS Letters. 579 (2): 357–62. doi:10.1016/j.febslet.2004.11.096. PMID 15642344. S2CID 33170865.
- ^ a b c Salway JG (2017). Metabolism at a Glance. Wiley-Blackwell. ISBN 978-0-470-67471-0.
- ^ Hue L, Rider MH, Rousseau GG (1990). "Fructose-2,6-bisphosphate in extra hepatic tissues". In Pilkis SJ (ed.). Fructose-2,6-bisphosphate. Boca Raton, Fla.: CRC Press. pp. 173–193. ISBN 978-0-8493-4795-5.
- ^ Pilkis SJ, el-Maghrabi MR, Claus TH (1988). "Hormonal regulation of hepatic gluconeogenesis and glycolysis". Annual Review of Biochemistry. 57: 755–83. doi:10.1146/annurev.bi.57.070188.003543. PMID 3052289.
- ^ Marker AJ, Colosia AD, Tauler A, Solomon DH, Cayre Y, Lange AJ, el-Maghrabi MR, Pilkis SJ (April 1989). "Glucocorticoid regulation of hepatic 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase gene expression". The Journal of Biological Chemistry. 264 (12): 7000–4. doi:10.1016/S0021-9258(18)83531-1. PMID 2540168.
- ^ Cosin-Roger J, Vernia S, Alvarez MS, Cucarella C, Boscá L, Martin-Sanz P, Fernández-Alvarez AJ, Casado M (February 2013). "Identification of a novel Pfkfb1 mRNA variant in rat fetal liver". Biochemical and Biophysical Research Communications. 431 (1): 36–40. doi:10.1016/j.bbrc.2012.12.109. PMID 23291237.
- ^ Darville MI, Chikri M, Lebeau E, Hue L, Rousseau GG (August 1991). "A rat gene encoding heart 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase". FEBS Letters. 288 (1–2): 91–4. doi:10.1016/0014-5793(91)81009-W. PMID 1652483. S2CID 34116121.
- ^ Marsin AS, Bertrand L, Rider MH, Deprez J, Beauloye C, Vincent MF, Van den Berghe G, Carling D, Hue L (October 2000). "Phosphorylation and activation of heart PFK-2 by AMPK has a role in the stimulation of glycolysis during ischaemia". Current Biology. 10 (20): 1247–55. doi:10.1016/S0960-9822(00)00742-9. PMID 11069105. S2CID 7920767.
- ^ Riera L, Manzano A, Navarro-Sabaté A, Perales JC, Bartrons R (April 2002). "Insulin induces PFKFB3 gene expression in HT29 human colon adenocarcinoma cells". Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1589 (2): 89–92. doi:10.1016/S0167-4889(02)00169-6. PMID 12007784.
- ^ Marsin AS, Bouzin C, Bertrand L, Hue L (August 2002). "The stimulation of glycolysis by hypoxia in activated monocytes is mediated by AMP-activated protein kinase and inducible 6-phosphofructo-2-kinase". The Journal of Biological Chemistry. 277 (34): 30778–83. doi:10.1074/jbc.M205213200. PMID 12065600.
- ^ a b c Sakakibara R, Kato M, Okamura N, Nakagawa T, Komada Y, Tominaga N, Shimojo M, Fukasawa M (July 1997). "Characterization of a human placental fructose-6-phosphate, 2-kinase/fructose-2,6-bisphosphatase". Journal of Biochemistry. 122 (1): 122–8. doi:10.1093/oxfordjournals.jbchem.a021719. PMID 9276680.
- ^ Manes NP, El-Maghrabi MR (June 2005). "The kinase activity of human brain 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase is regulated via inhibition by phosphoenolpyruvate". Archives of Biochemistry and Biophysics. 438 (2): 125–36. doi:10.1016/j.abb.2005.04.011. PMID 15896703.
- ^ Chesney J, Mitchell R, Benigni F, Bacher M, Spiegel L, Al-Abed Y, Han JH, Metz C, Bucala R (March 1999). "An inducible gene product for 6-phosphofructo-2-kinase with an AU-rich instability element: role in tumor cell glycolysis and the Warburg effect". Proceedings of the National Academy of Sciences of the United States of America. 96 (6): 3047–52. Bibcode:1999PNAS...96.3047C. doi:10.1073/pnas.96.6.3047. PMC 15892. PMID 10077634.
- ^ a b Manzano A, Rosa JL, Ventura F, Pérez JX, Nadal M, Estivill X, Ambrosio S, Gil J, Bartrons R (1998). "Molecular cloning, expression, and chromosomal localization of a ubiquitously expressed human 6-phosphofructo-2-kinase/ fructose-2, 6-bisphosphatase gene (PFKFB3)". Cytogenetics and Cell Genetics. 83 (3–4): 214–7. doi:10.1159/000015181. PMID 10072580. S2CID 23221556.
- ^ Sakai A, Kato M, Fukasawa M, Ishiguro M, Furuya E, Sakakibara R (March 1996). "Cloning of cDNA encoding for a novel isozyme of fructose 6-phosphate, 2-kinase/fructose 2,6-bisphosphatase from human placenta". Journal of Biochemistry. 119 (3): 506–11. doi:10.1093/oxfordjournals.jbchem.a021270. PMID 8830046.
- ^ Ventura F, Ambrosio S, Bartrons R, el-Maghrabi MR, Lange AJ, Pilkis SJ (April 1995). "Cloning and expression of a catalytic core bovine brain 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase". Biochemical and Biophysical Research Communications. 209 (3): 1140–8. doi:10.1006/bbrc.1995.1616. PMID 7733968.
- ^ Bando H, Atsumi T, Nishio T, Niwa H, Mishima S, Shimizu C, Yoshioka N, Bucala R, Koike T (August 2005). "Phosphorylation of the 6-phosphofructo-2-kinase/fructose 2,6-bisphosphatase/PFKFB3 family of glycolytic regulators in human cancer". Clinical Cancer Research. 11 (16): 5784–92. doi:10.1158/1078-0432.CCR-05-0149. PMID 16115917.
- ^ Riera L, Obach M, Navarro-Sabaté A, Duran J, Perales JC, Viñals F, Rosa JL, Ventura F, Bartrons R (August 2003). "Regulation of ubiquitous 6-phosphofructo-2-kinase by the ubiquitin-proteasome proteolytic pathway during myogenic C2C12 cell differentiation". FEBS Letters. 550 (1–3): 23–9. doi:10.1016/S0014-5793(03)00808-1. PMID 12935880. S2CID 41726316.
- ^ Ventura F, Rosa JL, Ambrosio S, Pilkis SJ, Bartrons R (September 1992). "Bovine brain 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase. Evidence for a neural-specific isozyme". The Journal of Biological Chemistry. 267 (25): 17939–43. doi:10.1016/S0021-9258(19)37133-9. PMID 1325453.
- ^ Manzano A, Pérez JX, Nadal M, Estivill X, Lange A, Bartrons R (March 1999). "Cloning, expression and chromosomal localization of a human testis 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase gene". Gene. 229 (1–2): 83–9. doi:10.1016/S0378-1119(99)00037-2. PMID 10095107.
- ^ Ros S, Santos CR, Moco S, Baenke F, Kelly G, Howell M, Zamboni N, Schulze A (April 2012). "Functional metabolic screen identifies 6-phosphofructo-2-kinase/fructose-2,6-biphosphatase 4 as an important regulator of prostate cancer cell survival". Cancer Discovery. 2 (4): 328–43. doi:10.1158/2159-8290.CD-11-0234. PMID 22576210.
- ^ a b 민첸코, O., O., Opentanova, I. 및 Caro, J.(2003).생체 내 6ph포스포프룩토22kin키나아제/프룩토스22, 6bis비스포스파타아제 유전자 패밀리(PFKFB11–4)의 저산소 조절.FEBS Letters, 554(3), 264-270.
- ^ Wang Q, Donthi RV, Wang J, Lange AJ, Watson LJ, Jones SP, Epstein PN (June 2008). "Cardiac phosphatase-deficient 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase increases glycolysis, hypertrophy, and myocyte resistance to hypoxia". American Journal of Physiology. Heart and Circulatory Physiology. 294 (6): H2889–97. doi:10.1152/ajpheart.91501.2007. PMC 4239994. PMID 18456722.
- ^ Minchenko OH, Opentanova IL, Ogura T, Minchenko DO, Komisarenko SV, Caro J, Esumi H (2005). "Expression and hypoxia-responsiveness of 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase 4 in mammary gland malignant cell lines". Acta Biochimica Polonica. 52 (4): 881–8. doi:10.18388/abp.2005_3402. PMID 16025159.
- ^ Stone WS, Faraone SV, Su J, Tarbox SI, Van Eerdewegh P, Tsuang MT (May 2004). "Evidence for linkage between regulatory enzymes in glycolysis and schizophrenia in a multiplex sample". American Journal of Medical Genetics. Part B, Neuropsychiatric Genetics. 127B (1): 5–10. doi:10.1002/ajmg.b.20132. PMID 15108172. S2CID 2420843.
- Van Schaftingen E, Hers HG (1981). "Phosphofructokinase 2: the enzyme that forms fructose 2,6-bisphosphate from fructose 6-phosphate and ATP". Biochem. Biophys. Res. Commun. 101 (3): 1078–84. doi:10.1016/0006-291X(81)91859-3. PMID 6458291.