플라빈아데닌디뉴클레오티드
Flavin adenine dinucleotide | |
 | |
| 식별자 | |
|---|---|
3D 모델(JSmol) | |
| 3 DMet | |
| 1208946 | |
| 체비 | |
| 첸블 | |
| 드러그뱅크 | |
| ECHA 정보 카드 | 100.005.149 |
| EC 번호 |
|
| 108834 | |
| 케그 | |
| 메쉬 | 플라빈아데닌디뉴클레오티드 |
PubChem CID | |
| 유니 | |
CompTox 대시보드 (EPA ) | |
| |
| 특성. | |
| C27H33N9O15P2 | |
| 몰 질량 | 785.557 g/g−1/g |
| 외모 | 백색 유리 결정 |
| 로그 P | -1.336 |
| 산도(pKa) | 1.128 |
| 기본성(pKb) | 12.8689 |
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |
생화학에서 플라빈 아데닌 디뉴클레오티드(FAD)는 다양한 단백질과 관련된 레독스 활성 코엔자임으로 신진대사의 여러 효소 반응에 관여한다.플라빈단백질은 FAD 또는 플라빈 모노뉴클레오티드(FMN)의 형태를 취할 수 있는 플라빈기를 포함하는 단백질이다.숙신산탈수소효소복합체 성분, α-케토글루타르산탈수소효소 복합체 성분, 피루브산탈수소효소복합체 성분 등 많은 플라빈단백질이 알려져 있다.
FAD는 플라빈-N(5)-옥사이드, 퀴논, 세미퀴논 및 하이드로퀴논의 [1]4가지 산화환원 상태로 존재할 수 있다.FAD는 이 상태들 사이에서 전자를 받아들이거나 기증함으로써 변환된다.FAD는 완전히 산화한 형태 또는 퀴논 형태로 두 개의 전자와 두 개의 양성자를 받아들여 FADH(히드로퀴논 형태)가2 된다.세미퀴논(FADH)·은 전자 1개와 양성자 1개를 각각 받아들이거나 기증함으로써 FAD의 환원2 또는 FADH의 산화에 의해 형성될 수 있다.그러나 일부 단백질은 플라빈 보조인자인 플라빈-N(5)-[2][3]옥시드의 초산화 형태를 생성하고 유지한다.
역사
플라보 단백질은 1879년 소젖의 성분을 분리함으로써 처음 발견되었다.그것들은 우유 기원과 노란색 [4]색소 때문에 처음에는 락토크롬으로 불렸다.과학계가 황색 색소의 원인이 되는 분자를 규명하는 데 상당한 진전을 이루는 데 50년이 걸렸다.1930년대는 많은 플라빈 및 니코틴아미드 유도체 구조와 산화환원 촉매 작용에서 필수적인 역할을 발표하면서 코엔자임 연구 분야를 시작했다.독일 과학자 오토 바르부르크와 발터 크리스찬은 1932년 세포 호흡에 필요한 효모 유래 황색 단백질을 발견했다.그들의 동료인 휴고 디스토렐은 이 노란색 효소를 아포엔자임과 노란색 색소로 분리했고, 효소와 색소는 스스로 NADH를 산화시킬 수 없지만, 그것들을 함께 섞으면 활동을 회복할 수 있다는 것을 보여주었다.1937년 디폴트렐은 이 색소가 리보플라빈의 인산 에스테르인 플라빈 모노뉴클레오티드(FMN)임을 확인했는데, 이는 효소 보조 [5]인자에 대한 최초의 직접적인 증거였다.워버그와 크리스찬은 1938년 [6]유사한 실험을 통해 FAD가 D-아미노산산화효소의 보조인자임을 발견했다.니코틴아미드를 수소화물 전달과 연결시킨 워버그의 연구와 플라빈의 발견은 40년대와 50년대의 많은 과학자들에게 많은 양의 산화환원 생화학을 발견하고 구연산 회로와 ATP 합성과 같은 경로에서 그것들을 함께 연결시킬 수 있는 길을 열어주었다.
특성.
플라빈 아데닌 디뉴클레오티드는 아데닌 뉴클레오티드(아데노신 일인산)와 플라빈 모노뉴클레오티드(FMN)의 두 부분으로 구성되어 있다.아데닌은 1' 탄소에서는 고리형 리보스에 결합하고, 인산염은 5' 탄소에서는 리보스에 결합하여 아데닌 누클레도티드를 형성한다.리보플라빈은 이소알록사진과 리비톨 사이의 탄소질소(C-N) 결합에 의해 형성된다.그 후 인산기는 말단 리보오스 탄소에 결합되어 FMN을 형성한다. 이소알록사진과 리비톨 사이의 결합은 글리코시드 결합으로 간주되지 않기 때문에 플라빈 모노뉴클레오티드는 진정한 [7]뉴클레오티드가 아니다.이것은 디뉴클레오티드 이름을 오해하게 만든다. 그러나 플라빈 모노뉴클레오티드 그룹은 구조와 화학적 특성에서 여전히 뉴클레오티드에 매우 가깝다.
FAD는 2H와+ 2e를− 첨가하여 FADH로2 환원할 수 있으며2, FADH는− 1H와+ 1e의 손실로 산화되어 FADH를 형성할 수도 있다.FAD 형태는 1H와+ 1e의− 추가 손실을 통해 재현될 수 있으며, FAD 형성은 플라빈-N(5)-[8]옥시드의 환원 및 탈수를 통해서도 발생할 수 있다.플라빈은 산화 상태에 따라 수용액에 있을 때 특정 색을 취한다.flavin-N(5)-oxide(초산화)는 황색-주황색, FAD(완전 산화)는 황색, FADH(반감소)는 pH를 기준으로 청색 또는 적색이며, 완전히 환원된 형태는 [9][10]무색이다.형태를 변경하면 다른 화학적 성질에 큰 영향을 미칠 수 있습니다.예를 들어 FAD는 완전 산화형이고, 완전 환원형이며2, FADH는 높은 분극성을 가지며,[11] 절반 환원형은 수용액에서 불안정하다.FAD는 방향족 고리 시스템인 반면2 FADH는 그렇지 않습니다.[12]이는 방향족 구조가 제공하는 공명을 통한 안정화 없이 FADH는2 에너지가 상당히 높다는 것을 의미합니다.FADH는2 에너지를 운반하는 분자인데, 일단 산화되면 방향족성을 회복하고 안정화에 의해 대표되는 에너지를 방출하기 때문입니다.
FAD와 그 변형체의 스펙트럼 특성은 UV-VIS 흡수 및 형광 분광법을 사용하여 반응 모니터링을 가능하게 한다.FAD의 각 형태는 뚜렷한 흡광도 스펙트럼을 가지고 있어 산화 [11]상태의 변화를 쉽게 관찰할 수 있다.FAD의 주요 국소 흡광도는 450nm에서 11,300Mcm의−1−1 [13]소멸계수로 관측된다.일반적으로 플라빈은 결합되었을 때 형광 활성을 가진다(플라빈 핵산 유도체에 결합된 단백질은 플라빈 단백질이라고 불린다).이 특성은 단백질 결합을 검사하고 결합 상태에 [11]있을 때 형광 활성 손실을 관찰할 때 활용될 수 있습니다.산화 플라빈은 약 450nm의 높은 흡수율을 가지며, 형광은 약 515~[9]520nm이다.
화학적 상태
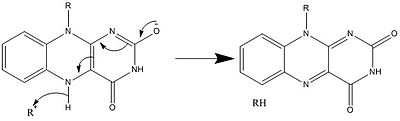
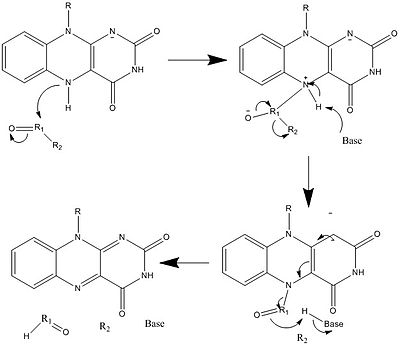
생물학적 시스템에서 FAD는 완전히 산화되는 H 및− e의 수용체+, FADH 형태의 수용체 또는 공여체, 환원된2 FADH 형태의 공여체로 작용한다.다음 그림은 잠재적인 변화를 요약한 것입니다.
위와 같이 다른 반응형 FAD가 형성되어 소비될 수 있다.이러한 반응에는 전자의 전달과 화학적 결합의 생성/파괴가 포함됩니다.반응 메커니즘을 통해 FAD는 생물학적 시스템 내의 화학 활동에 기여할 수 있습니다.다음 그림은 FAD가 관여할 수 있는 액션의 일반적인 형태를 나타내고 있습니다.
메커니즘 1과 2는 분자가 1개의 수소 이온에 해당하는 양을 얻는 수소화물 이득을 나타낸다.메커니즘 3 및 4 래디칼 생성 및 수소화물 손실.래디컬 종은 짝이 없는 전자 원자를 포함하고 있으며 화학적으로 매우 활동적이다.수소화물 손실은 이전에 본 수소화물 이득의 역과정이다.마지막 두 가지 메커니즘은 탄소 래디칼을 사용한 친핵성 첨가와 반응을 보여준다.
생합성
FAD는 리보플라빈에서 [8]유래한 또 다른 분자인 플라빈 모노뉴클레오티드와 함께 효소 보조 인자로서 중요한 역할을 한다.박테리아, 곰팡이 그리고 식물은 리보플라빈을 생산할 수 있지만, 인간과 같은 다른 진핵생물들은 리보플라빈을 [9]만드는 능력을 상실했다.그러므로, 인간은 비타민 B2로도 알려진 리보플라빈을 음식 [14]공급원으로부터 섭취해야 한다.리보플라빈은 일반적으로 소장에서 섭취되고 운반 [9]단백질을 통해 세포로 운반된다.리보플라빈 인산화효소(EC 2.7.1.26)는 리보플라빈에 인산기를 첨가하여 플라빈 모노뉴클레오티드를 생성하고 FAD 합성효소는 아데닌 뉴클레오티드를 결합하며,[9] 두 단계 모두 ATP를 필요로 한다.박테리아는 일반적으로 하나의 생체 기능 효소를 가지고 있지만, 고세균과 진핵 생물은 보통 두 개의 다른 [9]효소를 사용한다.현재의 연구는 세포와 미토콘드리아에 [9]서로 다른 동질체가 존재한다는 것을 보여준다.FAD는 양쪽에서 합성되어 필요에 [11]따라 운반될 가능성이 있는 것 같습니다.
기능.
플라보 단백질은 플라빈 부분의 독특하고 다용도 구조를 이용하여 어려운 산화환원 반응을 촉매한다.플라빈은 여러 개의 산화환원 상태를 가지고 있기 때문에 하나 또는 두 개의 전자, 수소 원자 또는 하이드로늄 이온의 전달을 수반하는 과정에 참여할 수 있다.완전 산화 플라빈 고리의 N5와 C4a도 친핵성 공격을 [15]받기 쉽다.플라빈 부분의 광범위한 이온화 및 수정은 플라빈 아데닌 디뉴클레오티드(FAD)를 포함한 플라빈의 결합 시 동적 매개변수를 크게 교란시키는 플라빈의 능력과 이소알록사진 고리 시스템에 기인할 수 있다.
게놈에서 플라빈 의존성 단백질 부호화 유전자의 수는 종에 따라 다르며 0.1% - 3.5%에 이를 수 있으며, 인간은 90개의 플라빈 부호화 [16]유전자를 가지고 있다.FAD는 플라빈의 보다 복잡하고 풍부한 형태이며, 전체 플라빈[16] 단백질의 75%, 인간 코드 플라빈 단백질의 [17]84%에 결합하는 것으로 보고되었다.다양한 배양 포유동물 세포군의 유리 또는 비공유 결합 플라빈 세포 농도는 FAD(2.2~17.0 아몰/세포)와 FMN(0.46~3.4 아몰/세포)[18]에 대해 보고되었다.
FAD는 NAD+보다 더 양의 환원 전위를 가지며 매우 강한 산화제이다.세포는 알켄에 대한 C-C 결합의 탈수소 등 에너지적으로 어려운 산화 반응에서 이를 이용한다.FAD 의존성 단백질은 전자 수송, DNA 복구, 뉴클레오티드 생합성, 지방산의 베타 산화, 아미노산 이화, CoA, CoQ 및 헴 그룹과 같은 다른 보조 인자의 합성을 포함한 다양한 대사 경로에서 기능한다.잘 알려진 반응 중 하나는 구연산 회로(TCA 또는 크렙스 회로라고도 함)의 일부이며, 석신산 탈수소효소(전자전달 사슬의 복합체 II)는 유비퀴논을 유비퀴놀로 [11]환원시킴으로써 후마르산염으로 석신산염의 산화를 촉매하기 위해 공유 결합 FAD를 필요로 한다.이2 산화의 고에너지 전자는 FAD를 FADH로2 환원함으로써 순간적으로 저장된다. FADH는 FAD로 돌아가 두 개의 고에너지 전자를 전자전달망을 통해 보낸다. FADH의2 에너지는 산화적 인산화로 1.5개의 상당량의[19] ATP를 생성하기에 충분하다.플라빈 아데닌 다이 뉴클레오타이드 Acetyl-CoA-dehydrogenases 같은 지방산의 베타 산화와 류신(isovaleryl-CoA 탈수소 효소), 이소류신,(short/branched-chain 아실 CoA탈수소 효소),valine(isobutyryl-CoA 탈수소 효소), 리신(glutaryl-CoA 탈수소 효소) 같은 아미노산 이화 작용에 관여하고 있는 일부 산화 환원 flavoproteins non-covalently다[20]대사를 조절하는 FAD 의존성 효소의 추가 예로는 글리세롤-3-인산탈수소효소(트리글리세리드 합성)와 퓨린뉴클레오티드 [21]이화작용에 관여하는 크산틴산화효소 등이 있다.FAD가 플라보 단백질에서 할 수 있는 비촉매 기능은 구조적인 역할로서 또는 생물학적 시계와 발달을 조절하는 청색 민감 광수용체와 관련이 있다.[20]
플라보단백질
플라보단백질은 보철기로 FMN 또는 FAD 분자를 가지며, 이 보철기는 단단하게 결합되거나 공유 결합될 수 있다.플라보 단백질의 약 5~10%만이 공유 결합 FAD를 가지고 있지만, 이러한 효소는 산화환원력이 [11]더 강하다.경우에 따라 FAD는 활성 부위의 구조적 지지를 제공하거나 촉매 [20]작용 중 중간체의 안정화를 제공할 수 있다.이용 가능한 구조 데이터에 기초하여 알려진 FAD 결합 부위는 200개 이상의 [22]유형으로 나눌 수 있다.
90개의 플라보 단백질은 인간 게놈에 암호화되어 있으며, 약 84%는 FAD를 필요로 하며, 약 16%는 FMN을 필요로 하는 반면, 5개의 단백질은 [17]둘 다 존재해야 한다.플라보 단백질은 산화환원 [17]능력 때문에 주로 미토콘드리아에 위치한다.모든 플라보단백질 중 90%는 산화환원반응을 수행하며, 나머지 10%는 전이효소, 리아제, 이성질화효소,[16] 리가아제이다.
탄소-헤테로아톰 결합의 산화
탄소질소
모노아민 산화효소(MAO)는 노르에피네프린, 세로토닌 및 도파민의 이화작용과 함께 생물학적 중요성으로 인해 광범위하게 연구되는 플라보엔자임이다.MAO는 1차, 2차 및 3차 아민을 산화시켜 비효소적으로 이미인에서 알데히드 또는 케톤으로 가수분해한다.비록 이 종류의 효소가 광범위하게 연구되었지만, 그것의 작용 메커니즘은 여전히 논의되고 있다.래디칼 메커니즘과 친핵 메커니즘의 두 가지 메커니즘이 제안되었다.라디칼 중간체의 존재에 대한 스펙트럼 또는 전자 상사성 공명 증거가 존재하지 않기 때문에 라디칼 메커니즘은 일반적으로 덜 받아들여진다.친핵성 메커니즘은 [23]기질의 친핵성을 증가시킬 것으로 예상되는 두 개의 티로신 잔기를 돌연변이시킨 부위 지향 돌연변이 유발 연구에 의해 뒷받침되기 때문에 더욱 선호된다.
탄소 산소
포도당산화효소(GOX)는 β-D-포도당의 D-글루코노-γ-락톤으로의 산화를 효소 결합 플라빈의 동시 환원과 함께 촉매한다.GOX는 각 서브유닛이 하나의 FAD 분자와 결합하는 호모디머로 존재한다.결정 구조는 FAD가 이합체 계면 근처에 있는 효소의 깊은 주머니에서 결합한다는 것을 보여준다.연구에 따르면 FAD를 8-히드록시-5-carba-5-deaza FAD로 치환했을 때 반응의 입체화학은 플라빈의 후면과 반응하여 결정되었다.이직 중에는 라디칼 [23]메커니즘을 나타내는 중성 세미퀴논과 음이온 세미퀴논이 관찰된다.
카본황
프레닐시스테인분해효소(PCLase)는 프레닐시스테인(단백질변성)의 분해를 촉매하여 단백질 타겟에 이소프레노이드 알데히드 및 유리시스테인 잔기를 형성한다.FAD는 PCLase에 비공유 결합되어 있습니다.플라빈의 반응을 살펴본 역학적 연구는 많지 않지만 제안된 메커니즘은 다음과 같다.프레닐부분의 C1에서 FAD로의 수소화물 전이를 제안하여 플라빈을 FADH로2 환원한다.COFORMED는 인접한 황 원자에 의해 안정화되는 카보카케이션이다.FADH는2 분자 산소와 반응하여 산화 [23]효소를 회복시킨다.
카본 카본
UDP-N-아세틸레놀피루코사민환원효소(MurB)는 엔올피루빌-UDP-N-아세틸글루코사민(기질)의 NADPH 의존적 환원을 대응하는 D-락틸 화합물 UDP-N-아세틸무라믹산(제품)에 촉매하는 효소이다.MurB는 단량체로 하나의 FAD 분자를 포함하고 있다.기질이 제품으로 전환되기 전에 NADPH는 먼저 FAD를 감소시켜야 한다.NADP가+ 분리되면 기질이 결합할 수 있고 감소된 플라빈은 [23]생성물을 감소시킬 수 있다.
티올/이황화물화학
글루타티온 환원효소(GR)는 글루타티온 이황화물(GSSG)의 글루타티온(GSH)으로의 환원을 촉매한다.GR은 이러한 반응을 촉진하기 위해 FAD와 NADPH를 필요로 한다. 먼저 수소화물은 NADPH에서 FAD로 전달되어야 한다.환원된 플라빈은 이황화물을 공격하는 친핵체로 작용할 수 있으며, 이는 C4a-시스테인 부가물을 형성한다.이러한 부가물을 제거하면 플라빈-티올레이트 전하 전달 [23]복합체가 생성된다.
전자 전달 반응
모노옥시게나아제(히드록실화) 반응을 촉매하는 시토크롬 P450형 효소는 FAD에서 P450으로의 두 전자의 전달에 의존한다.진핵생물에서 두 종류의 P450 시스템이 발견됩니다.소포체에 위치한 P450 시스템은 FAD와 FMN을 모두 포함하는 시토크롬 P-450 환원효소(CPR)에 의존합니다. 환원된 FAD(FADH)2의 2개의 전자는 한 번에 하나씩 FMN으로 전달되고 단일 전자는 FMN에서 [24]he450으로 전달됩니다.
미토콘드리아에 위치한 P450 시스템은 두 가지 전자전달 단백질에 의존합니다.아드레노독신환원효소(AR)를 포함한 FAD 및 아드레노독신이라는 단백질을 포함한 소량의 철황기.FAD는 AR의 [25][26]FAD 결합 도메인에 포함되어 있다.AR의 FAD는 AR의 NADP 결합 도메인에 결합하는 NADPH의 두 전자의 전달에 의해 FADH로2 환원된다.이 효소의 구조는 효율적인 전자 [26]전달을 위해 전자 공여체 NADPH와 수용체 FAD의 정렬을 정확하게 유지하기 위해 보존됩니다.환원된 FAD의 두 전자는 한 번에 한 번씩 아드레노독소로 전달되고, 아드레노독소는 다시 미토콘드리아 [27]P450의 헴 그룹에 단일 전자를 기증한다.
미토콘드리아 P450 시스템의 마이크로솜 환원효소 대 환원효소의 구조는 완전히 다르며 호몰로지를 [24]보이지 않는다.
레독스
p-히드록시벤조산수소효소(PHBH)는 p-히드록시벤조산염(pOHB)의 3,4-디록시벤조산염(3,4-diOHB)으로의 산소화를 촉매하며, 이 반응에는 FAD, NADPH 및 분자산소가 모두 필요하다.NADPH는 먼저 FAD에 상당하는 수소화물을 전달하여 FADH를 생성한− 후 NADP가+ 효소로부터 분리된다.환원된 PHBH는 분자 산소와 반응하여 플라빈-C(4a)-히드로페옥시드를 형성한다.플라빈 하이드로페옥시드는 pOHB를 빠르게 수산화시킨 후 물을 제거하여 산화 플라빈을 [23]재생합니다.대체 플라빈 매개 산소화 기구는 플라빈-C(4a)-(히드로)[2][3] 과산화물 대신 플라빈-N(5)-옥시드의 사용을 포함한다.
비레독스
맥락막산합성효소(CS)는 시키마이트 경로의 마지막 단계인 맥락막산염의 형성을 촉매한다.CS에는 2개의 클래스가 알려져 있으며, 둘 다 FMN이 필요하지만 환원제로서의 NADPH의 필요성에 대해서는 의견이 분분합니다.CS를 위한 제안된 메커니즘은 급진적인 종을 포함한다.래디칼 플라빈종은 기질 유사체를 사용하지 않고 분광학적으로 검출되지 않았으며, 이는 수명이 짧다는 것을 의미한다.다만, 불소화 기질을 사용했을 때는 중성 플라빈 세미퀴논이 [23]검출되었다.
복합 플라보엔자임
글루탐산합성효소는 L-글루타민이 반응의 질소원이 되는 L-글루탐산염의 L-글루탐산염으로의 전환을 촉매한다.모든 글루탐산염 합성은 철-황 클러스터와 FMN을 포함하는 철-황 플라보단백질이며, 글루탐산염 합성은 그 배열과 생화학적 특성에 따라 분류된다.비록 이 효소의 세 가지 클래스가 있지만, 그들은 모두 같은 메커니즘을 통해 작동한다고 믿어진다. 단지 FMN을 감소시키는 것에 의해서 다를 뿐이다. 이 효소는 두 개의 글루타민 분자를 생성한다: 하나는 글루타민(글루타민산염과 암모니아 형성)의 가수 분해에 의해, 그리고 다른 하나는 첫 번째 공격에서 생성된 암모니아에 의해 생성된다.FMN에 의해 글루탐산염으로 환원되는 2-옥소글루타르산염.[23]
임상적 의의
플라보 단백질의 중요성 때문에,[17] 인간 플라보 단백질의 약 60%가 돌연변이 시 인간 질병을 유발한다는 것은 놀랄 일이 아니다.어떤 경우에, 이것은 FAD 또는 FMN에 대한 친화력 감소에 기인하므로, 리보플라빈을 과다 섭취하면 다발성 아실-CoA 탈수소효소 [9]결핍과 같은 질병 증상을 줄일 수 있다.또한 리보플라빈 결핍 자체는 건강 문제를 [9]일으킬 수 있습니다.예를 들어, ALS 환자의 경우 FAD [9]합성 수준이 감소합니다.이 두 가지 경로 모두 발달 또는 위장 이상, 잘못된 지방 분해, 빈혈, 신경학적 문제, 암 또는 심장병, 편두통, 시력 악화 및 피부 [9]병변을 포함한 다양한 증상을 초래할 수 있습니다.따라서 제약업계는 특정한 경우에 식단을 보충하기 위해 리보플라빈을 생산한다.2008년 리보플라빈의 전 세계 수요는 연간 6000t,[4] 생산능력은 10,000t이었다.이 1억 5천만 달러 시장은 의료용뿐만 아니라, 농업에서 동물성 식품의 보충제나 [4]식품 착색제로도 사용되고 있습니다.
의약품 설계
항균제의 새로운 디자인은 일반적인 항생제에 대한 박테리아 항생제 내성이 증가함에 따라 과학 연구에서 지속적으로 중요하다.FAD(복합체 II)를 사용하는 특정 대사 단백질은 세균 독성에 필수적이므로 FAD 합성을 목표로 하거나 FAD 유사체를 만드는 것이 유용한 [28]조사 영역이 될 수 있다.이미 과학자들은 FAD가 보통 한 번 결합하는 것으로 가정하는 두 가지 구조, 즉 분자가 기본적으로 반으로 접히고 아데닌과 이소알록사진 [14]고리가 쌓이는 확장 또는 나비 형태를 결정하였습니다.유사한 방식으로 결합할 수 있지만 단백질 기능을 허용하지 않는 FAD 모방체는 세균 [14]감염을 억제하는 유용한 메커니즘이 될 수 있다.대체적으로, FAD 합성을 차단하는 약물은 같은 목표를 달성할 수 있다; 이것은 특히 인간과 박테리아 FAD 합성이 매우 다른 효소에 의존하기 때문에, 박테리아 FAD 합성효소를 목표로 만들어진 약물이 [29]인간 FAD 합성효소를 방해할 가능성이 없다는 것을 의미한다.
광유전학
광유전학을 통해 비침습적인 [30]방식으로 생물학적 이벤트를 제어할 수 있습니다.이 분야는 최근 몇 년 동안 Blue-Light-Utilizing FAD 도메인(BLUF)과 같은 빛 감도를 트리거하는 도구를 포함한 많은 새로운 도구들로 발전해 왔습니다. BLUF는 식물과 [30]박테리아에 있는 광수용체에서 유래한 100~140개의 아미노산 배열을 인코딩합니다.다른 감광체와 마찬가지로 빛은 BLUF 영역에 구조적 변화를 일으켜 다운스트림 [30]상호작용을 방해합니다.현재의 연구는 BLUF 도메인이 부가된 단백질과 다른 외부 요인이 [30]단백질에 어떻게 영향을 미칠 수 있는지를 조사한다.
치료 모니터링
체내에는 트립토판, 콜라겐, FAD, NADH, 포르피린 [31]등 자연 형광을 가진 분자가 다수 존재한다.과학자들은 질병의 진행이나 치료 효과를 관찰하거나 진단에 도움을 주기 위해 이것을 이용했다.예를 들어, FAD와 NADH의 자연 형광은 침습성 [31]구강암의 초기 신호인 정상 조직 및 구강 점막하 섬유증에서 변화한다.따라서 의사들은 표준 [31]생검과는 달리 진단을 돕고 치료를 모니터링하기 위해 형광을 사용해 왔다.
기타 이미지
「 」를 참조해 주세요.
레퍼런스
- ^ Teufel, Robin; Agarwal, Vinayak; Moore, Bradley S. (2016-04-01). "Unusual flavoenzyme catalysis in marine bacteria". Current Opinion in Chemical Biology. 31: 31–39. doi:10.1016/j.cbpa.2016.01.001. ISSN 1879-0402. PMC 4870101. PMID 26803009.
- ^ a b Teufel, R; Miyanaga, A; Michaudel, Q; Stull, F; Louie, G; Noel, JP; Baran, PS; Palfey, B; Moore, BS (28 November 2013). "Flavin-mediated dual oxidation controls an enzymatic Favorskii-type rearrangement". Nature. 503 (7477): 552–6. Bibcode:2013Natur.503..552T. doi:10.1038/nature12643. PMC 3844076. PMID 24162851.
- ^ a b Teufel, Robin; Stull, Frederick; Meehan, Michael J.; Michaudel, Quentin; Dorrestein, Pieter C.; Palfey, Bruce; Moore, Bradley S. (2015-07-01). "Biochemical Establishment and Characterization of EncM's Flavin-N5-oxide Cofactor". Journal of the American Chemical Society. 137 (25): 8078–8085. doi:10.1021/jacs.5b03983. ISSN 1520-5126. PMC 4720136. PMID 26067765.
- ^ a b c Abbas CA, Sibirny AA (Jun 2011). "Genetic control of biosynthesis and transport of riboflavin and flavin nucleotides and construction of robust biotechnological producers". Microbiology and Molecular Biology Reviews. 75 (2): 321–60. doi:10.1128/mmbr.00030-10. PMC 3122625. PMID 21646432.
- ^ Hayashi H (2013). B Vitamins and Folate: Chemistry, Analysis, Function and Effects. Cambridge, UK: The Royal Society of Chemistry. p. 7. ISBN 978-1-84973-369-4.
- ^ Warburg O, Christian W (1938). "Isolation of the prosthetic group of the amino acid oxidase". Biochemische Zeitschrift. 298: 150–168.
- ^ Metzler DE, Metzler CM, Sauke DJ (2003). Biochemistry (2nd ed.). San Diego: Harcourt, Academic Press. ISBN 978-0-12-492541-0.
- ^ a b Devlin TM (2011). Textbook of Biochemistry: with Clinical Correlations (7th ed.). Hoboken, NJ: John Wiley & Sons. ISBN 978-0-470-28173-4.
- ^ a b c d e f g h i j k Barile M, Giancaspero TA, Brizio C, Panebianco C, Indiveri C, Galluccio M, Vergani L, Eberini I, Gianazza E (2013). "Biosynthesis of flavin cofactors in man: implications in health and disease". Current Pharmaceutical Design. 19 (14): 2649–75. doi:10.2174/1381612811319140014. PMID 23116402.
- ^ Teufel, Robin; Miyanaga, Akimasa; Michaudel, Quentin; Stull, Frederick; Louie, Gordon; Noel, Joseph P.; Baran, Phil S.; Palfey, Bruce; Moore, Bradley S. (2013-11-28). "Flavin-mediated dual oxidation controls an enzymatic Favorskii-type rearrangement". Nature. 503 (7477): 552–556. Bibcode:2013Natur.503..552T. doi:10.1038/nature12643. ISSN 1476-4687. PMC 3844076. PMID 24162851.
- ^ a b c d e f Kim HJ, Winge DR (May 2013). "Emerging concepts in the flavinylation of succinate dehydrogenase". Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1827 (5): 627–36. doi:10.1016/j.bbabio.2013.01.012. PMC 3626088. PMID 23380393.
- ^ Liu S (2012). Bioprocess Engineering: Kinetics, Sustainability, and Reactor Design. Newnes. ISBN 978-0-444-63783-3.
- ^ Lewis JA, Escalante-Semerena JC (Aug 2006). "The FAD-dependent tricarballylate dehydrogenase (TcuA) enzyme of Salmonella enterica converts tricarballylate into cis-aconitate". Journal of Bacteriology. 188 (15): 5479–86. doi:10.1128/jb.00514-06. PMC 1540016. PMID 16855237.
- ^ a b c Kuppuraj G, Kruise D, Yura K (Nov 2014). "Conformational behavior of flavin adenine dinucleotide: conserved stereochemistry in bound and free states". The Journal of Physical Chemistry B. 118 (47): 13486–97. doi:10.1021/jp507629n. PMID 25389798.
- ^ Monteira M (2013). B Vitamins and Folate: Chemistry, Analysis, Function and Effects. Cambridge, UK: The Royal Society of Chemistry. p. 94. ISBN 978-1-84973-369-4.
- ^ a b c Macheroux P, Kappes B, Ealick SE (Aug 2011). "Flavogenomics--a genomic and structural view of flavin-dependent proteins". The FEBS Journal. 278 (15): 2625–34. doi:10.1111/j.1742-4658.2011.08202.x. PMID 21635694. S2CID 22220250.
- ^ a b c d Lienhart WD, Gudipati V, Macheroux P (Jul 2013). "The human flavoproteome". Archives of Biochemistry and Biophysics. 535 (2): 150–62. doi:10.1016/j.abb.2013.02.015. PMC 3684772. PMID 23500531.
- ^ Hühner J, Ingles-Prieto Á, Neusüß C, Lämmerhofer M, Janovjak H (Feb 2015). "Quantification of riboflavin, flavin mononucleotide, and flavin adenine dinucleotide in mammalian model cells by CE with LED-induced fluorescence detection". Electrophoresis. 36 (4): 518–25. doi:10.1002/elps.201400451. PMID 25488801. S2CID 27285540.
- ^ Stryer L, Berg JM, Tymoczko JL (2007). Biochemistry (6th ed.). New York: Freeman. ISBN 978-0-7167-8724-2.
- ^ a b c Mansoorabadi SO, Thibodeaux CJ, Liu HW (Aug 2007). "The diverse roles of flavin coenzymes--nature's most versatile thespians". The Journal of Organic Chemistry. 72 (17): 6329–42. doi:10.1021/jo0703092. PMC 2519020. PMID 17580897.
- ^ King MW (18 May 2020). "Vitamins, Minerals, Supplements". The Medical Biochemistry Page.
- ^ Garma, Leonardo D.; Medina, Milagros; Juffer, André H. (2016-11-01). "Structure-based classification of FAD binding sites: A comparative study of structural alignment tools". Proteins: Structure, Function, and Bioinformatics. 84 (11): 1728–1747. doi:10.1002/prot.25158. ISSN 1097-0134. PMID 27580869. S2CID 26066208.
- ^ a b c d e f g h Fagan RL, Palfey BA (2010). "Flavin-Dependent Enzymes". Comprehensive Natural Products II Chemistry and Biology. 7: 37–113.
- ^ a b Hanukoglu I (1996). "Electron transfer proteins of cytochrome P450 systems" (PDF). Adv. Mol. Cell Biol. Advances in Molecular and Cell Biology. 14: 29–55. doi:10.1016/S1569-2558(08)60339-2. ISBN 9780762301133.
- ^ Ziegler GA, Vonrhein C, Hanukoglu I, Schulz GE (Jun 1999). "The structure of adrenodoxin reductase of mitochondrial P450 systems: electron transfer for steroid biosynthesis". Journal of Molecular Biology. 289 (4): 981–90. doi:10.1006/jmbi.1999.2807. PMID 10369776.
- ^ a b Hanukoglu I (2017). "Conservation of the Enzyme-Coenzyme Interfaces in FAD and NADP Binding Adrenodoxin Reductase-A Ubiquitous Enzyme". Journal of Molecular Evolution. 85 (5): 205–218. Bibcode:2017JMolE..85..205H. doi:10.1007/s00239-017-9821-9. PMID 29177972. S2CID 7120148.
- ^ Hanukoglu I, Jefcoate CR (Apr 1980). "Mitochondrial cytochrome P-450scc. Mechanism of electron transport by adrenodoxin" (PDF). The Journal of Biological Chemistry. 255 (7): 3057–61. doi:10.1016/S0021-9258(19)85851-9. PMID 6766943.
- ^ McNeil MB, Fineran PC (May 2013). "Prokaryotic assembly factors for the attachment of flavin to complex II". Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1827 (5): 637–47. doi:10.1016/j.bbabio.2012.09.003. PMID 22985599.
- ^ Serrano A, Ferreira P, Martínez-Júlvez M, Medina M (2013). "The prokaryotic FAD synthetase family: a potential drug target". Current Pharmaceutical Design. 19 (14): 2637–48. doi:10.2174/1381612811319140013. PMID 23116401.
- ^ a b c d Christie JM, Gawthorne J, Young G, Fraser NJ, Roe AJ (May 2012). "LOV to BLUF: flavoprotein contributions to the optogenetic toolkit". Molecular Plant. 5 (3): 533–44. doi:10.1093/mp/sss020. PMID 22431563.
- ^ a b c Sivabalan S, Vedeswari CP, Jayachandran S, Koteeswaran D, Pravda C, Aruna PR, Ganesan S (2010). "In vivo native fluorescence spectroscopy and nicotinamide adinine dinucleotide/flavin adenine dinucleotide reduction and oxidation states of oral submucous fibrosis for chemopreventive drug monitoring". Journal of Biomedical Optics. 15 (1): 017010–017010–11. Bibcode:2010JBO....15a7010S. doi:10.1117/1.3324771. PMID 20210484. S2CID 40028193.
외부 링크
- PDB 단백질에 결합하는 FAD
- NIH 화학 데이터베이스에서의 FAD 입력