헤메 A
Heme A| | |||
| 이름 | |||
|---|---|---|---|
| 기타 이름 철 시토포피린 IX, 포밀포피린 | |||
| 식별자 | |||
3D 모델(JSmol) | |||
| 켐스파이더 | |||
| 메슈 | 헤메+a | ||
펍켐 CID | |||
CompTox 대시보드 (EPA) | |||
| |||
| |||
| 특성. | |||
| 촌페495664 | |||
| 어금질량 | 852.837 | ||
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |||
| Infobox 참조 자료 | |||
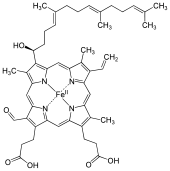
헤메 A(혹은 헴 A)는 헤메(heme)로, 포피린이라 불리는 매크로사이클릭 리간드로 이루어져 철 원자를 킬레이트화한다.Heme A는 생체 분자로서 많은 유기체에 의해 자연적으로 생성된다.헤메 A는 종종 용액에 있을 때 이분법적인 녹색/빨간색으로 나타나며 혈액 속의 붉은 색소인 헤모글로빈의 성분인 헤메 B의 구조적 친척이다.
다른 헤메인과의 관계
헤메 A는 링 위치 8의 메틸 사이드 체인이 포밀 그룹으로 산화되고 이소프로노이드 체인인 히드록시에틸파르네실 그룹이 철 테트라피롤 헤메의 링 위치 2의 비닐 사이드 체인에 부착됐다는 점에서 헤메 B와 다르다.헤메 A는 둘 다 위치 2에 이러한 파르네실 첨가물을 가지고 있지만 헤메 O는 위치 8에 포밀 그룹을 가지고 있지 않고 여전히 메틸 그룹을 포함하고 있다는 점에서 헤메 오와 유사하다.환원된 heme의 NMR과 IR 실험에 근거한 정확한 heme A 구조는 1975년에 출판되었다.[1]철분 없는 형태의 디메틸 에스테르 합성에 의해 구조가 확인되었다.[2]
역사
헤메 A는 1951년 독일 생화학자 오토 워버그에 의해 처음 격리되어 그에 의해 적분막 메탈로프로테인 시토크롬 c산화효소의 활성 성분으로 나타났다.[3]
입체화학
히드록실 그룹에 묶인 탄소인 링 I의 링 위치 3에서 첫 번째 탄소에 대한 정확한 기하학적 구성에 대한 최종 구조 문제가 최근 치랄 S 구성으로 발표되었다.[4]
헤메 B와 마찬가지로 헤메 A는 헤메 철과 보존된 아미노산 사이드체인 사이의 좌표 결합을 통해 아포프로테인에 부착되는 경우가 많다.중요한 호흡기 단백질 시토크롬 c 산화효소(CCO)에서 산소반응센터의 heme A에 대한 이 리간드 5는 히스티딜 그룹이다.[5]이것은 헤모글로빈과 미오글로빈을 포함한 많은 헤메프로테우스의 공통적인 리간드다.

시토크롬에 있는 헤메 A는 두 개의 히스티딘 잔류물로 묶인 시토크롬 c 산화효소의 일부분이다(핑크색으로 표시).[6]
헤메 A를 함유한 야금단백질의 예는 시토크롬 c산화효소다.이 매우 복잡한 단백질은 각각 다른 기능을 가진 두 곳의 헤미 A를 함유하고 있다.시토크롬 a의 헴 A의 철은 6개의 다른 원자와 결합한 육각이다.시토크롬 a3의 헴 A의 철은 때때로 다이옥시겐(분자 산소)을 결합할 수 있는 여섯 번째 부위를 남겨둔 다른 5개의 원자에 의해 결합된다.[6]게다가 이 효소는 구리, 마그네슘, 아연, 그리고 몇 개의 칼륨과 나트륨 이온을 묶는다.CCO에 있는 두 헤메 A 그룹은 서로 간에 전자, 즉 구리 이온과 밀접하게 연관된 단백질 시토크롬 c를 쉽게 교환하는 것으로 생각된다.
포밀 그룹과 이소프레노이드 사이드 체인 모두 시토크롬 c산화효소에 의한 산소 감소의 에너지 보존에 중요한 역할을 하는 것으로 생각된다.CCO는 양자를 암기간 미토콘드리아 공간에 펌핑하여 디옥시겐 감소의 에너지를 보존하는 역할을 한다고 생각된다.헤메 A의 포밀과 히드록시에틸파네실 그룹 모두 S의 영향력 있는 그룹에 의해 출판된 이 중요한 과정에서 중요한 역할을 하는 것으로 생각된다.요시카와 [7]입니다
참고 항목
- 헤메
- 헤모프로테인
- 시토크롬 c산화효소(세포 호흡의 복합 IV)
참조
- ^ Caughey, W.S.; Smythe, G.A.; O'Keefe, D.H.; Maskasky, J.E.; Smith, M.L. (1975). "Heme A of Cytochrome c Oxidase". Journal of Biological Chemistry. 250 (19): 7602–7622. doi:10.1016/S0021-9258(19)40860-0. PMID 170266.
- ^ Battersby, Alan R.; McDonald, Edward; Thompson, Mervyn; Chaudhry, Irshad A.; Clezy, Peter S.; Fookes, Christopher J. R.; Hai, Ton That (1985). "Isolation, crystallisation, and synthesis of the dimethyl ester of porphyrin a, the iron-free prosthetic group of cytochrome c oxidase". Journal of the Chemical Society, Perkin Transactions 1: 135. doi:10.1039/P19850000135.
- ^ Warburg, O; Gewitz H S. (1951). "Cytohämin aus Herzmuskel". Zeitschrift für Physiologische Chemie. 288 (1): 1–4. doi:10.1515/bchm2.1951.288.1.1. PMID 14860765.
- ^ Yamashita E, Aoyama H, Yao M, Muramoto K, Shinzawa-Itoh K, Yoshikawa S, Tsukihara T.; Aoyama; Yao; Muramoto; Shinzawa-Itoh; Yoshikawa; Tsukihara (2005). "Absolute configuration of the hydroxyfarnesylethyl group of heme A, determined by X-ray structural analysis of bovine heart cytochrome c oxidase using methods applicable at 2.8 Angstrom resolution". Acta Crystallographica D. 61 (10): 1373–1377. doi:10.1107/S0907444905023358. PMID 16204889.
{{cite journal}}: CS1 maint : 복수이름 : 작성자 목록(링크) - ^ Tsukihara T, Shimokata K, Katayama Y, Shimada H, Muramoto K, Aoyama H, Mochizuki M, Shinzawa-Itoh K, Yamashita E, Yao M, Ishimura Y, Yoshikawa S.; Shimokata; Katayama; Shimada; Muramoto; Aoyama; Mochizuki; Shinzawa-Itoh; Yamashita; Yao; Ishimura; Yoshikawa (2003). "The low-spin heme of cytochrome c oxidase as the driving element of the proton-pumping process". PNAS. 100 (26): 15304–15309. Bibcode:2003PNAS..10015304T. doi:10.1073/pnas.2635097100. PMC 307562. PMID 14673090.
{{cite journal}}: CS1 maint : 복수이름 : 작성자 목록(링크) - ^ a b Yoshikawa, S.; Shinzawa-Itoh, K.; Nakashima, R.; Yaono, R.; Yamashita, E.; Inoue, N.; Yao, M.; Fei, M. J.; et al. (1998). "Redox-Coupled Crystal Structural Changes in Bovine Heart Cytochrome c Oxidase". Science. 280 (5370): 1723–1729. doi:10.1126/science.280.5370.1723. PMID 9624044. S2CID 37147458.
- ^ Shimokata K, Katayama Y, Murayama H, Suematsu M, Tsukihara T, Muramoto K, Aoyama H, Yoshikawa S, Shimada H.; Katayama; Murayama; Suematsu; Tsukihara; Muramoto; Aoyama; Yoshikawa; Shimada (2007). "The proton pumping pathway of bovine heart cytochrome c oxidase". PNAS. 104 (10): 4200–4205. Bibcode:2007PNAS..104.4200S. doi:10.1073/pnas.0611627104. PMC 1820732. PMID 17360500.
{{cite journal}}: CS1 maint : 복수이름 : 작성자 목록(링크)