뿌리
Root
관속 식물에서 뿌리는 식물의 기관으로 식물의 고정장치를 제공하고 물과 영양분을 식물 몸에 흡수하도록 변형되어 식물이 키가 크고 빠르게 자랄 수 있게 합니다.[1]그들은 대부분 토양의 표면 아래에 있지만, 뿌리는 공중 또는 공기 중에 있을 수도 있고, 즉 땅 위 또는 특히 물 위에서 자랄 수도 있습니다.
기능.
뿌리의 주요 기능은 물의 흡수, 식물 영양 그리고 식물체를 땅에 고정시키는 것입니다.[2]
해부학

뿌리 형태학은 뿌리모, 심낭, 신근, 모발의 네 가지 영역으로 나뉩니다.[3]새로운 뿌리의 뿌리모는 뿌리가 토양에 침투하는 것을 돕습니다.뿌리가 깊어질수록 뿌리가 벗겨져 매끈매끈한 표면이 만들어져 윤활을 제공합니다.뿌리모 뒤에 있는 정강이 모양의 매리스템은 늘어나는 새로운 뿌리세포를 만들어냅니다.그리고 나서, 뿌리털이 흙으로부터 물과 미네랄 영양소를 흡수하는 형태를 만듭니다.[4]종자를 생산하는 식물의 첫 번째 뿌리는 종자 발아 후 식물 배아에서 확장되는 라디클입니다.
해부할 때, 뿌리 안의 세포 배열은 뿌리의 털, 표피, 표피, 피질, 내피질, 심낭, 그리고 마지막으로 뿌리에 의해 흡수된 물을 식물의 다른 곳으로 운반하기 위해 뿌리의 중심에 있는 혈관 조직입니다.[clarification needed]
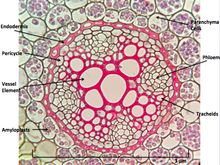
아마도 줄기-가지와 잎과 같은 다른 식물 기관과 구별되는 뿌리의 가장 두드러진 특징은 뿌리가 내생적인[5] 기원을 가지고 있다는 것, 즉 그것들은 회심과 같은 모축의 안쪽 층에서 기원하고 발달한다는 것입니다.[6]이와 대조적으로 줄기-가지와 잎은 외생적이며, 즉 외층인 피질로부터 발달하기 시작합니다.
영양소의 농도에 반응하여, 뿌리는 또한 시토키닌을 합성하는데, 이것은 새싹이 얼마나 빨리 자랄 수 있는지에 대한 신호의 역할을 합니다.뿌리는 종종 음식과 영양분을 저장하는 기능을 합니다.대부분의 관속식물종의 뿌리는 특정한 균류와 공생하여 균체를 형성하고, 박테리아를 포함한 많은 종류의 다른 생물체들 또한 뿌리와 밀접하게 연관됩니다.[7]

RSA(Root System Architecture)

정의.
RSA(Root System Architecture)라는 용어는 가장 간단한 형태로 식물의 루트 시스템의 공간적 구성을 나타냅니다.이 시스템은 매우 복잡할 수 있으며 식물 자체의 종, 토양의 구성 성분 및 영양분의 이용 가능성과 같은 여러 요인에 의존합니다.[8]뿌리 건축은 고정 및 지지뿐만 아니라 영양소와 물의 안전한 공급을 제공하는 중요한 역할을 합니다.
뿌리 시스템의 구성은 식물을 구조적으로 지탱하고 다른 식물들과 경쟁하며 토양으로부터 영양분을 흡수하는 역할을 합니다.[9]뿌리는 특정한 조건으로 자라는데, 만약 변화한다면, 식물의 성장을 방해할 수 있습니다.예를 들어, 건조한 토양에서 발달한 뿌리 시스템은 침수된 토양에서는 효율적이지 않을 수 있지만, 식물은 계절적 변화와 같은 환경의 다른 변화에 적응할 수 있습니다.[9]
용어 및 구성요소
루트 시스템의 아키텍처를 분류하기 위해 사용되는 주요 용어는 다음과 같습니다.[10]
| 가지 크기 | 링크 수(외부 또는 내부) |
| 위상 | 분기 패턴(헤링본, 다이코토머스, 방사형) |
| 링크길이 | 지점간 거리 |
| 근각 | 모근 둘레를 중심으로 하는 측근 밑면의 반경각, 모근에서 측근이 이루는 각도 및 전체 시스템이 퍼지는 각도. |
| 링크반경 | 근의 지름 |
루트 아키텍처의 모든 구성요소는 환경 자극으로 인한 유전자 반응과 반응 사이의 복잡한 상호작용을 통해 조절됩니다.이러한 발달 자극은 유전적, 영양적 영향 또는 환경적 영향 외재적 영향으로 분류되며 신호 전달 경로에 의해 해석됩니다.[11]
뿌리 구조에 영향을 미치는 외부 요인에는 중력, 빛 노출, 물 및 산소뿐만 아니라 질소, 인, 유황, 알루미늄 및 염화나트륨의 유무 또는 부족이 포함됩니다.뿌리 구조 발달을 담당하는 주요 호르몬(내재 자극) 및 각각의 경로는 다음과 같습니다.
| 오신 | 측근 형성, 정강이 지배적인 상태 유지 및 모험적인 근 형성. |
| 사이토키닌 | 사이토키닌은 근첨부 크기를 조절하고 측근 신장을 촉진합니다. |
| 에틸렌 | 크라운 루트 형성을 촉진합니다. |
| 기브렐린스 | 에틸렌과 함께, 그들은 크라운 원시 성장과 신장을 촉진합니다.그들은 auxin과 함께 뿌리 신장을 촉진합니다.또한 지브렐린은 측근 원초 시작을 억제합니다. |
성장

조기 뿌리 성장은 뿌리의 끝 근처에 위치한 정강이뼈의 기능 중 하나입니다.메리스템 세포는 어느 정도 지속적으로 분열하여 더 많은 메리스템, 루트 캡 세포(이것들은 메리스템을 보호하기 위해 희생됨) 및 미분화된 루트 세포를 생성합니다.후자는 뿌리의 주요 조직이 되며, 먼저 신장 과정을 거치는데, 이 과정은 성장 배지에서 뿌리 끝을 앞으로 밀어내는 과정입니다.이 세포들은 점차 분화하여 뿌리 조직의 특화된 세포로 성숙합니다.[12]
원추형 동맥류에 의한 성장은 모든 신장을 포함하는 일차 성장으로 알려져 있습니다.2차 성장은 나무로 된 식물 조직과 많은 비목재 식물의 주요 구성 요소인 직경의 모든 성장을 포함합니다.예를 들어 고구마의 저장뿌리는 2차 성장을 하지만 목질이 아닙니다.2차 성장은 측부 메리스템, 즉 혈관캠븀 및 코르크캠븀에서 발생합니다.전자는 2차 자일렘과 2차 자일렘을 형성하고, 후자는 주변부를 형성합니다.
2차 성장을 하는 식물에서, 자일렘과 플룸 사이에서 발생하는 혈관성 캠븀은 줄기와 뿌리를 따라 조직의 원통을 형성합니다.[citation needed]혈관캠븀은 캠븀 실린더의 안쪽과 바깥쪽 모두에 새로운 세포를 형성하고, 안쪽의 세포는 2차 자일렘 세포를 형성하고, 바깥쪽의 세포는 2차 자일렘 세포를 형성합니다.2차 자일렘이 축적되면 줄기와 뿌리의 "거트"(가로 방향 치수)가 증가합니다.결과적으로, 표피와 피질을 포함한 2차적인 플룸을 넘어선 조직들은 많은 경우에 바깥쪽으로 밀려나 결국 "밀어내는" 경향이 있습니다.[citation needed]
이 때, 코르크 캄비움은 보호 코르크 세포로 구성된 주변부를 형성하기 시작합니다.코르크 세포의 벽에는 여분의 세포 복합체 생물 중합체인 수베린 비후가 포함되어 있습니다.[13]수베린 비후는 물리적 장벽을 제공하고 병원균으로부터 보호하며 주변 조직으로부터의 수분 손실을 방지함으로써 기능합니다.또한 식물의 상처 치유 과정에도 도움을 줍니다.[14]또한 수베린은 독성 화합물이 뿌리로 들어가는 것을 방지하고 수분 벌목 중 실질에서 방사형 산소 손실(ROL)을 감소시키는 아포플라스틱 장벽(뿌리의 외부 세포 층에 존재)의 구성 요소일 수 있다고 가정됩니다.[15]코르크 캠비움은 뿌리에서 혈관 실린더의 구성 요소인 페리사이클에서 유래합니다.[15]
혈관캠븀은 매년 새로운 2차 자일렘 층을 생성합니다.[citation needed]자일렘 혈관은 성숙기에 죽지만 줄기와 뿌리의 혈관 조직을 통한 대부분의 물 수송을 담당합니다.

나무 뿌리는 보통 가지가 펴지는 지름의 3배까지 자라며, 나무 뿌리의 절반만이 몸통과 덮개 아래에 놓여 있습니다.나무 한 쪽의 뿌리는 보통 같은 쪽의 나뭇잎에 영양분을 공급합니다.그러나 사핀다과(단풍과)와 같은 일부 과들은 뿌리의 위치와 뿌리가 식물의 영양분을 공급하는 곳 사이에 상관관계를 보이지 않습니다.[16]
규정
식물의 지각 과정을 이용하여 빛의 감지를 [17]포함한 물리적 환경과 [18]물리적 장벽을 감지하는 뿌리의 상관관계가 있습니다.식물은 또한 중력을 감지하고 auxin 경로를 통해 반응하여 중력을 유발합니다.[19]시간이 지남에 따라, 뿌리는 기초를 갈라놓고, 물줄을 끊어내고, 보도를 들어 올릴 수 있습니다.연구에 따르면 뿌리는 같은 토양 환경에서 '자기'와 '비자기' 뿌리를 인식할 수 있는 능력을 가지고 있습니다.[20]
공기, 미네랄 영양소 및 물의 올바른 환경은 식물의 필요를 충족시키기 위해 식물 뿌리가 어떤 방향으로든 자라도록 합니다.뿌리는 건조하거나[21] 다른 열악한 토양 상태로부터 수줍어하거나 줄어들게 됩니다.
중력은 식물의 성장 메커니즘인 발아에서 뿌리가 아래로 자라도록 유도하는데, 이것은 또한 싹이 위로 자라도록 합니다.[22]원근, 반근, 측근 및 크라운과 같은 다양한 유형의 근은 서로 다른 중력적 설정 각도, 즉 성장 방향에서 유지됩니다.최근의 연구는 보리와 밀과 같은 곡물 작물의 뿌리 각도가 EGT1(Enhanced Gravitropism 1)이라고 불리는 새로운 유전자에 의해 조절된다는 것을 보여줍니다.[23]
생산적인 영양을 찾아 자라는 식물 뿌리가 에틸렌 가스의 확산을 통해 토양의 압축을 감지하고 피할 수 있다는 연구 결과가 나왔습니다.[24]

음영기피반응
식물은 그늘을 피하기 위해 그늘 회피 반응을 이용합니다.식물이 빽빽한 초목 아래에 있을 때, 근처의 다른 초목의 존재는 식물이 측면 성장을 피하고 아래쪽 뿌리 성장뿐만 아니라 위 방향 성장의 증가를 경험하게 합니다.식물은 그늘을 피하기 위해 뿌리 구조를 조정하는데, 가장 주목할 것은 일차 뿌리에서 나오는 측근의 길이와 양을 줄임으로써입니다.Arabidopsis thaliana의 돌연변이 변종을 실험한 결과 식물은 파이토크롬으로 알려진 광수용체를 통해 식물에 들어오는 적색 대 극적색의 비율을 감지하는 것으로 나타났습니다.[25]근처의 식물 잎들은 붉은 빛을 흡수하고 먼 붉은 빛을 반사하여 붉은 빛과 먼 붉은 빛의 비율을 낮춥니다.이러한 적색 대 극 적색 광비를 감지하는 파이토크롬 PhyA는 식물의 슛 시스템뿐만 아니라 뿌리 시스템 모두에서 국부화되어 있지만 녹아웃 돌연변이 실험을 통해 뿌리 국부화 PhyA는 직접적이든 축적이든 광비를 감지하지 못해 측면 뿌리 구조의 변화를 가져온다는 것을 발견했습니다.[25]대신 연구에 따르면 shoot localized PhyA가 측근의 구조적 변화를 일으키는 원인이 되는 파이토크롬이라고 합니다.피토크롬이 식물 뿌리에 있는 옥신 분포의 조작을 통해 이러한 건축적 변화를 완성한다는 연구 결과도 있습니다.[25]충분히 낮은 적색 대 극 적색 비율이 PhyA에 의해 감지될 때, 촬영의 PhyA는 대부분 활성 형태가 될 것입니다.[26]이 형태에서, PhyA는 전사 인자 HY5를 안정화시켜서, phyA가 비활성 형태일 때와 같이 더 이상 분해되지 않게 합니다.이렇게 안정화된 전사인자는 식물의 뿌리로 옮겨질 수 있으며, 여기서 신호를 증폭시키는 방법으로 자신의 전사를 유도합니다.식물의 뿌리에서, 잘 알려진 두 개의 옥신 수송 단백질인 PIN3와 LAX3의 번역을 담당하는 반응 인자인 ARF19로 알려진 옥신 반응 인자를 억제하는 기능을 합니다.[26]따라서, ARF19의 조작을 통해, auxin transporter PIN3 및 LAX3의 레벨 및 활성이 억제됩니다.[26]억제되면, auxin 수치는 측근 출현이 정상적으로 발생하는 영역에서 낮게 되며, 이로 인해 식물은 근주기를 통해 측근 원시의 출현을 갖지 못합니다.뿌리에서 Auxin 수송의 이러한 복잡한 조작으로, 측근 출현이 뿌리에서 억제되고 대신 뿌리가 아래로 늘어나게 되어 그늘을 피하려는 시도로 수직 식물의 성장을 촉진할 것입니다.[25][26]
아라비놉시스(Arabidopsis)에 대한 연구는 이 옥신 매개근 반응이 어떻게 작용하는지를 발견하게 했습니다.Salisbury 등은 피토크롬이 측근 발달에 어떤 역할을 하는지를 규명하기 위한 시도로,(2007)은 한천 접시에서 자란 Arabidopsis thaliana로 작업했습니다.솔즈베리 외.다양한 단백질 녹아웃 및 유전자 녹아웃 Arabidopsis 돌연변이와 함께 야생형 식물을 사용하여 이러한 돌연변이가 뿌리 구조, 단백질 존재 및 유전자 발현에 미치는 결과를 관찰했습니다.이를 위해서 솔즈베리 외.GFP 형광을 다른 형태의 거시적 이미지와 미시적 이미지와 함께 사용하여 다양한 돌연변이를 일으키는 모든 변화를 관찰했습니다.이러한 연구로부터 Salisbury et al. 은 슛 로케이트된 피토크롬이 뿌리 내의 auxin 수준을 변화시켜 측면 뿌리의 발달과 전체적인 뿌리 구조를 조절한다는 것을 이론화할 수 있었습니다.[25]van Gelderen et al.(2018)의 실험에서, 아라비놉시스 탈리아나의 슛이 뿌리 발달과 뿌리 구조에 변화와 영향을 주는지, 어떻게 주는지를 살펴보고자 했습니다.이것을 하기 위해서, 그들은 Arabidopsis 식물들을 가져다가, 그것들을 한천 겔에서 키웠고, 빛의 원천들을 분리하기 위해 뿌리들과 싹들을 노출시켰습니다.여기서, 그들은 식물의 새싹과 뿌리가 받는 다양한 빛의 파장을 바꾸고, 옆뿌리 밀도, 옆뿌리의 양, 그리고 옆뿌리의 일반적인 구조를 기록했습니다.특정 광수용체, 단백질, 유전자, 호르몬의 기능을 확인하기 위해, 그들은 다양한 Arabidopsis 녹아웃 돌연변이를 사용했고, 그 결과로 나타나는 측근 구조의 변화를 관찰했습니다.Van Gelderen et al.은 이들의 관찰과 다양한 실험을 통해 적색광과 원-적색광 비율의 근검출이 측근 발달을 어떻게 변화시키는지에 대한 메커니즘을 개발할 수 있었습니다.[26]
종류들
진정한 루트 시스템은 1차 루트와 2차 루트(또는 측면 루트)로 구성됩니다.
- 확산근계: 1차 뿌리가 우세하지 않습니다; 전체 뿌리계는 섬유질이고 모든 방향으로 분기됩니다.모노코트에서 가장 흔합니다.섬유근의 주된 기능은 식물을 고정시키는 것입니다.
특화된








많은 식물 종의 뿌리, 또는 뿌리의 일부는 서론에서 설명한 두 가지 주요 기능[clarification needed] 외에 적응적인 목적을 위해 특화되었습니다.
- 모험적인 뿌리는 일차 뿌리의 가지의 일반적인 뿌리 형성에서 순서를 벗어나며, 대신 줄기, 가지, 잎 또는 오래된 목질 뿌리에서 비롯됩니다.그것들은 외떡잎식물과 익룡에서 흔히 발생하지만, 클로버(트리폴리오), 아이비(헤데라), 딸기(프라가리아), 버드나무(살릭스)와 같은 많은 쌍떡잎식물에서도 발생합니다.대부분의 공근과 사근은 모험적입니다.어떤 침엽수에서는 모험적인 뿌리가 뿌리 체계의 가장 큰 부분을 형성할 수 있습니다.산소와 같은 가스의 교환과 저장을 증가시키기 위해 (부분적으로) 침수되는 동안 많은 식물 종에서 모험적인 뿌리 형성이 향상됩니다.[27]모험적인 뿌리의 독특한 유형은 분류될 수 있으며 형태학, 성장 역학 및 기능에 의존합니다.[28][29]
- 공기를 내뿜는 뿌리(또는 무릎 뿌리 또는 무릎 또는 기흉): 땅 위에 솟아 있는 뿌리, 특히 일부 맹그로브속(아비센니아, 소네라티아)과 같은 물 위에 있는 뿌리.아비센니아와 같은 일부 식물에서는 발기된 뿌리가 기체 교환을 위해 많은 수의 호흡 구멍을 가지고 있습니다.
- 공중 뿌리: 담쟁이덩굴(Hedera)이나 착생 난초와 같이 땅 위 전체에 있는 뿌리.많은 공기 뿌리가 안개, 이슬 또는 습도로부터 직접 공기로부터 수분과 영양소를 공급받는 데 사용됩니다.[30]어떤 사람들은 비나 습기를 모으기 위해 나뭇잎 시스템에 의존하고 심지어 그것을 비늘이나 주머니에 보관하기도 합니다.맹그로브 공중 뿌리와 같은 다른 공중 뿌리는 물 흡수를 위해 사용되지 않고 에어레이션을 위해 사용됩니다.다른 공중 뿌리는 주로 구조를 위해 사용되며, 옥수수나 앵커 뿌리에서와 같이 지주 뿌리로 기능하거나 목이 졸린 무화과에서 줄기로 기능합니다.일부 착생식물 – 다른 식물의 표면 위에 사는 식물에서, 공기 뿌리는 수원에 도달하거나 표면에 도달하기 위한 역할을 하고, 그리고 나서 규칙적인 표면 뿌리로서 기능합니다.[30]
- 캐노피 뿌리/식물 뿌리: 나무 가지가 캐노피에 물과 영양분을 보유하고 있는 착생식물과 찌꺼기의 매트를 지지할 때 형성되는 뿌리.그것들은 이용 가능한 영양분과 습기를 사용할 가능성이 있는 이러한 매트로 자랍니다.[31]
- 수축근: 히아신스나 백합과 같은 외뿔소의 구근이나 가마니, 민들레와 같은 일부 탭뿌리를 방사상으로 확장하고 종방향으로 수축함으로써 토양의 더 깊은 곳으로 끌어당기는 뿌리.그들은 주름진 표면을 가지고 있습니다.[32]
- 조근( secondary根): 2차 비후를 거친 뿌리로서 목질 구조를 갖는 것.이 뿌리들은 물과 영양분을 흡수하는 능력이 있지만, 그들의 주요 기능은 수송이고 더 작은 직경의 미세한 뿌리들을 식물의 나머지 부분에 연결하는 구조를 제공하는 것입니다.
- 이형성 루트 시스템: 두 개의 개별 함수에 대해 두 개의 고유한 형태를 갖는 루트
- 잔뿌리: 일반적으로 물과 영양 섭취의 기능을 가진 1차 뿌리 <2mm 직경>.그들은 종종 심하게 갈라져 있고 내 코로리자를 지탱합니다.이 뿌리들은 수명이 짧을 수 있지만, 뿌리 '돌려막기'의 진행 과정에서 식물로 대체됩니다.
- 하우스토리아 뿌리 : 겨우살이(Viscum album)와 다더(dodder)와 같이 다른 식물로부터 물과 영양분을 흡수할 수 있는 기생 식물의 뿌리.
- 번식근: 캐나다 엉겅퀴, 체리 및 기타 많은 식물과 같이 새로운 식물을 형성하는 빨판이라고 불리는 지상의 새싹으로 발달하는 모험적인 싹을 형성하는 뿌리.
- 프로테오이드 뿌리 또는 군집 뿌리: 프로테아과의 낮은 인산염 또는 낮은 철 조건에서 발달하는 제한된 성장의 뿌리의 밀집된 군집 및 다음과 같은 Betulaceae, Casuarinaceae, Elaagnaceae, Moraceae, Fabaceae 및 Myricaceae의 일부 식물.
- 사선근: 모험적인 지지근으로 맹그로브에서 흔히 볼 수 있습니다.그들은 흙 속에서 가지를 치고, 옆으로 뻗은 가지에서 아래로 자랍니다.
- 저장근: 당근, 비트 등 식품이나 물의 저장을 위해 변형된 뿌리.그들은 약간의 탭뿌리와 덩이뿌리를 포함합니다.
- 구조적 뿌리: 목본식물과 나무에 기계적 지지를 제공하고 상당한 2차 비후를 거친 큰 뿌리.
- 표층근: 토양 표면 바로 아래에서 증식하는 뿌리로, 물과 쉽게 구할 수 있는 영양분을 이용합니다.토양의 표면 층에서 조건이 최적에 가까운 경우, 표면 뿌리의 성장이 장려되고 일반적으로 지배적인 뿌리가 됩니다.
- 덩이뿌리: 고구마와 같이 음식이나 물을 저장하기 위한 살이 많고 넓어진 옆뿌리.taproot과 구분되는 저장소 루트 유형입니다.
- 광합성 뿌리 : 녹색이고 광합성을 하여 식물에 설탕을 제공하는 뿌리.그것들은 필로클레이드와 비슷합니다.덴드로필락스(Dendropylax)와 태니오필룸(Taeniophylum)과 같은 몇몇 난초에는 이런 것들이 있습니다.
- 뿌리 결절: 질소 고정 토양 박테리아를 보유한 뿌리.이것들은 종종 매우 짧고 둥글습니다.뿌리 결절은 거의 모든 콩류에서 발견됩니다.
- 코랄로이드 뿌리: 뿌리 결절과 유사하게, 이것들은 식물에 질소를 제공합니다.그것들은 종종 결절보다 크고, 분지형이며, 토양 표면 또는 근처에 위치하고, 질소 고정형 시아노박테리아를 보유합니다.그들은 사이카드에서만 발견됩니다.
깊이

토양 내에서 혈관 식물 뿌리의 분포는 식물 형태, 물과 영양분의 공간적, 시간적 가용성, 토양의 물리적 특성에 따라 달라집니다.가장 깊은 뿌리는 일반적으로 사막과 온대 침엽수림에서 발견되며, 가장 얕은 곳은 툰드라, 북방림, 온대 초원입니다.미국 애리조나주 노천 광산 발굴 과정에서 지표면에서 최소 60m 아래에서 가장 깊게 관찰된 살아있는 뿌리가 관찰됐습니다. 어떤 뿌리는 나무 높이만큼 깊게 자랄 수 있습니다.그러나 대부분의 식물에 있는 대부분의 뿌리는 영양분의 이용가능성과 공기호흡이 성장에 더 유리한 표면에 비교적 가까이 있는 것으로 발견됩니다.뿌리 깊이는 지표면 아래에 가까운 암석이나 압축된 토양이나 혐기성 토양 조건에 의해 물리적으로 제한될 수 있습니다.
기록.

| 종. | 위치 | 최대뿌리깊이(m) | 참고문헌[33][34] |
|---|---|---|---|
| 보시아알빗룬카 | 칼라하리 사막 | 68 | 제닝스 (1974) |
| 주니페루스속 | 콜로라도 고원 | 61 | 캐넌 (1960) |
| 유칼립투스 sp. | 오스트레일리아 숲 | 61 | 제닝스 (1971) |
| 아카시아에리올로바 | 칼라하리 사막 | 60 | 제닝스 (1974) |
| 줄리플로라속(Prosopis juliflora) | 애리조나 사막 | 53.3 | 필립스 (1963) |
진화사
뿌리의 화석 기록은 약 4억 3천만 년 전인 실루리아 후기까지 거슬러 올라갑니다.[35]뿌리의 깁스와 틀은 동물의 굴과 생김새가 매우 비슷하기 때문에 그들을 식별하는 것은 어렵습니다.그들은 다양한 특징을 이용해 구별할 수 있습니다.[36]뿌리의 진화적 발달은 원시적인 혈관 식물을 고정시킨 얕은 뿌리줄기(변형된 수평 줄기)의 수정과 식물을 고정시키고 토양에서 식물로 물을 공급하는 필라멘트 아웃 성장(리조이드라고 불리는)의 발달에서 발생했을 가능성이 있습니다.[37]
환경 상호작용

빛은 뿌리에 어느 정도 영향을 미치는 것으로 나타났지만, 빛이 다른 식물계에 미치는 영향만큼 연구되지는 않았습니다.1930년대의 초기 연구는 빛이 모험적인 뿌리 개시에 대한 인돌-3-아세트산의 효과를 감소시킨다는 것을 발견했습니다.1950년대 완두콩에 대한 연구는 빛에 의해 측근 형성이 억제되었다는 것을 보여주고, 1960년대 초 연구자들은 빛이 어떤 상황에서 긍정적인 중력 반응을 유도할 수 있다는 것을 발견했습니다.빛이 뿌리 신장에 미치는 영향은 외떡잎식물과 쌍떡잎식물을 대상으로 연구되어 왔으며, 대부분의 연구에서 빛이 펄스든 연속적이든 뿌리 신장을 억제한다는 것을 발견했습니다.1990년대 Arabidopsis에 대한 연구는 phyB에 의해 감지된 빛에서 음성 광유전증과 뿌리털의 신장 억제를 나타냈습니다.[38]
파바과(Fabaceae)와 같은 어떤 식물들은 뿌리 결절을 형성하는데, 이는 근막증(rhizobia)이라고 불리는 질소 고정 박테리아와 공생 관계를 형성합니다.대기에서 질소를 고치기 위해 필요한 높은 에너지 때문에, 박테리아는 그 과정에 연료를 공급하기 위해 그 공장으로부터 탄소 화합물을 가져갑니다.대신에, 그 식물은 박테리아에 의해 암모니아로부터 생성된 질소 화합물을 가져갑니다.[39]
토양 온도는 뿌리 시작과 길이에 영향을 미치는 요인입니다.루트 길이는 일반적으로 전체 질량보다 온도에 의해 더 큰 영향을 받으며, 저온은 하부 토양 수준의 저온 온도에 의해 아래로 확장이 제한되기 때문에 더 많은 측면 성장을 유발하는 경향이 있습니다.식물 종에 따라 필요한 것은 다르지만, 온대 지역에서는 서늘한 온도가 뿌리 시스템을 제한할 수 있습니다.귀리, 유채씨, 호밀, 밀과 같은 시원한 온도의 종들은 옥수수와 면화와 같은 여름의 한해살이보다 더 낮은 온도에서 더 좋습니다.연구원들은 목화와 같은 식물들이 더 시원한 온도에서 더 넓고 더 짧은 탭뿌리를 발달시킨다는 것을 발견했습니다.씨앗에서 기원한 첫 번째 뿌리는 일반적으로 뿌리 가지보다 직경이 넓으므로, 온도가 뿌리 시작을 증가시키면 뿌리 직경이 더 작아질 것으로 예상됩니다.루트가 늘어나면 루트 직경도 줄어듭니다.[40]
발전소 상호작용
식물들은 뿌리 체계를 통해 환경 속에서 서로 교류할 수 있습니다.연구에 따르면 식물과 식물의 상호작용은 토양을 매개로 뿌리 시스템 사이에서 발생합니다.연구원들은 주변 환경에서 자라는 식물들이 가뭄 상태에 노출될 경우 행동이 달라질지 실험했습니다.[41]인근 식물들은 기공에 변화가 없었기 때문에 연구원들은 가뭄 신호가 공기가 아닌 뿌리와 토양을 통해 휘발성 화학 신호로 확산된 것으로 보고 있습니다.[42]
토양 상호작용
토양 미생물은 질병과 유익한 뿌리 공생을 억제할 수 있습니다. (균질 균류는 무균 토양에서 더 쉽게 발견됩니다.)토양 박테리아를 접종하면 마디 내 연장, 수확량을 증가시키고 개화를 빠르게 할 수 있습니다.뿌리를 따라 박테리아가 이동하는 것은 자연 토양 조건에 따라 다릅니다.예를 들어, 연구는 아조토박터를 접종한 밀 종자의 뿌리 체계가 아조토박터 성장에 유리한 토양에서 더 높은 개체수를 나타냈다는 것을 발견했습니다.몇몇 연구들은 선행적인 멸균 없이 자연 토양의 특정한 미생물의 수치를 증가시키는데 성공하지 못했습니다.[43]
풀뿌리 시스템은 토양을 서로 붙여서 토양 침식을 줄이는 데 도움이 됩니다.야생에서 자생하는 여러해살이풀은 유익한 균류, 원생동물, 박테리아, 곤충, 벌레의 공격으로 오래된 뿌리가 썩을 때 토양에 유기물을 기여합니다.[4]
과학자들은 3주 된 뿌리 부분의 약 10%에서 뿌리의 미생물 덮개의 상당한 다양성을 관찰했습니다.어린 뿌리에서는 보장률이 낮았지만, 생후 3개월 된 뿌리에서도 보장률은 37% 정도에 불과했습니다.1970년대 이전에, 과학자들은 대부분의 뿌리 표면이 미생물에 의해 덮여있다고 믿었습니다.[4]
영양흡수
옥수수 묘목을 연구하는 연구자들은 칼슘 흡수가 가장 많은 것을 발견했고, 칼슘 흡수가 가장 많은 것은 뿌리의 아래 부분에 칼륨이 있다는 것을 발견했습니다.다른 뿌리 분절들과 마찬가지로 흡수도 유사했습니다.흡수된 칼륨은 뿌리 끝으로 운반되고, 뿌리의 다른 부분은 덜한 정도로 운반되고, 그 다음에는 새싹과 곡물로 운반됩니다.칼슘은 주로 위쪽으로 운반되어 줄기와 슛에서 축적됩니다.[44]
연구자들은 K 또는 P의 부분적인 결핍이 브라시카나푸스 L. 식물의 포스파티딜 콜린의 지방산 구성을 바꾸지 않았다는 것을 발견했습니다.반면 칼슘 결핍은 식물막의 완전성에 부정적인 영향을 미칠 것으로 예상되는 다불포화 화합물의 현저한 감소로 이어졌으며, 이는 투과성과 같은 특성에 영향을 미칠 수 있으며, 뿌리막의 이온 흡수 활성에 필요합니다.[45]
경제적 중요성

뿌리 작물이라는 용어는 먹을 수 있는 지하 식물 구조물을 가리키지만, 많은 뿌리 작물들은 실제로 감자 튜버와 같은 줄기입니다.먹을 수 있는 뿌리로는 카사바, 고구마, 비트, 당근, 루타바가, 순무, 파스닙, 무, 참마, 고추냉이 등이 있습니다.뿌리에서 얻은 향신료로는 사사프라, 당귀, 사사파리야, 감초 등이 있습니다.
사탕무는 설탕의 중요한 공급원입니다.참마뿌리는 피임약에 사용되는 에스트로겐 화합물의 공급원입니다.물고기 독과 살충제 로테논은 Lonchocarpus spp의 뿌리에서 얻어집니다.뿌리에서 나오는 중요한 약은 인삼, 아코나이트, 이펙, 젠티안 그리고 레세르핀입니다.질소를 고정하는 뿌리 결절을 가진 여러 콩류가 녹색 거름 작물로 사용되는데, 이것은 밑에 갈 때 다른 작물에 질소 비료를 제공합니다.무릎이라고 불리는 특수한 대머리 편백나무 뿌리는 기념품으로 팔리고, 등잔대는 민속 예술에 조각됩니다.미국 원주민들은 하얀 가문비나무의 유연한 뿌리를 바구니에 사용했습니다.
나무 뿌리는 콘크리트 보도를 짓누르고 파괴할 수 있으며 매설된 파이프를 부수거나 막힐 수 있습니다.[46]목이 졸린 무화과의 공중 뿌리가 중앙 아메리카의 고대 마야 사원들과 캄보디아의 앙코르 와트 사원을 손상시켰습니다.
나무는 산사태가 일어나기 쉬운 비탈길의 토양을 안정시킵니다.뿌리털은 흙 위에서 닻의 역할을 합니다.
절단을 통한 식물의 식물 번식은 모험적인 뿌리 형성에 달려 있습니다.국화, 포인세티아, 카네이션, 관상용 관목 및 많은 가재 식물을 포함한 수 억 개의 식물이 매년 절단을 통해 번식합니다.
또한 뿌리는 토양 침식을 줄이기 위해 토양을 보유함으로써 환경을 보호할 수 있습니다.이것은 모래 언덕과 같은 지역에서 특히 중요합니다.

참고 항목
- 물의 흡수
- 편백나무무릎
- 가뭄해갈
- 섬유근계
- 균사 – 균사체의 균사체에서 뻗어나가는 개별 균사체가 숙주 식물의 뿌리를 식민지화하는 뿌리 공생.
- 근관망
- 식물생리학
- 근권 – 뿌리 분비물과 미생물이 존재하는 뿌리 주변 토양의 영역
- 근절단
- 뿌리가루
- 스톨론
- 타나다 효과
- 탭루트
참고문헌
- ^ Harley Macdonald & Donovan Stevens (3 September 2019). Biotechnology and Plant Biology. EDTECH. pp. 141–. ISBN 978-1-83947-180-3.
- ^ "Plant parts=Roots". University of Illinois Extension.
- ^ Yaacov Okon (24 November 1993). Azospirillum/Plant Associations. CRC Press. pp. 77–. ISBN 978-0-8493-4925-6.
- ^ a b c "Backyard Gardener: Understanding Plant Roots". University of Arizona Cooperative Extension.
- ^ Gangulee HC, Das KS, Datta CT, Sen S. College Botany. Vol. 1. Kolkata: New Central Book Agency.
- ^ Dutta AC, Dutta TC. BOTANY For Degree Students (6th ed.). Oxford University Press.
- ^ Sheldrake, Merlin (2020). Entangled Life. Bodley Head. p. 148. ISBN 978-1847925206.
- ^ Malamy JE (2005). "Intrinsic and environmental response pathways that regulate root system architecture". Plant, Cell & Environment. 28 (1): 67–77. doi:10.1111/j.1365-3040.2005.01306.x. PMID 16021787.
- ^ a b Caldwell MM, Dawson TE, Richards JH (January 1998). "Hydraulic lift: consequences of water efflux from the roots of plants". Oecologia. 113 (2): 151–161. Bibcode:1998Oecol.113..151C. doi:10.1007/s004420050363. PMID 28308192. S2CID 24181646.
- ^ Fitter AH (1991). "The ecological significance of root system architecture: an economic approach". In Atkinson D (ed.). Plant Root Growth: An Ecological Perspective. Blackwell. pp. 229–243.
- ^ Malamy JE, Ryan KS (November 2001). "Environmental regulation of lateral root initiation in Arabidopsis". Plant Physiology. 127 (3): 899–909. doi:10.1104/pp.010406. PMC 129261. PMID 11706172.
- ^ Russell PJ, Hertz PE, McMillan B (2013). Biology: The Dynamic Science. Cengage Learning. p. 750. ISBN 978-1-285-41534-5. Archived from the original on 2018-01-21. Retrieved 2017-04-24.
- ^ "Suberin – an overview ScienceDirect Topics". www.sciencedirect.com. Retrieved 2021-08-31.
- ^ "Suberin Form & Function – Mark Bernards – Western University". www.uwo.ca. Retrieved 2021-08-31.
- ^ a b Watanabe, Kohtaro; Nishiuchi, Shunsaku; Kulichikhin, Konstantin; Nakazono, Mikio (2013). "Does suberin accumulation in plant roots contribute to waterlogging tolerance?". Frontiers in Plant Science. 4: 178. doi:10.3389/fpls.2013.00178. ISSN 1664-462X. PMC 3683634. PMID 23785371.
- ^ van den Driessche, R. (1974-07-01). "Prediction of mineral nutrient status of trees by foliar analysis". The Botanical Review. 40 (3): 347–394. doi:10.1007/BF02860066. ISSN 1874-9372. S2CID 29919924 – via Springer.
- ^ Nakagawa Y, Katagiri T, Shinozaki K, Qi Z, Tatsumi H, Furuichi T, et al. (February 2007). "Arabidopsis plasma membrane protein crucial for Ca2+ influx and touch sensing in roots". Proceedings of the National Academy of Sciences of the United States of America. 104 (9): 3639–44. Bibcode:2007PNAS..104.3639N. doi:10.1073/pnas.0607703104. PMC 1802001. PMID 17360695.
- ^ UV-B light sensing mechanism discovered in plant roots, San Francisco State University, December 8, 2008
- ^ Marchant A, Kargul J, May ST, Muller P, Delbarre A, Perrot-Rechenmann C, Bennett MJ (April 1999). "AUX1 regulates root gravitropism in Arabidopsis by facilitating auxin uptake within root apical tissues". The EMBO Journal. 18 (8): 2066–73. doi:10.1093/emboj/18.8.2066. PMC 1171291. PMID 10205161.
- ^ Hodge A (June 2009). "Root decisions". Plant, Cell & Environment. 32 (6): 628–40. doi:10.1111/j.1365-3040.2008.01891.x. PMID 18811732.
- ^ Carminati A, Vetterlein D, Weller U, Vogel H, Oswald SE (2009). "When roots lose contact". Vadose Zone Journal. 8 (3): 805–809. doi:10.2136/vzj2008.0147. S2CID 128600212.
- ^ Chen R, Rosen E, Masson PH (June 1999). "Gravitropism in higher plants". Plant Physiology. 120 (2): 343–50. doi:10.1104/pp.120.2.343. PMC 1539215. PMID 11541950.
- ^ Fusi, Riccardo; Rosignoli, Serena; Lou, Haoyu; Sangiorgi, Giuseppe; Bovina, Riccardo; Pattem, Jacob K.; Borkar, Aditi N.; Lombardi, Marco; Forestan, Cristian; Milner, Sara G.; Davis, Jayne L.; Lale, Aneesh; Kirschner, Gwendolyn K.; Swarup, Ranjan; Tassinari, Alberto; Pandey, Bipin K.; York, Larry M.; Atkinson, Brian S.; Sturrock, Craig J.; Mooney, Sacha J.; Hochholdinger, Frank; Tucker, Matthew R.; Himmelbach, Axel; Stein, Nils; Mascher, Martin; Nagel, Kerstin A.; De Gara, Laura; Simmonds, James; Uauy, Cristobal; Tuberosa, Roberto; Lynch, Jonathan P.; Yakubov, Gleb E.; Bennett, Malcolm J.; Bhosale, Rahul; Salvi, Silvio (2 August 2022). "Root angle is controlled by EGT1 in cereal crops employing an antigravitropic mechanism". Proceedings of the National Academy of Sciences. 119 (31): e2201350119. Bibcode:2022PNAS..11901350F. doi:10.1073/pnas.2201350119. PMC 9351459. PMID 35881796. S2CID 251104211.
- ^ Pandey, Bipin K.; Huang, Guoqiang; Bhosale, Rahul; Hartman, Sjon; Sturrock, Craig J.; Jose, Lottie; Martin, Olivier C.; Karady, Michal; Voesenek, Laurentius A. C. J.; Ljung, Karin; Lynch, Jonathan P. (2021-01-15). "Plant roots sense soil compaction through restricted ethylene diffusion". Science. 371 (6526): 276–280. Bibcode:2021Sci...371..276P. doi:10.1126/science.abf3013. ISSN 0036-8075. PMID 33446554. S2CID 231606782.
- ^ a b c d e Salisbury FJ, Hall A, Grierson CS, Halliday KJ (May 2007). "Phytochrome coordinates Arabidopsis shoot and root development". The Plant Journal. 50 (3): 429–38. doi:10.1111/j.1365-313x.2007.03059.x. PMID 17419844.
- ^ a b c d e van Gelderen K, Kang C, Paalman R, Keuskamp D, Hayes S, Pierik R (January 2018). "Far-Red Light Detection in the Shoot Regulates Lateral Root Development through the HY5 Transcription Factor". The Plant Cell. 30 (1): 101–116. doi:10.1105/tpc.17.00771. PMC 5810572. PMID 29321188.
- ^ Ayi, Qiaoli; Zeng, Bo; Liu, Jianhui; Li, Siqi; van Bodegom, Peter M.; Cornelissen, Johannes H. C. (October 2016). "Oxygen absorption by adventitious roots promotes the survival of completely submerged terrestrial plants". Annals of Botany. 118 (4): 675–683. doi:10.1093/aob/mcw051. PMC 5055620. PMID 27063366.
- ^ Lin, Chen; Ogorek, Lucas León Peralta; Liu, Dan; Pedersen, Ole; Sauter, Margret (11 January 2023). "A quantitative trait locus conferring flood tolerance to deepwater rice regulates the formation of two distinct types of aquatic adventitious roots". New Phytologist. 238 (4): 1403–1419. doi:10.1111/nph.18678. PMID 36519256. S2CID 254769152.
- ^ Maric, Aida; Hartman, Sjon (11 March 2023). "The leaf sheath promotes prolonged flooding protection by giving rise to specialized adventitious roots". New Phytologist. 238 (4): 1337–1339. doi:10.1111/nph.18824. PMID 36905344. S2CID 257438007.
- ^ a b Nowak EJ, Martin CE (1997). "Physiological and anatomical responses to water deficits in the CAM epiphyte Tillandsia ionantha (Bromeliaceae)". International Journal of Plant Sciences. 158 (6): 818–826. doi:10.1086/297495. hdl:1808/9858. JSTOR 2475361. S2CID 85888916.
- ^ Nadkarni NM (November 1981). "Canopy roots: convergent evolution in rainforest nutrient cycles". Science. 214 (4524): 1023–4. Bibcode:1981Sci...214.1023N. doi:10.1126/science.214.4524.1023. PMID 17808667. S2CID 778003.
- ^ Pütz N (2002). "Contractile roots". In Waisel Y., Eshel A., Kafkafi U. (eds.). Plant roots: The hidden half (3rd ed.). New York: Marcel Dekker. pp. 975–987.
- ^ Canadell J, Jackson RB, Ehleringer JB, Mooney HA, Sala OE, Schulze ED (December 1996). "Maximum rooting depth of vegetation types at the global scale". Oecologia. 108 (4): 583–595. Bibcode:1996Oecol.108..583C. doi:10.1007/BF00329030. PMID 28307789. S2CID 2092130.
- ^ Stonea EL, Kaliszb PJ (1 December 1991). "On the maximum extent of tree roots". Forest Ecology and Management. 46 (1–2): 59–102. doi:10.1016/0378-1127(91)90245-Q.
- ^ Retallack GJ (1986). "The fossil record of soils" (PDF). In Wright VP (ed.). Paleosols: their Recognition and Interpretation. Oxford: Blackwell. pp. 1–57. Archived (PDF) from the original on 2017-01-07.
- ^ Hillier R, Edwards D, Morrissey LB (2008). "Sedimentological evidence for rooting structures in the Early Devonian Anglo–Welsh Basin (UK), with speculation on their producers". Palaeogeography, Palaeoclimatology, Palaeoecology. 270 (3–4): 366–380. Bibcode:2008PPP...270..366H. doi:10.1016/j.palaeo.2008.01.038.
- ^ Amram Eshel; Tom Beeckman (17 April 2013). Plant Roots: The Hidden Half, Fourth Edition. CRC Press. pp. 1–. ISBN 978-1-4398-4649-0.
- ^ Kurata, Tetsuya (1997). "Light-stimulated root elongation in Arabidopsis thaliana". Journal of Plant Physiology. 151 (3): 345–351. doi:10.1016/S0176-1617(97)80263-5. hdl:2115/44841.
- ^ Postgate, J. (1998). Nitrogen Fixation (3rd ed.). Cambridge, UK: Cambridge University Press.
- ^ Lal, Rattan (2006). Encyclopedia of Soil Science. CRC Press. ISBN 978-0-8493-5054-2.
- ^ Chamovitz, Daniel. (21 November 2017). What a plant knows : a field guide to the senses. ISBN 9780374537128. OCLC 1041421612.
- ^ Falik O, Mordoch Y, Ben-Natan D, Vanunu M, Goldstein O, Novoplansky A (July 2012). "Plant responsiveness to root-root communication of stress cues". Annals of Botany. 110 (2): 271–80. doi:10.1093/aob/mcs045. PMC 3394639. PMID 22408186.
- ^ Bowen GD, Rovira AD (1976). "Microbial Colonization of Plant Roots". Annu. Rev. Phytopathol. 14: 121–144. doi:10.1146/annurev.py.14.090176.001005.
- ^ Plant Roots and their Environment. Elsevier. 1988. p. 17.
- ^ Plant Roots and their Environment. Elsevier. 1988. p. 25.
- ^ Zahniser, David (2008-02-21). "City to pass the bucks on sidewalks?". The Los Angeles Times. Retrieved 2023-03-30.
추가열람
- Baldocchi DD, Xu L (October 2007). "What limits evaporation from Mediterranean oak woodlands–The supply of moisture in the soil, physiological control by plants or the demand by the atmosphere?". Advances in Water Resources. 30 (10): 2113–22. Bibcode:2007AdWR...30.2113B. doi:10.1016/j.advwatres.2006.06.013.
- Brundrett, M. C. (2002). "Coevolution of roots and mycorrhizas of land plants". New Phytologist. 154 (2): 275–304. doi:10.1046/j.1469-8137.2002.00397.x. PMID 33873429.
- Clark L (2004). "Primary Root Structure and Development – lecture notes" (PDF). Archived from the original (PDF) on 3 January 2006.
- Coutts MP (1987). "Developmental processes in tree root systems". Canadian Journal of Forest Research. 17 (8): 761–767. doi:10.1139/x87-122.
- Raven JA, Edwards D (2001). "Roots: evolutionary origins and biogeochemical significance". Journal of Experimental Botany. 52 (Suppl 1): 381–401. doi:10.1093/jxb/52.suppl_1.381. PMID 11326045.
- Schenk HJ, Jackson RB (2002). "The global biogeography of roots". Ecological Monographs. 72 (3): 311–328. doi:10.2307/3100092. JSTOR 3100092.
- Sutton RF, Tinus RW (1983). "Root and root system terminology". Forest Science Monograph. 24: 137.
- Phillips WS (1963). "Depth of roots in soil". Ecology. 44 (2): 424. doi:10.2307/1932198. JSTOR 1932198.
- Caldwell MM, Dawson TE, Richards JH (1998). "Hydraulic lift: consequences of water efflux from the roots of plants". Oecologia. 113 (2): 151–161. Bibcode:1998Oecol.113..151C. doi:10.1007/s004420050363. PMID 28308192. S2CID 24181646.


