발달생물학
Developmental biology| 시리즈의 일부 |
| 생물학 |
|---|
발달생물학은 동물과 식물이 성장하고 발달하는 과정을 연구하는 학문이다.발달 생물학은 또한 재생, 무성 생식, 변성, 그리고 성체 유기체의 줄기세포의 성장과 분화의 생물학을 포함한다.
전망
동물의 배아 발달과 관련된 주요 과정은 조직 패턴화(지역별 특성 및 패턴화된 세포 분화를 통한), 조직 성장, 조직 형태 형성이다.
- 지역 사양은 초기에 유사한 셀의 볼 또는 시트에 공간 패턴을 생성하는 프로세스를 말합니다.이것은 일반적으로 수정란의 일부에 위치한 세포질 결정인자와 배아의 신호 중심에서 방출되는 유도 신호의 작용을 포함한다.지역특성의 초기단계는 기능적으로 분화된 세포를 생성하는 것이 아니라 특정 영역 또는 유기체의 일부에 발달시키기 위해 헌신하는 세포집단을 생성한다.이것들은, 전사인자의 특정의 편성의 표현에 의해서 정의됩니다.
- 세포 분화는 특히 신경, 근육, 분비 상피 등과 같은 기능성 세포 유형의 형성과 관련이 있다.분화된 세포는 세포 기능과 관련된 많은 양의 특정 단백질을 포함한다.
- 형태 형성은 3차원 형성과 관련이 있다.그것은 주로 세포 시트와 개별 세포의 조직화된 움직임을 포함한다.형태 형성은 초기 배아(외배엽, 중배엽, 내배엽)의 세 가지 배아층을 만들고 장기 발달 중에 복잡한 구조를 구축하는 데 중요하다.
- 조직의 성장은 조직 크기의 전반적인 증가와 형태 형성에 기여하는 부분의 차이적 성장을 모두 포함한다.성장은 대부분 세포 증식을 통해 이루어지지만 세포 크기의 변화나 세포 외 물질의 퇴적을 통해서도 일어난다.
식물의 발달은 동물과 비슷한 과정을 수반한다.그러나 식물 세포는 대부분 움직일 수 없기 때문에 세포 이동 없이 차등 성장에 의해 형태 형성이 이루어집니다.또한 유도 신호와 관련된 유전자는 동물의 발육을 조절하는 유전자와는 다르다.
개발 프로세스
세포 분화
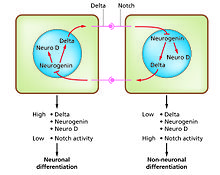
세포 분화는 발달 과정에서 서로 다른 종류의 기능성 세포가 발생하는 과정이다.예를 들어, 뉴런, 근육 섬유 및 간세포(간세포)는 잘 알려진 분화 세포 유형이다.분화된 세포는 보통 그들의 특정한 기능에 필요한 많은 양의 단백질을 생산하고 이것은 그들에게 빛 현미경으로 그들이 인식될 수 있게 하는 특징적인 외관을 준다.이 단백질을 코드하는 유전자들은 매우 활동적이다.전형적으로 그들의 염색질 구조는 매우 개방적이고, 전사 효소에 대한 접근을 허용하며, 특정 전사 인자는 유전자 [1][2]발현을 활성화하기 위해 DNA의 조절 배열에 결합합니다.예를 들어, NeuroD는 신경 분화를 위한 핵심 전사 인자, 근육 분화를 위한 미오제닌, 간세포 분화를 위한 HNF4이다.세포 분화는 일반적으로 눈에 띄게 분화되지 않은 몇 가지 헌신 상태에 선행하는 발전의 마지막 단계이다.단일 유형의 전구 세포 또는 줄기세포로 구성된 단일 조직은 종종 여러 개의 분화된 세포 유형으로 구성됩니다.이들의 형성을 제어하는 것은 노치 신호 [4]경로의 특성에 기초한 가로 방향 [3]억제 과정을 포함한다.예를 들어 배아의 신경판에서 이 시스템은 NeuroD가 고도로 발현되는 신경 전구 세포 집단을 생성하기 위해 작동한다.
재생
재생은 누락된 [5]부품을 재생하는 능력을 나타냅니다.이것은 지속적인 성장을 보이는 식물과 하이드로이드나 고시디언과 같은 군체 동물들 사이에서 매우 흔하다.그러나 발달생물학자들의 가장 큰 관심은 자유로운 동물의 부분 재생에 있다.특히 네 가지 모델이 많은 조사 대상이 되어 왔습니다.이들 중 두 가지는 전신을 재생하는 능력을 가지고 있다.작은 [6]조각에서 용종의 모든 부분을 재생시킬 수 있는 히드라, 그리고 보통 머리와 [7]꼬리를 재생시킬 수 있는 플라나리아 벌레.이 두 예 모두 줄기세포에 의해 공급되는 연속적인 세포 교체를 가지고 있으며, 적어도 플라나리아에서는 줄기세포 중 적어도 일부가 [8]만능인 것으로 나타났다.다른 두 모델은 부속물의 원위부 재생만 보여줍니다.이것은 곤충 부속물로,[9] 보통 귀뚜라미와 같은 반악성 곤충의 다리, 그리고 요로델 양서류의 [10]다리입니다.현재 양서류의 사지 재생에 대한 상당한 정보가 제공되고 있으며 연골, 진피 및 힘줄 사이에 상당한 상호 변환이 있는 결합 조직을 제외하고 각 세포 유형은 스스로 재생되는 것으로 알려져 있습니다.구조 패턴에 관해서는 배아에서 활성화된 신호의 재활성화에 의해 제어된다.재생이 "프리스티나"인지 "적응적"[11]인지에 대한 오래된 질문에 대해서는 여전히 논란이 있다.만약 전자라면, 지식이 향상되면, 인간의 재생 능력을 향상시킬 수 있을 것이라고 기대할 수 있다.후자의 경우, 재생의 각 사례는 그 종에 특정한 상황에서 자연선택에 의해 발생한 것으로 추정되므로 일반적인 규칙은 기대되지 않는다.
동물의 배아 발달
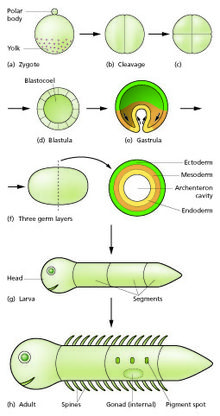
수정 과정에서 정자와 난자가 융합되어 수정란, 즉 접합자가 [12]형성된다.이것은 블래슐라 또는 배반포라고 불리는 비슷한 세포들의 공이나 판을 형성하기 위한 분열의 기간을 거친다.이러한 세포 분열은 보통 성장하지 않고 빠르게 이루어지기 때문에 딸 세포는 모세포의 절반 크기이고 전체 배아는 거의 같은 크기를 유지합니다.그들은 분열 분열이라고 불린다.
생쥐의 에피블라스트 원시 생식 세포(그림: "인간 배아 발생의 초기 단계" 참조)는 광범위한 후생유전 재프로그래밍을 [13]거친다.이 과정은 게놈 전체의 DNA 탈메틸화, 염색질 재구성 및 전능성으로 [13]이어지는 후생유전학적 각인 소거를 포함한다.DNA염기절제복원경로를이용하는공정에의해DNA탈메틸화를실행한다.[14]
형태유전학적 움직임은 세포 덩어리를 외배엽, 중배엽, 내배엽이라고 불리는 다세포 시트로 구성된 3층 구조로 변환합니다.이 시트들은 세균층으로 알려져 있다.이것은 위배작용의 과정이다.분할 및 위조절 중에 첫 번째 지역 사양 이벤트가 발생한다.3개의 배아층 자체의 형성 외에도, 이들은 종종 포유류의 태반과 같은 배아외 구조를 생성하며,[15] 배아의 지지와 영양을 위해 필요하며, 또한 앞뒤 축(머리, 몸통 [16]및 꼬리)을 따라 확약 차이를 확립한다.
접합자의 한 부분에 세포질 결정 인자가 존재함에 따라 국소 특정이 개시된다.결정 인자를 포함하는 셀은 신호 중심이 되어 유도 인자를 방출합니다.유도 인자는 한 곳에서 생성되어 확산 및 부패하기 때문에 소스 셀 부근에서 높고 멀리 [17][18]떨어진 곳에서 낮은 농도 구배를 형성한다.결정 인자를 포함하지 않는 배아의 나머지 세포들은 특정한 발달 제어 유전자를 상향 조절함으로써 다른 농도에 반응할 수 있다.그 결과 일련의 존이 설정되고 시그널링 센터로부터 점점 더 먼 거리에 배치됩니다.각 구역에서 발달 제어 유전자의 다른 조합은 상향 [19]조절된다.이 유전자들은 각 지역에서 유전자 활동의 새로운 조합을 상향 조정하는 전사인자를 암호화한다.다른 기능 중에서도 이들 전사 인자는 활성 세포에서 특정 접착제 및 운동성을 부여하는 유전자의 발현을 제어한다.이러한 다른 형태 형성 특성 때문에, 각 배아층의 세포는 시트를 형성하기 위해 이동하며, 외배엽은 바깥, 중배엽은 중간, 내배엽은 [20][21]안쪽이 된다.형태 발생학적 움직임은 배아의 형태와 구조를 바꿀 뿐만 아니라 세포 시트를 새로운 공간적 관계로 가져옴으로써 그들 사이의 신호 전달과 반응의 새로운 단계를 가능하게 합니다.
배아의 성장은 대부분 [22]자율적이다.세포의 각 영역에 대해 성장률은 활성 유전자의 조합에 의해 제어된다.자유생물의 배아는 외부 식량 공급이 없기 때문에 덩어리가 자라지 않는다.그러나 태반이나 배외 노른자 공급에 의해 공급되는 배아는 매우 빠르게 자랄 수 있으며, 이러한 유기체들 사이의 상대적 성장률에 대한 변화는 최종적인 전체적인 구조를 만드는데 도움을 준다.
전체 프로세스는 시간 내에 조정되어야 하며 어떻게 제어되는지는 이해되지 않습니다.사건의 진행을 제어하는 태아의 모든 부분과 통신할 수 있는 마스터 클럭이 있을 수 있으며, 또는 타이밍은 단순히 사건의 [23]국지적 인과적 순서에 따라 달라질 수 있다.
변성
발달 과정은 변성 과정 동안 매우 명백하다.이것은 다양한 종류의 동물에서 발생한다.잘 알려진 예는 보통 올챙이로 부화해 성충으로 변하는 개구리와 애벌레로 부화했다가 번데기 단계에서 성충으로 변신하는 곤충에서 볼 수 있다.
위에 열거된 모든 발달 과정은 변성 중에 일어난다.특히 잘 연구된 예로는 개구리 제노푸스의 [24][25]올챙이의 꼬리 손실과 다른 변화, 그리고 파리의 [26][27]성체 부분을 생성하는 상상의 디스크의 생물학 등이 있다.
플랜트 개발
플랜트 개발은 플랜트가 성장함에 따라 구조가 생성되고 성숙되는 과정입니다.그것은 식물 해부학, 식물 생리학 및 식물 형태학에서 연구된다.
식물은 장기의 끝이나 성숙한 조직 사이에 위치한 장기로부터[28] 일생 동안 끊임없이 새로운 조직과 구조를 생산한다.그러므로 살아있는 식물은 항상 배아 조직을 가지고 있다.대조적으로, 동물 배아는 매우 이른 시기에 그들이 평생 가질 수 있는 모든 신체 부위를 생산할 것이다.이 동물이 태어나면(또는 알에서 부화하면) 모든 신체 부위가 있고 그 시점부터 더 크고 더 성숙하게 자라게 됩니다.
플랜트에서 볼 수 있는 조직의 속성은 개별 부품의 합보다 더 큰 긴급 특성입니다."이러한 조직과 기능들이 통합된 다세포 유기체로 결합되면 분리된 부분과 과정의 특징뿐만 아니라 분리된 [29]부분의 검사로는 예측할 수 없었던 꽤 새로운 일련의 특징들이 생겨납니다."
성장
혈관식물은 정자세포에 의한 난세포 수정에 의해 형성된 단세포 접합자에서 시작된다.그 시점부터, 그것은 배아 발생 과정을 통해 식물 배아를 형성하기 위해 분열하기 시작한다.이렇게 되면 결과 셀은 한쪽 끝이 첫 번째 뿌리가 되고 다른 한쪽 끝이 촬영의 끝을 형성하도록 조직화됩니다.종자 식물에서, 배아는 하나 이상의 "종자 잎"을 발달시킬 것입니다.배아 발생이 끝날 때쯤이면 어린 식물은 생명을 시작하는 데 필요한 모든 부분을 갖게 될 것이다.
일단 배아는 씨앗이나 모식물에서 발아하면, 장기 형성의 과정을 통해 추가적인 장기(잎, 줄기, 뿌리)를 생산하기 시작한다.뿌리의 끝에 위치한 뿌리줄기에서 새로운 뿌리가 자라고,[30] 새 줄기와 잎은 새싹줄기에서 자라난다.분지는 분기에 의해 남겨진 세포들의 작은 덩어리들이 새로운 뿌리 또는 새싹의 끝부분으로 자라기 시작할 때 발생한다.뿌리 또는 새싹 끝의 이러한 자낭으로부터의 성장은 일차 성장이라고 불리며, 그 뿌리 또는 새싹의 연장을 초래한다.2차 성장은 뿌리가 넓어지거나 캄비움 [31]내 세포 분열에서 싹이 튼다.
식물은 세포분열에 의한 성장 외에 세포신장을 [32]통해 성장해도 된다.이것은 개별 세포나 세포 그룹이 더 길어질 때 발생합니다.모든 식물 세포가 같은 길이로 자라지는 않을 것이다.줄기 한쪽에 있는 세포가 다른 쪽에 있는 세포보다 더 길고 빠르게 자랄 때, 그 결과 줄기는 더 느리게 성장하는 세포 쪽으로 구부러질 것이다.이러한 방향성 성장은 빛, 중력, 물, 그리고 신체 접촉과 같은 특정한 자극에 대한 식물의 반응을 통해 일어날 수 있습니다.
식물의 성장과 발육은 특정 식물 호르몬과 식물 성장 조절제(PGR)에 의해 매개된다(Ross 등 1983년).[33]내인성 호르몬 수치는 식물의 나이, 냉간 견고성, 휴면 및 기타 대사 조건, 광작동, 가뭄, 온도 및 기타 외부 환경 조건, 외부 PGR의 원천, 예를 들어 외부 적용 및 근원 원인에 의해 영향을 받는다.
형태학적 변이
식물은 그 형태와 구조에서 자연적인 변화를 보인다.모든 유기체는 개인마다 다르지만, 식물은 추가적인 형태의 변화를 보인다.한 개인 내에서 다른 유사한 부품과 형태 및 구조가 다를 수 있는 부품이 반복됩니다.줄기나 꽃과 같은 다른 기관들도 비슷한 변이를 보일 수 있지만, 이 변이는 식물의 잎에서 가장 쉽게 볼 수 있다.이러한 변화에는 위치 효과, 환경 효과, 그리고 젊음의 세 가지 주요 원인이 있습니다.
식물형태학의 진화
전사 인자와 전사 조절 네트워크는 식물 형태 형성 및 그 진화에 중요한 역할을 한다.플랜트 랜딩 중에 많은 새로운 전사 인자 패밀리가 출현하여 다세포 발달,[34] 재생산 및 장기 발달 네트워크에 우선적으로 연결되어 육지 플랜트의 보다 복잡한 형태 형성에 기여하였다.
대부분의 육지 식물들은 공통의 조상인 다세포 조류를 공유한다.식물형태학의 진화의 예는 식물에서 볼 수 있다.연구들은 식물들이 육지 식물과 상동적인 특성을 가지고 있다는 것을 보여주었다.식물 형태학의 진화에 대한 두 가지 주요 이론이 있는데, 이 이론들은 상동 이론과 반대 이론이다.식물 형태학의 진화에 대해 일반적으로 받아들여지는 이론은 반대 이론이다.반대 이론은 감수분열 전에 일어나는 여러 유사분열들이 포자체의 발달을 일으킨다고 말한다.그러면 포자체는 독립된 [35]유기체로 발달할 것이다.
발달 모델 생물
최근 수십 년 동안 발달 생물학 연구의 대부분은 소수의 모델 유기체의 사용에 초점을 맞추고 있다.동물의 왕국에 걸쳐 발달 메커니즘이 많이 보존되어 있는 것으로 밝혀졌다.초기 발달에서 다른 척추동물 종들은 기본적으로 동일한 유도 신호와 지역 정체성을 코드하는 동일한 유전자를 사용한다.심지어 무척추동물들도 형성되는 신체 부위가 현저하게 다르지만 신호와 유전자의 유사한 레퍼토리를 사용한다.모델 유기체는 각각 연구자들 사이에서 인기를 끌 수 있는 몇 가지 특정한 실험적인 이점을 가지고 있다.어떤 의미에서는 동물 왕국 전체의 '모델'이고, 어떤 의미에서는 인간발달의 '모델'이며, 윤리적인 이유와 실제적인 이유 모두에서 직접 연구하기는 어렵다.모델 유기체는 발달 메커니즘의 광범위한 본질을 설명하는데 가장 유용했다.디테일을 추구할수록, 그들은 서로, 그리고 인간과 더 많이 다르다.
식물
척추동물
- 개구리[36]: Xenopus(X. laevis와 X. tropicalis).[37][38]배아의 공급이 좋다.특히 미세수술에 적합합니다.
- 제브라피시: 다니오 레리오.[39]배아의 공급이 좋다.잘 발달된 유전학.
- 닭: 갈매기.[40]초기 단계는 포유류와 비슷하지만 미세수술은 더 쉽습니다.저비용.
- 마우스: 근육.[41]유전학이 발달한 포유동물입니다[36].
무척추동물
- 초파리: 드로소필라 멜라노가스터.[42]배아의 공급이 좋다.잘 발달된 유전학.
- 네마토드:케노하브도염 [43]엘레강스배아의 공급이 좋다.잘 발달된 유전학.저비용.
단세포
다른이들
또한 성게와[44][36] [45]고수가 어떤 목적으로도 인기가 있다.재생에 관한 연구에는 Axolotl Ambystoma meticanum과 같은 우로델 양서류, Schmidtea mediteranea와 [7]같은 플라나리아 벌레가 사용된다.[46]유기체는 또한 효율적인 개발 [47]모델로서 입증되었다.식물 발달은 모델 [48]유기체로서 탈레 크레스 아라비도시스 탈리아나에 초점을 맞추고 있다.
「 」를 참조해 주세요.
레퍼런스
- ^ Li B, Carey M, Workman JL (February 2007). "The role of chromatin during transcription". Cell. 128 (4): 707–19. doi:10.1016/j.cell.2007.01.015. PMID 17320508.
- ^ Heintzman ND, Stuart RK, Hon G, Fu Y, Ching CW, Hawkins RD, et al. (March 2007). "Distinct and predictive chromatin signatures of transcriptional promoters and enhancers in the human genome". Nature Genetics. 39 (3): 311–8. doi:10.1038/ng1966. PMID 17277777. S2CID 1595885.
- ^ Meinhardt H, Gierer A (2000). "Pattern formation by local self-activation and lateral inhibition" (PDF). BioEssays. 22 (8): 753–760. CiteSeerX 10.1.1.477.439. doi:10.1002/1521-1878(200008)22:8<753::aid-bies9>3.0.co;2-z. PMID 10918306. Archived (PDF) from the original on 2017-10-27.
- ^ Sprinzak D, Lakhanpal A, Lebon L, Santat LA, Fontes ME, Anderson GA, et al. (May 2010). "Cis-interactions between Notch and Delta generate mutually exclusive signalling states". Nature. 465 (7294): 86–90. Bibcode:2010Natur.465...86S. doi:10.1038/nature08959. PMC 2886601. PMID 20418862.
- ^ Carlson BM (2007). Principles of Regenerative Biology. Burlington MA: Academic Press.
- ^ Bosch TC (March 2007). "Why polyps regenerate and we don't: towards a cellular and molecular framework for Hydra regeneration". Developmental Biology. 303 (2): 421–33. doi:10.1016/j.ydbio.2006.12.012. PMID 17234176.
- ^ a b Reddien PW, Sánchez Alvarado A (2004). "Fundamentals of planarian regeneration". Annual Review of Cell and Developmental Biology. 20: 725–57. doi:10.1146/annurev.cellbio.20.010403.095114. PMID 15473858. S2CID 1320382.
- ^ Wagner DE, Wang IE, Reddien PW (May 2011). "Clonogenic neoblasts are pluripotent adult stem cells that underlie planarian regeneration". Science. 332 (6031): 811–6. Bibcode:2011Sci...332..811W. doi:10.1126/science.1203983. PMC 3338249. PMID 21566185.
- ^ Nakamura T, Mito T, Bando T, Ohuchi H, Noji S (January 2008). "Dissecting insect leg regeneration through RNA interference". Cellular and Molecular Life Sciences. 65 (1): 64–72. doi:10.1007/s00018-007-7432-0. PMID 18030418.
- ^ Simon A, Tanaka EM (2013). "Limb regeneration". Wiley Interdisciplinary Reviews. Developmental Biology. 2 (2): 291–300. doi:10.1002/wdev.73. PMID 24009038. S2CID 13158705.
- ^ Slack JM (2013). "Chapter 20". Essential Developmental Biology. Oxford: Wiley-Blackwell.
- ^ Jungnickel MK, Sutton KA, Florman HM (August 2003). "In the beginning: lessons from fertilization in mice and worms". Cell. 114 (4): 401–4. doi:10.1016/s0092-8674(03)00648-2. PMID 12941269.
- ^ a b Hackett JA, Sengupta R, Zylicz JJ, Murakami K, Lee C, Down TA, Surani MA (January 2013). "Germline DNA demethylation dynamics and imprint erasure through 5-hydroxymethylcytosine". Science. 339 (6118): 448–52. Bibcode:2013Sci...339..448H. doi:10.1126/science.1229277. PMC 3847602. PMID 23223451.
- ^ Hajkova P, Jeffries SJ, Lee C, Miller N, Jackson SP, Surani MA (July 2010). "Genome-wide reprogramming in the mouse germ line entails the base excision repair pathway". Science. 329 (5987): 78–82. Bibcode:2010Sci...329...78H. doi:10.1126/science.1187945. PMC 3863715. PMID 20595612.
- ^ Steven DH, ed. (1975). Comparative Placentation. London: Academic Press.
- ^ Kimelman D, Martin BL (2012). "Anterior-posterior patterning in early development: three strategies". Wiley Interdisciplinary Reviews. Developmental Biology. 1 (2): 253–66. doi:10.1002/wdev.25. PMC 5560123. PMID 23801439.
- ^ Slack JM (1987). "Morphogenetic gradients - past and present". Trends in Biochemical Sciences. 12: 200–204. doi:10.1016/0968-0004(87)90094-6.
- ^ Rogers KW, Schier AF (2011). "Morphogen gradients: from generation to interpretation". Annual Review of Cell and Developmental Biology. 27: 377–407. doi:10.1146/annurev-cellbio-092910-154148. PMID 21801015. S2CID 21477124.
- ^ Dahmann C, Oates AC, Brand M (January 2011). "Boundary formation and maintenance in tissue development". Nature Reviews. Genetics. 12 (1): 43–55. doi:10.1038/nrg2902. PMID 21164524. S2CID 1805261.
- ^ Hardin J, Walston T (August 2004). "Models of morphogenesis: the mechanisms and mechanics of cell rearrangement". Current Opinion in Genetics & Development. 14 (4): 399–406. doi:10.1016/j.gde.2004.06.008. PMID 15261656.
- ^ Hammerschmidt M, Wedlich D (November 2008). "Regulated adhesion as a driving force of gastrulation movements". Development. 135 (22): 3625–41. doi:10.1242/dev.015701. PMID 18952908.
- ^ O'Farrell PH (2003). "How metazoans reach their full size: the natural history of bigness.". In Hall MN, Raff M, Thomas G (eds.). Cell Growth: Control of Cell Size. Cold Spring Harbor Laboratory Press. pp. 1–21.
- ^ Moss EG, Romer-Seibert J (2014). "Cell-intrinsic timing in animal development". Wiley Interdisciplinary Reviews. Developmental Biology. 3 (5): 365–77. doi:10.1002/wdev.145. PMID 25124757. S2CID 29029979.
- ^ Tata JR (1996). "Amphibian metamorphosis: an exquisite model for hormonal regulation of postembryonic development in vertebrates". Development, Growth and Differentiation. 38 (3): 223–231. doi:10.1046/j.1440-169x.1996.t01-2-00001.x. S2CID 84081060.
- ^ Brown DD, Cai L (June 2007). "Amphibian metamorphosis". Developmental Biology. 306 (1): 20–33. doi:10.1016/j.ydbio.2007.03.021. PMC 1945045. PMID 17449026.
- ^ Cohen SM (1993). "Imaginal Disc Development.". In Bate M, Martinez-Arias M (eds.). The Development of Drosophila melanogaster. Cold Spring Harbor Press.
- ^ Maves L, Schubiger G (October 2003). "Transdetermination in Drosophila imaginal discs: a model for understanding pluripotency and selector gene maintenance". Current Opinion in Genetics & Development. 13 (5): 472–9. doi:10.1016/j.gde.2003.08.006. PMID 14550411.
- ^ Bäurle I, Laux T (October 2003). "Apical meristems: the plant's fountain of youth". Review. BioEssays. 25 (10): 961–70. doi:10.1002/bies.10341. PMID 14505363.
- ^ Leopold AC (1964). Plant Growth and Development. New York: McGraw-Hill. p. 183.
- ^ Brand U, Hobe M, Simon R (February 2001). "Functional domains in plant shoot meristems". Review. BioEssays. 23 (2): 134–41. doi:10.1002/1521-1878(200102)23:2<134::AID-BIES1020>3.0.CO;2-3. PMID 11169586. S2CID 5833219.
- ^ Barlow P (May 2005). "Patterned cell determination in a plant tissue: the secondary phloem of trees". BioEssays. 27 (5): 533–41. doi:10.1002/bies.20214. PMID 15832381.
- ^ Pacifici E, Di Mambro R, Dello Ioio R, Costantino P, Sabatini S (August 2018). "Arabidopsis root". The EMBO Journal. 37 (16). doi:10.15252/embj.201899134. PMC 6092616. PMID 30012836.
- ^ Ross SD, Pharis RP, Binder WD (1983). "Growth regulators and conifers: their physiology and potential uses in forestry.". In Nickell LG (ed.). Plant growth regulating chemicals. Vol. 2. Boca Raton, FL: CRC Press. pp. 35–78.
- ^ Jin J, He K, Tang X, Li Z, Lv L, Zhao Y, et al. (July 2015). "An Arabidopsis Transcriptional Regulatory Map Reveals Distinct Functional and Evolutionary Features of Novel Transcription Factors". Molecular Biology and Evolution. 32 (7): 1767–73. doi:10.1093/molbev/msv058. PMC 4476157. PMID 25750178. Archived from the original on 2016-06-02.
- ^ Pires, Nuno D.; Dolan, Liam (2012-02-19). "Morphological evolution in land plants: new designs with old genes". Philosophical Transactions of the Royal Society B: Biological Sciences. 367 (1588): 508–518. doi:10.1098/rstb.2011.0252. ISSN 0962-8436. PMC 3248709. PMID 22232763.
- ^ a b c d e f Friedman, William E. (1999). "Expression of the cell cycle in sperm of Arabidopsis: implications for understanding patterns of gametogenesis and fertilization in plants and other eukaryotes". Development. The Company of Biologists. 126 (5): 1065–75. doi:10.1242/dev.126.5.1065. ISSN 0950-1991. PMID 9927606. S2CID 13397345.
- ^ Nieuwkoop PD, Faber J (1967). Normal table of Xenopus laevis (Daudin). North-Holland, Amsterdam.
- ^ Harland RM, Grainger RM (December 2011). "Xenopus research: metamorphosed by genetics and genomics". Trends in Genetics. 27 (12): 507–15. doi:10.1016/j.tig.2011.08.003. PMC 3601910. PMID 21963197.
- ^ Lawson ND, Wolfe SA (July 2011). "Forward and reverse genetic approaches for the analysis of vertebrate development in the zebrafish". Developmental Cell. 21 (1): 48–64. doi:10.1016/j.devcel.2011.06.007. PMID 21763608.
- ^ Rashidi H, Sottile V (April 2009). "The chick embryo: hatching a model for contemporary biomedical research". BioEssays. 31 (4): 459–65. doi:10.1002/bies.200800168. PMID 19274658. S2CID 5489431.
- ^ Behringer R, Gertsenstein M, Vintersten K, Nagy M (2014). Manipulating the Mouse Embryo. A Laboratory Manual (Fourth ed.). Cold Spring Harbor, NY: Cold Spring Harbor Laboratory Press.
- ^ St Johnston D (March 2002). "The art and design of genetic screens: Drosophila melanogaster". Nature Reviews. Genetics. 3 (3): 176–88. doi:10.1038/nrg751. PMID 11972155. S2CID 195368351.
- ^ Riddle DL, Blumenthal T, Meyer BJ, Priess JR (1997). C.elegans II. Cold Spring Harbor, NY: Cold Spring Harbor Laboratory Press.
- ^ Ettensohn CA, Sweet HC (2000). "Patterning the early sea urchin embryo". Current Topics in Developmental Biology Volume 50. Curr. Top. Dev. Biol. Current Topics in Developmental Biology. Vol. 50. Academic Press. pp. 1–44. doi:10.1016/S0070-2153(00)50002-7. ISBN 9780121531508. PMID 10948448.
- ^ Lemaire P (June 2011). "Evolutionary crossroads in developmental biology: the tunicates". Development. 138 (11): 2143–52. doi:10.1242/dev.048975. PMID 21558365.
- ^ Nacu E, Tanaka EM (2011). "Limb regeneration: a new development?". Annual Review of Cell and Developmental Biology. 27: 409–40. doi:10.1146/annurev-cellbio-092910-154115. PMID 21801016.
- ^ Ader M, Tanaka EM (December 2014). "Modeling human development in 3D culture". Current Opinion in Cell Biology. 31: 23–8. doi:10.1016/j.ceb.2014.06.013. PMID 25033469.
- ^ Weigel D, Glazebrook J (2002). Arabidopsis. A Laboratory Manual. Cold Spring Harbor, NY: Cold Spring Harbor Laboratory Press.
추가 정보
- Gilbert SF (2013). Developmental Biology. Sunderland, Mass.: Sinauer Associates Inc.
- Slack JM (2013). Essential Developmental Biology. Oxford: Wiley-Blackwell.
- Wolpert L, Tickle C (2011). Principles of Development. Oxford and New York: Oxford University Press.