모성 효과
Maternal effect모성효과는 생물체의 표현형이 자신이 경험하는 환경과 유전자형뿐만 아니라 어미의 환경과 유전자형에 의해서도 결정되는 상황을 말한다.유전학에서, 모성 영향은 유기체가 자신의 유전자형과 상관없이 엄마의 유전자형에서 예상되는 표현형을 보여줄 때 발생하는데, 이는 종종 엄마가 난자에 메신저 RNA나 단백질을 공급하기 때문이다.모성 영향은 유전자형과 무관한 모성 환경에 의해서도 발생할 수 있으며, 때로는 자손의 크기, 성별 또는 행동을 조절하기도 한다.이러한 적응적 모성 효과는 그들의 건강을 증가시키는 표현형으로 이어진다.또한 중요한 진화 개념인 표현형 가소성 개념을 소개한다.모성 영향이 환경 이질성에 대한 적응적 대응의 진화에 중요하다고 제안되었다.
유전학에서
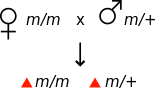
유전학에서 모성 효과는 생물의 표현형이 어미의 [1]유전자형에 의해 결정될 때 발생한다.예를 들어 돌연변이가 모성효과 열성일 경우 돌연변이에 대한 암컷 호모 접합은 표현형 정상으로 보일 수 있지만, 그녀의 자손은 돌연변이 표현형을 나타내며, 비록 돌연변이에 대한 헤테로 접합일지라도 변이 표현형을 나타낸다.
| 모성 효과 | |||
|---|---|---|---|
| 모든 자손은 야생형 표현형을 보여준다. | 모든 자손들이 돌연변이 표현형을 보여 | ||
모성 영향은 엄마가 난모세포에 특정 mRNA 또는 단백질을 공급하기 때문에 종종 발생하며, 따라서 모성 게놈은 분자가 기능하는지 여부를 판단한다.많은 유기체에서 태아가 처음에는 전사적으로 [2]활성화되지 않기 때문에 초기 배아에 대한 mRNA의 모성 공급은 중요하다.모성 효과 돌연변이의 유전 패턴 때문에, 그것들을 식별하기 위해서는 특별한 유전자 검사가 필요하다.일반적으로 어미가 발생하는 [3][4]모성 효과 돌연변이에 대해 잠재적으로 동질성을 가지기 때문에, 이것은 일반적인 ( 접합체) 화면보다 한 세대 늦게 유기체의 표현형을 검사하는 것을 포함한다.
드로소필라 조기배아발생
Drosophila melanogaster 난모세포는 간호사 세포라고 불리는 세포 세트와 밀접하게 연관되어 난실에서 발달합니다.난모세포와 간호사세포는 모두 단일 생식줄기세포에서 유래하지만 세포분열은 불완전하며, 간호사세포와 난모세포의 세포질은 [5]고리관이라고 알려진 구조로 연결되어 있다.오직 난모세포만이 감수분열 과정을 거치고 다음 세대에 DNA를 기여한다.
쌍체, 등체, 구르켄, 오스카를 포함한 [6][7][8]축 결정과 같은 배아 형성의 초기 단계에 영향을 미치는 많은 모성 효과 드로소필라 돌연변이들이 발견되었다.예를 들어, 동종 접합 쌍체 어미에서 나온 배아는 머리와 흉곽 구조를 만들어내지 못한다.
일단 바이코이드 돌연변이에 교란되는 유전자가 확인되면, 바이코이드 mRNA는 간호사 세포에서 전사되고 [9]난모세포로 다시 국재화되는 것으로 나타났다.다른 모성 효과 돌연변이는 간호사 세포에서 비슷하게 생산되어 난모세포 또는 이러한 [10]재국재화에 필요한 수송 기계의 일부에서 작용하는 제품에 영향을 미친다.이들 유전자는 난모세포나 수정배아가 아닌 모체 간호사 세포에서 발현되기 때문에 모체 유전자형이 기능할 수 있는지 여부를 결정한다.
모성 효과[11] 유전자는 산모(수정 전 발현)에 의해 발현되며 난자의 전후 및 배쪽 극성을 발달시킨다.알의 앞쪽 끝은 머리가 되고 뒤쪽 끝은 꼬리가 됩니다.등쪽은 위에, 복쪽은 아래에 있습니다.모성 mRNA라고 불리는 모성 효과 유전자의 산물은 간호사 세포와 모낭 세포에 의해 생성되어 난자 세포에 축적된다.현상 프로세스의 개시시에, mRNA 구배는 전후 및 배측 축을 따라서 난모세포에 형성된다.
30여 개의 모성 유전자가 패턴 형성에 관여하는 것이 확인되었다.특히, 4개의 모성 효과 유전자의 산물은 전후 축 형성에 매우 중요하다.두 모성 효과 유전자인 바이코이드와 꼽추의 산물은 앞구조의 형성을 조절하고 다른 한 쌍의 나노와 꼬리는 배아의 뒷구조를 조절하는 단백질을 규정한다.
바이코이드, 꼽추, 꼬리, 나노 등 4가지 유전자의 전사는 간호사와 모낭세포에 의해 합성되어 난모세포로 운반된다.
인버드
새들의 경우, 엄마들은 자손의 성장과 행동에 영향을 미치는 호르몬을 알에 물려줄 수 있다.국내 카나리아 실험 결과 노른자 안드로겐을 더 많이 함유한 달걀이 사회적 우위를 보이는 병아리로 발전하는 것으로 나타났다.노른자 안드로겐 수치에서 비슷한 변화가 미국 꿩과 같은 조류 종에서 보여졌지만, 효과 메커니즘은 아직 [12]확립되지 않았습니다.
인간에게는
2015년, 비만 이론가 에드워드 아처는 "비만 진화의 결과로 인한 소아 비만 전염병:모성 자원 가설'과 인간의 비만과 [13][14][15][16]건강에 대한 모성 영향에 대한 일련의 연구.이 연구에서 Archer는 모계 영양소 대사의 비유전적 진화를 통한 모성 영향이 비만과 당뇨병 유형 2의 전지구적 유병률 증가에 책임이 있다고 주장했다.Archer는 모성 대사 조절의 감소가 태아 췌장 베타 세포, 지방 세포 및 근세포(근육 세포) 발달을 변화시켜 영양 에너지 획득 및 격리에서 지방 세포의 지속적인 경쟁 우위를 유발한다고 가정했다.
식물 내
모식물이 접하는 빛, 온도, 토양 수분, 영양소와 같은 환경적 단서는 같은 유전자형 내에서도 종자의 품질에 변화를 일으킬 수 있습니다.따라서 모식물은 종자의 크기, 발아율, [17]생존력과 같은 종자 특성에 큰 영향을 미친다.
모성 환경 영향
엄마의 환경이나 상태는 또한 자손의 유전자형과 무관하게 자손의 표현형에 영향을 미칠 수 있다.
부성효과유전자
반대로,[18] 부성 효과는 표현형이 개인의 유전자형이 아니라 아버지의 유전자형에서 비롯되는 것이다.이러한 효과에 책임이 있는 유전자는 수정과 초기 [19]발육에 관여하는 정자의 성분이다.부성 효과 유전자의 예는 드로소필라의 ms(3) sneeky이다.이 유전자의 돌연변이 대립 유전자를 가진 수컷은 난자를 수정시킬 수 있는 정자를 생산하지만, 교활하게 수정한 난자는 정상적으로 발달하지 않는다.그러나 이 돌연변이를 가진 암컷은 수정 [20]시 정상적인 발육을 하는 알을 낳는다.
적응성 모성 영향
적응성 모성 효과는 자손의 표현형 변화를 유발하며,[21] 이는 체력의 증가를 초래한다.이러한 변화는 엄마들이 자손의 건강을 떨어뜨리는 데 효과가 있는 환경적 신호를 감지하고, 그리고 나서 그들의 미래 환경을 위해 자손들을 "예비"하는 방식으로 그들에게 반응하는 것에서 발생합니다."적응적 모성 효과" 표현형의 주요 특징은 가소성이다.표현형 가소성은 유기체가 표현형을 바꿈으로써 다른 환경에 반응할 수 있는 능력을 준다.이러한 "변형된" 표현형이 적합성을 증가시키면서 적응형 모성 효과가 진화하고 환경에 대한 중요한 표현형 적응이 될 가능성을 살펴보는 것이 중요하다.
적응형 모성 효과 정의
모성 환경이나 모성 표현형에 의해 특성이 영향을 받는 경우 모성 영향의 영향을 받는다고 합니다.모성 효과는 [22]DNA 이외의 경로를 통해 자손의 표현형을 변화시키는 역할을 한다.적응성 모성 영향은 이러한 모성적 영향이 [23]자손의 적합성을 높이는 표현형 변화로 이어질 때이다.일반적으로 적응형 모성 효과는 자손의 [24]체력을 감소시키는 요인들에 대처하는 메커니즘이다. 또한 환경마다 다르다.
모성 영향과 적응성 모성 영향을 구별하는 것은 때때로 어려울 수 있다.다음 사항을 고려하십시오.밤참나무가 아닌 검은참나무 잎에서 자란 집시나방은 더 [25]빨리 자라는 새끼를 낳았다.이것은 모성 효과이지 적응 모성 효과가 아닙니다.적응형 모성 효과가 되기 위해서는 엄마의 환경이 자식들의 [25]식습관이나 행동의 변화로 이어져야만 했을 것이다.따라서 이 둘의 중요한 차이점은 적응형 모성 영향이 환경에 따라 다르다는 것이다.발생하는 표현형은 엄마가 자손의 체력을 떨어뜨릴 환경을 감지한 것에 대한 반응이다.이러한 환경을 설명함으로써 그녀는 표현형을 변화시켜 실제로 자손의 체력을 향상시킬 수 있다.모성 영향은 환경적인 신호에 반응하지 않고, 또한 그들은 자손의 체력을 증가시킬 수 있는 잠재력을 가지고 있지만, 그렇지 않을 수도 있다.
이러한 "변형된" 표현형이 진화할 가능성을 볼 때, 많은 요인과 단서가 관련된다.적응형 모성 효과는 자손들이 많은 잠재적 환경에 직면할 수 있을 때, 엄마가 자손들이 태어날 환경을 "예측"할 수 있을 때, 그리고 엄마가 자손의 표현형에 영향을 미쳐 그들의 [25]적합성을 높일 때에만 진화한다.이 모든 요소들의 합계는 이러한 "변경된" 특성들을 진화에 유리하게 만들 수 있습니다.
적응형 모성 영향에서 발생하는 표현형 변화는 환경의 특정 측면이 자손의 생존을 감소시킬 수 있다는 어머니의 감지 결과이다.신호를 감지하면 엄마는 발달 중인 자손에게 정보를 "전달"하여 적응형 모성 효과를 유도한다.이것은 그들이 [24]경험할 것 같은 환경에 "준비"되어 있기 때문에 자손들이 더 높은 체력을 갖도록 하는 경향이 있다.이러한 단서는 포식자에 대한 대응, 서식지, 높은 인구 밀도, 식량 가용성을[26][27][28] 포함할 수 있다.
북미 붉은 다람쥐의 크기 증가는 적응형 모성 효과의 좋은 예입니다. 그 결과 몸매는 증가했습니다.적응성 모성 효과는 높은 인구밀도를 감지하고 개인별 낮은 식량 가용성과 상관관계에 의해 유발되었다.그녀의 자손들은 같은 종의 다른 다람쥐들보다 평균적으로 더 컸다; 그들은 또한 더 빨리 자랐다.결국, 이 높은 개체 밀도의 시기에 태어난 다람쥐들은 첫 [26]겨울 동안 생존율이 증가했습니다.
표현형 가소성
표현형에 일어날 수 있는 변화의 종류를 분석할 때, 우리는 행동, 형태학 또는 생리적인 변화를 볼 수 있다.적응성 모성 효과를 통해 발생하는 표현형의 특징은 이 표현형의 가소성이다.표현형 가소성은 유기체가 다양한 환경에 맞게 표현형을 조정할 수 있게 하여 변화하는 환경 [24]조건에 대한 적합성을 향상시킵니다.궁극적으로 그것은 유기체와 집단의 단기적인 [29][30]환경 변화에 적응하는 능력에 대한 중요한 속성이다.
표현형 가소성은 많은 유기체에서 볼 수 있는데, 이 개념을 보여주는 한 종은 종자 딱정벌레 스테이터 림바투스입니다.이 종자 딱정벌레는 다른 숙주 식물에서 번식하는데, 그 중 더 흔한 것은 세키디움 플로리덤과 아카시아 그레기이다.C. floridum이 숙주 식물일 경우 큰 알 크기를 선택할 수 있으며, A. gregii가 숙주 식물일 경우 작은 알 크기를 선택할 수 있습니다.한 실험에서 보통 A. greggii에 알을 낳는 딱정벌레를 C. floridum에 넣었을 때, C. florium 숙주 식물에 남아 있는 딱정벌레가 낳은 알에 비해 산란된 알의 생존율이 낮다는 것이 밝혀졌다.궁극적으로 이러한 실험들은 딱정벌레의 알 크기 생산의 가소성뿐만 아니라 모성 환경이 [27]자손의 생존에 미치는 영향을 보여주었다.
적응형 모성 영향의 추가 예
많은 곤충에서:
- 급격한 온도 냉각이나 일조량 감소와 같은 신호는 자손을 휴면 상태로 만들 수 있다.따라서 냉각 온도에서 더 잘 살아남고 에너지를 [31]보존할 수 있습니다.
- 부모가 영양소가 적은 환경에 알을 낳도록 강요받으면, 자손들은 더 많은 영양소와 같은 더 많은 자원을 알 [27]크기를 통해 제공받게 될 것이다.
- 서식지가 열악하거나 사람이 몰리는 것과 같은 단서는 날개가 달린 새끼를 낳게 할 수 있다.날개는 새끼를 열악한 환경에서 더 나은 [31]자원을 제공하는 환경으로 이동하게 해준다.
모성 식단과 환경이 후생유전 효과에 영향을 미침
적응성 모성 효과와 관련된 것은 후생유전 효과이다.후생유전학은 DNA 돌연변이와 같이 DNA 배열의 변화 대신 염색질에 대한 수정에 의해 생성되는 유전자 발현에서 오랫동안 지속되는 변화를 연구하는 학문이다.이 "변화"는 DNA 메틸화, 히스톤 아세틸화 또는 코드화되지 않은 RNA와 DNA의 상호작용을 의미한다. DNA 메틸화는 DNA에 메틸기를 추가하는 것이다.포유류에서 DNA가 메틸화되면, 그 위치의 유전자의 전사가 거부되거나 완전히 꺼집니다.DNA 메틸화의 유도는 모성 환경의 영향을 많이 받는다.어떤 모성 환경은 자손의 DNA에 더 높은 메틸화를 가져올 수 있는 반면, 다른 환경은 메틸화를 낮출 수 있다.[22][citation needed] 메틸화가 모성 환경의 영향을 받을 수 있다는 사실은 적응 모성 영향과 유사하다.메틸화가 종종 자손의 적합성을 높일 수 있다는 사실에 의해 더 많은 유사성이 나타난다.또한 후생유전학은 일종의 세포기억을 생성하는 히스톤 변형 또는 비부호화 RNA를 참조할 수 있다.세포기억은 복제하는 동안 비유전 정보를 딸세포에 전달하는 세포의 능력을 말한다.예를 들어, 분화 후에, 간세포는 뇌세포와 다른 기능을 수행합니다; 세포기억은 이러한 세포들이 복제 후에 어떤 기능을 수행해야 하는지 "기억"하게 합니다.이러한 후생유전학적 변화 중 일부는 미래 세대에 물려줄 수 있는 반면, 다른 것들은 특정 개인의 수명 내에 되돌릴 수 있다.이것은 왜 동일한 DNA를 가진 사람들이 특정한 만성 질환에 대한 그들의 감수성이 다를 수 있는지를 설명할 수 있다.
현재, 연구자들은 임신 중 모성 식이요법과 그것이 만삭의 만성 질환에 대한 자손의 감수성에 미치는 영향 사이의 상관관계를 조사하고 있다.태아 프로그래밍 가설은 태아 발달의 중요한 시기 동안 환경 자극이 신체 구조와 건강에 평생 영향을 미칠 수 있다는 생각을 강조하며, 어떤 의미에서는 그들이 태어날 환경에 자손을 준비시킨다.이러한 변이의 대부분은 스트레스, 식이요법, 임신 당뇨병, 담배와 알코올에 대한 노출과 같은 모성 환경에 의해 야기되는 후생유전 메커니즘에 기인한다고 생각됩니다.이러한 요인들은 비만과 심혈관 질환, 신경관 결손, 암, 당뇨병 [32]등에 기여하는 것으로 생각된다.이러한 후생유전 메커니즘을 결정하기 위한 연구는 보통 설치류 실험실 연구와 인간 역학 연구를 통해 수행됩니다.
일반 인구에 대한 중요성
이 섹션은 확인을 위해 추가 인용문이 필요합니다.(2017년 9월 (이 및 ) |
후생유전학적 변화로 인한 모성 식단에 대한 지식은 과학자뿐만 아니라 일반 대중에게도 중요하다.아마도 모성 식이요법의 효과에서 가장 중요한 장소는 의학 분야일 것이다.미국과 전 세계적으로 암, 비만, 심장병과 같은 전염되지 않는 질병들이 유행의 비율에 도달했다.의학계는 이러한 질병들을 발견하는 방법을 연구하고 있는데, 그 중 일부는 모성 식이요법의 영향으로 인해 후생유전학적 변화에 의해 크게 움직이는 것으로 밝혀졌다.일단 이러한 질병에 대한 게놈 마커가 확인되면, 이러한 질병의 조기 발생을 식별하고 아마도 후기 생활 단계에서 모성 식단의 후생유전학적 효과를 되돌리기 위한 연구가 시행되기 시작할 수 있다.후생유전학적 효과의 역전은 특정 유전자와 유전체 변화를 목표로 하는 약을 만들기 위해 제약 분야를 활용할 것이다.이러한 전염되지 않는 질병을 치료하기 위한 약물의 개발은 이미 이러한 질병을 가진 사람들을 치료하는데 사용될 수 있다.모성 식이요법 후생유전 효과의 이면에 있는 메커니즘에 대한 일반 지식은 또한 인식 측면에서 유익하다.일반 대중은 임신 중 특정한 식습관의 위험을 알고 있을 수 있으며, 이는 나중에 자손에게 발생할 수 있는 부정적인 결과를 억제하기 위한 시도로 볼 수 있다.후생학적 지식은 전세계 수십억 명의 사람들에게 전반적으로 건강한 생활양식으로 이어질 수 있다.
인간 이외의 종에서 모성 식단의 영향도 관련이 있다.지구 기후 변화의 많은 장기적인 영향은 알려져 있지 않다.후생유전 메커니즘에 대한 지식은 과학자들이 생태, 경제 및/또는 문화적으로 전 세계적으로 중요한 종에 대한 군집 구조의 변화를 더 잘 예측할 수 있도록 도울 수 있다.많은 생태계가 종 구조의 변화를 볼 것이기 때문에, 영양소의 가용성 또한 변화할 것이고, 궁극적으로 암컷이 번식할 수 있는 먹이 선택에 영향을 미칠 것입니다.모성 식생활 효과는 농업 및 양식업 관행을 개선하는 데 사용될 수도 있다.육종업자들은 과학적 데이터를 활용하여 보다 지속 가능한 관행을 만들어 낼 수 있을 것이며, 그들 자신과 소비자들을 위해 비용을 절약할 수 있을 것이다.
모성 식단과 환경은 후생적으로 성인병에 영향을 미친다.
임신 중 고혈당은 신생아의 렙틴 유전자에 후생유전적 변화를 일으켜 비만과 심장질환의 잠재적 위험을 증가시키는 것으로 생각된다.렙틴은 배고픔을 억제하기 위해 지방 세포에 의해 분비되기 때문에 때때로 포만감 호르몬으로 알려져 있습니다.동물 모형과 인간 관찰 연구 모두를 연구함으로써, 출산 전기의 렙틴 급증은 비만의 장기적인 위험에 기여하는 데 중요한 역할을 한다는 것이 제시되었다.임신 주기는 임신 22주부터 시작해서 태어난 지 일주일 후에 끝난다.[34] 렙틴 궤적 근처의 DNA 메틸화를 검사하여 모성 혈당과 신생아 렙틴 수치 사이에 상관관계가 있는지 여부를 판단하였다.그 결과 혈당은 렙틴 호르몬 생성을 조절하는 LEP 유전자의 메틸화 상태와 반비례하는 것으로 나타났다.따라서, 엄마의 높은 혈당 수치는 자녀의 LEP 유전자의 낮은 메틸화 상태와 일치한다.이 낮은 메틸화 상태에서는 LEP 유전자가 더 자주 전사되어 혈중 렙틴 [33]수치가 높아진다.임신 기간 동안 이러한 높은 혈중 렙틴 수치는 아마도 임신 기간 동안 더 높은 "정상적인" 렙틴 수치가 설정되었다는 사실 때문에 성인기의 비만과 관련이 있었다.비만은 심장병의 큰 원인이기 때문에, 이러한 렙틴 급증은 비만뿐만 아니라 심장병과도 관련이 있다.
자궁 내 고지방 식단은 대사증후군을 일으키는 것으로 알려져 있다.대사증후군은 비만과 인슐린 저항성을 포함한 일련의 증상들로 관련이 있는 것으로 보인다.이 증후군은 종종 고혈압과 아테롬성 동맥경화증뿐만 아니라 제2형 당뇨병과 관련이 있다.쥐 모델을 사용하여, 연구원들은 자궁 속의 고지방 식단이 유전자 발현을 바꾸는 아디포넥틴과 렙틴 유전자에 변형을 일으킨다는 것을 보여주었습니다; 이러한 변화는 대사 증후군의 원인이 됩니다.아디포넥틴 유전자는 지방산 분해뿐만 아니라 포도당 대사도 조절한다; 하지만, 정확한 메커니즘은 완전히 이해되지 않는다.인간과 마우스 모델 모두에서 아디포넥틴은 인슐린 민감성과 항염증 특성을 다른 유형의 조직, 특히 근육과 간 조직에 추가하는 것으로 나타났습니다.아디포넥틴은 또한 생쥐의 지방산 수송과 산화 속도를 증가시켜 지방산 [34]대사를 증가시키는 것으로 나타났다.임신 중 고지방 식단에서 아세틸화의 감소와 함께 아디포넥틴 유전자의 프로모터에서 메틸화의 증가가 있었다.이러한 변화는 메틸화의 증가와 아세틸화의 감소가 보통 전사를 억제하기 때문에 아디포넥틴 유전자의 전사를 억제할 가능성이 있다.또한 렙틴 프로모터의 메틸화가 증가하여 렙틴 유전자의 생산을 감소시켰다.따라서 포만감을 유발하기 위해 렙틴이 적었을 뿐만 아니라 세포가 포도당을 흡수하고 지방을 분해하는 데 도움을 주는 아디포넥틴이 적었습니다.이러한 호르몬의 감소는 동물의 일생 동안 지방질량 증가, 포도당 과민증, 고트리글리세리드혈증, 비정상적인 아디포넥틴과 렙틴 수치, 그리고 고혈압을 유발했다.하지만, 그 효과는 정상적인 식이요법으로 3세대를 거쳐 폐지되었다.이 연구는 이러한 후생유전학적 표시가 한 세대에 걸쳐 변할 수 있고 시간이 [35]지남에 따라 완전히 제거될 수 있다는 사실을 강조한다.이 연구는 생쥐의 고지방 식단과 아디포넥틴과 렙틴 사이의 연관성을 강조했습니다.이와는 대조적으로, 자궁 내 고지방 식단이 인간에게 미치는 영향을 보여주는 연구는 거의 없었다.그러나 감소된 아디포넥틴 수치는 인간의 비만, 인슐린 저항성, 제2형 당뇨병, 관상동맥 질환과 관련이 있는 것으로 나타났다.생쥐에서 설명된 것과 유사한 메커니즘이 인간의 [34]대사증후군에도 기여할 수 있다고 가정한다.
게다가, 고지방 식단은 태반, 지방, 간, 뇌, 그리고 혈관계에 만성 저급성 염증을 일으킨다.염증은 부상, 외상 또는 질병 후 신체의 자연 방어 시스템의 중요한 측면이다.염증 반응 동안, 상처나 감염된 부위를 치료하는데 도움을 주기 위해 혈류 증가, 세포 대사 증가, 혈관 확장과 같은 일련의 생리 반응이 일어납니다.그러나 만성 저급성 염증은 심혈관 질환, 신부전, 노화, 당뇨병 등과 같은 장기적인 결과와 관련이 있다.이 만성 저급성 염증은 고지방식을 하는 비만인 사람들에게서 흔히 볼 수 있다.마우스 모델에서는 고지방 식단을 섭취한 쥐에서 과도한 사이토카인이 검출되었습니다.사이토카인은 면역 반응 동안 세포 신호를 전달하는데 도움을 주며, 특히 염증, 감염 또는 외상 부위로 세포를 보냅니다.고지방식을 하는 산모의 태반에서 염증성 사이토카인의 mRNA가 유도되었다.고지방 식단은 또한 미생물 조성에 변화를 일으켜 자손들에게 과염증성 대장 반응을 유발했다.이 고염증 반응은 크론병이나 궤양성 대장염과 같은 염증성 장질환으로 이어질 수 있다.[35] 앞서 언급한 바와 같이 자궁 내 고지방 식단은 비만의 원인이 되지만 IL-6, MCP-1과 같은 일부 염증 인자는 체지방 퇴적과 관련이 있다.히스톤 아세틸화는 히스톤 탈아세틸화효소 억제제의 첨가가 아교세포에서 프로염증 매개체의 발현을 감소시키는 것으로 나타났기 때문에 염증과 밀접한 관련이 있다고 제안되었다.이러한 염증의 감소는 신경세포의 기능과 생존을 향상시켰다.이 염증은 또한 종종 비만, 심혈관 질환, 지방간, 뇌손상, 전립선증과 조산과도 관련이 있다.비록 고지방 식단이 염증을 유발한다는 것이 밝혀졌지만, 이러한 염증이 식사와 만성 [36]질환 사이의 매개자로 어떻게 작용하는지 명확하지 않다.
1944-1945년의 네덜란드 헝거 윈터 이후 실시된 연구는 임신 초기 영양 부족이 60년 후에도 인슐린 유사 성장인자 II 유전자의 저메틸화와 관련이 있다는 것을 보여주었다.이 사람들은 기근 동안 임신하지 않았던 동성 형제들에 비해 메틸화율이 현저히 낮았다.기근 전에 임신한 아이들과 비교했더니 임신 후반기에 엄마가 영양분을 빼앗겼다; 이 아이들은 정상적인 메틸화 패턴을 보였다.IGF2는 인슐린과 유사한 성장인자 II를 나타냅니다; 이 유전자는 인간의 성장과 발달에 중요한 기여자입니다.IGF2 유전자는 또한 어머니의 유전자가 침묵하는 것을 의미하며 모성적으로 각인되어 있다.산모의 유전자는 전형적으로 차등 메틸화 영역(DMR)에서 메틸화되지만, 저메틸화되면 유전자는 쌍방향으로 발현된다.따라서 메틸화 상태가 낮은 사람은 일부 각인 효과를 잃을 수 있다.임신을 시작하기 전 등열량 단백질 결핍 식단을 섭취한 랫드 자손의 Nr3c1 및 Ppara 유전자에서도 유사한 결과가 입증되었다.이것은 영양부족이 후생유전학적 변화의 원인이었음을 더욱 암시한다.놀랍게도, 메틸화 상태와 출생 체중 사이에는 상관관계가 없었다.이것은 출생 체중이 임신 기간 동안 영양 상태를 결정하는 적절한 방법이 아닐 수 있다는 것을 보여주었다.이 연구는 후생유전 효과는 노출 시기에 따라 다르며 포유류의 발달 초기 단계는 후생유전적 표시를 확립하는 데 중요한 시기라고 강조했다.임신 초기에 피폭된 사람들은 메틸화가 감소한 반면 임신 말기에 피폭된 사람들은 비교적 정상적인 메틸화 수준을 [37]보였다.저메틸화를 앓고 있는 산모의 자녀와 후손들은 심혈관 질환에 걸릴 가능성이 더 높았다.태아 발생과 초기 태아 발달 중에 발생하는 후생유전학적 변화는 더 많은 유사분열로 전달되기 때문에 더 큰 생리학적, 대사적 영향을 미친다.즉, 이전에 발생한 후생유전학적 변화는 더 많은 [37]세포에서 지속될 가능성이 더 높다.
또 다른 연구에서, 연구원들은 자궁 내 성장 제한(IUGR)을 초래하는 신생아 주기의 영양소 제한이 당뇨병의 2형(DM2)에 기여한다는 것을 발견했습니다.IUGR은 자궁에서 아기가 잘 자라지 못하는 것을 말한다.췌장에서 IUGR은 베타세포 기능 및 발달을 위한 중요한 전사인자를 코드하는 유전자의 프로모터의 발현 감소를 야기했다.췌장 베타 세포는 인슐린을 만드는 데 책임이 있다; 감소된 베타 세포 활동은 성인기에 DM2와 관련이 있다.골격근에서 IUGR은 글루트-4 유전자 발현 감소를 야기했다.글루트-4 유전자는 글루트-4 운반체의 생산을 조절한다; 이 전달체는 특히 인슐린에 민감하다.따라서 인슐린 수치가 상승하면 포도당의 세포 내 흡수를 증가시키기 위해 더 많은 글루트-4 수송체가 세포막으로 운반된다.이러한 변화는 근육으로의 포도당 수송 시스템의 효과를 감소시키는 골격근의 세포에 있는 히스톤 변형에 의해 야기된다.주요 포도당 운반체가 최적의 용량으로 작동하지 않기 때문에, 이러한 개인들은 나중에 에너지가 풍부한 식단으로 인슐린 저항성을 발달시켜 [38]DM2에 기여할 가능성이 더 높습니다.
추가 연구는 임신 중 고단백/저탄수화물 식단에서 발생하는 후생유전학적 변화를 조사했다.이 식단은 높은 혈압, 높은 코티솔 수치, 그리고 스트레스에 대한 높아진 시상하부-하수체-부신(HPA) 축 반응과 관련된 후생유전학적 변화를 야기했다.11β-히드록시스테로이드 탈수소효소 타입 2(HSD2), 글루코콜티코이드 수용체(GR) 및 H19 ICR의 메틸화 증가는 성인기에 지방성 및 혈압과 양성으로 상관되었다.글루코콜티코이드는 신진대사에 영향을 미칠 뿐만 아니라 조직의 발달과 성숙에도 중요한 역할을 한다.글루코콜티코이드의 GR에 대한 접근은 HSD1과 HSD2에 의해 조절된다. H19는 체중과 세포 증식에 제한적인 영향을 미치는 긴 코드화 RNA(lncRNA)의 임프린트 유전자이다.따라서 H19 ICR에서 높은 메틸화 속도는 전사를 억제하고 lncRNA가 체중을 조절하지 못하게 한다.임신 후기에 육류/생선과 야채 섭취가 더 많고 빵/감자 섭취가 더 낮다고 보고한 산모들은 GR과 HSD2의 평균 메틸화가 더 높았다.그러나, 이러한 유형의 연구의 한 가지 공통적인 도전은 많은 후생유전학적 변형들이 조직과 세포형 특이성 DNA 메틸화 패턴을 가지고 있다는 것이다.따라서 말초혈액과 같이 접근 가능한 조직의 후생유전학적 변형 패턴은 특정 [39]질병과 관련된 조직의 후생유전학적 패턴을 나타내지 않을 수 있다.
쥐의 강력한 증거는 신생아 에스트로겐 노출이 전립선암 발병의 한 역할을 한다는 결론을 뒷받침한다.인간 태아 전립선 이종 이식 모델을 사용하여, 연구원들은 에스트로겐과 테스토스테론 치료의 2차적 유무에 관계없이 에스트로겐에 대한 조기 노출의 영향을 연구했다.이종 이식 모형은 다른 종의 유기체 사이에 이식된 조직의 이식편이다.이 경우 인체조직을 쥐에게 이식했기 때문에 설치류에서 사람으로 추정할 필요가 없었다.이종 이식 후 다양한 시점에서 조직병리학적 병변, 증식 및 혈청 호르몬 수치를 측정하였다.200일째에, 에스트로겐의 두 가지 치료법에 노출된 이종 이식수술이 가장 심각한 변화를 보였습니다.추가적으로, 연구원들은 전립샘과 간질 성장, 세포 주기 진행, 아포토시스, 호르몬 수용체, 그리고 맞춤형 PCR 어레이를 사용하여 종양 억제제와 관련된 주요 유전자를 조사했다.DNA 메틸화 분석 결과 에스트로겐 처리 후 간질 구획의 CpG 부위에서 메틸화 차이가 나타났다.메틸화의 이러한 변화는 암 [40]발생에 기여하는 세포 주기 진행을 증가시키고 아포토시스를 억제하는 KEGG 전립선암 경로의 세포 사건 변화에 기여하는 원인일 수 있다.
보충제는 후생유전학적 변화를 반전시킬 수 있다
폴리카보네이트 플라스틱 제조에 사용되는 화학물질인 비스페놀A(BPA)에 대한 자궁 또는 신생아 피폭은 체중 증가, 유방암, 전립선암 및 생식기능의 변화와 관련이 있다.생쥐 모델에서 BPA 식단을 섭취한 생쥐는 아구티 유전자 상류의 역트랜스포존 프로모터 영역에서 낮은 메틸화 상태에 대응하는 노란색 외피를 가질 가능성이 더 높았다.아구티 유전자는 동물의 털에 띠가 있는지(아구티) 고체인지(비아구티)를 결정하는 역할을 한다.그러나 엽산이나 피토에스트로겐과 같은 메틸 공여체를 보충하면 하이포메틸화 효과가 없어진다.이것은 식이요법과 [41]보충제를 통해 후생유전학적 변화를 되돌릴 수 있다는 것을 보여준다.
모성 다이어트 효과 및 생태
이 섹션은 확인을 위해 추가 인용문이 필요합니다.(2017년 9월 (이 및 ) |
모성 식이요법의 효과는 사람에게만 나타나는 것이 아니라 동물의 왕국에서 많은 분류군에 걸쳐 나타난다.이러한 모성 식생활의 영향은 개체군과 세대를 통해 생태학적 변화를 더 크게 야기할 수 있다.모성 식생활로 인한 후생유전적 변화에 수반되는 가소성은 자손들이 태어날 환경을 나타낸다.많은 경우, 발달하는 동안 모성 식단에서 나오는 자손에 대한 후생유전학적 영향은 유전적으로 그들이 처음 접하게 될 환경에 더 잘 적응할 수 있도록 준비시킬 것이다.모성 식단의 후생유전학적 효과는 미래 세대에 적응적 이점을 제공하기 위해 서로 다른 생태학적 신호와 후생유전학적 메커니즘을 이용하여 많은 종에서 볼 수 있다.
생태학 분야에서는 모성 식이요법의 영향이 많은 예가 있다.불행하게도, 이러한 표현형 변화의 기초가 되는 후생유전 메커니즘은 거의 연구되지 않는다.미래에는 후생유전학 및 유전학 과학자들뿐만 아니라 생태학자들에게도 환경적 단서들과 표현형 다양성을 만들어내는 후생유전학적 변화들의 완전한 그림을 만들기 위해 협력하는 것이 유익할 것이다.
부모의 식단은 자손의 면역력에 영향을 준다
식물 저장소에서 흔히 볼 수 있는 피랄리드 나방종인 플로디아 인터펀텔라는 자손에게 부성 식이요법뿐만 아니라 모성 식이요법 효과를 나타낸다.나방 자손의 후생유전학적 변화는 많은 무척추동물 종에서 특정 병원균의 저항과 관련이 있는 효소인 페놀록시다아제 생산에 영향을 미친다.이 연구에서, 어미 나방은 번식 기간 동안 음식이 풍부한 환경 또는 음식이 부족한 환경에 수용되었습니다.음식물이 풍부한 환경에서 번식하는 나방보다 음식물이 부족한 환경에서 번식하는 나방이 적은 페놀록시다아제를 가진 자손을 낳아 면역체계가 약했다.이것은 자손들이 부족한 영양 기회의 신호를 받으면서 발달하기 때문에 적응력이 있다고 여겨진다.이러한 신호들은 나방이 면역 체계에 할당되는 에너지를 줄이고 더 많은 에너지를 성장과 번식에 쏟는 것을 통해 나방이 체력을 증가시키고 미래 세대를 보장할 수 있게 해줍니다.이 효과에 대한 한 가지 설명은 부모 유전자가 다른 유전자에 비해 발현되는 각인일 수도 있지만, 더 이상의 연구는 [42]아직 이루어지지 않았다.
면역에 대한 부모 매개 식단 후생유전 효과는 야생 유기체에 더 큰 의미를 갖는다.전체 모집단의 면역력 변화는 모집단을 병원체 도입과 같은 환경 장애에 더 민감하게 만들 수 있다.따라서 이러한 세대간 후생유전 효과는 후생유전학적으로 수정되는 부모환경과 다른 환경에 거주하는 인구의 안정성을 감소시킴으로써 인구역학에 영향을 미칠 수 있다.
모성 식단은 자손 성장률에 영향을 준다
음식의 가용성은 또한 구강 브로딩 시클리드, Simochromis pleurospilus의 성장 속도를 촉진하는 후생 유전 메커니즘에 영향을 미칩니다.영양소 가용성이 높을 때, 암컷은 영양소가 부족한 환경에서 적은 수의 작은 알과 더 큰 알을 낳습니다.알의 크기는 종종 부화 시 물고기 애벌레의 몸 크기와 관련이 있습니다: 작은 애벌레는 작은 알에서 부화합니다.시클리드의 경우, 작은 애벌레는 큰 알보다 더 빠른 속도로 자란다.성장호르몬 수용체인 GHR의 발현 증가 때문이다.GHR 유전자의 전사 수준이 증가하면 성장 호르몬인 GH와 결합할 수 있는 수용체가 증가하여 작은 물고기의 성장률이 증가하게 됩니다.몸집이 큰 물고기는 포식자에게 먹힐 가능성이 적기 때문에 생존을 위해 초기 단계에서 빨리 자라는 것이 유리하다.GHR 전사가 조절되는 메커니즘은 알려져 있지 않지만, 그것은 어머니가 생산한 노른자 내의 호르몬 또는 단지 노른자 양 자체 때문일 수 있다.이는 유전자 전사 [43]수준을 제어하는 DNA 메틸화 또는 히스톤 변형을 초래할 수 있다.
생태학적으로, 이것은 엄마가 실제로 의식적으로 노력하지 않고 자신의 환경을 활용하고 자손 생존을 극대화하는 최선의 방법을 결정하는 예이다.생태학은 일반적으로 영양분을 얻고 성공적으로 번식하기 위해 경쟁하는 유기체의 능력에 의해 추진된다.엄마가 풍부한 자원을 모을 수 있다면, 그녀는 더 높은 번식력을 갖게 될 것이고 포식자를 피하기 위해 빠르게 자랄 수 있는 자손들을 낳을 것이다.많은 영양분을 섭취할 수 없는 엄마들은 새끼를 덜 낳겠지만, 그들의 큰 크기가 성적 성숙으로의 생존을 보장해주기를 바라기 때문에 자손들은 더 커질 것이다.나방의 예와 달리, 시클리드 자손에게 제공되는 모성적 영향은 그들이 태어날 환경을 위해 시클리드들을 준비시키지 않는다; 이것은 구강 부화 시클리드들이 자손들에게 부모의 보살핌을 제공하고, 자손들이 자랄 수 있는 안정적인 환경을 제공하기 때문이다.성장률이 높은 자녀는 성장이 느린 자녀보다 더 빨리 독립할 수 있기 때문에 부모가 양육 기간 동안 소비하는 에너지의 양을 줄일 수 있다.
성게 Strongylocentrotus droebachiensis에서도 비슷한 현상이 나타난다.영양소가 풍부한 환경의 성게 어미들은 작은 알을 많이 낳는다.이 작은 알에서 나오는 자손들은 영양분이 부족한 엄마로부터 나오는 큰 알보다 더 빠른 속도로 자란다.다시, 플라눌라로 알려진 성게 유충은 빠르게 자라서 유충 단계의 지속 시간을 줄이고 포식 위험을 줄이기 위해 어린 개체로 변모하는 것이 유익하다.성게 유충은 모체와 유충의 영양을 바탕으로 두 가지 표현형 중 하나로 발달할 수 있는 능력을 가지고 있다.고영양으로 빠른 속도로 성장하는 애벌레는 어린 표현형 발달에 더 많은 에너지를 쏟을 수 있습니다.저영양으로 느린 속도로 성장하는 애벌레는 어린 시절의 생존을 늘리기 위해 포식자로부터 자신을 보호하기 위해 척추와 같은 부속물이 자라나는 데 더 많은 에너지를 쏟습니다.이러한 표현형의 판정은 모성 영양과 소아 영양 양쪽에 기초하고 있다.이러한 표현형 변화의 배후에 있는 후생유전 메커니즘은 알려져 있지 않지만, 발육에 영향을 미치는 후생유전학적 변화를 촉발하고 궁극적으로 유충 표현형에 [44]영향을 미치는 영양학적 임계값이 있을 수 있다고 믿어진다.
「 」를 참조해 주세요.
레퍼런스
- ^ Griffiths AJ (1999). An Introduction to genetic analysis. New York: W. H. Freeman. ISBN 978-0-7167-3771-1.[페이지 필요]
- ^ Schier AF (April 2007). "The maternal-zygotic transition: death and birth of RNAs". Science. 316 (5823): 406–7. Bibcode:2007Sci...316..406S. doi:10.1126/science.1140693. PMID 17446392. S2CID 36999389.
- ^ Jorgensen EM, Mango SE (May 2002). "The art and design of genetic screens: Caenorhabditis elegans". Nat. Rev. Genet. 3 (5): 356–69. doi:10.1038/nrg794. PMID 11988761. S2CID 152517.
- ^ St Johnston D (March 2002). "The art and design of genetic screens: Drosophila melanogaster". Nat. Rev. Genet. 3 (3): 176–88. doi:10.1038/nrg751. PMID 11972155. S2CID 6093235.
- ^ Bastock R, St Johnston D (December 2008). "Drosophila oogenesis". Curr. Biol. 18 (23): R1082–7. doi:10.1016/j.cub.2008.09.011. PMID 19081037. S2CID 14924601.
- ^ Nüsslein-Volhard C, Lohs-Schardin M, Sander K, Cremer C (January 1980). "A dorso-ventral shift of embryonic primordia in a new maternal-effect mutant of Drosophila". Nature. 283 (5746): 474–6. Bibcode:1980Natur.283..474N. doi:10.1038/283474a0. PMID 6766208. S2CID 4320963.
- ^ Schüpbach T, Wieschaus E (February 1986). "Germline autonomy of maternal-effect mutations altering the embryonic body pattern of Drosophila". Dev. Biol. 113 (2): 443–8. doi:10.1016/0012-1606(86)90179-X. PMID 3081391.
- ^ Nüsslein-Volhard C, Frohnhöfer HG, Lehmann R (December 1987). "Determination of anteroposterior polarity in Drosophila". Science. 238 (4834): 1675–81. Bibcode:1987Sci...238.1675N. doi:10.1126/science.3686007. PMID 3686007.
- ^ Berleth T, Burri M, Thoma G, et al. (June 1988). "The role of localization of bicoid RNA in organizing the anterior pattern of the Drosophila embryo". EMBO J. 7 (6): 1749–56. doi:10.1002/j.1460-2075.1988.tb03004.x. PMC 457163. PMID 2901954.
- ^ Ephrussi A, St Johnston D (January 2004). "Seeing is believing: the Bicoid morphogen gradient matures". Cell. 116 (2): 143–52. doi:10.1016/S0092-8674(04)00037-6. PMID 14744427. S2CID 1977542.
- ^ Pranav K, Mina U (2013). Life Sciences : Fundamentals and practice (3rd ed.). New Delhi: Pathfinder Academy. ISBN 9788190642774. OCLC 857764171.
- ^ Reed WL, Clark ME (July 2011). "Beyond maternal effects in birds: responses of the embryo to the environment". Integrative and Comparative Biology. 51 (1): 73–80. doi:10.1093/icb/icr032. PMID 21624931.
- ^ Archer E (January 2015). "The childhood obesity epidemic as a result of nongenetic evolution: the maternal resources hypothesis". Mayo Clinic Proceedings. 90 (1): 77–92. doi:10.1016/j.mayocp.2014.08.006. PMC 4289440. PMID 25440888.
- ^ Archer E (April 2015). "In reply—Maternal, paternal, and societal efforts are needed to "cure" childhood obesity". Mayo Clinic Proceedings. 90 (4): 555–7. doi:10.1016/j.mayocp.2015.01.020. PMC 4527549. PMID 25841259.
- ^ Archer E (May 2015). "In reply--Epigenetics and Childhood Obesity". Mayo Clinic Proceedings. 90 (5): 693–5. doi:10.1016/j.mayocp.2015.02.013. PMID 25939942.
- ^ Archer E (2015-02-28). "The mother of all problems". New Scientist. 225 (3010): 32–33. Bibcode:2015NewSc.225...32A. doi:10.1016/S0262-4079(15)60404-3.
- ^ Nguyen, Chi D (March 2021). "Effects of Maternal Environment on Seed Germination and Seedling Vigor of Petunia x Hybrida under Different Abiotic Stresses". Plants. 10 (3): 581. doi:10.3390/plants10030581. PMC 8003445. PMID 33808598.
- ^ Yasuda GK, Schubiger G, Wakimoto BT (May 1995). "Genetic characterization of ms (3) K81, a paternal effect gene of Drosophila melanogaster". Genetics. 140 (1): 219–29. doi:10.1093/genetics/140.1.219. PMC 1206549. PMID 7635287.
- ^ Fitch KR, Yasuda GK, Owens KN, Wakimoto BT (1998). "1 Paternal Effects in Drosophila: Implications for Mechanisms of Early Development". Paternal effects in Drosophila: implications for mechanisms of early development. Current Topics in Developmental Biology. Vol. 38. pp. 1–34. doi:10.1016/S0070-2153(08)60243-4. ISBN 9780121531386. PMID 9399075.
- ^ Fitch KR, Wakimoto BT (May 1998). "The paternal effect gene ms(3)sneaky is required for sperm activation and the initiation of embryogenesis in Drosophila melanogaster". Developmental Biology. 197 (2): 270–82. doi:10.1006/dbio.1997.8852. PMID 9630751.
- ^ Van Cann J, Koskela E, Mappes T, Sims A, Watts PC (September 2019). "Intergenerational fitness effects of the early life environment in a wild rodent". The Journal of Animal Ecology. 88 (9): 1355–1365. doi:10.1111/1365-2656.13039. PMID 31162628. S2CID 174808731.
- ^ Adkins-Regan E, Banerjee SB, Correa SM, Schweitzer C (September 2013). "Maternal effects in quail and zebra finches: Behavior and hormones". General and Comparative Endocrinology. 190: 34–41. doi:10.1016/j.ygcen.2013.03.002. PMID 23499787.
- ^ Leftwich PT, Nash WJ, Friend LA, Chapman T (February 2019). "Contribution of maternal effects to dietary selection in Mediterranean fruit flies". Evolution; International Journal of Organic Evolution. 73 (2): 278–292. doi:10.1111/evo.13664. PMC 6492002. PMID 30592536.
- ^ a b c Galloway LF (April 2005). "Maternal effects provide phenotypic adaptation to local environmental conditions". The New Phytologist. 166 (1): 93–9. doi:10.1111/j.1469-8137.2004.01314.x. PMID 15760354.
- ^ a b c Spitzer BW (2004). "Maternal effects in the soft scale insect Saissetia coffeae (Hemiptera: Coccidae)". Evolution. 58 (11): 2452–61. doi:10.1554/03-642. JSTOR 3449399. PMID 15612288. S2CID 198152929.
- ^ a b Dantzer B, Newman AE, Boonstra R, Palme R, Boutin S, Humphries MM, McAdam AG (June 2013). "Density triggers maternal hormones that increase adaptive offspring growth in a wild mammal". Science. 340 (6137): 1215–7. Bibcode:2013Sci...340.1215D. doi:10.1126/science.1235765. PMID 23599265. S2CID 206548036.
- ^ a b c Fox CW, Thakar MS, Mousseau TA (1997). "Egg Size Plasticity in a Seed Beetle: An Adaptive Maternal Effect". The American Naturalist. 149 (1): 149–63. doi:10.1086/285983. JSTOR 2463535. S2CID 85194061.
- ^ Van Buskirk J (February 2002). "Phenotypic lability and the evolution of predator-induced plasticity in tadpoles". Evolution; International Journal of Organic Evolution. 56 (2): 361–70. doi:10.1554/0014-3820(2002)056[0361:PLATEO]2.0.CO;2. JSTOR 3061574. PMID 11926504. S2CID 198152866.
- ^ Nussey DH, Wilson AJ, Brommer JE (2007). "The evolutionary ecology of individual phenotypic plasticity in wild populations". Journal of Evolutionary Biology. 20 (3): 831–44. doi:10.1111/j.1420-9101.2007.01300.x. PMID 17465894. S2CID 18056412.
- ^ Garland T, Kelly SA (2006). "Phenotypic plasticity and experimental evolution". The Journal of Experimental Biology. 209 (Pt 12): 2344–61. doi:10.1242/jeb.02244. PMID 16731811.
- ^ a b Mousseau TA, Fox CW (1998). "The adaptive significance of maternal effects". Trends in Ecology & Evolution. 13 (10): 403–7. doi:10.1016/S0169-5347(98)01472-4. PMID 21238360.
- ^ Barua S, Junaid MA (2015). "Lifestyle, pregnancy and epigenetic effects". Epigenomics. 7 (1): 85–102. doi:10.2217/epi.14.71. PMID 25687469.
- ^ Allard C, Desgagné V, Patenaude J, Lacroix M, Guillemette L, Battista MC, Doyon M, Ménard J, Ardilouze JL, Perron P, Bouchard L, Hivert MF (2015). "Mendelian randomization supports causality between maternal hyperglycemia and epigenetic regulation of leptin gene in newborns". Epigenetics. 10 (4): 342–51. doi:10.1080/15592294.2015.1029700. PMC 4622547. PMID 25800063.
- ^ a b Chandran M, Phillips SA, Ciaraldi T, Henry RR (2003). "Adiponectin: more than just another fat cell hormone?". Diabetes Care. 26 (8): 2442–50. doi:10.2337/diacare.26.8.2442. PMID 12882876.
- ^ Masuyama H, Mitsui T, Nobumoto E, Hiramatsu Y (2015). "The Effects of High-Fat Diet Exposure In Utero on the Obesogenic and Diabetogenic Traits Through Epigenetic Changes in Adiponectin and Leptin Gene Expression for Multiple Generations in Female Mice". Endocrinology. 156 (7): 2482–91. doi:10.1210/en.2014-2020. PMID 25853666.
- ^ Zhou D, Pan YX (2015). "Pathophysiological basis for compromised health beyond generations: role of maternal high-fat diet and low-grade chronic inflammation". The Journal of Nutritional Biochemistry. 26 (1): 1–8. doi:10.1016/j.jnutbio.2014.06.011. PMID 25440222.
- ^ a b Heijmans BT, Tobi EW, Stein AD, Putter H, Blauw GJ, Susser ES, Slagboom PE, Lumey LH (2008). "Persistent epigenetic differences associated with prenatal exposure to famine in humans". Proceedings of the National Academy of Sciences of the United States of America. 105 (44): 17046–9. Bibcode:2008PNAS..10517046H. doi:10.1073/pnas.0806560105. PMC 2579375. PMID 18955703.
- ^ Lopez-Jaramillo P, Gomez-Arbelaez D, Sotomayor-Rubio A, Mantilla-Garcia D, Lopez-Lopez J (2015). "Maternal undernutrition and cardiometabolic disease: a Latin American perspective". BMC Medicine. 13: 41. doi:10.1186/s12916-015-0293-8. PMC 4346113. PMID 25858591.

- ^ Drake AJ, McPherson RC, Godfrey KM, Cooper C, Lillycrop KA, Hanson MA, Meehan RR, Seckl JR, Reynolds RM (2012). "An unbalanced maternal diet in pregnancy associates with offspring epigenetic changes in genes controlling glucocorticoid action and foetal growth". Clinical Endocrinology. 77 (6): 808–15. doi:10.1111/j.1365-2265.2012.04453.x. PMID 22642564. S2CID 28199749.
- ^ Saffarini CM, McDonnell-Clark EV, Amin A, Huse SM, Boekelheide K (2015). "Developmental exposure to estrogen alters differentiation and epigenetic programming in a human fetal prostate xenograft model". PLOS ONE. 10 (3): e0122290. Bibcode:2015PLoSO..1022290S. doi:10.1371/journal.pone.0122290. PMC 4370592. PMID 25799167.

- ^ Dolinoy DC, Huang D, Jirtle RL (2007). "Maternal nutrient supplementation counteracts bisphenol A-induced DNA hypomethylation in early development". Proceedings of the National Academy of Sciences of the United States of America. 104 (32): 13056–61. Bibcode:2007PNAS..10413056D. doi:10.1073/pnas.0703739104. PMC 1941790. PMID 17670942.
- ^ Vargas G, Michaud JP, Nechols JR, Moreno CA (2014). "Age-specific maternal effects interact with larval food supply to modulate life history in Coleomegilla maculata". Ecological Entomology. 39 (1): 39–46. doi:10.1111/een.12065. S2CID 54585960.
- ^ Triggs AM, Knell RJ (2012). "Parental diet has strong transgenerational effects on offspring immunity". Functional Ecology. 26 (6): 1409–17. doi:10.1111/j.1365-2435.2012.02051.x.
- ^ Bertram DF, Strathmann RR (1998). "Effects of Maternal and Larval Nutrition on Growth and Form of Planktotrophic Larvae". Ecology. 79 (1): 315–27. doi:10.1890/0012-9658(1998)079[0315:EOMALN]2.0.CO;2. JSTOR 176885. S2CID 85923751.