다이옥솔레인
Dioxolane| | |||
| 이름 | |||
|---|---|---|---|
| 선호 IUPAC 이름 1,3-다이옥솔레인[3] | |||
| 체계적 IUPAC 이름 1,3-다이옥사시클로펜탄 | |||
| 기타 이름 | |||
| 식별자 | |||
3D 모델(JSmol) | |||
| 체비 | |||
| 켐스파이더 | |||
| ECHA InfoCard | 100.010.422 | ||
| EC 번호 |
| ||
펍켐 CID | |||
| 유니 | |||
| |||
| |||
| 특성. | |||
| C3H6O2 | |||
| 어금질량 | 74.08 g/192 | ||
| 밀도 | 1.06 g/cm3 | ||
| 녹는점 | -95°C(-139°F, 178K) | ||
| 비등점 | 75°C(167°F, 348K) | ||
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |||
| Infobox 참조 자료 | |||
디옥솔레인은 화학식(CH2)2을 가진 이질성 태아이다.OCH22. 이것은 CH2 그룹과 하나의 산소를 교환함으로써 테트라하이드로푸란과 관련이 있다. 그에 상응하는 포화 6-membed CO42 링은 다이옥산이라고 불린다. 이소메릭 1,2-다이옥솔란(두 산소 중심이 인접한 곳)은 과산화물이다. 1,3-다이옥솔란은 용매로, 다산소에서는 코모노머로 사용된다.
화합물의 한 종류로서
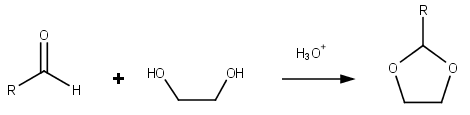
다이옥솔레인은 다이옥솔레인 링을 함유한 유기 화합물의 그룹이다. 다이옥솔란스는 알데히드의 아세트화 및 에틸렌 글리콜로 케톤을 케탈화하여 준비할 수 있다.[4]
(+--cis-dioxolane)는 Muscarinic 아세틸콜린 수용체 작용제인 L-(+-cis-2--methyl-4-트리메틸아미노메틸-1,3-dioxolane)의 사소한 이름이다.
그룹 보호
카보닐 그룹을 포함하는 유기 화합물은 존재하는 다른 기능 그룹의 변환 중에 반응을 일으키지 않도록 보호가 필요한 경우가 있다. 이산화[6] 탄소를 포함한 카보닐의[5] 보호 및 제제에 대한 다양한 접근법이 알려져 있다. 예를 들어 리튬 알루미늄 하이드라이드 감소가 4-히드록시메틸사이클로헥사논-4-카복실산 화합물을 고려하십시오. 에스테르 기능군은 케톤을 케탈로 보호함으로써 케톤에 영향을 주지 않고 줄일 수 있다. 케탈은 에틸렌 글리콜과의 산성 촉매 반응, 수행된 감소 반응, 가수 분해에 의해 제거된 보호 그룹에 의해 생성되어 4-히드록시메틸사이클로헥사논을 생산한다.
또한 NaBArF는4 아세트 또는 케탈로 보호되는 카보닐 화합물의 절제에 사용될 수 있다.[5][6] 예를 들어, 2-페닐-1,3-디옥솔렌을 벤츠알데히드로 30 °C에서 5분 안에 물에 담가 제거할 수 있다.[7]
- PhCH(OCH2)2 + HO2→ / 4 / PhCHO + HOCHCHOH22
천연 생산물
네오스포롤은 천연제품으로 1,3-다이옥솔란 모이티를 함유하고 있으며, 1,3-다이옥산 링을 가진 스포톨의 이소머다.[8] 두 화합물의 총합성이 보고되었으며, 각각 과산화수소 – 요소법에 의해 준비된 트리플루오르오페아세트산(TFPAA)을 사용하여 다이옥솔레인계가 형성되는 단계를 포함한다.[9][10] 이 방법은 물을 포함하지 않기 때문에 완전히 무수 과산염을 제공하며,[11] 물의 존재는 원치 않는 부작용의 원인이 될 수 있기 때문에 이 경우에 필요하다.[9]
- CFCOOCOCF
3
3 + HO
2
2•CO(NH
2)
2 → CFCOOOH
3 + CFCOOH
3 + CO(NH
2)
2
네오스포롤의 경우 트라이플루오로페아세트산과의 프리레즈하프 반응을[12] 이용해 적절한 아군 알코올 전구체를 에폭시드로 변환한 다음 근위 카보닐 기능군과 함께 링-팽창 반응을 거쳐 다이옥솔란 링을 형성한다.[9][10]
유사한 접근법이 스포톨의 총합성에 사용되며, 다이옥솔라인 링은 나중에 다이옥산 시스템으로 확장된다.[8]
참고 항목
참조
- ^ 시그마알드리히의 1,3-다이옥솔레인
- ^ 공식 글리콜 - PubChem 공공 화학 데이터베이스
- ^ "Front Matter". Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. p. 145. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ R. A. Daignault, E. L. Eliel (1973). "2-Cyclohexyloxyethanol (involves acetalisation of cyclohexanone)". Organic Syntheses.; Collective Volume, vol. 5, p. 303
- ^ a b Greene, Theodora W.; Wuts, Peter G. M. (1999). "Dimethyl acetals". Greene's Protective Groups in Organic Synthesis (3rd ed.). Wiley-Interscience. pp. 297–304, 724–727. ISBN 9780471160199. Archived from the original on December 3, 2016. Retrieved June 20, 2017.
- ^ a b Greene, Theodora W.; Wuts, Peter G. M. (1999). "1,3-Dioxanes, 1,3-Dioxolanes". Greene's Protective Groups in Organic Synthesis (3rd ed.). Wiley-Interscience. pp. 308–322, 724–727. ISBN 9780471160199. Archived from the original on December 7, 2016. Retrieved June 20, 2017.
- ^ Chang, Chih-Ching; Liao, Bei-Sih; Liu, Shiuh-Tzung (2007). "Deprotection of Acetals and Ketals in a Colloidal Suspension Generated by Sodium Tetrakis(3,5-trifluoromethylphenyl)borate in Water". Synlett. 2007 (2): 283–287. doi:10.1055/s-2007-968009.
- ^ a b Pirrung, Michael C.; Morehead, Andrew T.; Young, Bruce G., eds. (2000). "10. Neosporol, Sporol". Part B: Bicyclic and Tricyclic Sesquiterpenes. The Total Synthesis of Natural Products. Vol. 11. John Wiley & Sons. pp. 222–224. ISBN 9780470129630.
- ^ a b c Ziegler, Fredrick E.; Metcalf, Chester A.; Nangia, Ashwini; Schulte, Gayle (1993). "Structure and total synthesis of sporol and neosporol". J. Am. Chem. Soc. 115 (7): 2581–2589. doi:10.1021/ja00060a006.
- ^ a b Caster, Kenneth C.; Rao, A. Somasekar; Mohan, H. Rama; McGrath, Nicholas A.; Brichacek, Matthew (2012). "Trifluoroperacetic Acid". e-EROS Encyclopedia of Reagents for Organic Synthesis. doi:10.1002/047084289X.rt254.pub2. ISBN 978-0471936237.
- ^ Cooper, Mark S.; Heaney, Harry; Newbold, Amanda J.; Sanderson, William R. (1990). "Oxidation Reactions Using Urea–Hydrogen Peroxide; A Safe Alternative to Anhydrous Hydrogen Peroxide". Synlett. 1990 (9): 533–535. doi:10.1055/s-1990-21156.
- ^ Hagen, Timothy J. (2007). "Prilezhaev reaction". In Li, Jie Jack; Corey, E. J. (eds.). Name Reactions of Functional Group Transformations. John Wiley & Sons. pp. 274–281. ISBN 9780470176504.



![{\displaystyle {\ce {->[{\ce {NaBAr4}}][{\text{30 °C / 5 min}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3fb42849d6133fe653a7fe5dd019b12e0f6184b5)



