트리플루오페라세트산
Trifluoroperacetic acid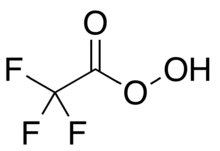 | |
| 이름 | |
|---|---|
| 선호 IUPAC 이름 트리플루오로에탄페록소산 | |
기타 이름
| |
| 식별자 | |
3D 모델(JSmol) | |
| 켐스파이더 | |
펍켐 CID | |
| |
| |
| 특성. | |
| C2HF3O3 | |
| 어금질량 | 130.022 g·192−1 |
| 외관 | 무색 액체 |
| 비등점 | 162°C(324°F, 435K) |
| 용해성 | 아세토나이트릴, 디클로로메탄, 디에틸에테르, 설폴렌에 녹는다. |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
트리플루오페라세트산(Trifluoroperoxyacetic acid, TFPAA)은 유기농 루오린 화합물로, 트리플루오로아세트산의 과옥시산 아날로그로, 응축된 구조 공식
3 CFCOOOH이다.[Note 1]케톤(케톤)의 배이어-빌라이거 산화와 같이 유기 산화 반응을 위한 강한 산화제다.[1]유기 과산화산 중 가장 반응성이 높아 상대적으로 비반응성 알케인을 다른 과산화산이 효과가 없는 에폭시드로 성공적으로 산화시킬 수 있다.[2]그것은 또한 셀레노어를 자기 것으로 변형시키는 것과 같은 일부 기능 그룹의 찰코균을 산화시킬 수 있다.[3]폭발 가능성이 있는 소재여서[4] 상업적으로 구할 수 없지만 필요에 따라 신속하게 준비할 수 있다.[5]실험실용 시약으로 사용한 것은 윌리엄 D에 의해 개척되고 개발되었다. 에몬스.[6][7]
특성.
표준 주위 온도와 압력에서 삼불화오페라세트산은 비등점이 162 °C인 무색 액체다.[8]아세토나이트릴, 디클로로메탄, 디에틸에테르, 설폴레인 등에 용해되며 물과 쉽게 반응한다.[5]모든 과산화산과 마찬가지로 잠재적으로 폭발성이 있으며 세심한 취급이 필요하다.[4]상업적으로 구할 수는 없지만, 실험실에서 제작하여 -20℃에서 최대 몇 주 동안 저장할 수 있다.[5]일부 준비 방법은 과산화수소와 삼불화탄산 잔류수소를 함유한 혼합물을 발생시키며, 그러한 혼합물을 가열하는 것은 매우 위험하다; 과산화수소는 가열하기 전에 안전을 위해 이산화망간을 사용하여 분해될 수 있다.[5][8]
준비
삼불화합산은 과산화수소의 농축(90%)[2] 수용액으로 삼불화합물을 처리하는 유기합성[9] 공정을 통해 쉽게 준비할 수 있다.
- CFCOOCOCF
3
3 + HO
2
2 → CFCOOOH
3 + CFCOOH
3
무수화물은 물과 접촉하여 삼불화아세트산을 형성하므로 무수화물의 과다는 과산화 반응제로부터 용매를 제거하는 역할을 한다.[9]
- CFCOOCOCF
3
3 + HO
2 → 2 CFCOOH
3
보다 희석된 과산화수소 용액(30%)을 사용하여 트리플루오로아세트산의 일부 반응을 위해 트리플루오르오페아세트산을 형성할 수 있다.[2]
- CFCOOH
3 + HO
2
2 → CFCOOOH
3 + HO
2
과산화수소의 순수 또는 고농축 용액을 취급하는 위험을 피하기 위해 과산화수소-요소를 사용하여 과산화수소를 투여할 수 있다.[5]이 방법은 물을 전혀 포함하지 않기 때문에 완전히 무수 과산염을 주는데,[10] 특정 산화 반응 시 물의 존재로 인해 부작용이 발생할 경우 장점이다.[11]
- CFCOOCOCF
3
3 + HO
2
2·CO(NH
2)
2 → CFCOOOH
3 + CFCOOH
3 + CO(NH
2)
2
합성을 위해 pH 완충제가 필요하고 물의 존재가 용인되는 경우, 또 다른 접근법이 개발되었다.과탄산나트륨과 함께 3불화수소계 무수화물 반응, 2NaCO
2
3/3HO
2
2, trifluoroperacetic acid와 탄산 나트륨을 산출하여 추가 완충제의 필요성을 제거한다.[5][12]
- 3 CFCOOCOCF
3
3 + 4 NaCO
2
3/1+1⁄2HO
2
2 → 6 CFCOOOH
3 + 4 NaCO
2
3 + 3 HO
2
트리플루오페라세트산도 현장에서 생성될 수 [13]있어 나중에 사용하기 위해 시약 한 묶음을 미리 합성하는 것이 아니라 대상 기질에 신속하게 반응할 수 있다.
사용하다
Trifluoroperacetic acid는 주로 산화제로 사용된다.[5][7]1953년 9월, 미국 화학 협회 저널은 윌리엄 D의 작품을 출판했다. 에몬스와 아서 F. 현장에서 생성된 이 시약이 아닐린을 니트로벤젠으로 산화시킬 수 있다고 보고한 페리스.[13]다음 2년에 걸쳐 에몬스와 이 저널에 응용에 대한 6추가 원고 출판된;[14][15][16]Emmons 부분에trifluoroperacetic 산성의 이후 시약으로 쓸모 있는 실험실 시약, pioneer[6]과 developer[7]는 만큼 많은 다른 t. 것으로 이 시약에 대한 예비의 법 보도했다syntheti의 ypesc 반응
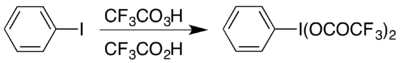
한 예로 고밸런트 요오드화합물(bis(trifluoracetoxy)iodo)벤젠, (CFCOO
3)
2의 형성이 있다.산성 조건에서 Hofmann 재배치를 수행하는 데 사용되는 ICH
6
5.[17]고밸런트 화합물은 두 가지 방법으로 접근할 수 있으며, 어떤 물질은 사용 가능한 물질에 따라 선택된다: 교환 반응에 의해 아세테이트 아날로그로부터 준비될 수 있다.[18] 또는 트리플루오페아세트산과 트리플루오프로아세트산의 조합으로 요오드오벤젠을 반응시켜 사용할 수 있다.[17]
배이어-빌라이거 산화

트리플루오페라세트산은 유사한 과산화물과 과산화물에 비해 높은 산도의 결과로 배이어-빌라이거 산화에 사용되는 가장 강력한 시약 중 하나이다.[19]: 17 이 반응은 케톤을 직선 사슬 에스테르나 락토네로 변환시키고, 1899년 처음 보고한 아돌프 폰 배이어와 빅토르 빌라이거의 이름을 따서 명명한다.[1]이 반응은 Criege 중간을[5] 통해 진행된다고 믿으며, 산소 원자 삽입 위치에 대한 양호한 재열성 및 화학적 선택성을 보여주고, 다음 예에서 볼 수 있듯이 인접 위치에 입체화학이 유지된다.이소듐인산(NaHPO
2
4)을 pH 완충제로[2] 첨가하여 산성이 높은 트리플루오로아세트산 부산물이 에스테르 제품의 가수분해[20] 또는 트랜세스터를[21] 유발하지 않도록 방지한다.
에폭시디화
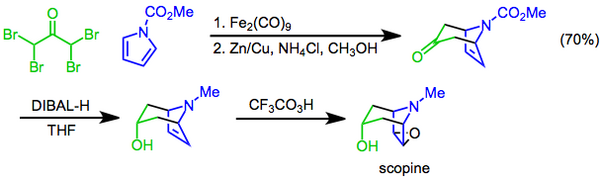
프릴레자예프 반응은 과산화물을 산화제로[22] 사용한 알켄을 에폭시드로 변환하는 것을 포함하며 1909년에 처음 보고되었다.[23]이 반응은 트로판 알칼로이드인 스코핀 합성의 마지막 단계로 사용되어 왔다.이 접근법에서는 디아이론 논아카르보닐에 의해 매개된 [4+3] 사이클로 추가가 사용되어 자전거 골격을 구성하고, 이어 디이소부틸루미눔 하이드라이드를 사용한 케톤에 대한 이질회수감소 및 프리레즈해프 3플루오페라세트산 에폭시드로 완성된 제제를 도입한다.[24]
다른 과산화산에 비해 트리플루오르오페아세트산의 높은 반응성은 과산화산화에 일반적으로 내성이 있는 기판인 메틸메타크릴레이트 등 상대적으로 전자가 부족한 알케인과 α, β-불포화 에스테르를 성공적으로 산화시킬 수 있게 한다.[2]혼합물에 완충된 트리플루오로아세트산을 추가하면 에폭시드 대신 비실하이드록시-트리플루오로아세테이트 구조를 갖게 되는데, 이는 다음과 같이 1도데시엔을 1,2도데카니올로 변환하는 경우와 같이 산성 메탄올로 처리하여 디올로 변환할 수 있다.[2]
근위 카보닐 기능군을 가진 아릴 알코올 화합물의 경우 에폭시드는 링 팽창 반응을 거쳐 다이옥솔린을 형성할 수 있다.[5][11]아래의 프로세스는 천연 제품인 네오스포롤의 총합성의 일부로 사용되었다.[11][25]
이소성 화합물의 준비는 유사한 다이옥솔란 형성을 수반했다.이 경우, 과산화수소에서 유래한 트라이플루오페아세트산을 사용했는데, 따라서 물의 흔적이 있을 것으로 추정되며, 이는 닫힌 링 다이옥솔레인보다는 대부분 헤미아세트산(hemiacetal)을 주었다.무수 재료를 주었던 요소 콤플렉스의 활용으로 디옥솔레인이 주산물이 됐다.[11]다이옥솔레인은 합성의 후반 단계에서 스포톨에서 발견된 1,3-다이옥산 계통으로 확장된다.[25]
이질 원자 산화
산화력이 낮은 상태에서 이질성을 포함하는 기능군은 트리플루오르오페아세트산에 의해 산화될 수 있다.[5][7]일반적인 경우로는 요오드의 산화(예를 들어, 앞에서 언급한 요오드오벤젠에서 고밸런트 요오드 화합물의 형성), 질소, 유황, 셀레늄 등이 있다.
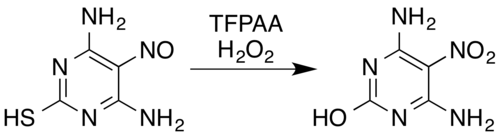
nitrogen-containing 화합물의 경우, 알고 있는 변화 향기로운 N-oxides고 향기로우azine N-oxides,[5]는 경우 2nitramines,[7][14]을 형성하는데 oximes[5]고 향기로우일차 amines[15]compounds[7](electron-withdrawing substituents으로 예를 들어, pentafluoroaniline pentafluoronitrobenzene[26]에)nitro에, nitrosamines을 포함한다.7해결과 nitroso의 변환.니트로 화합물 또는 니트라민에 대한 [5]화합물예를 들어 과산화수소와 트라이플루오페라세트산의 혼합물은 니트로소 대체 피리미딘 4,6-디아미노-5-니트로소피리미딘-2-thiol을 니트로 아날로그로 산화시키는 동시에 산화 가수분해성 탈황에 의한 티올 모이티티를 제거한다.[5][28]
찰코겐 원소의 경우, 황화 모이에티(R–S–R)는 사용된 조건에 따라 삼불화오페아세트산에 의해 황산화물(R–S(O)–R) 및/또는 황화수소(R–S(O)–2R) 형태로 산화될 수 있다.[5]아날로그 셀레늄 시스템에서 셀레노어(R–Se–R)의 트리플루오페라세트산 산화는 관련 셀레녹시드(R–Se(O)–R)를 분리 가능한 제품으로 형성하지 않고 셀론(R–Se(O)–2R)을 생성하는데,[3] 이 반응은 R이 아릴 그룹일 때 특히 효과적이다.[29]일반적으로 황화비닐염화합물(RS(O)Cl)의 형성에 대한 접근방식은 해당 티올과 염화황산염화황(SOCl
2
2)의 반응이다.대신 황화염화물(RSCl)이 발생하는 경우, 2,2,2-트리플루오로-1,1-디페닐타네티올의 경우와 같이 후속 3불화오페라세트산 산화는 원하는 제품을 제공한다.[30]
티오페네의 트리플루오르페아세트산 산화는 S-산소와 에폭시드가 모두 가능한 반응 경쟁 경로를 보여준다.[31][Note 2]주요 경로는 처음에는 황산화물을 형성하지만, 이 화학 물질은 더 이상의 산화가 발생하기 전에 즉시 디엘-알데르 형태의 조광화를 거친다. 티오펜-S-S, S-다이옥사이드 중 어느 것도 반응 제품에서 발견되지 않는다.[5][31]그러면 디머는 더 산화되어 S-산화 모이에티 중 하나를 S-S-dioxide로 변환할 수 있다.소반응 경로에서 프리레즈해프 에폭시드는[22] 티오페네-2-1로 빠르게 재배열되는 티오페네-2,3-에폭시드를 형성한다.[31]트랩 실험은[35] 이 에폭시드 경로가 S-산화질소 중간계의 대체 반응이 아님을 증명하고, 동위원소 라벨링 실험은 1,2-하이드리드 시프트(NIH 시프트)가 발생하여 양이온성 중간이 관여한다는 것을 증명한다.[31]물이 경미한 반응 경로를 억제하기 때문에 경미한 반응 경로를 억제하기 때문에 삼불산 준비 방법의 선택이 중요하다.[31]
산성 재배열을 통한 산화
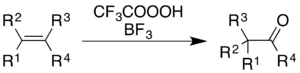
붕소삼불화합물과 함께 트리플루오페아세트산을 사용하면 분자골격의 일치 재배열과 함께 알케인과 방향족 고리의 산화가 발생한다.[5]
알케인의 경우, 기계론적 과정이 단순히 BF를3 이용한 바그너-메르바인 재배치에 따르는 것은 아니지만, 이 반응은 케톤 제품을 제공한다.[36]
아로마틱스의 경우, 유기합성 보고서에서 입증된 예는 1,2,3,4,5,6-헥사메틸벤젠을 2,3,4,5,6-헥사메틸-2,4-사이클로헥사디엔온으로 변환하는 것이다.[9]
산화아레네 갈라짐
방향족 링의 단순한 산화 작용으로 카보닐 화합물을 형성할 수 있을 뿐만 아니라(산성 재배열을 통한 § 산화 참조), 트리플루오페라세트산은 링 내에서 탄소-탄소 결합을 완전히 분리할 수 있다.반응성 벤질 위치에서 알킬 체인의 갈라짐으로 벤조산과 관련 화합물을 생성하는 알킬로메틱 구조의 다른 산화와는 달리, 트리플루오로페아세트산은 "역방향 산화"를 일으켜 알킬군은 그대로 두고 방향족 링 자체를 갈라 놓는다.[37][38]
특정 유형의 결합에 대한 이러한 선택성은 구조적 세부사항을 결정하기 위해 석탄과 같은 탄화수소의 복합 혼합물을 분해하는 데 사용될 수 있다.[39][37]
이질 원자 산화가 우선적으로 일어나고 과록시산에 의한 전기적 공격을 향한 고리를 비활성화하기 때문에 이질 원자 산화를 포함하는 방향족 시스템은 이 링 개방에 내성이 있다.예를 들어 청진, 피리딘, 퀴놀린은 대신 N-산화물을 형성하고,[5] 옥타플루오디벤조티오페인과 같은 유황계통은 황산으로 변환된다.[7][40]
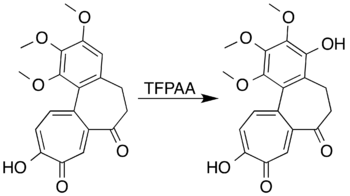
링 활성 대체물이 있는 방향족 시스템은 링 개방 반응을 거치지 않고 산화하여 페놀을 형성할 수 있다.예를 들어, 미비엔은 트리플루오르오페아세트산과 반응하여 메시톨(2,4,6-트리메틸페놀)을 형성한다.[7]배이어-빌라이거 산화에 의해 7-oxodeacetamidocolchechnology의 락톤을 형성하려는 연구자들은 원하는 제품을 준비할 수는 없었지만, 높은 수율의 페놀-이발제를 생산하기 위해 방향족 링의 산화를 달성했다.[5][41]
메모들
참조
- ^ a b Kürti, László; Czakó, Barbara (2005). Strategic Applications of Named Reactions in Organic Synthesis. Elsevier Academic Press. p. 28. ISBN 9780124297852.
- ^ a b c d e f Hiyama, Tamejiro (2000). "8.2 Trifluoroacetic acid and Trifluoroperacetic acid". Organofluorine Compounds: Chemistry and Applications. Springer Science & Business Media. pp. 255–257. ISBN 9783662041642.
- ^ a b Kataoka, T.; Yoshimatsu, M. (1995). "Alkyl Chalcogenides: Selenium- and Tellurium-based Functional Groups". In Ley, Steven V. (ed.). Synthesis: Carbon with One Heteroatom Attached by a Single Bond. Comprehensive Organic Functional Group Transformations. Elsevier. pp. 277–296. ISBN 9780080423234.
- ^ a b Carey, Francis A.; Sundberg, Richard J. (2007). "5.5 Addition Reactions Involving Epoxides". Advanced Organic Chemistry: Part A: Structure and Mechanisms (5th ed.). Springer Science & Business Media. pp. 503–514. ISBN 9780387448978.
- ^ a b c d e f g h i j k l m n o p q r s Caster, Kenneth C.; Rao, A. Somasekar; Mohan, H. Rama; McGrath, Nicholas A.; Brichacek, Matthew (2012). "Trifluoroperacetic Acid". Encyclopedia of Reagents for Organic Synthesis. e-EROS Encyclopedia of Reagents for Organic Synthesis. doi:10.1002/047084289X.rt254.pub2. ISBN 978-0471936237.
- ^ a b Freeman, Jeremiah P. (November 14, 2002). "William D. Emmons: November 18, 1924 – December 8, 2001" (PDF). Org. Synth. 80: xxvii–xxix. Archived from the original (PDF) on March 16, 2015. Retrieved January 21, 2017.
- ^ a b c d e f g h Chambers, Richard D. (2004). "Functional Compounds Containing Oxygen, Sulphur or Nitrogen and their Derivatives". Fluorine in Organic Chemistry. CRC Press. pp. 242–243. ISBN 9780849317903.
- ^ a b Luxon, S. G. (1992). Hazards in the Chemical Laboratory (5th ed.). Royal Society of Chemistry. p. 627. ISBN 9780851862293.
- ^ a b c Hart, Harold; Lange, Richard M.; Collins, Peter M. (1968). "2,3,4,5,6,6-Hexamethyl-2,4-cyclohexadien-1-one". Organic Syntheses. 48: 87. doi:10.15227/orgsyn.048.0087.; Collective Volume, vol. 5, p. 598
- ^ Cooper, Mark S.; Heaney, Harry; Newbold, Amanda J.; Sanderson, William R. (1990). "Oxidation Reactions Using Urea–Hydrogen Peroxide; A Safe Alternative to Anhydrous Hydrogen Peroxide". Synlett. 1990 (9): 533–535. doi:10.1055/s-1990-21156.
- ^ a b c d Ziegler, Fredrick E.; Metcalf, Chester A.; Nangia, Ashwini; Schulte, Gayle (1993). "Structure and total synthesis of sporol and neosporol". J. Am. Chem. Soc. 115 (7): 2581–2589. doi:10.1021/ja00060a006.
- ^ Kang, Ho-Jung; Jeong, Hee-Sun (1996). "New Method of Generating Trifluoroperoxyacetic acid for the Baeyer-Villiger Reaction". Bull. Korean Chem. Soc. 17 (1): 5–6.
- ^ a b Emmons, William D.; Ferris, Arthur F. (1953). "Oxidation Reactions with Pertrifluoroacetic Acid". J. Am. Chem. Soc. 75 (18): 4623–4624. doi:10.1021/ja01114a539.
- ^ a b Emmons, William D. (1954). "Peroxytrifluoroacetic Acid. I. The Oxidation of Nitrosamines to Nitramines". J. Am. Chem. Soc. 76 (13): 3468–3470. doi:10.1021/ja01642a029.
- ^ a b Emmons, William D. (1954). "Peroxytrifluoroacetic Acid. II. The Oxidation of Anilines to Nitrobenzenes". J. Am. Chem. Soc. 76 (13): 3470–3472. doi:10.1021/ja01642a030.
- ^ Emmons, William D.; Pagano, Angelo S.; Freeman, Jeremiah P. (1954). "Peroxytrifluoroacetic Acid. III. The Hydroxylation of Olefins". J. Am. Chem. Soc. 76 (13): 3472–3474. doi:10.1021/ja01642a031.
Emmons, William D.; Pagano, Angelo S. (1955). "Peroxytrifluoroacetic Acid. IV. The Epoxidation of Olefins". J. Am. Chem. Soc. 77 (1): 89–92. doi:10.1021/ja01606a029.
Emmons, William D.; Lucas, George B. (1955). "Peroxytrifluoroacetic Acid. V. The Oxidation of Ketones to Esters". J. Am. Chem. Soc. 77 (8): 2287–2288. doi:10.1021/ja01613a077.
Emmons, William D.; Pagano, Angelo S. (1955). "Peroxytrifluoroacetic Acid. VI. The Oxidation of Oximes to Nitroparaffins". J. Am. Chem. Soc. 77 (17): 4557–4559. doi:10.1021/ja01622a036. - ^ a b Aubé, Jeffrey; Fehl, Charlie; Liu, Ruzhang; McLeod, Michael C.; Motiwala, Hashim F. (1993). "6.15 Hofmann, Curtius, Schmidt, Lossen, and Related Reactions". Heteroatom Manipulations. Comprehensive Organic Synthesis II. Vol. 6. pp. 598–635. doi:10.1016/B978-0-08-097742-3.00623-6. ISBN 9780080977430.
- ^ Almond, M. R.; Stimmel, J. B.; Thompson, E. A.; Loudon, G. M. (1988). "Hofmann Rearrangement Under Mildly Acidic Conditions Using [I,I-Bis(Trifluoroacetoxy)]Iodobenzene: Cyclobutylamine Hydrochloride from Cyclobutanecarboxamide". Organic Syntheses. 66: 132. doi:10.15227/orgsyn.066.0132.; Collective Volume, vol. 8, p. 132
- ^ Myers, Andrew G. "Chemistry 115 Handouts: Oxidation" (PDF). Harvard University. Retrieved 10 January 2017.
- ^ Carruthers, William (1971). "6.3 Oxidation of Olefins". Some Modern Methods of Organic Synthesis. Cambridge University Press. pp. 259–280. ISBN 9780521096430.
- ^ Carruthers, William (1971). "6.5 Baeyer–Villiger oxidation of ketones". Some Modern Methods of Organic Synthesis. Cambridge University Press. pp. 287–290. ISBN 9780521096430.
- ^ a b Hagen, Timothy J. (2007). "Prilezhaev reaction". In Li, Jie Jack; Corey, E. J. (eds.). Name Reactions of Functional Group Transformations. John Wiley & Sons. pp. 274–281. ISBN 9780470176504.
- ^ Prileschajew, Nikolaus (1909). "Oxydation ungesättigter Verbindungen mittels organischer Superoxyde" [Oxidation of unsaturated compounds by means of organic superoxides]. Ber. Dtsch. Chem. Ges. (in German). 42 (4): 4811–4815. doi:10.1002/cber.190904204100.
- ^ Hayakawa, Y.; Baba, Y.; Makino, S.; Noyori, R. (1978). "Carbon-carbon bond formation promoted by transition metal carbonyls. 19. General synthesis of tropane alkaloids via the polybromo ketone-iron carbonyl reaction". J. Am. Chem. Soc. 100 (6): 1786–1791. doi:10.1021/ja00474a021.
- ^ a b Pirrung, Michael C.; Morehead, Andrew T.; Young, Bruce G., eds. (2000). "10. Neosporol, Sporol". Part B: Bicyclic and Tricyclic Sesquiterpenes. The Total Synthesis of Natural Products. Vol. 11. John Wiley & Sons. pp. 222–224. ISBN 9780470129630.
- ^ Brooke, G. M.; Burdon, J.; Tatlow, J. C. (1961). "Aromatic polyfluoro-compounds. Part VII. The reaction of pentafluoronitrobenzene with ammonia". J. Chem. Soc.: 802–807. doi:10.1039/JR9610000802.
- ^ Williams, W. Michael; Dolbier, William R. (1969). "Thermal and photochemical rearrangements of azine oxides. I. Pyrolytic decomposition to nitriles". J. Org. Chem. 34 (1): 155–157. doi:10.1021/jo00838a034.
- ^ Taylor, Edward C.; McKillop, Alexander (1965). "A New Synthesis of 5-Nitropyrimidines". J. Org. Chem. 30 (9): 3153–3155. doi:10.1021/jo01020a067.
- ^ Taylor, P. C. (1995). "Vinyl and Aryl Chalcogenides: Sulfur-, Selenium- and Tellurium-based Functional Groups". In Ley, Steven V. (ed.). Synthesis: Carbon with One Heteroatom Attached by a Single Bond. Comprehensive Organic Functional Group Transformations. Elsevier. pp. 705–736. ISBN 9780080423234.
- ^ Page, P. C. B.; Wilkes, R. D.; Reynolds, D. (1995). "Alkyl Chalcogenides: Sulfur-based Functional Groups". In Ley, Steven V. (ed.). Synthesis: Carbon with One Heteroatom Attached by a Single Bond. Comprehensive Organic Functional Group Transformations. Elsevier. pp. 113–276. ISBN 9780080423234.
- ^ a b c d e Treiber, Alexander (2002). "Mechanism of the Aromatic Hydroxylation of Thiophene by Acid-Catalyzed Peracid Oxidation". J. Org. Chem. 67 (21): 7261–7266. doi:10.1021/jo0202177. PMID 12375952.
- ^ Mansuy, Daniel; Valadon, Philippe; Erdelmeier, Irene; López Garcia, Pilar; Amar, Claudine; Girault, Jean-Pierre; Dansette, Patrick M. (1991). "Thiophene S-Oxides as new Reactive Metabolites: Formation by Cytochrome P-450 Dependent Oxidation and Reaction with Nucleophiles". J. Am. Chem. Soc. 113 (20): 7825–7826. doi:10.1021/ja00020a089.
- ^ Correia, Maria A.; Hollenberg, Paul F. (2015). "Inhibition of Cytochrome P450 Enzymes". In Ortiz de Montellano, Paul R. (ed.). Cytochrome P450: Structure, Mechanism, and Biochemistry (4th ed.). Springer. pp. 177–260. ISBN 9783319121086.
- ^ Macherey, Anne-Christine; Dansette, Patrick M. (2015). "Biotransformations Leading to Toxic Metabolites:Chemical Aspects". In Wermuth, Camille Georges; Aldous, David; Raboisson, Pierre; Rognan, Didier (eds.). The Practice of Medicinal Chemistry (4th ed.). Elsevier. pp. 585–614. ISBN 9780124172135.
- ^ Anslyn, Eric V.; Dougherty, Dennis A. (2006). "8.8 Miscellaneous Experiments for Studying Mechanism". Modern Physical Organic Chemistry. University Science Books. pp. 471–482. ISBN 9781891389313.
- ^ Hart, Harold; Lerner, Lawrence R. (1967). "Oxidations with peroxytrifluoroacetic acid-boron trifluoride. IX. Direct oxidation of alkenes to ketones using peroxytrifluoroacetic acid–boron fluoride". J. Org. Chem. 32 (9): 2669–2673. doi:10.1021/jo01284a004.
- ^ a b Deno, Norman C.; Greigger, Barbara A.; Stroud, Stephen G. (1978). "New method for elucidating the structures of coal". Fuel. 57 (8): 455–459. doi:10.1016/0016-2361(78)90153-9.
- ^ Deno, Norman C.; Greigger, Barbara A.; Messer, Lauren A.; Meyer, Michael D.; Stroud, Stephen G. (1977). "Aromatic ring oxidation of alkylbenzenes". Tetrahedron Lett. 18 (20): 1703–1704. doi:10.1016/S0040-4039(01)93253-8.
- ^ Deno, Norman C.; Curry, Kenneth W.; Greigger, Barbara A.; Jones, A. Daniel; Rakitsky, Walter G.; Smith, Karen A.; Wagner, Karen; Minard, Robert D. (1980). "Dihydroaromatic structure of Illinois No. 6 Monterey coal". Fuel. 59 (10): 694–698. doi:10.1016/0016-2361(80)90021-6.
- ^ Chambers, R. D.; Cunningham, J. A.; Spring, D. J. (1968). "Polyfluoroaryl organometallic compounds. Part VIII. Synthesis of and nucleophilic substitution in octafluorodibenzofuran". J. Chem. Soc. C: 1560–1565. doi:10.1039/J39680001560.
- ^ Berg, Ulf; Bladha, Håkan; Mpamposa, Konstantinos (2004). "Stereochemical variations on the colchicine motif. Peracid oxidation of thiocolchicone. Synthesis, conformation and inhibition of microtubule assembly". Org. Biomol. Chem. 2 (14): 2125–2130. doi:10.1039/B402840F. PMID 15254641.