차가스병
Chagas disease| 차가스병 | |
|---|---|
| 기타 이름 | 미국의 트라이파노소미아시스 |
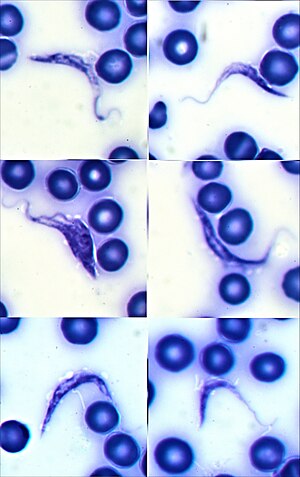 | |
| 인간의 피 속에 있는 지엠사(Giemsa)에 얼룩진 트라이파노소마 크루지 트라포마스티고테의 광학사진 | |
| 발음 |
|
| 전문 | 전염병 |
| 증상 | 열, 큰 림프절, 두통[1] |
| 합병증 | 심부전, 식도 확대, 대장[1] 확대 |
| 원인들 | 벌레에게[1] 키스하여 퍼진 트라이파노소마 크루지 |
| 진단법 | 혈액에서[2] 기생충, DNA 또는 항체를 찾는 것 |
| 예방 | 키스 벌레 제거 및 물림[1] 방지 |
| 약물 | 벤츠니다졸, 니푸르트이목스[1] |
| 빈도 | 650만(2019년)[3] |
| 죽음 | 9,490 (2019)[3] |
미국의 트라이파노소마증이라고도 불리는 샤가스병은 트라이파노소마 크루지에 의해 발생하는 열대기생성 질환이다.그것은 "키싱 벌레"로 알려진 트라이아토민아과에 속하는 곤충들에 의해 주로 퍼진다.감염이 진행되는 동안 증상은 변한다.초기에는 일반적으로 증상이 나타나지 않거나 경미하며, 발열, 림프절 붓기, 두통, 물린 부위에 붓기 등이 있을 수 있다.[1]4~8주가 지나면 치료되지 않은 개인은 만성적인 질병 단계로 접어들게 되는데, 대부분의 경우 더 이상의 증상이 나타나지 않는다.[2][4]만성 감염자의 최대 45%가 초기 질환 후 10~30년이 지나면 심장질환이 발생하는데, 이는 심부전으로 이어질 수 있다.식도 확대나 대장 확대 등 소화기 합병증도 21%까지 발생할 수 있으며 10%까지 신경 손상을 경험할 수 있다.[2]
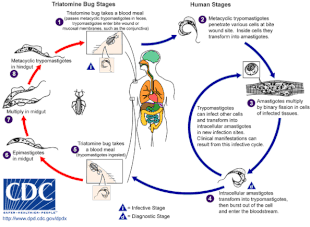
T. cruzi는 일반적으로 키스 벌레의 물림으로써 인간과 다른 포유류에게 전파된다.[5]이 병은 또한 수혈, 장기 이식, 기생충에 오염된 음식이나 음료 섭취, 그리고 (산모에서 아기까지) 수직 전염을 통해서도 전파될 수 있다.[1]초기 질환 진단은 현미경을 이용해 혈액 속 기생충을 찾거나 중합효소 연쇄반응에 의해 DNA를 검출하는 것이다.[4]만성질환은 혈액에서 T.크루지 항체를 발견함으로써 진단된다.[6]
예방은 키스 벌레들을 제거하고 그들의 물림을 피하는 데 초점을 맞춘다.[1]이것은 살충제나 모기장의 사용을 포함할 수 있다.[7]다른 예방적 노력으로는 수혈에 사용되는 혈액을 검사하는 것도 있다.2022년[update] 현재 백신은 개발되지 않았다.초기 감염은 벤츠니다졸이나 니푸르트이목스(nifurtimox) 약으로 치료할 수 있는데, 보통 사람이 감염된 직후에 주면 병을 치료하지만, 샤가스병에 걸린 지 오래되면 효과가 떨어진다.만성질환에 사용할 경우 약물치료가 말기 증상 발달을 지연시키거나 예방할 수 있다.벤츠니다졸과 니푸르트미녹스는 피부질환, 소화기 계통 자극, 신경증상 등 부작용을 일으키는 경우가 많아 치료가 중단될 수 있다.[2][8]2019년[update] 현재 차가스병 신약 개발이 진행 중이며, 동물 모델에서 실험용 백신이 연구되고 있다.[9][10]
2019년 현재 주로 멕시코, 중앙아메리카, 남미에서 650만명이 차가스 질환을 앓고 [1][3]있어 연간 약 9,490명이 사망하는 것으로 추산된다.[3]그 병에 걸린 대부분의 사람들은 가난하고,[11] 대부분의 사람들은 그들이 감염되었다는 것을 깨닫지 못한다.[12]대규모 인구이동으로 미국과 많은 유럽 국가들이 포함된 차가스병이 새로운 지역으로 옮겨졌다.[1]그 질병은 150종 이상의 동물들에게 영향을 미친다.[13]
이 병은 1909년 브라질의 의사 카를로스 샤가스에 의해 처음 설명되었고, 그 이름을 따서 이름이 지어졌다.[1]차가스병은 방치된 열대성 질환으로 분류된다.[14]
징후 및 증상
차가스병은 두 단계로 나누어 발생하는데, 곤충에 물린 후 1~2주 후에 발병하는 급성기와 여러 해에 걸쳐 발병하는 만성 단계다.[2][4][15]급성기에는 증상이 없는 경우가 많다.[2]증상이 나타나면 일반적으로 경미하며 특정 질병에 특정되지 않는다.[4]증상과 증상으로는 발열, 병해, 두통, 간, 비장, 림프절 확대 등이 있다.[1][2][4]간혹 감염 부위에서 부어오른 결절이 생기기도 하는데, 눈꺼풀에 있으면 '로마냐 사인'이라고 하고, 피부 다른 곳에 있으면 '차고마'라고 한다.[4][16]드물게(1~5% 미만) 감염자가 심장근육 염증, 심장주위액 축적, 뇌와 주변조직 염증 등을 동반할 수 있는 중증 급성질환에 걸리며 생명을 위협할 수 있다.급성기는 보통 4~8주 정도 지속되며 치료 없이 해소된다.[2]
항타라스틱 약물로 치료하지 않는 한, 개인은 급성기에서 회복한 후에도 T. 크루지에 감염된 채로 남아 있다.대부분의 만성 감염은 증상이 없으며, 이를 불규칙한 만성 샤가스병이라고 한다.그러나 수십 년 동안 이 질병으로 인해 약 30~40%의 사람들이 장기 기능장애(만성 샤가스병 결정)를 앓고 있는데, 이는 심장이나 소화기관에 가장 자주 영향을 미친다.[2][4]
가장 흔한 장기 징후는 심장질환으로 만성 차가스병 환자의 14~45%에서 발생한다.[2]샤가스 심장병을 앓고 있는 사람들은 종종 심장 기능이 불규칙해서 심장이 두근거리고 때때로 실신하는 것을 경험한다.심전도에 따르면, 차가스 심장병에 걸린 사람들은 부정맥이 가장 자주 나타난다.병이 진행되면 심장의 심실이 비대해져(질식 심근증) 혈액을 펌프질하는 능력이 저하된다.많은 경우에 차가스 심장병의 첫 징후는 심부전, 혈전증, 또는 미세조직의 이상과 관련된 가슴통증이다.[17]
만성 샤가스병에서도 흔히 볼 수 있는 것은 소화기 계통의 손상이며, 이는 사람의 10~21%에 영향을 미친다.[2]식도나 결장의 확대는 가장 흔한 소화기 질환이다.[15]식도가 비대해진 사람들은 흔히 통증(오디노파기증)이나 삼키는 데 어려움을 겪는다(디스피기증), 산성 역류, 기침, 체중 감소를 경험한다.대장장이 커진 사람은 변비를 자주 겪으며 장이나 혈액 공급이 심하게 막힐 수 있다.만성적으로 감염된 사람의 최대 10%는 무감각과 변화된 반사 또는 움직임을 유발할 수 있는 신경 손상을 유발한다.[2]일반적으로 만성질환이 수십 년에 걸쳐 발병하는 반면 샤가스병(10% 미만)을 앓는 일부 개인은 급성질환 직후 심장마비로 진행되기도 한다.[17]
흔하지 않은 경로를 통해 T. 크루지에 감염된 사람에게는 징후와 증상이 다르다.기생충 섭취를 통해 감염되는 사람은 섭취 후 3주 이내에 중증 질환이 발생하기 쉬운데, 발열, 구토, 호흡곤란, 기침, 가슴, 복부, 근육통 등의 증상이 나타난다.[2]선천적으로 감염되는 증상은 대개 거의 없거나 증상이 거의 없지만 가벼운 비특이성 증상이나 황달, 호흡곤란, 심장병 등의 심각한 증상이 나타날 수 있다.[2]장기이식이나 수혈을 통해 감염된 사람은 벡터 매개 질환과 비슷한 증상을 보이는 경향이 있지만 일주일에서 5개월 동안 증상이 나타나지 않을 수 있다.[2]HIV 감염으로 인해 면역억제제가 된 만성 감염자들은 특히 심각하고 뚜렷한 질병을 겪을 수 있는데, 가장 흔한 특징은 뇌와 주변 조직 또는 뇌의 종기에 염증이 있는 것이다.[4]증상은 뇌종양의 크기와 위치에 따라 크게 다르지만 일반적으로 발열, 두통, 발작, 감각 상실 또는 신경계 손상의 특정 부위를 나타내는 다른 신경학적 문제를 포함한다.[18]때때로 이러한 사람들은 급성 심장염, 피부병변, 위, 장, 복막의 질병을 경험하기도 한다.[4]
원인
차가스병은 원생동물 기생충 T. 크루지에 감염되어 발생하는 것으로, 일반적으로 삼원자 벌레의 물림을 통해 인간에게 유입되는데, 이를 '키싱 벌레'라고도 한다.[4]벌레가 물린 곳에서 배변을 하면 트립포마스티고테라고 불리는 모빌레 T. 크루지 형태가 혈류로 들어가 각종 숙주세포를 침범한다.[5]숙주세포 안에서 기생충은 아마스티고테라고 불리는 복제형태로 변하는데, 이것은 여러 차례의 복제를 거친다.[5]복제된 아마스티고테는 다시 trypomastigotes로 변환되는데, 이 trypomastigotes는 숙주세포를 터뜨려 혈류로 방출된다.[2]그리고 나서 트라포마스티고테는 세포에 침입하여 복제하는 다양한 조직으로 몸 전체에 퍼진다.[2]여러 해 동안 기생충 복제와 면역 반응의 주기는 특히 심장과 소화관을 심하게 손상시킬 수 있다.[2]
전송
T. cruzi는 삼종, 판스트롱길러스, 로드니우스에서 다양한 삼종벌레에 의해 전염될 수 있다.[2]인체감염의 주요 벡터는 삼원충류로, 즉 삼원충류, 즉 삼원충류, 로드니우스 프롤릭스, 삼원충류, 판스트롱길러스 메가스티투스 등이 서식한다.[19]이 곤충들은 아르헨티나, 볼리비아, 칠레, 파라과이의 빈추카, 브라질의 바베리로(이발사), 콜롬비아의 피토, 중앙아메리카의 친치, 베네수엘라의 치파 등 많은 지역 이름으로 알려져 있다.[20]벌레들은 밤에 먹이를 먹는 경향이 있는데, 눈이나 입 근처의 촉촉한 표면을 선호한다.[15][19]삼원자 벌레는 감염된 호스트를 먹이면 T. 크루지에 감염될 수 있다.[15]T. cruzi는 곤충의 장내에서 복제되고 벌레의 배설물에 버려진다.[15]감염된 삼원자가 먹이를 주면 피부를 뚫고 혈식을 섭취하면서 동시에 배변을 하여 새로운 식사를 위한 공간을 마련한다.[15]물린 상처는 전형적으로 통증이 없지만 가려움증을 유발한다.[15]물린 곳을 긁으면 T. 크루지가 가득 찬 대변이 물린 상처로 유입되어 감염을 일으킨다.[15]
차가스병은 고전적인 벡터 확산 외에도 삼원자 곤충이나 그들의 배설물에 오염된 음식이나 음료 섭취를 통해 전염될 수 있다.[21]가열이나 건조는 기생충을 죽이기 때문에 음료와 특히 과일 주스가 감염의 가장 빈번한 원인이다.[21]이러한 구강 전염 경로는 여러 발병에 연루되었는데, 삼원자 벌레에 물린 것보다 더 높은 기생충 부하의 감염으로 인해 유별나게 심한 증상이 나타났다.[6][21]
T. cruzi는 수혈 중, 장기이식 후, 또는 임신 중 태반을 가로질러 삼원자 벌레와 독립적으로 전염될 수 있다.[2]감염된 기증자의 혈액을 수혈하면 10~25%의 수혈자가 감염된다.[2]이를 예방하기 위해 미국뿐만 아니라 차가스 풍토병이 있는 많은 나라에서 T. 크루지에 대한 헌혈을 심사한다.[6]마찬가지로, 감염된 기증자의 고형 장기 이식은 T. 크루지를 받는 사람에게 전달할 수 있다.[2]이는 특히 T. 크루지(t. cruzi)를 75~100% 전송하는 심장 이식의 경우, 간(0–29%)이나 신장(0–19%)[2]의 이식의 경우는 더 적다.감염된 산모는 태반을 통해 아이에게 T. 크루지를 전달할 수 있다; 이것은 감염된 산모에 의한 출산의 최대 15%에서 발생한다.[22]2019년 기준 신규 감염의 22.5%가 선천성 전염을 통해 발생했다.[23]
병리학
병의 급성기에는 T. cruzi의 복제와 그에 대한 면역체계의 반응에 의해 징후와 증상이 직접 일어난다.[2]이 단계에서 T. cruzi는 몸 전체의 여러 조직에서 발견되어 혈액 속에서 순환한다.[2]감염 초기 몇 주 동안 기생충 복제는 항체의 생산과 숙주의 염증 반응의 활성화, 특히 TNF-α와 IFN-progen과 같은 염증 신호 분자에 의해 구동되는 NK 세포와 대식세포와 같은 세포 내 병원체를 대상으로 하는 세포에 의해 통제된다.[2]
만성 샤가스병 중에는 기생충의 지속적인 복제와 면역체계 손상으로 인해 장기간의 장기 손상이 수년에 걸쳐 발생한다.질병의 초기에 T. cruzi는 심장의 줄무늬근섬유에서 자주 발견된다.[24]질병이 진행됨에 따라 심장은 일반적으로 확대되며 심장 근육섬유의 상당 부분이 흉터 조직과 지방으로 대체된다.[24]활성 염증이 있는 부위는 심장 전체에 흩어져 있으며, 각 부위는 일반적으로 대식세포와 T세포로 구성되어 있다.[24]늦은 병에는 심장에서 기생충이 거의 발견되지 않으며, 아주 낮은 수치로만 존재할 수도 있다.[24]
심장, 대장, 식도에서는 만성질환이 신경종말의 대규모 손실로 이어진다.[17]심장에서는, 이것은 아르히트미아나 다른 심장기능 장애의 원인이 될 수 있다.[17]결장과 식도에서는 신경계통 조절의 상실이 장기 기능장애의 주요 원인이다.[17]신경 상실은 소화관을 통한 음식의 이동을 저해하며, 이는 식도나 결장의 막힘과 혈액 공급의 제약을 초래할 수 있다.[17]
진단

혈액 속에 T. 크루지의 존재는 샤가스병 진단이다.급성 감염 단계에서는 운동성 기생충에 대한 신선한 항응고혈액 또는 그 완충성 피복의 현미경 검사 또는 기암사로 얼룩진 얇고 두꺼운 혈흔을 준비하여 기생충을 직접 시각화하여 검출할 수 있다.[4][6]혈액검사에서 34~85%의 경우 기생충이 검출된다.혈액을 농축하기 위해 마이크로헤마토크리트 원심분리 등의 기법을 사용하면 민감도가 높아진다.[2]얼룩진 혈흔의 현미경 검사에서 T.크루지 트라포마스티고테는 편모세포가 기형막에 의해 몸에 연결된 S 또는 U자 모양의 유기체로 나타난다.기생충의 몸 안에는 키네토플라스틱이라고 불리는 핵과 작은 구조가 보인다; T. cruzi의 키네토플라스틱은 비교적 커서 인간을 감염시키는 다른 종류의 트라이파노솜과 구별하는데 도움이 된다.[25]
또는 PCR(중합효소 연쇄반응)에 의해 T. 크루지 DNA를 검출할 수 있다.급성·기생성 차가스병에서는 PCR이 현미경 검사보다 민감하며,[23] 산모에서 아기에게 T.크루지에 대한 항체가 전이(수동 면역)되어도 영향을 받지 않기 때문에 선천성 질환 진단에 대한 항체 기반 검사보다 신뢰성이 높다.[26]PCR은 장기이식수취자와 면역억제자의 T.크루지 수치를 감시하는 데도 사용돼 감염이나 재활성화를 조기에 발견할 수 있다.[2][4][23]
만성 차가스병에서는 혈액 속 기생충의 농도가 너무 낮아 현미경이나 PCR로 신뢰성 있게 검출할 수 없기 때문에 [2]대개 혈액 속 T. 크루지에 대한 면역글로불린 G 항체를 검출하는 세로학적 검사를 이용해 진단을 내린다.[6]진단을 확인하려면 다른 검사 방법을 사용하여 두 가지 양성 혈청학 결과가 필요하다.[4]검사 결과가 확정되지 않은 경우 Western Blot 등 추가 검사 방법을 사용할 수 있다.[2]
차가스 질환에 대한 다양한 신속한 진단 테스트가 가능하다.이러한 테스트는 운반이 용이하며 특별한 훈련 없이 사람들이 수행할 수 있다.[27]다수의 인원을 선별하고 헬스케어 시설에 접근할 수 없는 사람을 검사하는 데 유용하지만, 민감도가 상대적으로 낮으며,[2] 긍정적인 결과를 확인할 수 있는 두 번째 방법을 사용하는 것이 좋다.[27][28]
T. 크루지 기생충은 혈액의 배양, 이종교배증, 또는 동물의 혈액 접종을 통해 혈액 샘플로부터 자랄 수 있다.혈액배양법에서는 사람의 적혈구를 혈장과 분리시켜 전문성 있는 성장매체에 넣어 기생충의 증식을 촉진한다.결과를 얻는 데는 최대 6개월이 걸릴 수 있다.이노다이아뇨증은 3원자 곤충에게 혈액을 공급한 후 30일에서 60일 후에 기생충을 위해 그들의 배설물을 검사하는 것을 포함한다.[27]이러한 방법은 느리고 감도가 낮기 때문에 일상적으로 사용되지 않는다.[29][27]
예방
샤가스병을 예방하기 위한 노력은 주로 삼원자 벌레에 대한 노출을 제한하기 위한 벡터 제어에 초점이 맞춰져 있다.살충제 살포 프로그램은 잔류 살충제가 있는 가정과 주변 지역을 살포하는 것으로 구성돼 벡터 제어의 주축이 돼 왔다.[30]이것은 원래 1980년대에 피레트로이드로 대체된 오르가노클로린, 오르가노인산염, 카르바메이트 살충제로 이루어졌다.[30]이 프로그램들은 브라질과 칠레의 전송을 대폭 감소시켰으며 특정 지역의 주요 벡터를 제거했다.[15]트리아토마는 브라질, 칠레, 우루과이, 페루와 파라과이의 일부 지역과 중앙아메리카의 로드니우스 프롤리수스에서 온 유혈종이다.[17]일부 지역의 벡터 제어는 삼원자 벌레의 살충제 내성 발달로 인해 방해를 받아왔다.[30]이에 대응하여 벡터 제어 프로그램은 대체 살충제(예: 아르헨티나 및 볼리비아의 페니트로션 및 벤디오카브), 살충제, 살충제 억제 페인트, 기타 실험적인 접근법으로 길들여진 동물(삼원자 벌레가 먹기도 함)의 처리를 시행하고 있다.[30]삼원자 벌레가 있는 지역에서는 모기장 아래서 잠을 자고 삼원자 벌레가 집을 식민지화하는 것을 막는 주거개선을 통해 T. 크루지 전송을 막을 수 있다.[15]
수혈은 이전에 차가스병에서 두 번째로 흔한 전염 방식이었다.[31]T. 크루지는 냉장 보관된 혈액에서 생존할 수 있으며, 냉동과 해동에도 생존할 수 있어 전혈, 포장된 적혈구, 과립구, 극저온증, 혈소판 등에서 버틸 수 있다.[31]혈액은행 검진검사 개발 및 시행으로 수혈 중 감염 위험이 획기적으로 낮아졌다.[31]라틴 아메리카 국가들의 거의 모든 헌혈은 샤가스 검사를 거친다.[31]영국(1999년 시행), 스페인(2005년), 미국(2007년), 프랑스·스웨덴(2009년), 스위스(2012년), 벨기에(2013년) 등 고질적인 지역 출신 이민자 수가 많은 비고질적인 국가에서도 광범위한 심사가 일반적이다.[32]일반적으로 ELISA는 기증자 혈액에서 T. 크루지 단백질에 대한 항체를 검출하는 데 사용된다.[31]
차가스 질병 예방 프로그램의 타겟은 다른 전염병이다.임신 중 T. 순결핵에 감염된 산모를 치료하면 선천적으로 감염이 전이될 위험이 줄어든다.[22]이를 위해 중남미의 많은 나라들이 T. 크루지 감염에 대해 임산부와 영유아에 대한 정기적인 검진을 실시하고 있으며, 세계보건기구(WHO)는 선천성 감염이 만성질환으로 발전하는 것을 막기 위해 감염된 산모에게서 태어난 모든 아동을 검진할 것을 권고하고 있다.[1][33]수혈과 유사하게, 차가스 병이 있는 많은 나라들은 이식수술을 위해 혈청검사를 통해 장기를 검사한다.[2]
샤가스병에 대한 백신은 없다.[8]여러 실험용 백신이 T. 크루지에 감염된 동물을 대상으로 실험해 혈액과 심장의 기생충 수를 줄일 수 있었지만 2016년 현재 인체에서 임상실험을 받은 백신 후보는 없었다.[34][35]
관리
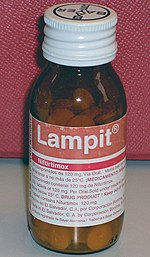
차가스병은 체내에서 T.크루지를 제거하기 위한 항가라스틱 약물과 감염의 영향을 해소하기 위한 증상적 치료를 이용하여 관리한다.[6]벤츠니다졸과 니푸르트미막스는 2018년 현재 대부분의 라틴아메리카에서 벤츠니다졸이 유일한 약품임에도 불구하고 차가스병을 치료하기 위해 선택한 항타라스틱 약품이었다.[2][36]어느 약이든 치료는 일반적으로 60~90일 동안 하루에 2~3회 경구 투여로 이루어진다.[2]항타라스틱 치료는 감염 초기에 가장 효과적이다. 급성기 환자의 50~80%에서 T. 크루지를 제거하지만 만성기 환자의 20~60%만 제거한다.[6]만성질환의 치료는 성인보다 어린이에게 더 효과적이며, 선천성 질환의 치료율은 생후 1년차에 치료하면 100%에 근접한다.[2]항타라스틱 치료는 또한 병의 진행을 늦추고 선천적인 전염의 가능성을 줄일 수 있다.[1]T. cruzi를 제거한다고 해서 만성 차가스병으로 인한 심장과 위장 손상이 치료되는 것은 아니므로 이러한 질환은 따로 치료해야 한다.[6]항타라스틱 치료는 이미 확장된 심근증이 있는 사람에게는 권장하지 않는다.[17]
벤츠니다졸은 니푸르트미녹스보다 부작용이 적고 효능도 더 잘 알기 때문에 보통 1차 치료제로 꼽힌다.[2][23]벤츠니다졸과 니푸르트미녹스 모두 공통적인 부작용이 있어 치료가 중단될 수 있다.벤츠니다졸의 가장 흔한 부작용은 피부 발진, 소화불량, 식욕저하, 허약, 두통, 수면장애 등이다.이러한 부작용은 항히스타민제나 코르티코스테로이드로 치료할 수 있는 경우가 있으며, 일반적으로 치료가 중단되면 역전된다.[2]다만 벤지다졸은 최대 29%까지 단종된다.[2]니푸르트이목스는 부작용이 더 잦아 개인의 97.5%까지 약물을 복용하는 데 영향을 미친다.[2]가장 흔한 부작용으로는 식욕저하, 체중감소, 메스꺼움, 구토 등이 있으며 기분변화, 불면증, 마취, 말초신경장애 등 다양한 신경장애가 있다.[2]치료는 케이스의 75%까지 중단된다.[2][23]두 약 모두 임산부와 간 또는 신장 장애가 있는 사람들에게 사용이 금지되어 있다.[1]2019년을 기점으로 이들 약물에 대한 내성이 보고되고 있다.[36]
합병증
만성적인 단계에서 치료는 그 질병의 임상적 징후를 관리하는 것을 포함한다.차가스 심근증의 치료는 다른 형태의 심장병과 비슷하다.[2]베타 차단제와 ACE 억제제를 처방할 수도 있지만, 샤가스병을 앓고 있는 일부 사람들은 혈압이 낮거나 심박수가 낮기 때문에 이러한 약의 표준 복용량을 복용하지 못할 수도 있다.[2][17]불규칙한 심장박동을 관리하기 위해 아미오다론 같은 부정맥 방지제를 처방받거나 심박조율기를 이식받을 수도 있다.[4]혈액 희석제는 혈전증과 뇌졸중을 예방하는 데 사용될 수 있다.[17]차가스에 의한 만성 심장병은 심장 이식 수술의 흔한 원인이다.[15]장기이식 대상자는 장기 거부를 막기 위해 면역억제제를 복용하기 때문에 PCR을 이용해 질병의 재활성화를 감지하는 모니터링을 한다.심장 이식을 받는 차가스병은 평균 심장 이식을 받는 사람보다 생존율이 높다.[17]
가벼운 위장병은 변비에 설사약을 사용하거나 식도 증상을 완화하기 위해 식전에 메토클로프라미드 같은 조제제를 복용하는 등 증상적으로 치료할 수 있다.[4][37]식도 아래 괄약근의 근육을 절단하는 수술(심장절개술)은 식도질환이 더 심한 경우 시행될 수 있으며,[37] 고도 메가콜론 및 메가소포거스의 경우 장기의 환부를 수술적으로 제거해야 할 수도 있다.[4][29]
역학

2019년에는 전 세계적으로 약 650만 명의 사람들이 샤가스병을 앓았고, 매년 약 173,000명의 새로운 감염자와 9,490명의 사망자가 발생했다.[3]이 질병은 2013년 72억 달러로 추산되는 전세계적인 연간 경제적 부담을 초래했으며, 이 중 86%는 고질적인 국가들이 부담하고 있다.[32][40]샤가스병은 매년 80만년 이상의 장해가 조절된 생명을 잃는 결과를 낳는다.[2]
차가스병은 미국 남부에서 칠레 북부, 아르헨티나까지 분포하며 볼리비아(6.1%), 아르헨티나(3.6%), 파라과이(2.1%)가 가장 높은 유병률을 보이고 있다.[2]중남미 대륙 내에서 샤가스병은 21개국에 만연해 있다.아르헨티나, 벨리즈, 볼리비아, 브라질, 칠레, 콜롬비아, 코스타리카, 에콰도르, 엘살바도르, 프랑스령 기아나, 과테말라, 가이아나, 온두라스, 멕시코, 니카라과, 파나마, 파라과이, 페루, 수리남, 우루과이, 베네수엘라.[1][2]풍토 지역에서는 벡터 제어 노력과 헌혈 심사 등으로 인해 1980년대부터 2010년대까지 연간 감염률과 사망률이 각각 67%, 73% 이상 감소했다.[2][41]우루과이(1997년), 칠레(1999년), 브라질(2006년)에서는 곤충 벡터 및 수혈에 의한 전송이 완전히 중단되었고,[41] 아르헨티나에서는 2001년 현재 19개 고유성 중 13개 지역에서 벡터 전송이 중단되었다.[42]베네수엘라의 인도주의 위기 동안 이전에 방해를 받았던 지역에서 벡터적 전염이 일어나기 시작했고, 차가스병 발생률이 높아졌다.[43]그란차코 지역은 살충제 저항성 때문에, 아마존 유역은 구강 전염으로 인해 전염률이 높아졌다.[2]
벡터 전이 차가스 질병의 비율은 라틴 아메리카의 대부분에서 감소했지만, 경구 전염률은 증가했는데, 이는 도시화와 삼림 벌채의 증가로 사람들이 삼원자와 더 가깝게 접촉하고 삼원자의 분포를 변경했기 때문일 것이다.[21][44][45]베네수엘라에서는 특히 2007~2018년 16건의 발생이 발생한 차가스 질병이 특히 우려된다.[43]
샤가스는 두 개의 다른 생태 구역에 존재한다.서던콘 지방에서는 주 벡터가 사람의 집 안과 주변에 산다.중앙아메리카와 멕시코에서는 주 벡터 종들이 주거지 안과 무인도 지역에서 모두 살고 있다.두 지역 모두에서 샤가스는 거의 전적으로 시골 지역에서 발생하는데, T. 크루지는 야생 동물과 가축 동물에서도 순환한다.[46]T. cruzi는 보통 삼원자 벌레와 다른 감염된 동물들을 먹음으로써 벡터나 구강으로 감염될 수 있는 포섬,[47] 아르마딜로, 마모셋, 박쥐, 다양한 설치류[48] 그리고 개들을[47] 포함하여 라틴 아메리카 전역의 100종 이상의 포유류들을 감염시킨다.[48][47]곤충을 좋아하는 동물들에게 이것은 흔한 방법이다.[47]디델피스 spp.는 전송에 삼원자(triatomine)가 필요 없다는 점에서 독특하며, 자신의 소변과 대변을 통해 수명을 완성한다.[47]수의학적 전염은 또한 태반, 수혈, 장기 이식을 통한 수직 전달을 통해서도 발생한다.[47]
비독점 국가
샤가스는 전통적으로 라틴 아메리카 시골의 질병으로 여겨지지만, 국제적인 이주는 이 질병으로 고통 받는 사람들을 북미와 유럽을 중심으로 수많은 비독점 국가로 분산시켰다.[1][32]2020년 현재 미국에 약 30만 명의 감염자가 살고 있으며 2018년에는 3만~4만 명의 미국인이 샤가스 심장병증을 앓고 있는 것으로 추정됐다.[49][17]미국의 경우 대부분 중남미 출신 이민자에게 발생하지만 현지 전송이 가능하다.[17][23]삼원자 11종은 미국 토착종이며, 일부 남부 주에서는 곤충 벡터와 동물 저장고 사이에 지속적으로 질병 전염 주기가 있는데,[2][23] 여기에는 목동, 주머니쥐, 너구리, 아르마딜로, 스컹크가 포함된다.[50]그러나 국지적으로 후천적으로 감염되는 경우는 매우 드물다. 1955년부터 2015년까지 28건만이 기록되었다.[2][49]2013년 기준 미국의 치료비는 연간 9억달러(글로벌 비용 70억달러)로 추정돼 입원비와 페이스메이커 등 의료기기가 포함됐다.[40]
차가스병은 2019년 현재 유럽에서 약 6만8천명에서 12만3천명이 발병하고 있다.[51]중남미로부터의 이민률이 높은 스페인은 이 병의 유병률이 가장 높다.차가스병을 앓고 있는 스페인인은 5만~7만 명으로 추정돼 유럽인 사례의 대부분을 차지하고 있다.[52]유병률은 이민 패턴의 차이로 인해 유럽 국가들 내에서 매우 다양하다.[51]이탈리아가 두 번째로 유병률이 높고, 네덜란드, 영국, 독일이 그 뒤를 잇고 있다.[52]
역사
T. cruzi는 인간이 대륙에 도착하기 훨씬 전에 남아메리카 포유류에서 유통되었을 것이다.[53]T. 크루지는 아타카마 사막의 9000년 된 친초로 미라에서부터 미나스 제라이스의 다양한 연령의 유골, 리오 그란데 근처의 치와후안 사막 북쪽의 1100년 된 미라까지 남아메리카 전역의 고대 인류 유적에서 발견되었다.[53]많은 초기의 서면 서술은 샤가스병과 일치하는 증상을 기술하고 있는데, 이 병에 대한 초기 서술은 때때로 미겔 디아즈 피멘타(1707), 루이스 고메스 페레이라 (1735), 테오도로 J. H. 랭가르드(1842)에 기인하기도 한다.[53]
샤가스병에 대한 공식적인 설명은 1909년 카를로스 샤가스(Carlos Chagas)가 발열, 림프절 부종, 비장과 간 확장증세를 보이는 2세 소녀를 진찰한 후 만든 것이다.[53]그녀의 혈액을 검사한 샤가스는 트라이파노솜을 3원자 벌레의 뒷굿에서 최근에 확인한 것과 동일한 것으로 보고 그의 멘토인 브라질의 의사 오스왈도 크루즈를 기리기 위해 트라이파노소마 크루지라고 명명했다.[53]그는 감염된 삼원자 벌레들을 리우데자네이루의 크루즈에게 보냈는데, 그는 감염된 삼원자 벌레가 T. 크루즈를 마모셋 원숭이에게도 전염시킬 수 있다는 것을 보여주었다.[53]1908년과 1909년 단 2년 만에 샤가스는 이 질병에 대한 설명과 그 원인이 된 유기체, 감염에 필요한 곤충 벡터 등을 발표했다.[54][55][56] 그 직후, 당시 메디치나의 교수였던 미겔 쿠토의 제안으로, 이 병은 널리 "샤가스병"[54]이라고 불렸다샤가스의 발견은 그에게 국가적, 국제적 명성을 가져다 주었지만, 브라질 정부의 이 질병에 대한 대처가 불충분하다는 점을 부각시키면서, 샤가스는 자신과 자신의 이름을 딴 질병에 대한 비판을 불러 일으켜, 그의 발견에 대한 연구를 억누르고 1921년 노벨상 후보 지명을 좌절시킬 것 같다.[54][57]
1930년대에 살바도르 마자는 아르헨티나 차코 주에서 일어난 천 건 이상의 사례를 설명하면서 차가스 질병 연구에 다시 불을 붙였다.[53]아르헨티나에서, 이 병은 그를 기리기 위해 말 드 샤가스-마자로 알려져 있다.[58]1940년대에 샤가스병에 대한 혈루학적 검사가 도입되어 T. 크루지 감염이 라틴 아메리카 전역에 광범위하게 퍼져 있음을 증명했다.[53]이는 살충제 사용을 통한 말라리아 벡터 제거 성공과 맞물려 삼원충 퇴치를 위한 살충제 주택 치료에 초점을 맞춘 공중보건 캠페인의 창설을 촉진했다.[30][53]1950년대는 수정 보랏빛으로 혈액을 치료하면 기생충을 퇴치할 수 있다는 사실이 발견되어 라틴 아메리카에서 수혈 검사 프로그램에 널리 사용되게 되었다.[53]대규모 통제 프로그램은 1960년대에 형성되기 시작했는데, 처음에는 상파울루에서, 그 다음에는 아르헨티나의 다양한 지역에서, 그리고 그 다음에는 중남미 전역의 국가 차원의 프로그램이었다.[59]이러한 프로그램들은 1980년대에 응용 후 얼룩이나 냄새를 남기지 않고 지속적이고 비용 효율이 높은 피레로이드 살충제의 도입으로 큰 힘을 얻었다.[53][59]1991년 차가스병해소를 위한 남부콘 이니셔티브(Southern Console of Chagas Disease)가 발족하고, 안데스 국가들의 이니셔티브(1997년), 중미 국가들의 이니셔티브(1997년), 이니셔티브(1997년)가 출범하는 등 차가스병 통제를 전담하는 지역 단체들이 범아메리카 보건기구의 지원을 통해 생겨났다.아마존 국가들(2004년)[30]의
리서치
치료
아프리카 트라이파노소미아시스(Trypanosomiasis) 치료 허가를 받은 항타라스틱 약인 펙시니다졸(Fexinidazole)이 동물 모델에서 차가스 질환에 대한 활동성을 보였다.2019년 현재 스페인에서 만성 차가스 질환에 대한 임상 2상을 진행 중이다.[36][60]다른 약물 후보로는 쥐에서 차가스병에 효과가 있어 예비 독성 연구를 진행 중인 프로테아솜 억제제 GNF6702와 동물 모델에서 유망한 성과를 거둔 AN4169 등이 있다.[10][61]
많은 실험용 백신이 동물들에게 실험되었다.서브유닛 백신 외에도, 일부 접근법은 감쇠된 T. 크루지 기생충이나 T. 크루지와 같은 항원을 표현하지만 트라이파노소마 레인지리나 피토모나스 세르펜스와 같은 인체 질환을 일으키지 않는 유기체에 대한 예방접종을 포함했다.DNA 예방접종도 함께 연구됐다.2019년 현재 백신 연구는 주로 작은 동물 모델에 한정되어 있다.[9]
진단 테스트
2018년 현재 차가스병 표준진단검사는 T. 크루지가 몸에서 제거된 후 수년 동안 혈중 기생충 농도가 낮을 때 PCR이 거짓 음성 판정을 내릴 수 있어 항타라스틱 치료 효과 측정 능력에 한계가 있었다.특정 T. 크루지 항원에 대한 면역측정, T. 크루지의 다른 수명 단계에 대한 항체를 검출하기 위한 흐름 세포측정 검사, 응고 및 지질대사의 변화 등 기생충에 의한 생리적 변화 표시 등 치료 대응의 잠재적 바이오마커 몇 개가 조사 중에 있다.[17]
또 다른 연구 분야는 바이오마커를 활용해 만성질환의 진행을 예측하는 것이다.종양 괴사 인자 알파, 뇌 및 심방 내추럴 펩타이드, 안지오텐신전환효소2의 혈청수치가 샤가스 심장병증 예후를 나타내는 지표로 연구되어 왔다.[62]
T. 크루지는 ELISA나 Western Blotte를 이용하여 혈액에서 검출할 수 있는 급성상 항원(SAPA)[22]이 초기 급성 및 선천성 감염의 지표로 사용되어 왔다.[62]소변에서 T. 크루지 항원에 대한 검사가 선천성 질환을 진단하기 위해 개발되었다.[22]
참고 항목
참조
- ^ a b c d e f g h i j k l m n o p q "Chagas disease (American trypanosomiasis)". World Health Organization. 17 April 2019. Archived from the original on 20 January 2020. Retrieved 9 March 2020.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj ak al am an ao ap aq ar as at au av aw ax Pérez-Molina JA, Molina I (2018). "Chagas disease". The Lancet. 391 (10115): 82–94. doi:10.1016/S0140-6736(17)31612-4. ISSN 0140-6736. PMID 28673423. S2CID 4514617.
- ^ a b c d e "Global Health Metrics: Chagas disease—Level 3 cause" (PDF). The Lancet. 2020. Archived (PDF) from the original on 18 March 2022.
- ^ a b c d e f g h i j k l m n o p Bern C (July 2015). "Chagas' disease". N. Engl. J. Med. (Review). 373 (5): 456–66. doi:10.1056/NEJMra1410150. PMID 26222561.
- ^ a b c "DPDx – Trypanosomiasis, American. Fact Sheet". Centers for Disease Control (CDC). 30 April 2019. Archived from the original on 5 September 2019. Retrieved 10 March 2020.
- ^ a b c d e f g h Guarner J (May 2019). "Chagas disease as example of a reemerging parasite". Seminars in Diagnostic Pathology. 36 (3): 164–9. doi:10.1053/j.semdp.2019.04.008. PMID 31006555.
- ^ "Prevention of Chagas disease". World Health Organization. Archived from the original on 11 February 2018. Retrieved 24 February 2018.
- ^ a b Santi AM, Murta SM (2022). "Antioxidant defence system as a rational target for Chagas disease and Leishmaniasis chemotherapy". Memórias do Instituto Oswaldo Cruz. 117: e210401. doi:10.1590/0074-02760210401. PMC 8896756. PMID 35239945.
- ^ a b Rios LE, Vázquez-Chagoyán JC, Pacheco AO, Zago MP, Garg NJ (2019). "Immunity and vaccine development efforts against Trypanosoma cruzi". Acta Tropica. 200: 105168. doi:10.1016/j.actatropica.2019.105168. ISSN 0001-706X. PMC 7409534. PMID 31513763.
- ^ a b Vermelho AB, Rodrigues GC, Supuran CT (2019). "Why hasn't there been more progress in new Chagas disease drug discovery?". Expert Opinion on Drug Discovery. 15 (2): 145–158. doi:10.1080/17460441.2020.1681394. ISSN 1746-0441. PMID 31670987. S2CID 207815975.
- ^ Rassi Jr A, Rassi A, Marcondes de Rezende J (June 2012). "American trypanosomiasis (Chagas disease)". Infectious Disease Clinics of North America. 26 (2): 275–91. doi:10.1016/j.idc.2012.03.002. PMID 22632639.
- ^ Capinera JL, ed. (2008). Encyclopedia of entomology (2nd ed.). Dordrecht: Springer. p. 824. ISBN 9781402062421.
- ^ Rassi A, Rassi A, Marin-Neto JA (April 2010). "Chagas disease". Lancet. 375 (9723): 1388–402. doi:10.1016/S0140-6736(10)60061-X. PMID 20399979. S2CID 5068417.
- ^ "Neglected Tropical Diseases". cdc.gov. 6 June 2011. Archived from the original on 4 December 2014. Retrieved 28 November 2014.
- ^ a b c d e f g h i j k l Despommier DD, Griffin DO, Gwadz RW, Hotez PJ, Knirsch CA (2019). "American Trypanosomiasis". Parasitic Diseases (7 ed.). New York: Parasites Without Borders. pp. 71–84. Retrieved 26 March 2020.
- ^ "Chagas Disease – Detailed Fact Sheet". www.cdc.gov. CDC-Centers for Disease Control and Prevention. Archived from the original on 16 August 2019. Retrieved 15 April 2020.
- ^ a b c d e f g h i j k l m n Nunes MC, Beaton A, Acquatella H, et al. (September 2018). "Chagas cardiomyopathy: an update of current clinical knowledge and management: a scientific statement from the American Heart Association". Circulation (Review). 138 (12): e169–e209. doi:10.1161/CIR.0000000000000599. PMID 30354432.
- ^ Echeverria LE, Morillo CA (February 2019). "American Trypanosomiasis (Chagas Disease)". Infectious Disease Clinics of North America. 33 (1): 119–134. doi:10.1016/j.idc.2018.10.015. PMID 30712757. S2CID 73446292.
- ^ a b c Alba Soto CD, González Cappa SM (9 September 2019). "Trypanosoma cruzi Journey from the Insect Vector to the Host Cell". In Marcelo Altcheh J, Freilij H (eds.). Chagas Disease: A Clinical Approach. Birkhäuser Advances in Infectious Diseases. Switzerland: Springer Nature. pp. 25–59. doi:10.1007/978-3-030-00054-7_2. ISBN 978-3-030-00054-7. ISSN 2504-3811. S2CID 203357705.
- ^ Maudlin I, Holmes PH, Miles MA, eds. (2004). The Trypanosomiases. Wallingford: CAB International. p. 184. ISBN 9780851990347.
- ^ a b c d Robertson LJ, Deveesschauwer B, de Noya BA, Gozalez ON, Togerson PR (June 2016). "Trypanosoma cruzi: Time for International Recognition as Foodborne Parasite". PLOS Neglected Tropical Diseases. 10 (6): e0004656. doi:10.1371/journal.pntd.0004656. PMC 4890754. PMID 27253136.
- ^ a b c d Messenger LA, Bern C (2018). "Congenital Chagas disease: current diagnostics, limitations, and future perspectives" (PDF). Current Opinion in Infectious Diseases. 31 (5): 415–21. doi:10.1097/QCO.0000000000000478. PMID 30095485. S2CID 51955023.
- ^ a b c d e f g Bern C, Messenger LA, Whitman JD, Maguire JH (2019). "Chagas Disease in the United States: a Public Health Approach". Clinical Microbiology Reviews (Review). 33 (1). doi:10.1128/CMR.00023-19. ISSN 0893-8512. PMC 6927308. PMID 31776135.
- ^ a b c d Bonney KM, Luthringer DJ, Kim SA, Garg NJ, Engman DM (January 2019). "Pathology and Pathogenesis of Chagas Heart Disease". Annu Rev Pathol (Review). 14: 421–47. doi:10.1146/annurev-pathol-020117-043711. PMC 7373119. PMID 30355152.
- ^ Bain BJ (20 January 2015). Blood Cells: A Practical Guide. John Wiley & Sons. pp. 165–7. ISBN 978-1-118-81733-9.
- ^ Schijman AG (August 2018). "Molecular diagnosis of Trypanosoma cruzi". Acta Tropica. 184: 59–66. doi:10.1016/j.actatropica.2018.02.019. hdl:11336/79861. PMID 29476727. S2CID 3513900.
- ^ a b c d Luquetti AO, Schijman AG (9 September 2019). "Diagnosis of Chagas disease". In Marcelo Altcheh J, Freilij H (ed.). Chagas Disease: A Clinical Approach. Birkhäuser Advances in Infectious Diseases. Switzerland: Springer Nature. pp. 141–58. doi:10.1007/978-3-030-00054-7_7. ISBN 978-3-030-00054-7. ISSN 2504-3811. S2CID 203376369.
- ^ Angheben A, Buonfrate D, Cruciani M, et al. (May 2019). "Rapid immunochromatographic tests for the diagnosis of chronic Chagas disease in at-risk populations: A systematic review and meta-analysis". PLOS Neglected Tropical Diseases. 13 (5): e0007271. doi:10.1371/journal.pntd.0007271. PMC 6561601. PMID 31150377.
- ^ a b Kirchhoff OV (26 April 2019). "Chagas disease (American Trypanosomiasis)". eMedicine. Archived from the original on 12 March 2020. Retrieved 8 April 2020.
- ^ a b c d e f Mougabure-Cueto G, Picollo MI (September 2015). "Insecticide resistance in vector Chagas disease: Evolution, machanisms, and management". Acta Tropica. 149: 70–85. doi:10.1016/j.actatropica.2015.05.014. PMID 26003952.
- ^ a b c d e Angheben A, Boix L, Buonfrate D, et al. (October 2015). "Chagas disease and transfusion medicine: a perspective from non-endemic countries". Blood Transfusion. 13 (4): 540–50. doi:10.2450/2015.0040-15. PMC 4624528. PMID 26513769.
- ^ a b c Lidani KCF, Andrade FA, Bavia L, et al. (July 2019). "Chagas disease: from discovery to a worldwide health problem". Frontiers in Public Health. 7: 166. doi:10.3389/fpubh.2019.00166. PMC 6614205. PMID 31312626.
- ^ Bonney KM (March 2014). "Chagas disease in the 21st century: a public health success or an emerging threat". Parasite. 21 (11): 11. doi:10.1051/parasite/2014012. PMC 3952655. PMID 24626257.
- ^ Dumonteil E, Herrera C, Buekens P (January 2019). "A therapeutic preconceptional vaccine against Chagas disease: A novel indication that could reduce congenital transmission and accelerate vaccine development". PLOS Neglected Tropical Diseases. 13 (1): e0006985. doi:10.1371/journal.pntd.0006985. PMC 6354953. PMID 30703092.
- ^ Beaumier CM, Gillespie PM, Strych U, et al. (June 2016). "Status of vaccine research and development of vaccines for Chagas disease". Vaccine. 34 (26): 2996–3000. doi:10.1016/j.vaccine.2016.03.074. PMID 27026146.
- ^ a b c Ribeiro V, Dias N, Paiva T, et al. (December 2019). "Current trends in the pharmacological management of Chagas disease". Int J Parasitol Drugs Drug Resist (Review). 12: 7–17. doi:10.1016/j.ijpddr.2019.11.004. PMC 6928327. PMID 31862616.
- ^ a b de Oliveira EC, da Silveira ABM, Luquetti AO (9 September 2019). "Gastrointestinal Chagas Disease". In Marcelo Altcheh J, Freilij H (eds.). Chagas Disease: A Clinical Approach. Birkhäuser Advances in Infectious Diseases. Switzerland: Springer Nature. pp. 243–62. doi:10.1007/978-3-030-00054-7_12. ISBN 978-3-030-00054-7. ISSN 2504-3811. S2CID 203457516.
- ^ Liu Q, Zhou XN (December 2015). "Preventing the transmission of American trypanosomiasis and its spread into non-endemic countries". Infectious Diseases of Poverty. 4: 60. doi:10.1186/s40249-015-0092-7. PMC 4693433. PMID 26715535.
- ^ World Health Organization. "Disease burden and mortality estimates". Archived from the original on 10 February 2020. Retrieved 27 April 2020.
- ^ a b Lee BY, Bacon KM, Bottazzi ME, Hotez PJ (April 2013). "Global economic burden of Chagas disease: a computational simulation model". The Lancet Infectious Diseases. 13 (4): 342–8. doi:10.1016/S1473-3099(13)70002-1. PMC 3763184. PMID 23395248.
- ^ a b Moncayo A, Silveria AC (2017). "Current epidemiological trends of Chagas disease in Latin America and future challenges: epidemiology, surveillance, and health policies". American Trypanosomiasis – Chagas Disease (2 ed.). Elsevier. pp. 59–88. doi:10.1016/B978-0-12-801029-7.00004-6.
- ^ "The Southern Cone Initiative: an update". Special Programme for Research and Training in Tropical Diseases (TDR) (Press release). WHO. 2004. Archived from the original on 22 September 2009. Retrieved 29 August 2008.
- ^ a b Grillet ME, Hernández-Villena JV, Llewellyn MS, et al. (May 2019). "Venezuela's humanitarian crisis, resurgence of vector-borne diseases, and implications for spillover in the region" (PDF). Lancet Infect Dis (Review). 19 (5): e149–e161. doi:10.1016/S1473-3099(18)30757-6. PMID 30799251. S2CID 73475841.
- ^ Alarcón de Noya B, Noya Gonzáles O (9 September 2019). "Orally Transmitted Chagas Disease: Biology, Epidemiology, and Clinical Aspects of a Foodborne Infection". In Marcelo Altcheh J, Freilij H (ed.). Chagas Disease: A Clinical Approach. Birkhäuser Advances in Infectious Diseases. Switzerland: Springer Nature. pp. 225–241. doi:10.1007/978-3-030-00054-7_11. ISBN 978-3-030-00054-7. ISSN 2504-3811. S2CID 239445211.
- ^ Hotez PJ, Basáñez MG, Acosta-Serrano A, Grillet ME (2017). "Venezuela and its rising vector-borne neglected diseases". PLOS Neglected Tropical Diseases. 11 (6): e0005423. doi:10.1371/journal.pntd.0005423. ISSN 1935-2735. PMC 5490936. PMID 28662038.
- ^ Morel CM, Lazdins J (October 2003). "Chagas disease". Nat Rev Microbiol. 1 (1): 14–5. doi:10.1038/nrmicro735. PMID 15040175. S2CID 29869370.
- ^ a b c d e f Wilkowsky SE (9 March 2022). "Trypanosomiasis in Animals - Circulatory System". Merck Veterinary Manual. Archived from the original on 28 March 2022. Retrieved 28 March 2022.
- ^ a b Jansen AM, Roque ALR (2010). "11 - Domestic and Wild Mammalian Reservoirs". In Telleria J, Tibayrenc M (eds.). American Trypanosomiasis. Elsevier. pp. 249–276. doi:10.1016/B978-0-12-384876-5.00011-3. ISBN 978-0-123-84876-5.
- ^ a b Turabelidze G, Vasudevan A, Rojas-Moreno C, et al. (2020). "Autochthonous Chagas Disease — Missouri, 2018". MMWR. Morbidity and Mortality Weekly Report. 69 (7): 193–195. doi:10.15585/mmwr.mm6907a4. ISSN 0149-2195. PMC 7043387. PMID 32078594.
- ^ Montgomery SP, Starr MC, Cantey PT, Edwards MS, Meymandi SK (2014). "Neglected Parasitic Infections in the United States: Chagas Disease". Am J Trop Med Hyg. 90 (5): 814–818. doi:10.4269/ajtmh.13-0726. PMC 4015570. PMID 24808250.
- ^ a b Alonso-Padilla J, Pinazo MJ, Gascón J (9 September 2019). "Chagas Disease in Europe". In Marcelo Altcheh J, Freilij H (ed.). Chagas Disease: A Clinical Approach. Birkhäuser Advances in Infectious Diseases. Switzerland: Springer Nature. pp. 111–123. doi:10.1007/978-3-030-00054-7_5. ISBN 978-3-030-00054-7. ISSN 2504-3811. S2CID 203406723.
- ^ a b Velasco M, Gimeno-Feliú LA, Molina I, et al. (February 2020). "Screening for Trypanosoma cruzi infection in immigrants and refugees: Systematic review and recommendations from the Spanish Society of Infectious Diseases and Clinical Microbiology". Euro Surveill. (Review). 25 (8). doi:10.2807/1560-7917.ES.2020.25.8.1900393. PMC 7055039. PMID 32127121.
- ^ a b c d e f g h i j k Steverding D (July 2014). "The history of Chagas disease". Parasites & Vectors. 7: 317. doi:10.1186/1756-3305-7-317. PMC 4105117. PMID 25011546.
- ^ a b c Kropf SP, Sá MR (July 2009). "The discovery of Trypanosoma cruzi and Chagas disease (1908–1909): tropical medicine in Brazil". Hist Cienc Saude Manguinhos. 16 (Suppl 1): 13–34. doi:10.1590/s0104-59702009000500002. PMID 20027916. S2CID 36106351.
- ^ Chagas C (1909). "Neue Trypanosomen". Vorläufige Mitteilung Arch Schiff Tropenhyg. 13: 120–2.
- ^ 샤가스 C(1909년)."노바tripanozomiase humana:Estudos morfolojia eOOOsobre ciclo Schizotrypanum cruzi n. gen.,n. sp 하evolutivo., ajente etiolojico 드 novaentidade morbida니 homem -LSB- 새로운 인간 트리파노소마증.남자의 새 병적인 실체]"의 Schizotripanum cruzi의 체형과 라이프 사이클에 대해 연구, 유병 기생충.기념품 Inst Oswaldo 크루즈. 1(2):159–218. doi:10.1590/S0074-02761909000200008.ISSN 0074-0276.("Ueber eine neue 트리파노소마증 desMenschen-."만큼 독일 전체 번역 포르투갈어에서).
- ^ Bestetti RB, Martins CA, Cardinalli-Neto A (May 2009). "Justice where justice is due: A posthumous Nobel Prize to Carlos Chagas (1879–1934), the discoverer of American Trypanosomiasis (Chagas' disease)". International Journal of Cardiology. 134 (1): 9–16. doi:10.1016/j.ijcard.2008.12.197. PMID 19185367.
- ^ "Enfermedad de Chagas – Mazza" (in Spanish). Asociación Lucha Contra el Mal de Chagas. Archived from the original on 16 September 2011. Retrieved 15 September 2011.
- ^ a b Dias JCP (September 2015). "Evolution of Chagas disease screening programs and control programs". Global Heart. 10 (3): 193–202. doi:10.1016/j.gheart.2015.06.003. PMID 26407516.
- ^ Deeks ED (2019). "Fexinidazole: First Global Approval". Drugs (Review). 79 (2): 215–220. doi:10.1007/s40265-019-1051-6. ISSN 0012-6667. PMID 30635838. S2CID 57772417.
- ^ Kratz JM (2019). "Drug discovery for Chagas disease: A viewpoint". Acta Tropica (Review). 198: 105107. doi:10.1016/j.actatropica.2019.105107. ISSN 0001-706X. PMID 31351074.
- ^ a b Balouz V, Agüero F, Buscaglia CA (2017). "Chagas disease diagnostic applications: present knowledge and future steps". Adv. Parasitol. (Review). 97: 1–45. doi:10.1016/bs.apar.2016.10.001. PMC 5363286. PMID 28325368.
외부 링크
| 위키미디어 커먼스는 샤가스 질병과 관련된 미디어를 보유하고 있다. |